БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 2.РОЛЬ ВОДИ, МАКРО- І МІКРОЕЛЕМЕНТІВ У ЖИТТЄДІЯЛЬНОСТІ ОРГАНІЗМІВ
2.1. Унікальна властивість води — розчиняти речовини різного походження
Унікальні властивості води зумовлені її характерними особливостями. У порівнянні з іншими рідинами вода має високі температури кипіння і плавлення, високу теплоту випаровування (енергія для перетворення 1 г рідини на пару при температурі кипіння і атмосферному тиску). Наприклад, ці показники для води становлять відповідно +100 °С, 0 °С і 540 кал, а для етилового спирту - +78 °С, -117 °С і 204 кал. Ці дані свідчать про сильне притягання між молекулами води. Незважаючи на те, що в цілому молекула води є електронейтральною (має однакове число електронів і протонів), електрони розподілені несиметрично, що надає їй полярного характеру. Ядро атома кисню дещо відтягує електрони від ядер атомів водню, залишаючи на них невеликий сумарний позитивний заряд. Ділянки з невеликим сумарним від'ємним зарядом розміщуються поблизу атома кисню у двох кутах уявного тетраедра (рис. 2.1, А).
Таке розділення зарядів приводить до створення дипольного моменту. Завдяки такій поляризації дві сусідні молекули води утворюють водневі зв'язки у 25 разів слабкіші (4,5 ккал/моль = = 18,83 кДж/моль), ніж ковалентні зв'язки (110 ккал/моль = = 460,25 кДж/моль), тобто дві сусідні молекули води електростатично взаємодіють. Такий тип електростатичного притягання називається водневим зв’язком, час напівжиття якого становить 10 9 с. Оскільки молекула води є тетраедром (рис. 2.1, А), то вона може максимально зв'язати чотири сусідні молекули води. Завдяки таким водневим зв'язкам молекули води об'єднуються в короткоживучі (10-10 с) кластери (рис. 2.1, Б), в яких кожна молекула сполучена з чотирма сусідніми. Зі зростанням температури помітно зменшується середня величина кластера. Якщо при 0 °С кластер досягає 90 молекул, то при 7 °С - лише 25, тобто зі зростанням температури відбувається ніби "оплавлення" кластера. Внесок теплоти "оплавлення" становить третину повної теплоємності води - 18 ккал/ град-моль. Цим пояснюється велика теплоємність води порівняно з іншими рідинами.
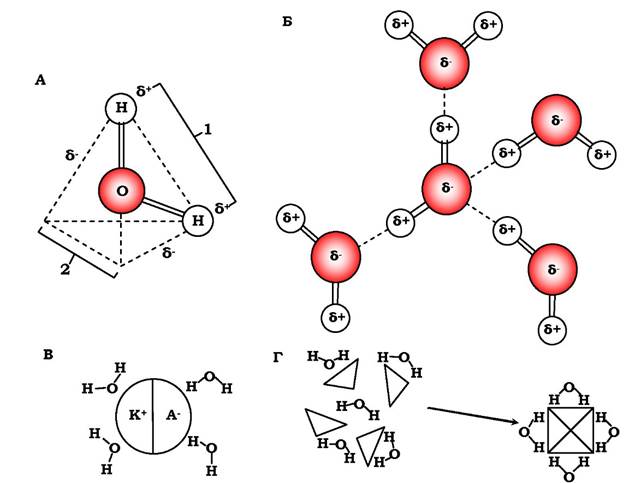
Рис. 2.1. Схема структури молекули води, яка пояснює її когезивні властивості:
А - локалізація "зарядів" в уявному тетраедрі: 1 - електропозитивна область, 2 - електронегативна область;
Б - миготливий кластер із чотирьох молекул води; В - взаємодія молекул води з катіонами (K+ ) і аніонами (A- );
Г - поведінка гідрофобних молекул у воді, яка забезпечує найменший контакт із водою
Описана природа води називається когезивною (від лат. cohaesus - зв'язаний). Вона зумовлює багато незвичайних властивостей води, у т. ч. високий поверхневий натяг, питому теплоємність і теплоту випаровування.
Оскільки молекули води полярні, то вони групуються навколо іонів чи інших полярних молекул (рис. 2.1, В). Такі іони й молекули, які беруть участь в утворенні стабілізованих водневими зв'язками води структур, називаються гідрофільними. Вони добре розчиняються у воді, тобто речовини, які іонізуються, розчиняються в ній тому, що біполярні молекули води взаємодіють з іонами, гід- ратують їх та переводять у розчин. Якщо речовини полярні, але не іонізуються (цукри, спирти, альдегіди), то вони розчиняються у воді за рахунок утворення Н-зв'язків з їхніми ОН-групами. Навпаки, неполярні молекули порушують структуру води, утворену Н-зв'язками. Такі сполуки називаються гідрофобними, вони у воді не розчиняються. Тому дві та більше таких груп у воді намагаються наблизитись одна до одної, вони групуються, ніби виштовхуються водою. Унаслідок такої поведінки гідрофобних речовин у воді структура води менше руйнується (рис. 2.1, Г). Проте багато речовин є такими, що більша частина їх гідрофобна, а інша - гідрофільна. Це амфіпатичні сполуки, прикладом яких можуть бути солі жирних кислот. Такі речовини розчинитися у воді не можуть, вони диспергують, утворюючи в ній агрегати, які називаються міцелами. У таких структур гідрофільні від'ємно заряджені карбоксильні групи (COO-) повернуті до води, вони взаємодіють з молекулами води як з диполями. Неполярні частини молекули "заховані" всередині міцели (за принципами, наведеними на рис. 2.1, Г). Міцели не об'єднуються, оскільки несуть від'ємний заряд (рис. 2.2). Тому мильна вода (мило, наприклад, олеат натрію) завжди є мутною, бо міцели розсіюють світло.
Ураховуючи незначну енергію водневих зв'язків, час напівжиття та довжину зв'язку 0,26-0,31 нм у рідкій фазі, кожна молекула води при підвищеній температурі зв'язується Н-зв'язками з меншою кількістю аналогічних молекул. При кімнатній температурі кожна молекула води утворює зв'язки з 3-4 іншими молекулами, а в льоді (кристалічна решітка) - зв'язується з максимальною кількістю молекул води, тобто з чотирма. Лід тому й плаває на поверхні води, що його густина менша.
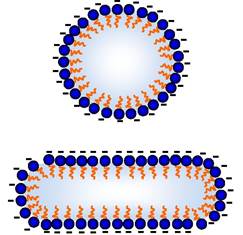
Рис. 2.2. Схема структури міцел із жирних кислот:
"-" - Від'ємний заряд іонізованої карбоксильної групи
Водневий зв'язок є найміцнішим, коли три атоми лежать в одній площині (О---Н-О). Якщо така направленість змінюється, енергія Н-зв'язку зменшується, що обов'язково відбивається на стабілізації (чи зміні) просторової структури макромолекули - білків, нуклеїнових кислот, полісахаридів. Особливо це важливо при формуванні комплементарних зв'язків.
Кооперативний характер утворення Н-зв'язків між сусідніми молекулами відіграє виняткову роль у визначенні властивостей води й льоду. У льоді кожна молекула води зв'язана з усіма своїми чотирма сусідами, утворюючи максимально можливу кількість Н-зв'язків. Суцільна сітка Н-зв'язків об'єднує всі молекули води в єдину систему — «одну гігантську молекулу» з виключно ажурною структурою.
Протони в такій сітці розташовані не посередині між атомами кисню, а розміщуються ближче до атома кисню, з яким зв'язані ковалентним зв'язком. Оскільки будова молекули води симетрична, у протонів є не один, а два стани. Переходи протона з одного стану в інший відбуваються по "тунелю" водневого зв'язку (по пунктиру на рис. 2.1, Б), який полегшує такий перехід у 70 разів. Така здатність протона перебувати у двох можливих станах у структурі льоду, пояснює аномально високу рухливість протона в ньому, яка наближається до рухливості електронів у металах. Важливо зрозуміти, що переміщується не один і той самий протон, а лише форма його вільного стану, тобто протони приєднуються до найближчої молекули води, від якої відщеплюється інший протон і приєднується до наступної і т. д. Така міграція протона через тунелі Н-зв'язків знижує енергетичні бар'єри, тобто для льоду характерна здатність дальнодії.
Істинно молекулярним розчинам притаманні взаємозв'язані властивості: температури кипіння та замерзання, тиску пари та осмотичний тиск. Ці чотири властивості змінюються під впливом розчинених у ній речовин. Але це залежить не від їхньої хімічної природи та розмірів, а від кількості розчинених часток в одиниці об'єму. Це пояснюється тим, що 1 моль будь-якої сполуки має 6,02 х 1023 молекул (число Авогадро). Такі властивості води мають велике біологічне значення. Наприклад, прісноводні риби активні при температурі замерзання води, бо їхня кров (та інші рідини) має достатню концентрацію речовин, щоб її температура замерзання була нижчою, ніж температура замерзання води.
Іншою причиною колігативних властивостей води є те, що розчинені в ній речовини, намагаються зруйнувати водневі зв'язки між молекулами води та "забрати" частину молекул води на утворення гідратних оболонок (рис. 2.1, В). Це погіршує кластер- ну структуру води та її властивості як розчинника. Тому розчини нейтральних солей (NaCl тощо) використовуються для розділення суміші білків ("висолювання" білків), оскільки різні білки по- різному осідають із сольових розчинів.
Особлива увага приділяється іонам Н+ і OH-, які посідають перше місце за впорядковною дією на воду серед одновалентних іонів. У воді Н+ -іон у вільному стані не існує, а комплексує з молекулою води, утворюючи іон гідронію (гідроксонію) H3O+. (Насправді кожний Н+ оточений декількома молекулами Н2О, кількість яких залежить від температури). Іони H3O+ та ОН- координують біля себе по три молекули води, створюючи структуру H3O+ (Н2О)3 та ОН- (Н2О)3. В той же час, іони Н+ та ОН- не локалізовані в просторі, а переміщуються з великою швидкістю, тому їхня впорядковна дія усереднюється по всіх молекулах води. Таким чином проявляється ефект дальнодії в упорядкуванні структури. Дальнодія виявляється і в разі впливу інших іонів на воду, хоч і меншою мірою. Полягає вона в тому, що іони змінюють розміри й час життя впорядкованих кластерів.
Молекулам води притаманна слабко виражена електролітична дисоціація: H2O = Н+ + OH- з константою рівноваги
![]()
Оскільки концентрація Н2О дуже велика (997,07 : 18,0153 = = 55,35 моль/л; 997, 07 - маса 1 л води, 18,0153 - м. м. води) і що до дуже низьких концентрацій іонів (10 7 моль/л при 25 0С) є величиною постійною, то![]() , а 55,35 Kв = [H + ][OH- ].
, а 55,35 Kв = [H + ][OH- ].
Оскільки Kв = 1,821 · 10 16 (визначається електропровідністю чистої води при 25 0С), то це рівняння для іонного добутку води можна записати у вигляді: Kв = [H+ ][OH- ] = const = 55,35 · 1,821 · 10 16 = 100 · 10 16 = 1 · 10 14 . Величина Kв називається іонним добутком води і при температурі 25 0С: Kв = 1 · 10 14 . Такий розчин нейтральний, оскільки концентрація кожного іона H+ і OH- становить 10 7 моль/л. А оскільки Kв завжди дорівнює 10 14 , то в розчинах кислот концентрація [H+ ] дуже висока, а [OH- ] - дуже низька: розчин має кислу реакцію. У розчинах лугів навпаки: [H+ ] < [ OH~ ] - реакція лужна. Отже, кислотність розчину визначається концентрацією в ньому H+. У науковій літературі реакцію середовища у водних розчинах характеризують не молекулярною концентрацією іонів водню, а від'ємним десятковим логарифмом цієї величини: рН = lg 1/[H+ ] = - lg [H+] (символ «р» означає «від'ємний логарифм»). Це дозволяє користуватися невеликими безрозмірними числами від 0 до 14. Шкала рН є не арифметичною, а логарифмічною. Тому, якщо рН двох розчинів відрізняються на одну одиницю рН, то це означає, що концентрація H+ у них відрізняється в 10 разів.
У нейтральному розчині, в якому концентрація іонів Н+ становить 1,0 · 10 7 моль/л, величина рН при 25 0С така:
рН = lg 1/1,0 · 10-7 = -lg (1 · 10-7) = lg (1 · 107) = lg 1,0 + lg107 = 0 + 7 = 7.
Аналогічним способом можна розраховувати рОН (інколи використовується для кількісної характеристики основності, тобто концентрації іонів OH у розчині). У всіх випадках рН + рОН = 14. Проте в біологічних об'єктах виміри проводять при температурі тіла людини (36,6 0С), тоді рН + рОН = lg 2,325 · 10 14 ≈ 13,6. Кислими вважаються розчини з рН < ~ 6,8, а лужними - з рН > ~ 6,8. Це пояснюється тим, що зі зростанням температури збільшується іонний добуток води (при 25 0С рН + рОН = 14, а при 100 0С рН + рОН = 12,26). Водневий показник рН дуже широко використовується в біохімічних дослідженнях, а також у клінічній і фармакологічній практиці для характеристики кислотно-лужних властивостей різних біологічних середовищ і лікувальних препаратів.
Як видно з рис. 2.3, рН біологічних рідин варіює в широких межах. Найнижче значення рН (найвища концентрація іонів Н+) притаманне для шлункового соку, а найвище - для панкреатичного.
Середовище |
[H+], моль/л |
рН |
Середні значення рН для рідин |
Кисле середовище |
1,0 моль/л NаСІ (0,00) |
||
10-1 |
1 |
шлунковий сік (1,65) |
|
10-2 |
2 |
лимонний сік (2,00) |
|
10-3 |
3 |
столовий оцет (3,00) кока-кола (3,20) червоне вино (3,80) |
|
10-4 |
4 |
пиво (4,50) |
|
10-5 |
5 |
кава чорна (5,00) вода насичена СО2 (5,50) сеча (5,80) |
|
10 -6 |
6 |
сік верхнього відділу товстого кишечнику (6,10) сік тонкого кишечнику та молоко (6,51) слина (6,75) жовч пухиря і тканинна рідина м'язів (6,80) |
|
для чистої води 10-7 |
7 |
||
Лужне середовище |
сік середнього відділу товстого кишечнику (7,05) тканинна рідина більшості органів (7,15) сік нижнього відділу товстого кишечнику (7,23) жовч печінкова (7,35) плазма крові (7,36) піт (7,40) спинномозкова рідина (7,60) сльози (7,70) |
||
10-8 |
8 |
морська вода (8,00) сік підшлункової залози (8,80) |
|
10 -9 |
9 |
сода питна (9,00) |
|
10 -10 |
10 |
||
10 -11 |
11 |
||
10 -12 |
12 |
нашатирний спирт (12,00) |
|
10 -13 |
13 |
||
10 -14 |
14 |
1,0 моль/л НаОН (14,00) |
|
Рис. 2.3. Концентрація іонів Н+, відповідні для них значення рН і приклади значень рН для конкретних рідин.
Значення рН для рідин організму мають широкі межі коливань - від 1,65 для шлункового до 8,80 для панкреатичного соків. Концентрація іонів Н+ у шлунковому соку більша, ніж у панкреатичному приблизно в 10 млн разів
Буферними називаються розчини, рН яких практично не змінюється від додавання невеликих кількостей сильних кислоти (Н+) чи лугу (OH-), а також при розбавленні. Найпростіші буферні розчини:
1. Суміш слабкої кислоти та її солі зі спільним аніоном (оцтова кислота СН3СООН і ацетат натрію CH3COONa).
2. Суміш слабкої основи й солі зі спільним катіоном (гідроксид амонію NH4OH і хлорид амонію NH4CI).
На прикладі пари "оцтова кислота - ацетат натрію» розглянемо, на чому основана буферна властивість системи, тобто здатність протидіяти зміні рН при додаванні лугу, стабілізувати на певному рівні концентрацію іонів водню і рН розчину. Оскільки у випадку чистої кислоти [H+ ] = [CH3COO- ], а рівноважна концентрація [СН3СООН] практично рівна загальній концентрації оцтової кислоти (бо вона слабка, слабкодисоційована), то для 0,1 моль/л її розчину концентрація іонів водню
![]()
де 1,75·10-5 - константа електролітичної дисоціації цієї кислоти ![]() . рН такого розчину буде: pH = -lg(1,32·10-3) ≈2,88.
. рН такого розчину буде: pH = -lg(1,32·10-3) ≈2,88.
Якщо до такого розчину додати ацетат натрію, щоб його концентрація в розчині була 0,1 М, то концентрація іонів водню (тепер уже в буферному розчині, а не в розчині оцтової кислоти) зменшиться, що видно з рівняння
![]()
а pH = - lg(1,75 · 10- 5 ) ≈ 4,76 . Це значення рН відповідає значенню рK', як це видно з табл. 2.1 та з рівняння Хендерсона - Хасельбаха, яке аналізується далі. Символ «р» у р K', як і у випадку рН, означає «від'ємний логарифм».
Тепер розглянемо титрування розчину оцтової кислоти розчином NaOH. Іони ОН-, які утворюються при дисоціації лугу,
з'єднуються з іонами H+ з утворенням Н2О. Оскільки завжди KB = [H+][OH] = 1 ·10-14, то при зменшенні [H+ ] за рахунок утворення Н2О, частина недисоційованих молекул CH3COОH дисоціює і концентрація іонів Н+ відновлюється. Тобто, чим більше додається NaOH, тим більше дисоціюють молекули оцтової кислоти. А це означає, що при титруванні розчину оцтової кислоти лугом кількість недисоційованих молекул CH3COOH зменшується, а кількість іонів CH3COO- - збільшується. Коли досягається рівність [CH3COОH] = [CH3COO- ] (середня точка на рис. 2.4), то рН розчину рівна величині р K' оцтової кислоти. У даному випадку рН = р K' = 4,76.
Таблиця 2.1
Приклади констант електролітичної дисоціації (K', М) кислот і величини їхніх р K' при 25 °С
Кислота |
K' |
рK' |
Фосфорна Н3РО4 |
7,25 · 10-3 |
2,14 |
Мурашина Н-СООН |
1,78 · 10-3 |
3,75 |
Вугільна Н2СО3 |
1,70 · 10-4 |
3,77 |
Молочна СН3-СНОН-СООН |
1,38 · 10-4 |
3,86 |
Оцтова СН3СООН |
1,74 · 10-5 |
4,76 |
Дигідрофосфат-іон H2PO4- |
1,38 · 10-7 |
6,86 |
Іон амонію NH4 |
5,62 · 10-10 |
9,25 |
Бікарбонат-іон HCO3 |
6,31 · 10-11 |
10,20 |
Моногідрид-іон HPO4 2- |
3,98 · 10-13 |
12,40 |
При подальшому додаванні лугу молекули оцтової кислоти, що залишились, дисоціюють, іони H+ ідуть на утворення води, а концентрація ацетат-іонів зростає. Процес продовжується до повної дисоціації оцтової кислоти (рис. 2.4). Такий процес титрування можна провести і у зворотному напрямку: додані іони H+ (результат дисоціації доданої кислоти) зв'язуються з CH3COO3 , що призводить до утворення недисоційованих молекул CH3COОH. З поправкою на зміни об'єму, крива зворотного титрування повністю збігається з кривою титрування.
На рис. 2.4 зображено три криві титрування трьох слабких кислот різної природи. Видно, що вони мають однакову форму, але розміщуються на різних рівнях рН через те, що в них різні константи дисоціації (табл. 2.1), тобто мають різну силу. А чим більша сила кислоти, тим легше вона віддає протон. На цих же кривих титрування є відносно пряма ділянка, що свідчить про невеликі зміни рН, хоч луг додається постійними кількостями. Ця ділянка називається буферною областю (зоною) спряженої кислотно-основної пари. У середній точці буферної зони, де концентрація донора протонів рівна концентрації акцептора протона, буферна ємність системи є максимальною, а рН = р K'. З рисунка видно також, що три буферні системи ефективні поблизу значень рН близьких до значень рK'. Тому, користуючись даними, наведеними на рис. 2.3 і 2.4, можна підібрати спряжені кислотно-основні пари як ефективні буферні системи: для сечі - оцтова кислота - ацетат, а для жовчі та крові - пара H2PO4-; -HPO42-. Кислотно-основна пара NH4+-NH3 для біологічних рідин використовується рідко. Ось тому при біохімічних дослідженнях і використовуються найчастіше буферні системи, до складу яких входять Na2CO3, NaHCO3, NaH2PO4, Na2HPO4 або їхні калієві аналоги.
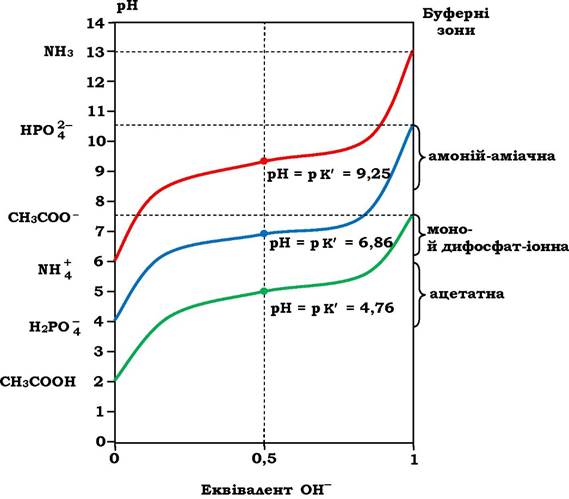
Рис. 2.4. Криві титрування трьох слабких кислот:
ліворуч - форми цих сполук, яких найбільше за даних значень рН; праворуч - буферні зони цих самих буферних систем
У всіх живих організмах позаклітинні та внутрішньоклітинні рідини мають постійну величину рН, що забезпечується буферними системами. У теплокровних найважливішими буферними системами є система оксигемоглобін - гемоглобін, фосфатна та бікарбонатна (гідрокарбонатна) системи. Остання є головною буферною системою плазми крові. Вона спряжена кислотно-основною парою, яка складається з молекули Н2СО3 - донора протона та бікарбонат- іона HCO3 - акцептора протона: Н2СО3 ↔ H+ + HCO3. Унікальною характеристикою цієї системи є те, що один з її компонентів - Н2СО3 утворюється в результаті взаємодії розчиненого у воді (р) СО2 з водою згідно зі зворотною реакцією: СО2 (р) + Н2О ↔ Н2СО3. Концентрація розчиненого СО2 визначається рівновагою з газовою фазою вуглекислого газу: СО2 (г) ↔ СО2 (р).
Бікарбонатна буферна система функціонує при значенні рН близько 7,4, оскільки донор протона Н2СО3 у плазмі крові перебуває в рівновазі з великим резервним об'ємом газоподібного СО2 в об'ємі легень. Якщо кров "змушена" поглинати іони OH3, рН зростає, то кількість Н2СО3 (яка частково перетворилася в HCO3- у результаті взаємодії з OH-) швидко відновлюється за рахунок великого запасу газоподібного СО2 в легенях. СО2 (г) розчиняється в крові, утворюється розчинний СО2 (р), який, реагуючи з водою, утворює Н2СО3. Навпаки, при зниженні рН крові частина HCO3-, зв'язуються з надлишком іонів H+ з утворенням надлишку Н2СО3. Вугільна кислота розпадається з виділенням СО2 (р), який, у свою чергу, переходить у газову фазу СО2 (г) у легенях і видихається організмом.
Фосфатна буферна система характеризується рівновагою між гідрофосфат- і дигідрофосфат-іонами:
![]()
На частку буферної системи оксигемоглобін - гемоглобін припадає близько 75 % буферної ємності крові. Система характеризується рівновагою між іонами гемоглобіну Нb- і самим гемоглобіном ННb, який є дуже слабкою кислотою: Hb- + H+ ↔ ННb; Hb- + Н2О ↔ HHb + OH- , а також між іонами оксигемоглобіну HbO2- і самим оксигемоглобіном HHbO2(трохи сильніша кислота, ніж гемоглобін): HbO2- + H+ ↔ HHbO2; HbO2 + Н2О ↔ HHbO2 + OH-
Іони HCO3-, HPO42-, Hb- і HbO2- є аніонами слабких кислот і ефективними акцепторами іонів H+. Тому, якщо у кров надходять сильні кислоти, то їхні Н+-іони зв'язуються з цими аніонами з утворенням недисоційованих молекул вугільної кислоти, дигідрофосфат-іонів, гемоглобіну, оксигемоглобіну:
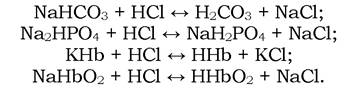
Це означає, що завдяки буферній дії вказаних систем відбувається лише невелике зниження рН крові. Важливо, що при цьому в крові знижується вміст іонів HCO3-, HPO42-, Нb, HbO2, у зв'язку з чим знижується буферна ємність цих систем, або лужний резерв крові. Він вимірюється хімічно зв'язаним (у вигляді гідрокарбонатів) об'ємом СО2 зі 100 мл плазми крові, насиченої газом з таким парціальним тиском СО2, як і в альвеолярному повітрі (53,3 гПа). Лужний резерв крові виражають в об'ємних частках хімічно зв'язаного в крові СО2. У нормі він відповідає 50-70 % (25-30 ммоль/л).
Аналогічні процеси відбуваються в крові при надходженні в неї лугів. У цьому випадку іони гідроксилу, які утворюються при гідролізі відповідних солей, взаємодіють з вільними кислотами Н2СО3, ННb, ННbО2 та іонами дигідрофосфату з виділенням води:
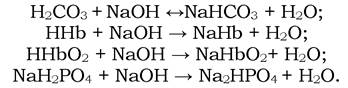
Буферні системи крові протидіють змінам рН у бік його зниження, оскільки в процесі засвоєння поживних речовин в організмі утворюється значна кількість СО2 (550-775 г/добу). При взаємодії СО2 з Н2О утворюється вугільна кислота в кількості, яка еквівалентна надходженню 25-35 моль/добу іонів Н+. Зниженню рН також сприяє перетворення гемоглобіну в оксигемоглобін у легенях, оскільки ННbО2 сильніша за ННb кислоту. У капілярах тканин оксигемоглобін перетворюється на гемоглобін (протилежний процес описаному вище), що збільшує лужний резерв крові.
Зміщення кислотно-лужної рівноваги крові в бік підвищення концентрації іонів Н+ (зниження рН) є зменшенням лужного резерву крові. Такий процес називається ацидозом. Наприклад, при діабеті збільшується концентрація метаболічних кислот, рН крові знижується до 6,5-6,8. Підвищення рН через зниження концентрації іонів Н+ , а це є підвищенням резервної лужності, називається алкалозом. Ацидоз і алкалоз виникають або в результаті безпосереднього надходження в організм надлишку продуктів з підвищеною кислотністю чи лужністю (їжа, вода, напої, медикаменти, забруднене повітря), або є результатом аномальної евакуації з організму такого типу речовин при різних патологічних станах організму: порушення обміну речовин, функцій дихання, кровообігу.
У клінічній практиці кислотно-лужну рівновагу організму визначають шляхом дослідження крові за методом Аструпа й виражають в одиницях ВЕ (лат. «бі-ексцесс» - надлишок основ). Норма (рН = 7,40) - ВЕ = 0. При значеннях ВЕ від 0 до ± 3 кислотно-лужний стан організму також вважається нормальним, при ВЕ = ± (6-9) - тривожним, при ВЕ - ± (10-14) - загрозливим, а при ВЕ > 14 - критичним.
Криві титрування слабких кислот, у тому числі описаних вище, свідчать про загальну закономірність. Форма кривих титрування описується рівнянням Хендерсона - Хасельбаха, (однією з форм вираження константи електролітичної дисоціації кислот), аналіз якого допомагає зрозуміти буферні властивості крові, що забезпечують підтримання в ній кислотно-основної рівноваги. Константа дисоціації кислоти K' (часто позначається як Ка — «а» від англ. acid - кислота) виражається таким чином:
![]()
Від'ємні логарифми членів рівняння мають такий вигляд: - lg [H+ ] = - lgK' - lg [HA]/[A- ] або pH = pK' - lg[HA]/[A- ], що (після заміни місцями чисельника і знаменника зі зміною знаку "-" на "+") відповідає pH = pK' + lg [A-]/lg[HA] і означає рН = рK' + lg[акцептор протонів]/[донор протонів]. Це і є рівняння Хендерсона - Хасельбаха, з якого можна зрозуміти, чому величина р K' слабкої кислоти чисельно рівна величині рН розчину цієї кислоти в середній точці титрування: тому що в цій точці [HA] = [A- ]. Тоді рН = р K' + lg 1,0 = р K' + 0 = р K'.
Крім того, це рівняння дає можливість вирахувати величину р K' за даного рН, розрахувати співвідношення між молярними концентраціями донора й акцептора протонів за будь-якого значення рН. З рівняння видно, що концентрація іонів H+у буферному розчині залежить не тільки від концентрації K' слабкої кислоти чи слабкої основи, а й від концентрації солі, яка має з кислотою загальний аніон, або з основою - загальний катіон. Чим вища концентрація солі в буферних розчинах типу «слабка кислота - її сіль», тим менша в них концентрація іонів Н+. За рівних концентрацій кислоти й солі концентрація іонів Н+ у таких розчинах наближається до значення, рівного константі дисоціації кислот:
![]()
З описаного зрозуміло, що здатність буферного розчину зберігати рН у міру титрування на постійному рівні обмежена буферною ємністю. За її одиницю беруть ємність такого буферного розчину, для зміни рН якого на одиницю необхідне введення кислоти (або лугу) у кількості 1 моль еквівалента на 1 л розчину. Буферна ємність (В) визначається таким чином:
![]()
де рНі і рН2 - крайні значення рН буфера, С - концентрація кислоти (чи лугу). Буферна ємність розчину зростає із збільшенням концентрації його компонентів і наближення співвідношення кислоти до її солі (чи лугу до його солі) до одиниці. Загальна буферна ємність артеріальної крові становить 25,3 ммоль/л; у венозної крові вона дещо нижча - 24,3 ммоль/л.
Збереження постійності рН рідин організму має для життєдіяльності організму першорядне значення щонайменше з трьох причин:
1) іони Н+ виявляють каталітичну дію на багато біохімічних перетворень;
2) ферменти й гормони виявляють біологічну активність тільки у визначеному інтервалі значень рН;
3) навіть невеликі зміни концентрації Н+ у крові й міжклітинній рідині істотно впливають на величину осмотичного тиску в цих рідинах.