БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 3. КЛІТИНА І ПОЗАКЛІТИННИЙ МАТРИКС
3.3. Позаклітинний матрикс
За сучасними уявленнями позаклітинний матрикс є супрамолекулярним комплексом, який утворює клітинне оточення і впливає на диференціювання, проліферацію, організацію та прикріплення клітин. Він відіграє ключову роль в органогенезі, ембріогенезі, загоюванні ран, пухлинній інвазії й метастазах пухлин. Матрикс утворює і тверді структури кісток і зубів, формує прозору речовину рогівки ока, набуває форми каната, що робить сухожилля дуже міцними на розрив. Спеціалізована форма позаклітинного матриксу - базальна мембрана є місцем прикріплення клітин і впливає на міграцію й фенотипування клітин. Механічна стабільність базальної мембрани забезпечується колагеном IV типу (рис. 3.4; 5), який утворює не фібрили (як інші типи колагенів - рис. 3.4., 2), а сітку. Окрім колагену, до складу базальної мембрани входить глікопротеїн ламінін (рис. 3.4, 3) - хрестоподібна структура з трьох поліпептидних ланцюгів, зв'язаних дисульфідними зв'язками. Цей білок відіграє роль адгезивного субстрату для різних клітин, підсилює проліферацію, зв'язується з інтегринами, колагеном IV та нідогеном (ентактином) - гантелеподібною молекулою.
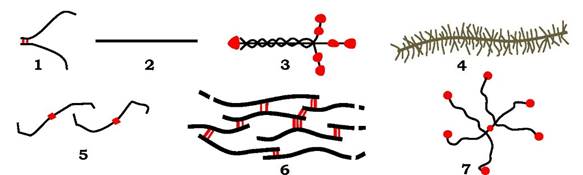
Рис. 3.4. Основні білкові компоненти позаклітинного матриксу:
1 - фібронектин; 2 - колагени типу І, ІІ, ІІІ, V, VI та ін.; 3 - ламінін; 4 - протеоглікан; 5 - колаген типу IV; 6 - еластин; 7 — тенасцин
Базальна мембрана складається з двох шарів: електронно-прозорого шару (lamina lucida, або rara), який прилягає до плазматичної мембрани клітин, що "лежать" на базальній мембрані. Під цим шаром лежить шар електроннощільний (lamina densa). Інколи спостерігається і третій шар, в якому локалізовані колагенові фібрили (lamina reticularis), який зв'язує базальну мембрану зі сполучною тканиною. Функції базальної мембрани різноманітні: як молекулярний фільтр регулює перехід молекул із крові в сечу; слугує вибірковим бар'єром для клітин (наприклад, бар'єр між епітеліальними клітинами і фібробластами сполучної тканини, але пропускає макрофаги, лімфоцити, нервові волокна); є субстратом для міграції регенеруючих клітин, координує просторову організацію компонентів по обидва боки синапсу та ін.
Важливим компонентом позаклітинного матриксу є родина колагенів (рис. 3.4, 2, 5) - фібрилярних білків, які становлять 25 % від усіх білків організму ссавців. Молекула має вигляд триланцюгової спіралі довжиною 300 нм, з них утворюються колагенові фібрили (товщиною до 300 нм), що групуються в колагенові волокна товщиною в кілька мікрометрів, які видно під світловим мікроскопом. Так побудовані колагени І, ІІ. IІІ і ін. типів, окрім колагену IV. У колагенах присутні «нестандартні» амінокислоти - гідроксилізин і гідроксипролін (рис. 3.5, 1, 2), які утворюють водневі зв'язки між поліпептидами і стабілізують триланцюгову спіраль.
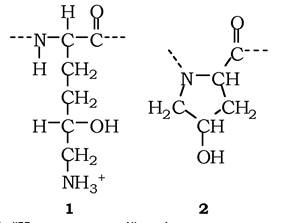
Рис. 3.5. "Нестандартні" амінокислоти колагенів:
1 - гідроксилізин; 2 — гідроксипролін
Гідроксилювання амінокислот відбувається в цистернах ендоплазматичного ретикулума. Гідроксипролін утворюється в присутності аскорбінової кислоти - вітаміну С. При цинзі - хвороба людини за відсутності даного вітаміну - негідроксильовані ланцюги не можуть утворити потрійну спіраль, кровоносні судини стають ламкими, а зуби починають хитатись. На сьогодні ідентифіковано понад 20 різних ланцюгів колагену, з яких теоретично можна побудувати більш ніж 1000 видів триланцюгових молекул. Фактично поки що ідентифіковано лише 10 колагенів, серед яких найбільш вивченими є колагени І, ІІ, ІІІ і IV. Перший із них найпоширеніший і становить 90 % колагенів організму, входить до складу майже всіх органів (табл. 3.2). До складу цих чотирьох колагенів входить два типи α-ланцюгів - а 1 і а2.
Таблиця 3.2
Чотири основні типи колагену та їхні властивості
Тип |
Формула |
Полімерна формула |
Характерні риси |
Місцезнаходження в організмі |
І |
[α1]2α2 |
Фібрила |
Мало гідроксилізину, мало вуглецю, товсті фібрили. |
Шкіра, сухожилля, кістка, зв'язки, рогівка, внутрішні органи (становить 90 % від усього колагену в організмі). |
ІІ |
[α1]3 |
Фібрила |
Багато гідроксилізину, багато вуглецю, фібрили тонші, ніж у типу І. |
Хрящ, міжхребцеві диски, хорда, склисте тіло ока. |
ІІІ |
[α1]3 |
Фібрила |
Багато гідроксипроліну, мало гідроксилізину, мало вуглецю. |
Шкіра, кровоносні судини, внутрішні органи. |
IV |
[α1]2α2 |
Базальна мембрана |
Дуже багато гідроксилізину, багато вуглецю; зберігає кінцеві пептиди проколагену. |
Базальні мембрани. |
Певні тканини повинні не тільки витримувати механічне навантаження, а й бути еластичними. Це забезпечується компонентом позаклітинного матриксу еластином (рис. 3.4, 6) - гідрофобний негліколізований білок, який має мало гідроксипроліну, а гідро- ксилізин - відсутній. Еластин завдяки зшивкам із залишків лізину утворює розгалужену сітку, яка може розтягуватись у 5 разів більше, ніж гумова стрічка такого самого перерізу. Вплетені в таку сітку колагенові фібрили (які міцніші за сталевий дріт такого ж діаметра) обмежують її розтягування й розрив тканини.
Складовими позаклітинного матриксу є й кілька адгезивних глікопротеїнів, згаданий ламінін, а також фібронектин і тенасцин. Фібронектин (рис. 3.4, 1) - димер з дисульфідними зв'язками, існує в трьох формах. Розчинна димерна форма (фібронектин плазми) сприяє згортанню крові, загоєнню ран і фагоцитозу. Поверхневий і матриксний фібронектини - зв'язані в олігомерну форму димери. Фібронектини є багатофункціональними молекулами. Вони зв'язуються з клітинними рецепторами типу інтегринів, з колагеном, з гепарином та іншими компонентами позаклітинного матриксу, тобто беруть участь у формуванні матриксу та в прикріпленні до нього клітин, міжклітинної адгезії, у визначенні шляхів міграції клітин і морфогенетичних рухів.
Тенасцин (рис. 3.4, 7) також є адгезивним глікопротеїном, але поширений менше, найчастіше зустрічається в ембріональних тканинах. Форма тенасцину нагадує колесо, шпицями якого є шість поліпептидних ланцюгів, зв'язаних дисульфідними зшивками.
Другий клас макромолекул позаклітинного матриксу - полісахариди глікозаміноглікани - довгі нерозгалужені полісахаридні ланцюги з дисахаридів, які здебільшого представлені сульфатованим (по С-4 гексози) N-ацетилглюкозаміном або N-ацетилгалактозаміном звідси й назва) і уроновою кислотою (рис. 3.6, 2). Наявність у молекулах сульфатних і карбоксильних груп надає глікозаміногліканам значний від'ємний заряд, які притягують осмотично активні іони Na+ . Це приводить до збільшення кількості води в позаклітинному матриксі, що забезпечує його протистояння стискуванню (на противагу колагеновим волокнам, які протидіють розтягуванню). Хоча глікозаміноглікани становлять лише 10 % від складових позаклітинного матриксу, вони займають більше об'єму, оскільки утворюють розпушений гідратований гель. Глікозаміноглікани є в позаклітинних матриксах усіх тканин і поділяються на чотири групи: гіалуронова кислота, хондроїтин- і дерматансульфати, гепарансульфат і гепарин та кератансульфат (табл. 3.3).
Таблиця 3.3
Глікозаміноглікани
Група |
Глюкозамі- ноглікан |
Молекулярна маса |
Дисахарид, що повторюється( А-В) n |
Кількість сульфо груп на дисахарид |
Зв'язок із білком |
|
Залишок А |
Залишок В |
|||||
1 |
Гіалуронова кислота |
4·103 - 8·106 |
D-глюкуронова кислота |
N-ацетил-D- глюкозамін |
0 |
- |
2 |
Хондроїтин - сульфат |
5·103 - 5·104 |
N-ацетил-D- галактозамін |
0,2-0,3 |
+ |
|
Дерматан-сульфат |
15·103 - 4·104 |
D-глюкуронова кислота або L-ідуронова кислота |
- |
1,0-2,0 |
+ |
|
3 |
Гепаран-сульфат |
5·103 - 12·103 |
N-ацетил-D- глюкозамін |
0,2-2,0 |
+ |
|
Гепарин |
6·103 - 25·103 |
- |
2,0-0,3 |
+ |
||
4 |
Кератан-сульфат |
4·103 - 19·103 |
D-галактоза |
- |
0,9-1,8 |
+ |
До дерматансульфату окрім D-глюкуронової кислоти часто входить L-ідуронова кислота, яка є продуктом епімеризації першої за місцем приєднання карбоксильної групи. Це означає, що дерматансульфат можна вважати модифікованою формою хондроїтинсульфату.
Гіалуронова кислота складається з повторів несульфатованих дисахаридних одиниць (рис. 3.6, 2), зустрічається в усіх тканинах і рідинах тварин, особливо її багато в ранніх зародків. Це зумовлено тим, що кислота виконує особливу функцію там, де відбувається міграція клітин, загоєння ран. Тобто при морфогенезі й регенерації локально збільшується синтез гіалуронової кислоти, що викликає набухання матриксу. У синовіальній рідині ця кислота відіграє роль мастила. Руйнується гіалуронова кислота гіалуронідазою.
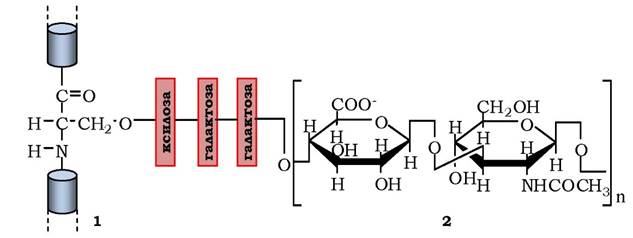
Рис. 3.6. Схема приєднання через зв'язувальний трисахарид глікозамінового ланцюга до білка з утворенням протеоглікану:
1 - білок із залишком серину; 2 — глікозаміноглікан
Глікозаміноглікани широко представлені в організмі. Гіалуронова кислота локалізована в різноманітних сполучних тканинах, шкірі, склистому тілі, хрящах, синовіальній рідині. Хондроїтин-сульфат локалізується переважно у хрящі, рогівці, кістках, шкірі, артеріях, а дерматансульфат - у шкірі, кровоносних судинах, серці, серцевих клапанах. Гепарансульфат переважає в легенях, артеріях, на поверхні клітин, у базальній мембрані. Гепарин є в легенях, печінці, шкірі, тучних клітинах, а кератансульфат - у хрящах, рогівці, міжхребцевих дисках.
За винятком гіалуронової кислоти, усі глікозаміноглікани ковалентно зв'язані з білками у формі протеогліканів (рис. 3.4, 4; 3.6). Ці білки від глікопротеїнів відрізняються тим, що мають до 95 % вуглеводів (за масою) у вигляді нерозгалужених ланцюгів, кожний із 80 залишків без сіалових кислот. Глікопротеїни мають короткі (до 15 цукрових залишків) розгалужені олігосахаридні ланцюги, які часто закінчуються сіаловою кислотою.
Протеоглікани різняться між собою білком, молекулярною масою, кількістю, типом і довжиною глікозаміногліканових ланцюгів, розміщенням гідроксильних, карбоксильних і сульфатних груп, що забезпечує їм майже необмежене розмаїття. Вони зв'язуються через глікозаміногліканові ланцюги з фібронектинами, колагенами, ламінінами, факторами росту, взаємодіють із клітинною поверхнею, а також деякі із них є власними інтегральними компонентами плазматичної мембрани. Тому питання, де закінчується плазматична мембрана і де розпочинається позаклітинний матрикс, залишається значною мірою семантичним.
Глікозаміноглікани і протеоглікани в матриксі зв'язані один з одним і з фібрилярними білками. Наприклад, головний протеоглікан хряща із вмістом кератин- і хондроїтинсульфату організовані в матриксі у великі агрегати (рис. 3.7), які нековалентно зв'язані через свої серцевинні білки з макромолекулою гіалуронової кислоти. З однією молекулою цієї кислоти зв'язується приблизно 100 мономерів протеогліканів, утворюючи гігантський комплекс із м. м. 100 млн (і більше), який займає простір, рівний об'єму бактерії.
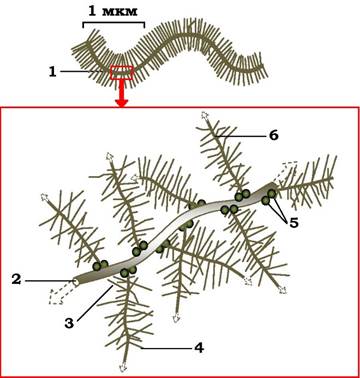
Рис. 3.7. Схема будови гігантського протеогліканового агрегату:
1 - частина протеогліканового агрегату; 2 - серцевина з гіалуронової кислоти; 3 - кератансульфат; 4 - хондроїтинсульфат; 5 - зв'язувальний білок; 6 - серцевинний білок
Отже, позаклітинний матрикс складається в основному із фібрилярних білків, занурених у гідратований полісахаридний гель. Завдяки високій щільності від'ємних зарядів останнього в матриксі локалізуються іони натрію, що веде до сильної гідратації гелю. Це створює тургор (тиск набухання). А білки (головним чином колаген, фібронектин, еластин та ін.) укріплюють і впорядковують позаклітинний матрикс, надають йому пружності, сприяють прикріпленню до нього клітин.
Базальна мембрана - це тонкий шар спеціалізованого позаклітинного матриксу. Вона підстилає пласти епітеліальних клітин, розташовується між двома різними шарами клітин у легеневих альвеолах і ниркових клубочках, обволікає окремі м'язові волокна, жирові клітини тощо. Ці утворення слугують структурною опорою, високоефективним фільтром і вибірковим бар'єром, визначають полярність клітин, впливають на клітинний метаболізм і диференціацію клітин, відіграють важливу роль у регенерації тканини, координують просторову організацію компонентів по обидва боки синапсу, посідають важливе місце в регулюванні процесів морфогенезу, упорядковують вуглеводи й білки в прилеглих плазматичних мембранах. В останньому випадку йдеться про взаємодію позаклітинного матриксу з глікокаліксом - збагаченою вуглеводами позаклітинною поверхнею плазматичної мембрани. За допомогою спеціальних білків-рецепторів цитоскелет, плазматична мембрана й позаклітинний матрикс об'єднуються в динамічну рухливу структуру. Це забезпечує передачу механічних сигналів уздовж і впоперек мембрани, відіграє важливу роль в прояві адгезивних властивостей та імунних реакцій клітини, у створенні й підтриманні орієнтації клітин у тканинах і органах у процесі розвитку, трансдукції зовнішніх сигналів у біохімічні процеси.