БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 4. МОЛЕКУЛЯРНА ОРГАНІЗАЦІЯ І БІОЛОГІЧНІ ФУНКЦІЇ МЕМБРАН
4.2. Молекулярна організація мембран
4.2.2. Мембранні білки
Багато білків пронизують бішар ліпідів (рис. 4.6) і називаються трансмембранними (інтегральними). Гідрофобність деяких білків збільшується за рахунок ковалентно приєднаних до них ланцюгів жирної кислоти, інші білки асоційовані з ліпідним бі- шаром за рахунок ковалентних зв'язків через специфічний олігосахарид з фосфатидилінозитолом. Окремі білки зв'язані з мембраною без контактів з ліпідами за рахунок нековалентних зв'язків з іншими власне мембранними білками. Вони легко вивільнюються з мембрани при змінах іонної сили чи рН розчину. Такі білки називають периферичними. Оскільки пептидні групи полярні, а молекул води в ліпідному матриксі мало, то всі пептидні групи в ліпідному бішарі намагаються утворити Н-зв'язки між собою. Число водневих зв'язків між такими пептидними групами буде максимальним, якщо ділянка поліпептидного ланцюга, яка проходить через бішар, утворює регулярну правозакручену α-спіраль. Умови максимізації кількості Н-зв'язків за відсутності води означає, що поліпептидний ланцюг у ліпідному бішарі не змінює свого напрямку, не має згинів, оскільки наявність останніх зменшила б число регулярних Н-зв'язків. Можливо тому досі не виявлено білків, занурених у ліпідний бішар лише частково. Цитоплазматичні домени білка не утворюють дисульфідних зв'язків через відновні умови в цитозолі.
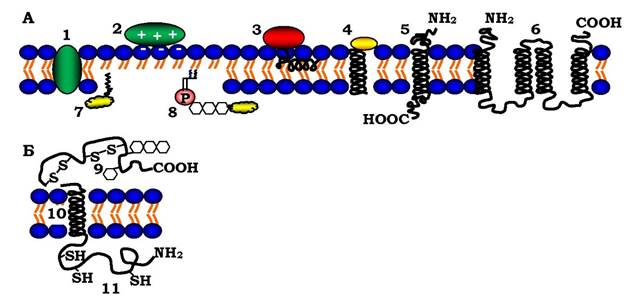
Рис. 4.6. Різні способи асоціації мембранних білків з ліпідним матриксом мембрани:
А: 1 - інтегральний білок (сукцинатдегідрогеназа); 2 - електростатичне зв'язування периферичного білка з голівками фосфоліпідів (основний білок мієліну); 3 - гідрофобне зв'язування периферичного білка (кінцевим спіральним фрагментом) за межами гідрофільних ліпідних голівок (піруватоксидаза); 4 - вбудовування інтегрального білка коротким кінцевим фрагментом (цитохром); 5 - інтегральний білок з однією трансмембранною α-спіраллю (глікофорин); 6 - інтегральний білок з більш ніж однією трансмембранною α-спіраллю (лактозопермеаза, родопсин); 7, 8 - периферичні білки, зв'язані з мембраною через жирну кислоту і через фосфатидилінозитол (лужна фосфатаза). Б: Трансмембранний глікопртеїн, який проходить бімолекулярний ліпідний шар один раз: 9 - позаклітинний білковий домен із S-S-зв'язками та олігосахаридами; 10 - внутрішньомембранна α-спіраль; 11 - цитоплазматичний домен білка з SH-групами
Трансмембранні білки локалізовані в мембрані асиметрично, що відображає асиметричний характер їхнього біосинтезу і вбудовування в мембранний бішар ендоплазматичного ретикулума, а також різні функції цитоплазматичних і позаклітинних доменів цих білків. Олігосахаридні ланцюги мембранних глікопротеїнів і протеогліканів (див. розділ 3) завжди локалізовані на позаклітинному боці мембрани. Свідченням асиметрії білків є внутрішньо- та між- ланцюгові дисульфідні зв'язки лише в позаклітинних доменах.
Розміщення білків на цитоплазматичному боці плазматичної мембрани найліпше вивчати на "тінях" еритроцитів, які легко отримати, помістивши еритроцити в гіпотонічний розчин. Вода входить в еритроцити, вони набухають і лопаються, вивільнюючи вміст клітини. На таких об'єктах установлено, що більшість мембранних білків еритроцитів - це периферичні білки. Найпоширеніший із них - спектрин. Це паличкоподібна молекула, яка є найважливішим компонентом цитоскелета еритроцита, підтримує цілісність і форму клітини. Молекула спектрину складається з двох поліпептидів: α-спектрину (240 кДа) і β-спектрину (220 кДа). Такі спектринові гетеродимери самовільно агрегують голова до голови, утворюючи тетрамер довжиною 200 нм. Кінці кількох тетрамерів зв'язуються між собою актиновим філаментом і білком смуги 4.1, формуючи вузловий комплекс (рис. 4.7). Так утворюється сіткоподібна структура на цитоплазматичному боці мембрани, яка дозволяє еритроцитам протистояти тиску на мембрану при проходженні через вузькі капіляри. До мембрани спектриновий цитоскелет приєднується через анкірин: цей білок одним кінцем зв'язується з β-спектрином, а другим - з інтегральним білком смуги 3 (білки смуги 3 і 4.1 названо за номерами смуг, де вони локалізуються після електрофорезу). Окрім цього, білок смуги 4.1 зв'язує вузловий комплекс із цитоплазматичним доменом інтегрального білка глікофорину. Цей білок, кількість якого в еритроциті сягає 105 молекул, став першим мембранним білком, для якого була визначена повна амінокислотна послідовність - 131 залишок. Більша частина глікофорину локалізована в зовнішньому моношарі мембрани, де локалізований і його гідрофільний N-кінець, і 15 олігосахаридних бокових ланцюгів (~100 моносахаридів, 60 % маси всього глікопротеїну), в якому багато сіалових кислот, які формують від'ємний заряд клітинної поверхні. Гідрофільний С-кінець глікофорину занурений у цитозоль, а гідрофобний α-спіральний домен (20 залишків)
локалізований у ліпідному матриксі. Глікофорин належить до класу мембранних глікопротеїнів, які перетинають ліпідний бішар один раз у вигляді α-спіралі (рис. 4.7)
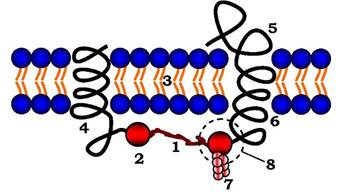
Рис. 4.7. Схема локалізації білків мембранного скелета еритроцита:
1 - спектрин; 2 - анкірин; 3 - ліпідний бішар мембрани; 4 - білок смуги 3; 5 - глікофорин; 6 - білок смуги 4.1;
7 - актин; 8 - вузловий комплекс
Білок смуги 3 (рис. 4.7), як і глікофорин, є трансмембранним білком, перетинає ліпідний бішар 10 разів. Його основною функцією є участь в обміні О2 і СО2 шляхом заміни іонів HCO3- на Сl-. Аналогічні (але складніші) цитоскелетні сітки лежать в основі плазматичних мембран ядерних клітин.
Багатьом клітинам притаманна властивість утримувати мембранні білки в специфічних доменах. Наприклад, в епітеліоцитах кишечнику деякі ферменти плазматичної мембрани та транспортні білки розміщуються тільки на апікальній поверхні клітини, а інші - на базальній і латеральній Ліпідний склад цих двох доменів також відмінний. Такий просторовий розподіл білків і ліпідів у цих клітинах підтримується щільними міжклітинними контактами. Обмеження латеральної рухливості мембранних білків забезпечується також зв'язуванням їх з макромолекулярними структурами зовні та всередині клітини, з цитоскелетом, з позаклітинним матриксом.
Отже, мембранні білки виконують функції рецепторів і ферментів, забезпечують трансмембранне переміщення речовин, міжклітинні взаємодії тощо. Серед них є білки, які перетинають бішар ліпідів як поодинока α-спіраль чи серії таких спіралей, або асоційовані на обох боках мембрани за рахунок ковалентних зв'язків з ліпідами і нековалентних взаємодій з інтегральними білками. Більшість білків здатні до латеральної дифузії зі значно меншою, ніж ліпіди, швидкістю. Є білки, які утримуються у вигляді доменів.