БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.1. Будова та властивості амінокислот, які входять до складу білків. Пептидні зв’язки
5.1.3. Хімічні реакції, які використовують для виявлення амінокислот
Здатність амінокислот вступати в ті чи інші реакції визначається наявністю в їхньому складі функціональних груп. Оскільки всі амінокислоти, що входять до складу білків, містять біля α-вуглецевого атома аміно- та карбоксильну групи, вони можуть вступати в характерні для всіх амінокислот хімічні реакції. Наявність будь-яких функціональних груп у радикалах індивідуальних амінокислот визначає їхню здатність вступати у специфічні для даних амінокислот реакції.
Нінгідринова реакція на α-амінокислоти. Для виявлення та кількісного визначення амінокислот, що містяться в розчині, можна використовувати нінгідринову реакцію. Ця реакція заснована на тому, що безбарвний нінгідрин, реагуючи з амінокислотою, конденсується у вигляді димеру через атом азоту, який відщеплюється від α-аміногрупи амінокислоти. У результаті утворюється пігмент червоно-фіолетового кольору. Одночасно відбувається декарбоксилювання амінокислоти, що приводить до утворення СО2 і відповідного альдегіду. Нінгідринову реакцію широко використовують під час вивчення первинної структури білка:
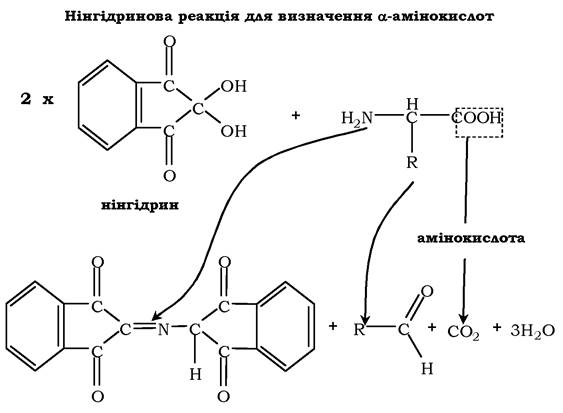
Оскільки інтенсивність забарвлення є пропорційною кількості амінокислот у розчині, її використовують для визначення концентрації α-амінокислот.
Специфічні реакції на окремі амінокислоти. Якісне та кількісне визначення окремих амінокислот стає можливим завдяки наявності в їхніх радикалах особливих функціональних груп. Аргінін визначають за допомогою якісної реакції на гуанідинову групу (реакція Сакагучі), а цистеїн виявляють реакцією Фоля, специфічною для SH-групи даної амінокислоти. Наявність ароматичних амінокислот у розчині визначають ксантопротеїновою реакцією (реакція нітрування), а наявність гідроксильної групи в ароматичному кільці тирозину - за допомогою реакції Міллона.