БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.2. Структура білків
5.2.3. Третинна структура білків
Третинна структура білків - це тривимірна просторова структура, що утворюється за рахунок взаємодій між радикалами амінокислот, які можуть розмішуватися на значній відстані один від одного в поліпептидному ланцюзі.
Зв'язки, які беруть участь у формуванні третинної структури білків. Під час укладання поліпептидний ланцюг білка намагається прийняти енергетично вигідну конформацію, яка характеризується мінімумом вільної енергії. Тому гідрофобні радикали амінокислот прагнуть до об'єднання всередині глобулярної структури розчинених у воді білків. Між ними виникають так звані гідрофобні взаємодії, а також вандерваальсові сили між близько розташованими атомами. У результаті всередині білкової глобули формується гідрофобне ядро. Гідрофільні групи пептидного каркаса під час формування вторинної структури утворюють велику кількість водневих зв'язків, завдяки чому виключається зв'язування з ними води й руйнування внутрішньої, щільної структури білка.
Гідрофільні радикали амінокислот прагнуть утворити водневі зв'язки з водою і тому в основному розміщуються на поверхні білкової молекули. Усі гідрофільні групи радикалів амінокислот, опинившись усередині гідрофобного ядра, взаємодіють одна з одною за допомогою іонних і водневих зв'язків (рис. 5.11).
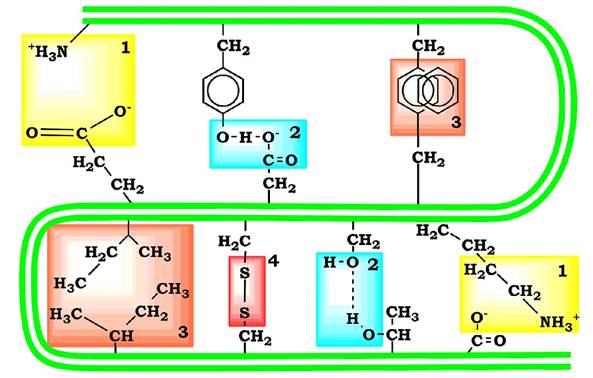
Рис. 5.11. Типи зв'язків, які виникають між радикалами амінокислот під час формування третинної структури білка:
1 - іонні; 2 - водневі; 3 - гідрофобні; 4 — дисульфідні
Іонні зв’язки можуть виникати між негативно зарядженими (аніонними) карбоксильними групами радикалів аспарагінової та
глутамінової кислот і позитивно зарядженими (катіонними) групами радикалів аргініну, лізину або гістидину.
Водневі зв’язки виникають між гідрофільними незарядженими групами (такими, як -ОН, -CONH2, SH-групи) і будь-якими іншими гідрофільними групами.
Білки, що функціонують у неполярному (ліпідному) оточенні, наприклад білки мембран, мають іншу будову: гідрофільні радикали амінокислот розміщені всередині білка, тоді як гідрофобні амінокислоти локалізовані на поверхні молекули й контактують з неполярним оточенням. У кожному випадку радикали амінокислот займають найвигідніше біоенергетичне положення.
Третинну структуру деяких білків стабілізують дисульфідні зв’язки, які утворюються за рахунок взаємодії SH-груп двох залишків цистеїну. Ці два залишки цистеїну можуть бути розташовані далеко один від одного в лінійній первинній структурі білка, але під час формування третинної структури вони зближуються й утворюють міцний ковалентний зв'язок між радикалами (рис. 5.12).
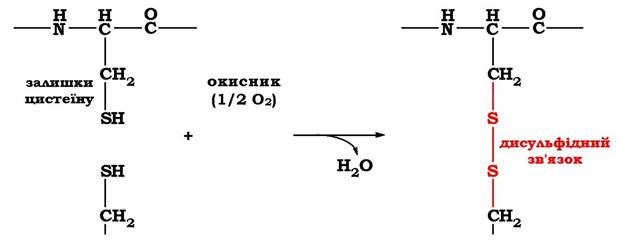
Рис. 5.12. Утворення дисульфідного зв'язку в білках
Більшість внутрішньоклітинних білків позбавлені дисульфідних зв'язків. Але такі зв'язки поширені в білках, що секрету- ються клітиною в позаклітинний простір. Вважають, що ці ковалентні зв'язки стабілізують конформацію білків поза клітиною і запобігають їхній денатурації. До таких належать гормон інсулін та імуноглобуліни.
Інсулін - білковий гормон; містить 51 амінокислоту, складається з двох поліпептидних ланцюгів (ланцюг А містить 21 амінокислоту, ланцюг В - 30 амінокислот). Інсулін синтезується в β-клітинах підшлункової залози й секретується в кров у відповідь на підвищення концентрації глюкози в крові. У структурі інсуліну є два дисульфідні зв'язки, що з'єднують два поліпептидні ланцюги А і В, і один дисульфідний зв'язок усередині ланцюга А (рис. 5.13).
Усі білки з однаковою первинною структурою, що знаходяться в однакових умовах, набувають однакової, характерної для даного індивідуального білка конформації, що визначає його специфічну функцію. Функціонально активну конформацію білка називають «нашивна структура».
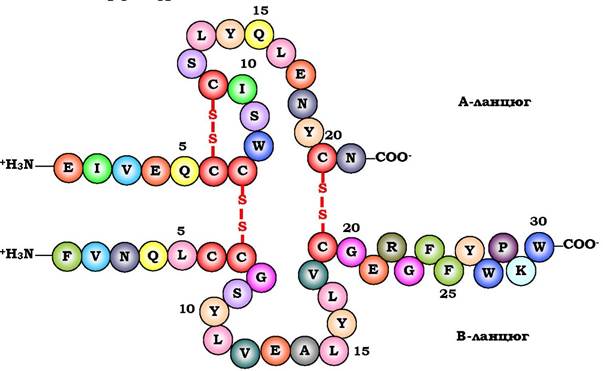
Рис. 5.13. Дисульфідні зв'язки у структурі гормону інсуліну
Гідрофобні взаємодії, а також іонні та водневі зв'язки належать до розряду слабких, оскільки їхня енергія лише ненабагато перевищує енергію теплового руху атомів при кімнатній температурі (уже за цієї температури можливий розрив таких зв'язків). Підтримання характерної для білка конформації є можливим завдяки виникненню великої кількості слабких зв'язків між різними ділянками поліпептидного ланцюга.
Білки складаються з величезної кількості атомів, які перебувають у постійному (броунівському) русі, що приводить до невеликих переміщень окремих ділянок поліпептидного ланцюга, які зазвичай не порушують загальну структуру білка та його функції. Отже, білкам притаманна конформаційна лабільність - схильність до невеликих змін конформації за рахунок руйнування одних і утворення інших слабких зв'язків. Конформація білка може змінюватися в разі зміни хімічних і фізичних властивостей середовища, а також при взаємодії білка з іншими молекулами. Унаслідок цього відбувається зміна просторової структури не тільки ділянки, що контактує з іншою молекулою, але й конформації білка в цілому. Конформаційні зміни відіграють величезну роль у функціонуванні білків у живій клітині.
Розрив великої кількості слабких зв'язків у молекулі білка приводить до руйнування її конформації. Оскільки розрив зв'язків за дії різних факторів має випадковий характер, то молекули одного індивідуального білка набувають у розчині форми випадково сформованих невпорядкованих клубків, що відрізняються один від одного тривимірною структурою. Втрата нативної конформації супроводжується втратою специфічної функції білків. Цей процес називається денатурацією білків. Розриву пептид- них зв'язків під час денатурації білків не відбувається, тобто первинна структура білка не порушується.
У денатурованому білку гідрофобні радикали, які в нативній структурі молекули заховані всередині гідрофобного ядра, опиняються на поверхні. За достатньо великої концентрації білка й за відсутності сильного відштовхувального заряду молекули можуть об'єднуватись одна з одною гідрофобними взаємодіями, при цьому розчинність білка знижується й відбувається утворення осаду.
Компактна, щільна просторова структура нативного білка під час денатурації стрімко збільшується в розмірах і стає легко досяжною для розщеплення пептидних зв'язків протеолітичними ферментами (рис. 5.14). Термічна обробка м'ясної їжі перед уживанням не тільки поліпшує її смакові якості, але й полегшує її ферментативне перетравлювання в травній системі. Крім того, денатуруючу дію на харчові білки має і кисле середовище шлунка, що викликає денатурацію тих білків, які не піддавалися попередній температурній обробці, а також чинить денатуруючий вплив на білки мікроорганізмів, які потрапили до шлунку з їжею.
Денатурацію білків викликають фактори, котрі сприяють розриву гідрофобних, водневих та іонних зв'язків, які стабілізують конформацію білків:
✵ висока температура (понад 50 °С), що збільшує тепловий рух атомів і молекул і приводить до розриву слабких зв'язків;
✵ інтенсивне струшування розчину, що спричинює зіткнення білкових молекул з повітряним середовищем на поверхні розділу фаз і зміни конформації цих молекул;
✵ органічні речовини (наприклад, етиловий спирт, фенол і його похідні) здатні взаємодіяти з функціональними групами білків, що викликає їхні конформаційні зміни. Для денатурації білків у біохімічних дослідженнях часто використовують сечовину або гуанідинхлорид, які утворюють водневі зв'язки з аміно- і карбонільними групами пептидного каркасу та деякими функціональними групами радикалів амінокислот. Відбувається розривання зв'язків, які беруть участь у формуванні вторинної та третинної структури нативних білків, і утворення нових зв'язків з хімічними реагентами:
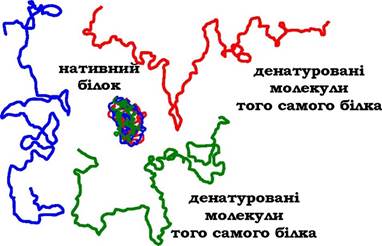
Рис. 5.14. Структура нативної молекули білка (у центрі) і трьох денатурованих молекул цього самого білка
✵ солі важких металів (мідь, ртуть, срібло, свинець та ін.) утворюють міцні зв'язки з важливими функціональними групами білків (найчастіше з -SH), змінюючи їхню конформацію та активність;
✵ детергенти - речовини, які містять гідрофобний вуглеводневий радикал і гідрофільну функціональну групу (такі речовини називають амфіфільними). Гідрофобні радикали білків взаємодіють з гідрофобними частинами детергентів, що змінює конформацію білків. Денатурований під дією детерген-
тів білок зазвичай залишається в розчиненому вигляді, тому що гідрофільні частини денатуруючої речовини утримують його в розчині. До найвідоміших детергентів відносять різноманітні мила (рис. 5.15).
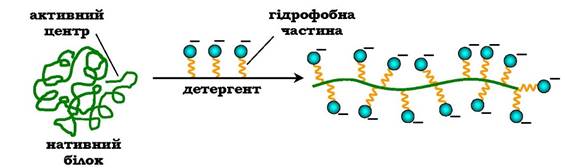
Рис. 5.15. Денатурація білків за допомогою детергентів
Схильність більшості білків до денатурації в процесі їхнього виділення, зберігання й використання значно ускладнює їхнє отримання та використання в медицині.
Для правильного поводження з білковими лікарськими препаратами до них додають інструкцію, в якій указують умови їхнього зберігання та використання. Так, більшість білкових препаратів необхідно зберігати при температурі не вище 10 °С, розчиняти сухі препарати охолодженою до кімнатної температури кип'яченою водою для запобігання їхньої денатурації.
У біохімічних дослідженнях перед визначенням у біологічному матеріалі низькомолекулярних сполук із розчину зазвичай видаляють білки. Для цього найкраще використовувати трихлороцтову кислоту. Після її додавання до розчину денатуровані білки випадають в осад і легко видаляються фільтруванням. Трихлороцтову кислоту можна також використовувати для денатурації ферментів з метою припинення ферментативної реакції.
У медицині денатуруючи агенти часто використовують для стерилізації медичних інструментів і матеріалу, а також як антисептики. Наприклад, у автоклаві при високій температурі стерилізують медичні інструменти та матеріали.
Фенол і його похідні (крезол, резорцин) належать до відомих антисептиків ароматичного ряду. Маючи високу гідрофобність, вони ефективно діють на вегетативні форми бактерій і гриби, викликаючи денатурацію їхніх білків. Ефективність антисептичних властивостей зменшується зі збільшенням розчинності препарату у воді.
Розчин крезолу в калійному милі відомий як препарат лізол, що використовується як дезінфікуючий засіб.
Березовий дьоготь - одна з основних складових частин мазі Вишневського - містить у своєму складі фенол. Препарат використовується для лікування ран, має високу антимікробну дію.
Значна кількість антисептиків представлена солями важких металів. Їхня антимікробна дія пов'язана з тим, що вже і досить низьких концентраціях вони взаємодіють з білками мікроорганізмів, блокують їхні SH-групи і змінюють їхню конформацію. Через високу токсичність більшість ліків, до складу яких входять солі важких металів, використовують як поверхневі антисептики.
Сильну антимікробну активність має, наприклад, сулема - дихлорид ртуті (HgCl2). Її використовують для обробки рук і дезінфекції приміщень. Випадкове чи зумисне отруєння препаратами ртуті викликає важкі некротичні ураження слизової оболонки травного тракту та некротичні зміни в нирках. Антимікробні властивості мають і препарати срібла, такі як ляпіс (AgNОз), коларгол (срібло колоїдальне), їх використовують для обробки слизових оболонок під час інфекційних захворювань.