БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 6. ОБМІН І ФУНКЦІЇ АМІНОКИСЛОТ. БІОСИНТЕЗ БІЛКА
6.4. Катаболізм амінокислот
6.4.2. Дезамінування амінокислот
Дезамінування амінокислот - реакція відщеплення α-аміногрупи від амінокислоти, у результаті чого утворюється відповідна α-кетокислота (безазотистий залишок) і виділяється молекула аміаку. Подальше перетворення продуктів дезамінування амінокислот наведено на рис. 6.7.
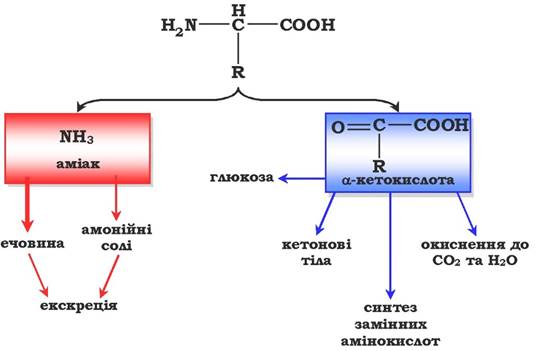
Рис. 6.7. Схема перетворення продуктів дезамінування амінокислот
Аміак токсичний для ЦНС, тому в організмі людини та ссавців він перетворюється в нетоксичну добре розчинну сполуку - сечовину. У вигляді сечовини та солей амонію аміак виводиться з організму. Безазотистий залишок використовується для утворення амінокислот у реакціях трансамінування, процесах глюконеогенезу, кетогенезу, в анаплеротичних реакціях для поповнення спаду метаболітів ОПК, реакціях окиснення до СО2 та Н2О.
Існує декілька способів дезамінування амінокислот:
✵ окисне;
✵ непряме (трансдезамінування);
✵ неокисне;
✵ внутрішньомолекулярне.
Окисне дезамінування. Найактивніше в тканинах відбувається дезамінування глутамінової кислоти. Реакцію каталізує фермент глутаматдегідрогеназа, коферментом глутамат- дегідрогенази є НАД+. Реакція відбувається у два етапи. Спочатку відбувається ферментативне дегідрування глутамату й утворення α-іміноглутарату, потім - неферментативне гідролітичне відщеплення іміногрупи у вигляді аміаку, у результаті утворюється α-кетоглутарат:
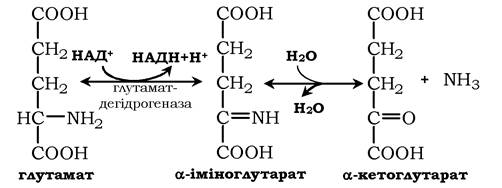
Окисне дезамінування глутамату - оборотна реакція й при підвищенні концентрації аміаку в клітині може проходити у зворотному напрямку як відновне амінування α-кетоглутарату.
Глутаматдегідрогеназа дуже активна в мітохондріях клітин практично всіх органів, крім м'язів. Цей фермент - олігомер, що складається з шести субодиниць (молекулярна маса 312 кДа). Глутаматдегідрогеназа відіграє важливу роль, оскільки є регуляторним ферментом амінокислотного обміну. Алостеричні інгібітори глутаматдегідрогенази (АТФ, ГТФ, НАДН) викликають дисоціацію ферменту та втрату глутаматдегідрогеназної активності. Високі концентрації АДФ активують фермент. Таким чином, низький енергетичний рівень у клітинах стимулює руйнування амінокислот та утворення α-кетоглутарату, що надходить у ЦТК як енергетичний субстрат. Глутаматдегідрогеназа може індукуватися стероїдними гормонами (кортизолом).
У печінці й нирках знайдено фермент оксидазу L-амінокислот, здатний дезамінувати деякі L-амінокислоти:
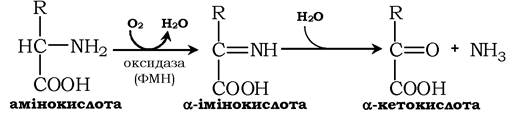
Коферментом у даній реакції виступає ФМН. Проте внесок оксидази L-амінокислот у дезамінування незначний, оскільки оптимальне значення рН для ферменту становить 10,0. У клітинах, де рН середовища наближається до нейтрального, активність ферменту дуже низька.
Оксидаза D-амінокислот також знайдена в нирках і печінці. Це ФАД-залежний фермент. Оптимум рН цієї оксидази знаходиться в нейтральному середовищі, тому фермент активніший, ніж оксидаза L-амінокислот. Роль оксидази D-амінокислот є незначною, оскільки кількість D-ізомерів в організмі дуже мала через те, що в білки їжі та в білки тканин людини і тварин входять тільки природні L-амінокислоти. Імовірно, оксидаза D-амінокислот сприяє їхньому перетворенню у відповідні L-ізомери (рис. 6.8).
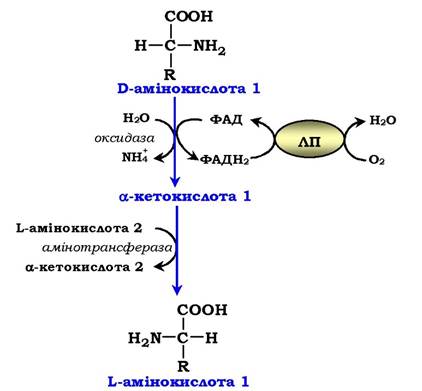
Рис. 6.8. Біологічна роль оксидази D-амінокислот
Непряме дезамінування (трансдезамінування). Більшість амінокислот не здатні дезамінуватись в одну стадію, подібно до Глу. Аміногрупи таких амінокислот у результаті трансамінування переносяться на α-кетоглутарат з утворенням глутамінової кислоти, яка потім зазнає прямого окисного дезамінування. Такий механізм дезамінування амінокислот у дві стадії називається трансдезамінуванням, або непрямим дезамінуванням:
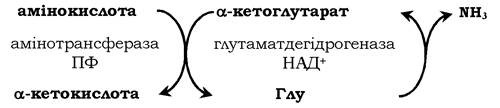
Непряме дезамінування амінокислот відбувається з участю двох ферментів: амінотрасферази (кофермент ПФ) і глутаматдегідрогенази (кофермент НАД+).
Значення цих реакцій в обміні амінокислот дуже велике, оскільки непряме дезамінування є основним способом дезамінування більшості амінокислот. Обидві стадії непрямого дезамінування оборотні (рис. 6.9), що забезпечує як катаболізм амінокислот (рис. 6.9, А), так і можливість утворення практично будь-якої амінокислоти з відповідної α-кетокислоти (рис. 6.9, Б).
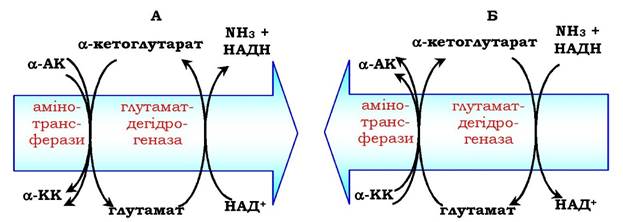
Рис. 6.9. Біологічна роль непрямого дезамінування:
А - катаболізм амінокислот; Б - синтез амінокислот; АК - амінокислоти; КК — кетокислоти
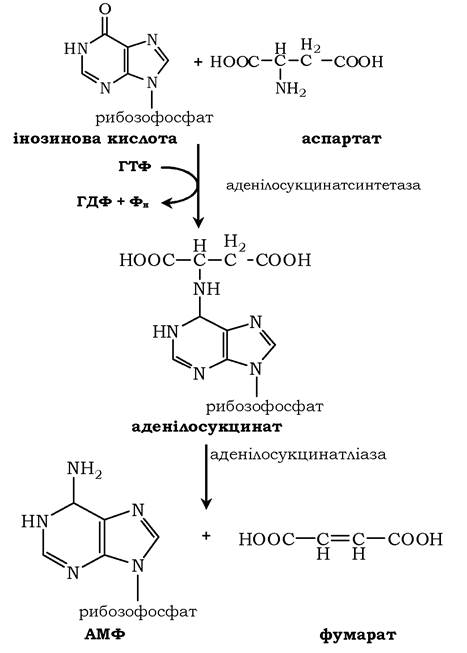
У м'язовій тканині активність глутаматдегідрогенази низька, тому в цих клітинах при інтенсивному фізичному навантаженні функціонує ще один шлях непрямого дезамінування за участю циклу ІМФ-АМФ. Спочатку відбувається перенесення аміногрупи амінокислот на аспартат, потім на інозинову кислоту (ІМФ) і на закінчення - дезамінування АМФ. На схемі зображено послідовність реакцій непрямого неокисненого дезамінування:
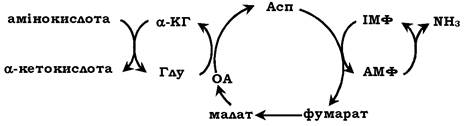
Виділяють чотири стадії процесу:
✵ трансамінування з α-кетоглутаратом, утворення глутамату;
✵ трансамінування глутамату з оксалоацетатом (фермент АСТ), утворення аспартату;
✵ реакція перенесення аміногрупи від аспартату на ІМФ (інозинмонофосфат), утворення АМФ і фумарату;
✵ гідролітичне дезамінування АМФ.
На схемі показано яким саме чином здійснюється перенесення аміногрупи від аспартату та синтез АМФ:
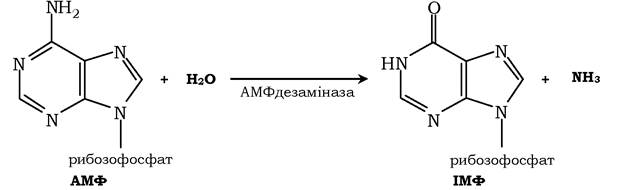
Реакція дезамінування аденілової кислоти відбувається за дії ферменту АМФ дезамінази:
Цей шлях дезамінування переважає у м'язах при інтенсивній праці, у результаті якої накопичується молочна кислота. Аміак, що виділяється, попереджає закислення середовища в клітинах, викликане утворенням лактату.
Неокисне дезамінування. У печінці людини присутні специфічні ферменти, які каталізують реакції дезамінування амінокислот серину, треоніну та гістидину неокисним шляхом.
Неокисне дезамінування серину каталізує сериндегідратаза (СД):
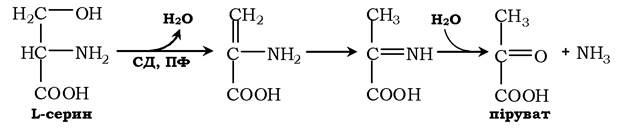
Реакція починається з відщеплення молекули води й утворенням метиленової групи, потім відбувається неферментативна перебудова молекули, у результаті якої утворюється іміногрупа, яка слабо зв'язана з α-вуглецевим атомом. Далі внаслідок неферментативного гідролізу відщеплюється молекула аміаку й утворюється піруват.
Неокисне дезамінування треоніну каталізує фермент треоніндегі- дратаза (ТД). Механізм реакції аналогічний дезамінуванню серину:
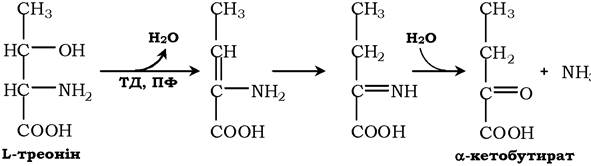
Ці ферменти піридоксальфосфатзалежні.
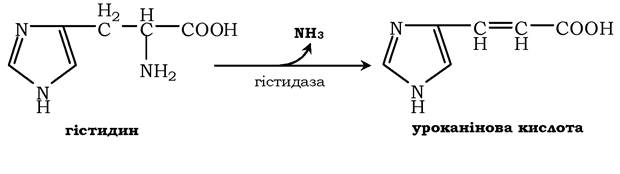
Неокисне дезамінування гістидину під дією ферменту гістидази (гістидинаміакліази) є внутрішньомолекулярним, оскільки молекули аміаку утворюються з атомів самої амінокислоти без участі молекули води. Ця реакція відбувається тільки в печінці та шкірі: