БИОЛОГИЯ Том 1 - руководство по общей биологии - 2004
4. ФЕРМЕНТЫ
4.1. Свойства ферментов
4.1.2. Механизм действия ферментов
Ферменты обладают очень высокой специфичностью. Фишер (Fischer) в 1890 г. высказал предположение, что эта специфичность обусловливается особой формой молекулы фермента, точно соответствующей форме молекулы субстрата (или субстратов). Эту гипотезу часто называют гипотезой «ключа и замка»: субстрат сравнивается в ней с «ключом», который точно подходит по форме к «замку», т. е. к ферменту. В схематическом виде это представлено на рис. 4.2. Часть молекулы фермента, вступающую в контакт с субстратом, называют активным центром фермента, и именно активный центр фермента имеет особую форму.
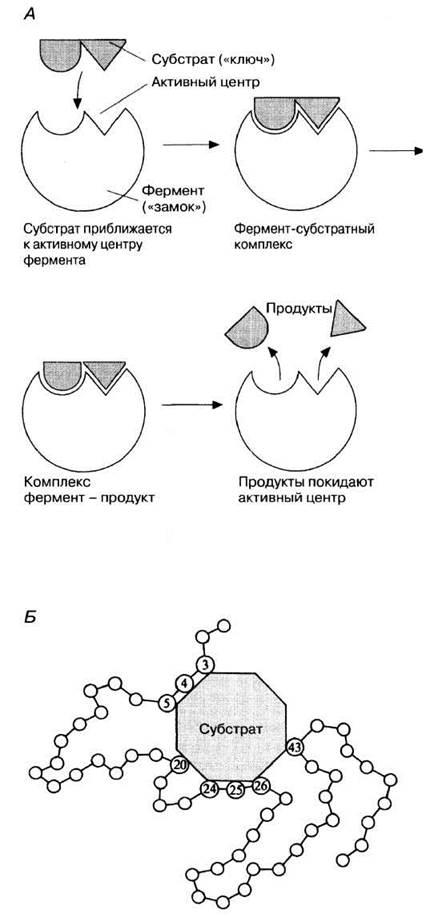
Рис. 4.2. А. Схема, иллюстрирующая гипотезу «ключа и замка», предложенную Фишером для объяснения действия ферментов. Б. Более детальное схематическое изображение фермент-субстратного комплекса. Аминокислотные остатки, образующие активный центр фермента, пронумерованы в соответствии с их положением в первичной структуре фермента.
Молекулы большей части ферментов во много раз крупнее, чем молекулы тех субстратов, которые атакует данный фермент. Активный же центр фермента составляет лишь очень небольшую часть его молекулы, обычно от 3 до 12 аминокислотных остатков. Роль остальных аминокислот, составляющих основную массу фермента, заключается в том, чтобы обеспечить его молекуле правильную глобулярную форму, которая, как мы увидим далее, очень важна для наиболее эффективной работы активного центра фермента.
Образовавшиеся продукты по форме уже не соответствуют активному центру фермента. Они отделяются от него (поступают в окружающую среду), после чего освободившийся активный центрможет принимать новые молекулы субстрата.
В 1959 г. Кошланд (Koshland) предложил новую интерпретацию гипотезы «ключа и замка», получившую название гипотезы «индуцированного соответствия». На основе данных, позволяющих считать ферменты и их активные центры физически более гибкими, чем это казалось вначале, он заключил, что субстрат, соединяясь с ферментом, вызывает какие-то изменения в структуре его активного центра. Аминокислотные остатки, составляющие активный центр фермента, принимают определенную форму, которая дает возможность ферменту наиболее эффективным образом выполнять свою функцию (рис. 4.3). Подходящей аналогией в этом случае может служить перчатка, которая при надевании на руку соответствующим образом изменяет свою форму. По мере выяснения отдельных деталей механизма различных реакций в эту гипотезу вносятся уточнения.
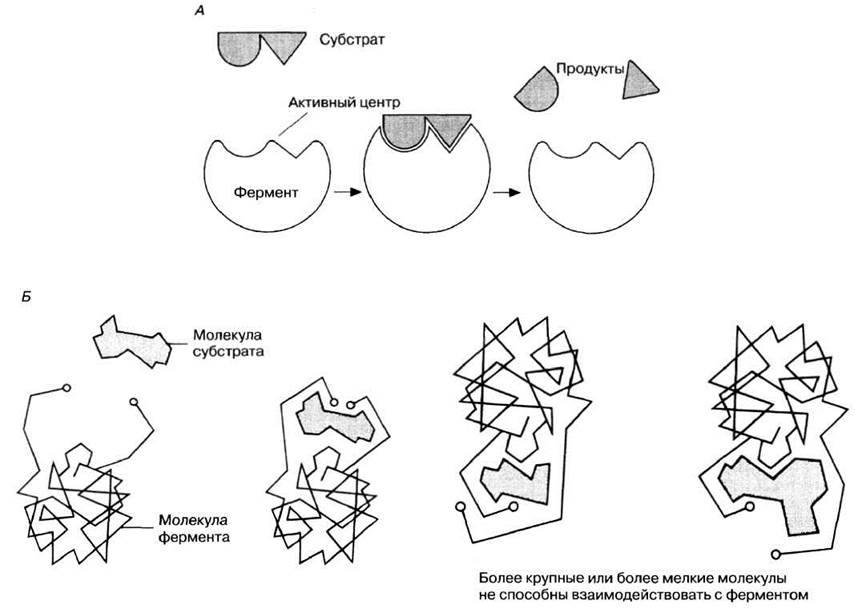
Рис. 4.3. Схемы, иллюстрирующие кошландовскую гипотезу индуцированного соответствия. А. Простая схема, поясняющая механизм действия. Фермент в результате присоединения субстрата к активному центру слегка изменяет форму, и соответственно становится более объемным. Б. Более подробная схема. Соединяясь с ферментом, субстрат вызывает в нем изменение, в результате которого активные группы фермента сближаются. (По J. С. Marsden, С. F. Stoneman (1977), Enzymes and equilibria, Heinemann Educational Books.)
Представление о том, как работает фермент, можно получить с помощью рентгеноструктурного анализа и компьютерного моделирования. Рис. 4.4 иллюстрирует это на примере фермента лизоцима.
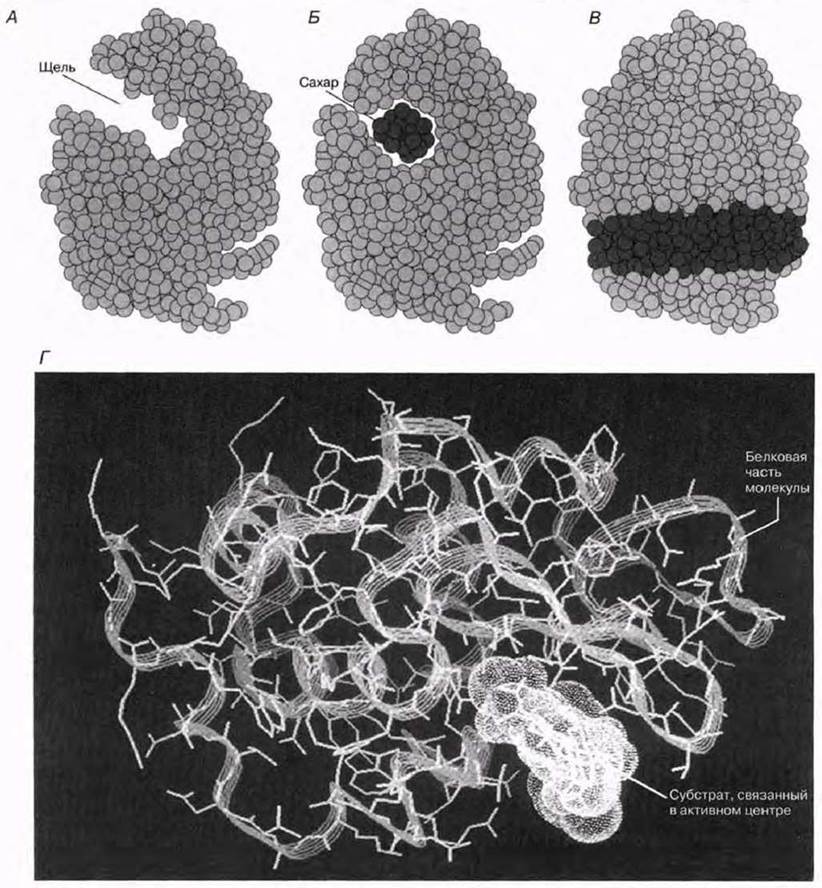
Рис. 4.4. Созданные на компьютере модели третичной структуры лизоцима до и после присоединения субстрата, показывающие, как работает этот фермент. А. Вид сбоку. Активный центр имеет форму щели, проходящей по всей толще молекулы. Б. Вид сбоку. Активный центр с находящейся в нем молекулой субстрата. Обратите внимание на некоторое изменение формы фермента, вызванное присоединением субстрата. Это пример «индуцированного соответствия», постулированного Кошландом в 1959 г. Субстрат лизоцима представляет собой короткую олигосахаридную цепь, легко умещающуюся в активном центре и расщепляемую ферментом. Такие олигосахариды входят в состав бактериальных клеточных стенок и их разрушение влечет за собой гибель бактерий — меточные стенки утрачивают присущую им жесткость и клетки лопаются под действием осмотических сил. Лизоцим — широко распространенный фермент, выполняющий защитную функцию; он содержится в слезах, слюне и в слизи носовой полости. В. Вид спереди. Активный центр с находящейся в нем молекулой субстрата. Г. Компьютерная модель лизоцима с субстратом в активном центре.