БИОЛОГИЯ Том 2 - руководство по общей биологии - 2004
14. ТРАНСПОРТ У ЖИВОТНЫХ
14.8. Функции крови у млекопитающих
14.8.5. Защитные функции крови
Человек обладает сложной системой защитных механизмов, которые позволяют ему противостоять атакам болезнетворных агентов и удалять из организма чужеродные материалы. С кровью связаны три важных защитных механизма:

Первые два механизма рассматриваются в этом разделе, а третий — в разд. 14.9.
Свертывание (коагуляция) крови
При повреждении любой ткани из нее вытекает кровь, которая вскоре свертывается (коагулирует), образуя кровяной сгусток. Последний предотвращает дальнейшую потерю крови и препятствует проникновению в организм болезнетворных микроорганизмов, что, как совершенно очевидно, имеет большое значение для выживания. Не менее важно и то, что в неповрежденных сосудах кровь не свертывается. Чрезвычайная сложность последовательной цепи реакций, участвующих в процессе свертывания, служит одновременно для того, чтобы этот процесс не происходил там, где в этом нет необходимости. Для осуществления этого процесса нужны по меньшей мере 12 различных факторов, действующих согласованно. Ниже описаны только важнейшие из них, а на рис. 14.34 схематически представлены важнейшие стадии процесса свертывания крови.
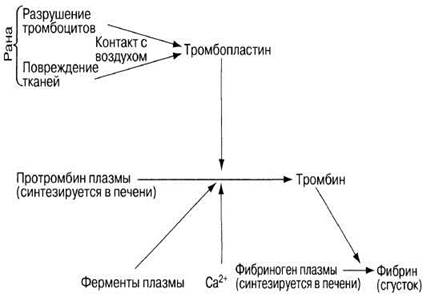
Рис. 14.34. Основные этапы процесса свертывания крови.
Кровь, вытекающая из раны, соприкасается с воздухом и смешивается с веществами, выделяющимися из поврежденных клеток и разрушенных тромбоцитов. К числу таких веществ относятся в частности: 1) тромбопластин — липопротеин, который высвобождается из поврежденных тканей; 2) факторы свертывания VII и X, представляющие собой ферменты плазмы; 3) ионы кальция. Все вместе эти вещества катализируют превращение растворенного в плазме белка протромбина в тромбин, представляющий собой активную протеазу, т. е. фермент, расщепляющий белки. Тромбин гидролизует фибриноген (другой растворенный в плазме белок) с образованием фибрина. Фибрин нерастворим и имеет волокнистую структуру. Волокна на формируют густо переплетенную трехмерную сеть, в которой задерживаются клетки крови (рис. 14.35). Так образуется сгусток. Высыхая, он превращается в прикрывающий рану струп, который предотвращает дальнейшую потерю крови и создает механический барьер для проникновения патогенов.
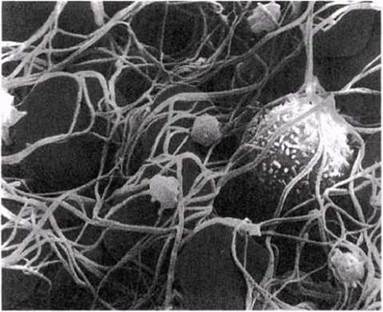
Рис. 14.35. Структура кровяного сгустка. Фотография получена с помощью сканирующего электронного микроскопа. Видны эритроциты, опутанные фиброзными волокнами, а также лейкоцит (крупная шиповатая клетка) и несколько мелких тромбоцитов.
При такой сложности процесса свертывания крови отсутствие или недостаточная концентрация хотя бы одного из его факторов способны привести к массированному кровотечению. Например, если фактор, инициирующий активность тромбопластина, отсутствует совсем или содержится в ничтожно малом количестве, то для человека смертельно опасной становится даже маленькая ранка. Такая болезнь называется гемофилией. Различают две ее наследственные формы в зависимости от того, какой белковый фактор свертывания отсутствует, и соответственно какой ген дефектен (впрочем, клинически они проявляются одинаково). Гемофилия А (85% всех случаев) вызывается утратой фактора VIII, а гемофилия В (остальные 15%) — фактора IX. Оба гена находятся в половой Х-хромосоме. Поскольку у мужчин она только одна (их вторая половая хромосома Y не несет генов, кодирующих факторы свертывания), именно они в основном и страдают гемофилией. Наличие у женщины одновременно двух дефектных по одному и тому же гену Х-хромосом — ситуация исключительно редкая. Если неполноценна одна X-хромосома, то вторая обычно содержит нормальный ген, который является доминантным (см. разд. 24.6.1), т. е. обеспечивает синтез необходимого фактора свертывания. Однако такая женщина, оставаясь здоровой, служит носителем гена гемофилии и может передать его своему потомству.
В неповрежденных кровеносных сосудах свертывания не происходит, поскольку их эндотелиальная выстилка обладает очень гладкой поверхностью и не вызывает разрушения тромбоцитов или клеток крови. Кроме того, в крови содержатся вещества, которые активно противодействуют свертыванию. Одно из них — гепарин, растворенный в плазме и образуемый так называемыми тучными клетками (мастоцитами, лаброцитами), которые обнаружены в соединительной ткани и печени. Он препятствует превращению протромбина в тромбин и фибриногена в фибрин, поэтому широко применяется в медицине как антикоагулянт.
Если внутри сосуда все же образуется сгусток, его называют тромбом; образование сгустка ведет к острому нарушению кровообращения — тромбозу. Такое случается, например, при повреждении эндотелия, так как шероховатость поврежденного участка способствует разрушению тромбоцитов, в результате чего запускается процесс свертывания крови. Особенно опасен и может привести к внезапной смерти коронарный тромбоз, т. е. тромбоз венечной артерии сердца (разд. 15.5).
Фагоцитоз
Главная функция некоторых лейкоцитов — «заглатывание» микроорганизмов, а также остатков мертвых клеток и других частиц, например пыли в легких Этот процесс называют фагоцитозом, а клетки, осуществляющие его, — фагоцитами. Фагоциты образуют первую линию активной обороны организма при проникновении в него патогенов.
Фагоциты способны к особой форме локомоции, называемой амебоидным движением: они как бы ползут по субстрату благодаря упорядоченному току своей цитоплазмы. К месту, где находятся объекты-мишени, их направляет градиент концентрации определенных веществ, выделяемых поврежденными клетками крови, тканями, кровяным сгустком или непосредственно бактериями. Такое движение к источнику химического стимула называется хемотаксисом. Прибыв на место, фагоциты распознают вредных бактерий, в чем им способствуют примерно 20 белков, называемых вместе системой комплемента. Эти белки активируются проникшими в организм бактериями и выполняют следующие функции:
1) некоторые обладают способностью привлекать фагоциты к инфицированному участку (направляют хемотаксис);
2) некоторые участвуют в опсонизации (см. ниже);
3) некоторые «продырявливают» поверхностную мембрану бактерий, в результате чего бактериальные клетки набухают и лопаются;
4) некоторые стимулируют воспалительную реакцию.
Опсонизация — это процесс прикрепления к поверхности бактерии особых белков, называемых опсонинами. Обычно опсонины относятся к системе комплемента или к антителам. Роль опсонизации проиллюстрирована рис. 14.36. На поверхности фагоцитов находятся рецепторы, структурно соответствующие прикрепленным к бактериям опсонинам и способные с ними соединяться. В результате при соприкосновении опсонизированной мишени с фагоцитом он ее распознает, связывает, а затем заглатывает. При этом его цитоплазма обтекает неподвижную мишень со всех сторон, так что она оказывается внутри фагоцитарной вакуоли (рис. 14.37). С этой вакуолью сливаются мелкие лизосомы, формируя фаголизосому. В нее высвобождаются лизосомные и другие гидролитические ферменты, а также кислота, переваривающие бактерию. Растворимые продукты переваривания поглощаются окружающей цитоплазмой фагоцита.
Существуют два типа лейкоцитов, способных к фагоцитозу: нейтрофилы и моноциты (табл. 14.2). Нейтрофилы могут протискиваться сквозь стенки капилляров и мигрировать по межклеточным пространствам тканей. Моноциты вне крови превращаются в крупные амебоподобные макрофаги (греч. macros — большой). Одни макрофаги активно передвигаются, как бы патрулируя ткани, особенно в печени, селезенке и лимфатических узлах; другие стационарно окружают заполненные кровью пространства разных органов. Они фагоцитируют как неживые частицы, так и микроорганизмы, причем их мишени могут быть гораздо крупнее, чем мишени нейтрофилов. Макрофаги поглощают, например, старые эритроциты и малярийных плазмодиев, которые являются эукариотеческими клетками, и, следовательно, по своим размерам намного превышают прокариотических бактерий. Если макрофаги не в состоянии переварить фагоцитированные частицы, то эти частицы надолго задерживаются внутри макрофагов, иногда вплоть до их гибели. Вместе с нейтрофилами макрофаги образуют ретикуло-эндотелиальную систему организма.
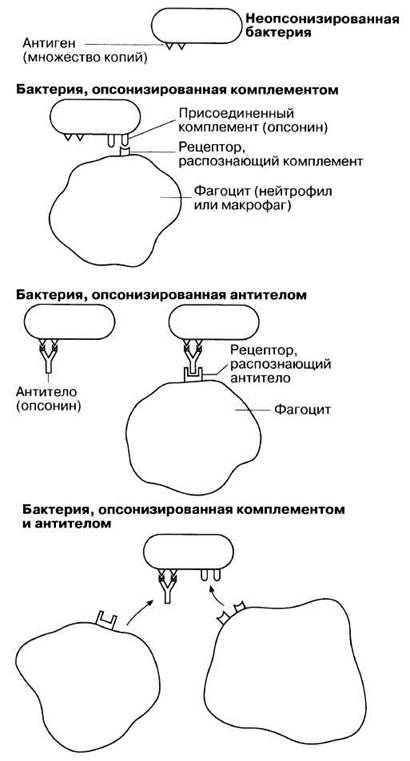
Рис. 14.36. Роль системы комплемента и антител (опсонинов) в «мечении» (опсонизации) бактерии. Опсонизированная бактерия распознается и захватывается фагоцитом. (Термин «опсонизация» происходит от греческого слова opson — приправа.)
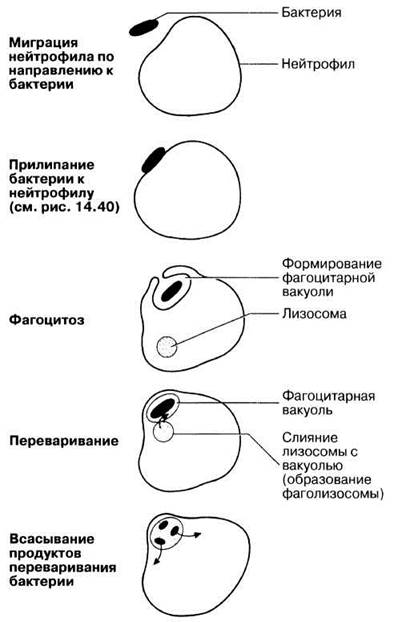
Рис. 14.37. Фагоцитоз: захват и переваривание бактерии нейтрофилом.
Воспаление
При ранении какого-либо участка тела или его инфицировании возникает местная реакция окружающих тканей, которая проявляется в отеке и болезненности. Такое состояние называется воспалением; оно обусловлено высвобождением из пораженных тканей специфических веществ, в том числе гистамина и 5-гидрокситриптамина (серотонина) Эти вещества вызывают местное расширение капилляров, в результате чего увеличивается приток крови к данному участку и повышается его температура. Усиливается и проницаемость капилляров, что позволяет плазме и лейкоцитам выходить в окружающие ткани. Это состояние называется отеком. Плазма содержит вещества, подавляющие рост бактерий или убивающие их, а также антитела и фагоциты; все вместе эти агенты препятствуют распространению инфекции. Одним из химических веществ, поступающих в воспаленный участок, является особый белок интерферон, секретируемый в основном макрофагами, а также другими лейкоцитами под влиянием чужеродных антигенов. Он неспецифично повышает устойчивость клеток тела к вирусной инфекции. Кроме болезнетворных агентов, фагоциты поглощают и остатки мертвых тканей, очищая таким образом пострадавший участок от всего лишнего. Кроме того, в плазме содержится фибриноген, способствующий в случае необходимости свертыванию излившейся крови, а избыток тканевой жидкости снижает концентрацию и токсичность любых потенциально опасных агентов.
Заживление ран
К концу воспалительного процесса пострадавший участок заселяется клетками, называемыми фибробластами, которые секретируют межклеточные элементы соединительной ткани, в основном коллаген. Коллаген представляет собой фибриллярный белок; соединяясь с другими продуктами фибробластов — мукополисахаридами, — он образует сеть из беспорядочно переплетающихся волокон рубцовой ткани. Для образования коллагена необходим витамин С, так как без него невозможно гидроксилирование, и молекулы коллагена остаются недостроенными (в них отсутствуют такие аминокислоты, как оксипролин и оксилизин). Спустя примерно две недели неупорядоченная масса волокон переориентируется вдоль линий напряжения поврежденного участка. В него прорастают многочисленные капилляры, которые снабжают клетки, вовлеченные в процесс заживления раны, кислородом и питательными веществами.
К этим процессам, протекающим в глубине раны, одновременно подключается окружающий эпидермис. Некоторые эпидермальные клетки мигрируют в рану и переваривают значительную часть скопившихся в нем остатков тканей и фибрина кровяного сгустка. При встрече друг с другом эпидермальные клетки прочно соединяются, постепенно образуя под струпом непрерывный слой. Когда формирование этого слоя заканчивается, струп отпадает и новый эпидермис вступает в контакт с атмосферой.
ХРОНОЛОГИЧЕСКАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ СТАДИЙ ПРОЦЕССА ЗАЖИВЛЕНИЯ
1. В поврежденном участке возникает кровотечение.
2. Происходит свертывание крови.
3. Начинается процесс воспаления.
4. В рану мигрируют лейкоциты, поглощающие чужеродный материал, бактерий и клеточный дебрис.
5. Рану заселяют фибробласты, с интезирующие коллаген и другие элементы рубцовой ткани.
6. Эпидермальные клетки окончательно очищают рану от мертвых остатков и начинают отделять струп от живых тканей, расположенных под ним.
7. На месте раны образуется сплошной слой эпидермиса.
8. Происходит отслаивание струпа.
Если рана небольшая, то фагоциты обычно справляются с попавшими в нее патогенами. Однако при значительных масштабах повреждения в действие вступает иммунная система организма.