БИОЛОГИЯ Том 2 - руководство по общей биологии - 2004
16. КООРДИНАЦИЯ И РЕГУЛЯЦИЯ У РАСТЕНИЙ
16.2. Ростовые вещества растений
Химическая (гуморальная) координация у животных осуществляется с помощью гормонов, т. е. веществ, которые синтезируются в одном месте, а действуют, причем в очень малых концентрациях, в других местах. У растений координация функций осуществляется с помощью соединений, которые вовсе не обязательно транспортируются куда-то из места, где они синтезируются, поэтому их не всегда можно назвать гормонами. Кроме того, поскольку эти химические агенты обычно в той или иной мере влияют на рост, их рекомендуется называть ростовыми веществами. Впрочем, эта терминологическая тонкость многими авторами не соблюдается, и широко применяются такие понятия, как «гормоны растений», или «фитогормоны», которыми мы тоже будем пользоваться. Важно только осознавать, что точные механизмы действия ростовых веществ растений пока неясны и аналогия с действием гормонов животных может только ввести в заблуждение. Следует помнить, что процесс роста складывается из трех этапов — деления клеток, увеличения их размеров и дифференцировки (специализации), и что этот процесс протекает не во всех частях растения (разд. 22.4). Это, следовательно, будет отражаться на действии и распределении различных ростовых веществ в растении. Выделяют пять основных классов ростовых веществ:
1) ауксины, обычно связанные с увеличением размеров клеток и их дифференцировкой;
2) гиббереллины, близкие по действию к ауксинам;
3) цитокинины, связанные с клеточным делением;
4) абсцизовая кислота, обычно связанная с периодом покоя, например в боковых почках;
5) этилен (этен), часто связываемый с процессами старения органов.
В этой главе мы сначала рассмотрим отдельно каждый класс ростовых веществ, а затем обсудим ключевые моменты жизненного цикла растений, особо отметив, что ростовые вещества часто вызывают тот или иной эффект, действуя совместно.
16.2.1. Ауксины и фототропизм
Открытие ауксинов
Ауксины были открыты в результате изучения фототропизма, которое было начато в опытах Чарлза Дарвина и его сына Франсиса. Используя в качестве материала колеоптили овса (рис. 16.2), они показали, что рост проростков в направлении источника света является результатом некоторого «влияния», распространяющегося от их верхушки к расположенной ниже зоне роста. Некоторые из этих опытов схематично представлены на рис. 16.3, где каждая схема отражает результаты, полученные на многих колеоптилях.
16.5. а) Запишите выводы, которые можно сделать на основании экспериментов А-Г (рис. 16.3), учитывая, что изгиб колеоптиля вызван асимметричным ростом зоны, расположенной ниже верхушки.
б) Зачем, исходя из результата эксперимента Б, потребовалось поставить эксперимент В?
Если этот тропизм анализировать с точки зрения классической цепочки «сигнал → рецептор → передача → эффектор → ответ», то самый большой пробел в наших знаниях имеет отношение к способу передачи сигнала. В 1913 г. этот вопрос исследовал датский физиолог растений Бойсен-Йенсен. Некоторые результаты его экспериментов проиллюстрированы на рис. 16.4.
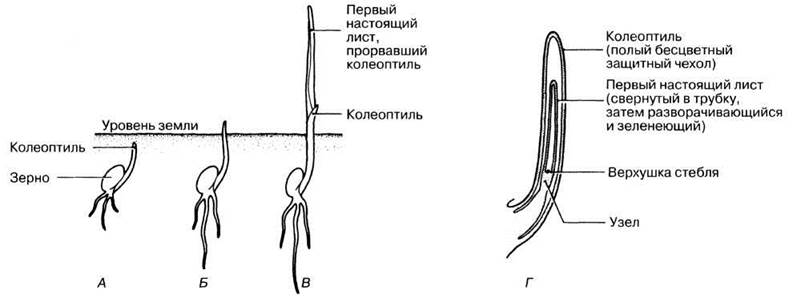
Рис. 16.2. Типичное прорастание зерна злака: А, Б и В — различные стадии прорастания; Г — продольный срез колеоптиля на стадии Б.
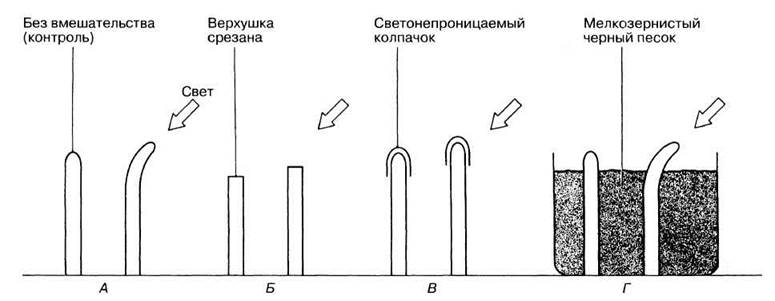
Рис. 16.3. Опыты Дарвина по фототропизму колеоптилей овса. А, Б, В и Г — схемы разных опытов, демонстрирующие тип воздействия (слева) и результат (справа).
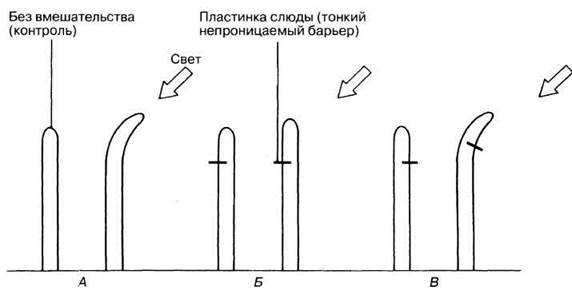
Рис. 16.4. Опыты Бойсен-Йенсена по фототропизму колеоптилей овса. А, Б и В — схемы разных опытов, демонстрирующие тип воздействия (слева) и результат (справа).
16.6. Какую дополнительную информацию дали эксперименты Бойсен-Йенсена?
16.7. Какие результаты будут получены, если повторить эти эксперименты при равномерном освещении со всех сторон. Нарисуйте схемы и поясните свой ответ.
16.8. Какие выводы вы сделаете, основываясь на результатах, приведенных на рис. 16.5?
16.9. Какого результата можно ожидать, если поместить обработанный агаровый блок с правой стороны декапитированного колеоптиля в опыте Б?
Наконец в 1928 г. голландский физиолог растений Вент доказал существование особого химического посредника. Предположив наличие такого вещества, он решил перехватить и собрать его на пути от верхушки колеоптиля в нижележащую зону, а затем проверить эффективность данного агента в других опытах. Вент допустил, что речь идет о мелких молекулах, которые смогут диффундировать в кусочек агарового геля, структура которого такова, что между его молекулами остаются довольно большие свободные пространства. Некоторые данные, полученные в его экспериментах, представлены на рис. 16.5.
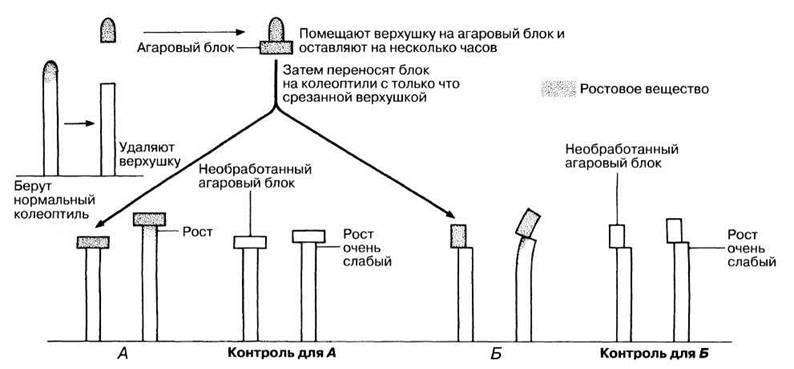
Рис. 16.5. Опыты Вента. А и Б — схемы разных опытов, демонстрирующие тип воздействия (слева) и результат (справа). Рядом показаны схемы контрольных опытов. Все опыты проводились в темноте или при одинаковом со всех сторон освещении.
На рис. 16.6. представлен еще один остроумный эксперимент Вента. В контрольных опытах верхушку колеоптиля помещали на два агаровых блока (А и Б) и инкубировали в темноте или при равномерном освещении; затем эти блоки переносили на колеоптиль с удаленной верхушкой; величина изгиба, индуцируемого блоками А и Б, в этом случае была одинакова. Одностороннее же освещение верхушки привело к неравномерному распределению активного вещества в блоках А и Б. Это не только подтвердило выводы Бойсен-Йенсена о влиянии света на распределение активного вещества, но и создало основу для его количественного определения с помощью так называемых биотестов. Биотест — это опыт, в котором количество (концентрация) вещества измеряется по его воздействию на биологическую систему. Вент показал, что степень изгиба колеоптилей овса прямо пропорциональна концентрации ростового фактора (в пределах физиологической нормы).
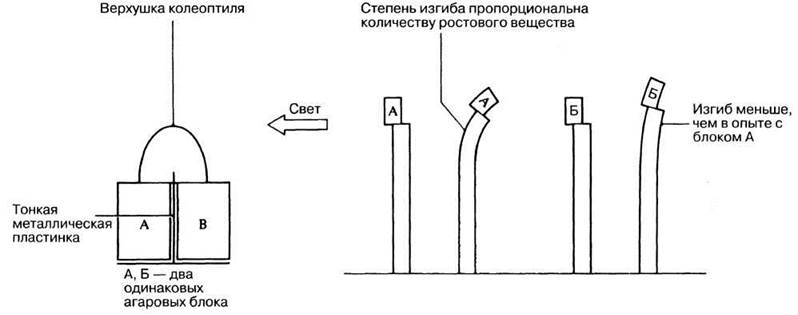
Рис. 16.6. Опыт Вента, демонстрирующий влияние одностороннего освещения на распределение ростового вещества (ауксина).
Впоследствии это вещество было названо ауксином (от греч. auxein — увеличивать). В 1934 г. оно было идентифицировано как индолилуксусная кислота (ИУК). Вскоре выяснилось, что ИУК широко распространена в растительном царстве и что с нею тесно связано увеличение размеров растительных клеток. На рис. 16.7 обобщены современные представления о перемещении ИУК при одностороннем освещении колеоптилей. Следует, однако, отметить, что из всех изученных с этой точки зрения растительных систем колеоптиль — самая простая; в других случаях механизм ростовой реакции, вероятно, сложнее. Кроме того, пока накоплено мало данных о том, что градиент ауксина создается еще во время критического периода, до проявления ответной реакции.
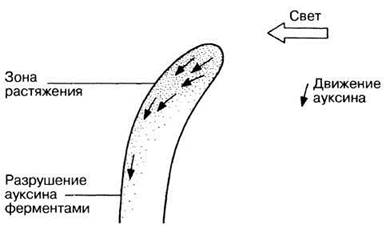
Рис. 16.7. Гипотеза, объясняющая эффект одностороннего освещения на распределение ауксина в колеоптиле. Ауксин не инактивируется под действием света, а движется от его источника. В результате на теневой стороне его концентрация возрастает, что стимулирует растяжение клеток в этой области, и растение изгибается.
Строение ИУК
Структурная формула ИУК приведена на рис. 16.8.
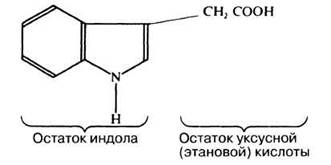
Рис. 16.8. Структурная формула индолилуксусной кислоты (ИУК), или гетероауксина.
Вскоре были выделены и другие вещества, сходные с ИУК по строению и активности; кроме того, удалось синтезировать несколько соединений аналогичного типа. Все они сейчас объединяются в один из классов фитогормонов под названием ауксины (ИУК называют также гетероауксином). Некоторые способы их коммерческого применения обсуждаются в разд. 16.2.5.
Синтез и распределение ауксинов
Ауксины непрерывно образуются в верхушке (апексе) побега и молодых листьев. Движение их от места синтеза происходит базипетально (от вершины к основанию органа) и полярно (только в одном направлении). По-видимому, они движутся от клетки к клетке путем диффузии и в конечном итоге инактивируются и разрушаются ферментами. Транспорт на дальние расстояния осуществляется по проводящей системе (в основном по флоэме) и направлен из побегов к корням. Небольшое количество ауксинов, вероятно, синтезируется самими корнями. Влияние различных концентраций этих веществ на рост проростков можно исследовать различными способами, например так, как описано в эксперименте 16.1.
Опыт 16.1. Изучение влияния индолилуксусной кислоты (ИУК) на рост колеоптилей овса
Цель эксперимента — изучить влияние различных концентраций ИУК на рост колеоптилей овса. Этот рост зависит от солнечного (белого) света, поэтому манипуляции с колеоптилями надо проводить при красном свете или при возможно более слабом освещении. Как источник энергии для роста используется сахароза в растворе. Чтобы исключить влияние на рост ауксинов, образующихся в колеоптилях, их верхушки (длиной 3 мм) удаляют.
Материалы и оборудование
Проростки овса с колеоптилями длиной не менее 1,5 см. [Замочите в воде 100 зерен овса и оставьте их на ночь; замоченные семена положите на влажную фильтрованную бумагу в чашке Петри, накройте ее алюминиевой фольгой и поставьте в темное место (в термостат) на 5 суток при температуре 20 °С. Для того чтобы получить 60 колеоптилей, необходимых для каждого опыта, следует замачивать по меньше мере 100 зерен, поскольку некоторые из них могут не прорасти.]
6 пробирок в штативе
6 чашек Петри с крышками
5 градуированных пипеток на 5 мл
Мерный цилиндр на 25 мл или градуированная пипетка на 10 мл
Резак для колеоптилей (рис. 16.9)
Кисточка
2% раствор сахарозы
Дистиллированная вода
Маточный раствор ИУК (концентрация 1 г/л). ИУК плохо растворяется в воде, поэтому ее сначала растворяют в этаноле; 1 г ИУК помещают в 2 мл этанола, а затем добавляют 900 мл дистиллированной воды. Нагревают раствор до 80 °С, выдерживают при этой температуре 5 мин и доводят объем дистиллированной водой до 1 л. Количество раствора готовится в соответствии с тем, сколько его нужно для опыта.
Методика
1. Пометьте шесть пробирок и шесть чашек Петри буквами от А до Е.
2. Налейте в каждую пробирку по 18 мл 2% раствора сахарозы.
3. Используя чистую пипетку на 5 мл, добавьте в пробирку А 2 мл раствора ИУК и тщательно перемешайте.
4. С помощью другой пипетки перенесите 2 мл раствора из пробирки А в пробирку Б и тщательно перемешайте содержимое пробирки Б.
5. Беря каждый раз новую пипетку, перенесите 2 мл из пробирки Б в пробирку В, перемешайте; затем 2 мл из пробирки В в пробирку Г, перемешайте; и, наконец, из пробирки/ 2 мл в пробирку Д.
6. В пробирку Е добавьте 2 мл дистиллированной воды.
7. Перенесите растворы из пробирок А—Е в чашки Петри А—Е.
8. Вырежьте фрагменты колеоптиля длиной 10 мм из 60 проростков овса на расстоянии 2 мм от их верхушек. Используйте для этого резак с двумя лезвиями, расстояние между которыми составляет точно 10 мм; для установки лезвий используйте шайбы или другие прокладки; резак скрепляется винтом и двумя гайками (рис. 16.9). Если колеоптили расположить параллельно друг другу, выровнять их верхушки по одной линии, то можно сразу отрезать по нескольку препаратов.
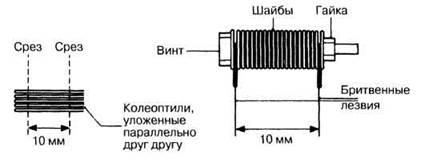
Рис. 16.9. Как получить фрагменты колеоптилей длиной 10 мм.
9. С помощью кисточки перенесите по 10 фрагментов колеоптилей в каждую чашку Петри, следя за тем, чтобы не происходило перекрестного смешивания растворов в них (чем больше колеоптилей вы возьмете, тем статистически достовернее будут результаты).
10. Накройте чашки крышками и выдержите их трое суток при температуре 25 °С в темноте (в термостате).
11. Как можно точнее измерьте длину колеоптилей.
12. Отбросив максимальные и минимальные величины, определите среднюю длину ко- леоптиля для каждой чашки.
13. Постройте график зависимости средней длины колеоптиля (по оси ординат) от концентрации ИУК в млн.-1 (по оси абсцисс).
16.10. Какова будет концентрация ИУК в каждой чашке Петри, если выразить ее в частях на миллион (млн.-1)
(1 г/л = 1000 млнг1)?
14. Проконтролируйте полученные результаты и сравните их с результатами, приведенными на рис. 16.10. Более точные результаты можно получить, если объединить данные всей группы учащихся.
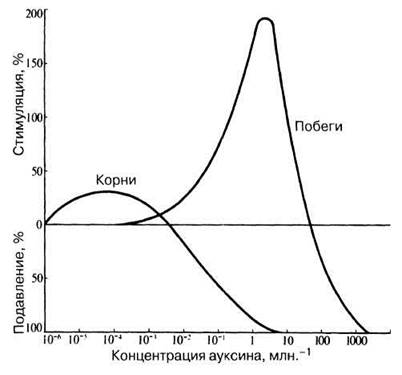
Рис. 16.10. Зависимость роста корней и побегов от концентрации ауксина (она представлена по оси абсцисс в виде логарифмической шкалы). Обратите внимание на то, что концентрация ауксина, стимулирующая рост побегов, подавляет рост корней.