БИОЛОГИЯ Том 2 - руководство по общей биологии - 2004
17. КООРДИНАЦИЯ И РЕГУЛЯЦИЯ У ЖИВОТНЫХ
17.1. Нервная система
17.1.2. Синапсы
Синапс — это специализированный функциональный контакт между двумя возбудимыми клетками, служащий для передачи возбуждения. В случае нейронов он обычно находится между тонким ответвлением на конце аксона одной клетки и дендритом или перикарионом другой. Физического контакта между клетками в данном случае не бывает — они остаются разделенными небольшим пространством, так называемой синаптической щелью. Число синапсов обычно очень велико — они образуют огромную поверхность для передачи информации. Например, на дендритах и теле одного мотонейрона спинного мозга их может насчитываться более 1000, а на некоторых нейронах головного мозга — до 10 000 (рис. 17.8).
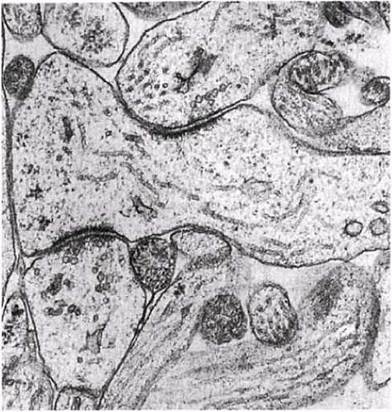
Рис. 17.8. Фотография синапсов мотонейронов, полученная с помощью просвечивающего электронного микроскопа. Синаптические щели находятся на снимке между темными утолщенными синаптическими мембранами.
Особый тип синапсов со сходной функцией, но иной структурой связывает окончания мотонейронов с мышечными волокнами. Их называют нервно-мышечными соединениями, и они будут рассмотрены в этом разделе ниже.
Строение синапса
Строение типичного синапса показано на рис. 17.9 и 17.10. Он состоит из синаптического окончания в виде луковицеобразного вздутия на конце аксона, которое находится в непосредственной близости от мембраны дендрита. В цитоплазме этого вздутия находятся многочисленные митохондрии (поставляющие энергию) и мелкие синаптические пузырьки диаметром 50 нм. Последние содержат вещество, называемое нейромедиатором, которое служит для передачи импульса через синаптическую щель шириной примерно 20 нм. Обращенные к ней клеточные мембраны утолщены и называются пресинаптической у аксона и постсинаитической у дендрита. Пресинаптическая мембрана модифицирована таким образом, что может быстро присоединять синаптические пузырьки и высвобождать их содержимое в синаптическую щель (экзоцитоз). Постсинаптическая мембрана содержит крупные белковые молекулы, которые функционируют как рецепторы для нейромедиаторов, и многочисленные каналы (поры), в покое закрытые, но способные, открываясь, пропускать в клетку определенные ионы (рис. 17.11).
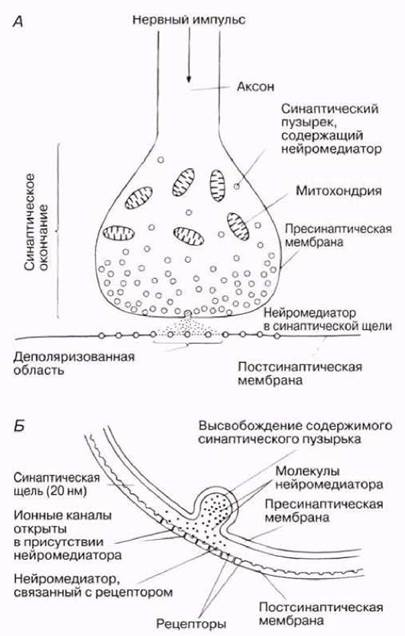
Рис. 17.9. Строение синапса.
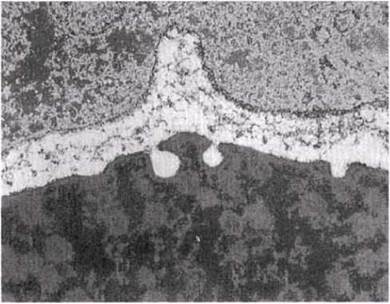
Рис. 17.10. Электронная микрофотография синапса.
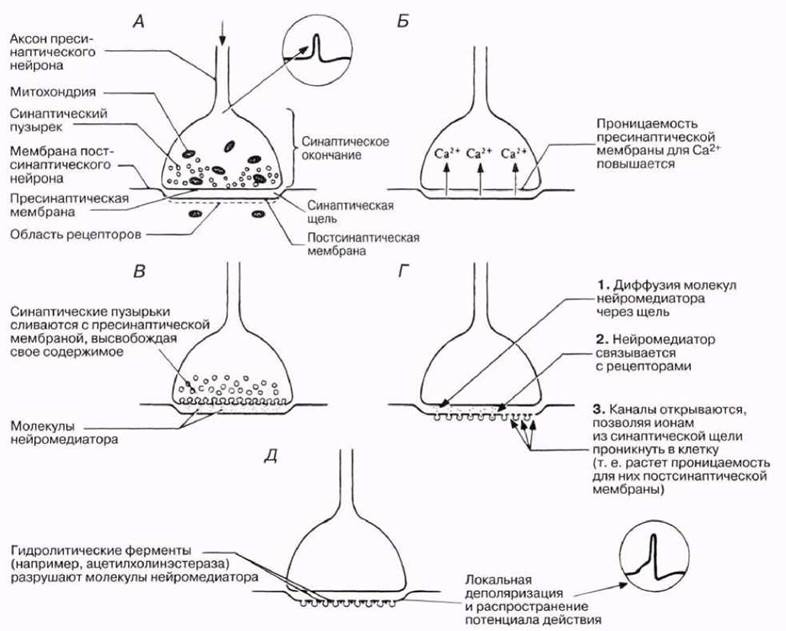
Рис. 17.11. Механизм химической передачи импульсов в нервном синапсе; от А до Д— временная последовательность событий.
Нейромедиатор синтезируется либо в перикарионе, откуда транспортируется в пресинаптическое окончание нейрона, либо непосредственно в самом окончании. В обоих случаях для этого нужны ферменты, собираемые на рибосомах в теле нейрона. В синаптическом окончании нейромедиатор «упаковывается» в пузырьки и хранится там до высвобождения. В нервной системе позвоночных имеются два главных вещества этого типа — ацетилхолин (АцХ) и норадреналин, хотя существуют и другие нейромедиаторы, которые мы рассмотрим в конце настоящего раздела. Ацетилхолин представляет собой уксуснокислый эфир холина. Это первый выделенный учеными нейромедиатор (в 1920 г.). Норадреналин описан в разд. 17.6.5. Нейроны, связь между которыми опосредована ацетилхолином, называются холинергическими, а использующие для синаптической передачи норадреналин — адренергическими. Норадреналин высвобождается симпатическими нервами, тогда как ацетилхолин — почти всеми остальными нервами (кроме некоторых в головном мозге).
Механизм синаптической передачи
Этот процесс мы рассмотрим на примере холинергических нейронов. Поступление нервных импульсов в синаптическое окончание деполяризует пресинаптическую мембрану, вызывая открывание в ней кальциевых каналов, т. е. повышая ее проницаемость для ионов кальция (Са2+). Ионы кальция устремляются внутрь клетки, что приводит к слиянию синаптических пузырьков с пресинаптической мембраной и высвобождению их содержимого в синаптическую щель (экзоцитоз). Затем пузырьки возвращаются в цитоплазму, где вновь заполняются нейромедиатором. Каждый пузырек содержит примерно 3000 молекул ацетилхолина.
Ацетилхолин диффундирует через синаптическую щель, что вызывает задержку проведения примерно на 0,5 мс, и связывается со специфическим рецептором (белком) постсинаптической мембраны, «распознающим» молекулярную структуру нейромедиатора. При этом рецепторная область изменяет конфигурацию, что приводит к открыванию сопряженного с нею ионного канала в постсинаптической мембране. Обратите внимание на то, что при проведении нервного импульса по аксону эти каналы открывались в ответ на деполяризацию, тогда как в постсинаптической мембране они открываются в ответ на связывание нейромедиатора с рецепторным белком.
Поступлению в дендрит ионов натрия через постсинаптическую мембрану вызывает ее деполяризацию (рис. 17.4, А). Если при этом достигается порог возбуждения, в нейроне генерируется потенциал действия, и нервный импульс распространяется дальше. Изменив проницаемость постсинаптической мембраны, ацетилхолин практически мгновенно удаляется из синаптической щели под действием фермента ацетилхолинэстеразы, иногда называемого просто холинэстеразой. Этот фермент локализован на постсинаптической мембране и гидролизует ацетилхолин до холина и остатка уксусной кислоты. В результате ионные каналы закрываются и синапс возвращается в «исходное положение». Холин реабсорбируется синаптическим окончанием и вновь превращается в ацетилхолин в синаптических пузырьках (рис. 17.11). Некоторые нервнопаралитические газы, инсектициды и другие яды ингибируют ацетилхолинэстеразу, нарушая тем самым нервное проведение, о чем говорилось в разд. 4.4.3.
Другие нейромедиаторы
Некоторые нейромедиаторы оказывают не возбуждающее, а тормозное действие на нейроны, приводя к гиперполяризации, а не к деполяризации постсинаптической мембраны. При этом внутри клетки увеличивается отрицательный заряд, и затрудняется достижение пороговой деполяризации, необходимой для генерирования потенциала действия по принципу «все или ничего».
Известны три пути удаления нейромедиатора из синаптической щели: 1) реабсорбция пресинаптической мембраной; 2) диффузия из щели; 3) ферментативный гидролиз.
Роль синапсов
ВОЗБУЖДАЮЩИЕ СИНАПСЫ, ПРОСТРАНСТВЕННАЯ И ВРЕМЕННАЯ СУММАЦИЯ. В возбуждающих синапсах нейромедиатор открывает постсинаптические ионные каналы, позволяя ионам натрия поступать в клетку, а ионам калия покидать ее по своим градиентам концентрации. Это ведет к деполяризации постсинаптической мембраны — возникает так называемый возбуждающий постсинаптический потенциал (ВПСП). Обычно он невелик, но сохраняется дольше потенциала действия. Амплитуда ВПСП изменяется ступенчато, что наводит на мысль о «порционном», а не постепенном выделении нейромедиатора. По-видимому, каждая такая «ступень» соответствует содержимому одного синаптического пузырька. Одиночный ВПСП обычно не способен вызвать деполяризацию пороговой величины, необходимой для генерирования потенциала действия и распространения импульса по постсинаптическому нейрону. Однако у следующего ВПСП, появившегося через малый интервал времени, шансы в этом плане уже выше. Это явление называется синаптическим облегчением. Деполяризующие эффекты, соответствующие нескольким ВПСП, складываются — происходит их суммация. Несколько ВПСП, возникающих одновременно в разных синапсах одного и того же нейрона (обычно стимулы приходят от разных нейронов), могут, накладываясь друг на друга, давать пороговую деполяризацию, генерирующую постсинаптический потенциал действия. Это называют пространственной суммацией (рис. 17.12). Быстро повторяющееся высвобождение нейромедиатора из нескольких синаптических пузырьков одного и того же синаптического окончания под действием интенсивного стимула вызывает отдельные ВПСП, которые следуют так часто один за другим во времени, что их эффекты тоже суммируются и вызывают в постсинаптическом нейроне потенциал действия. Это называется временнóй суммацией (рис. 17.12). Таким образом, импульсы в одиночном постсинаптическом нейроне могут возникать либо как результат слабой стимуляции нескольких связанных с ним пресинаптических нейронов, либо как результат повторяющейся стимуляции одного из его пресинаптических нейронов.
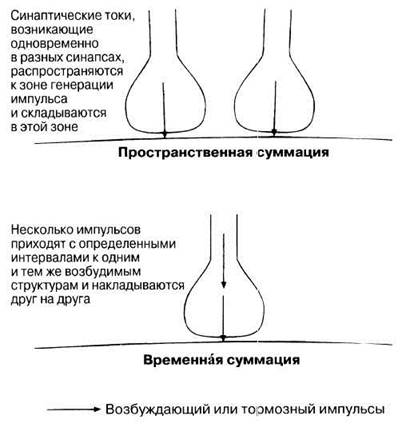
Рис. 17.12. Пространственная и временная суммация.
ТОРМОЗНЫЕ СИНАПСЫ. В тормозных синапсах высвобождение нейромедиатора повышает проницаемость постсинаптической мембраны для хлорид-ионов (Сl-) и ионов калия. Когда Сl--ионы устремляются в клетку, а К+-ионы — из нее по своим концентрационным градиентам, происходит гиперполяризация мембраны, называемая тормозным постсинаптическим потенциалом (ТПСП). Другими словами, содержимое клетки становится более отрицательным (до —90 мВ). Очевидно, что это затрудняет пороговую деполяризацию, т. е. генерирование потенциала действия.
Сами по себе нейромедиаторы не обладают возбуждающими или тормозящими свойствами. Например, ацетилхолин оказывает возбуждающее действие в большинстве нервно-мышечных соединений и межнейронных синапсов, но тормозит активность миокарда и мускулатуры пищеварительного тракта. Конечный результат зависит от особенностей постсинаптической мембраны. Строение ее рецепторно-поровых комплексов определяет, какие ионы будут поступать в клетку под действием нейромедиатора, а следовательно, какова будет природа вызываемого им постсинаптического потенциала.
НЕРВНО-МЫШЕЧНОЕ СОЕДИНЕНИЕ (рис. 17.13 и 17.14). Мотонейроны связаны с волокнами скелетных мышц особыми синапсами. Каждое поперечнополосатое мышечное волокно имеет специализированный участок — двигательную концевую пластинку. К ней подходит разветвленное немиелинизированное окончание аксона с синаптическими вздутиями. Они погружены в мелкие углубления наружной мембраны мышечного волокна (рис. 17.13, А), называемой сарколеммой. Каждое такое углубление в свою очередь усложнено многочисленными глубокими складками (рис. 17.13, Б). При стимуляции синаптические окончания высвобождают ацетилхолин по описанному выше механизму. Структурные изменения рецепторов в складках сарколеммы (постсинаптической мембраны) повышают ее проницаемость для ионов натрия и калия и вызывают ее местную деполяризацию, называемую потенциалом концевой пластинки (ПКП). Эта деполяризация вполне достаточна для возникновения и распространения по сарколемме и в глубине мышечного волокна по системе поперечных трубочек (Т-системе) потенциала действия (разд. 18.4.4), который вызывает сокращение мышцы, как описано в разд. 18.4.7, В большей части скелетных мышц на каждом волокне находится только одна концевая пластинка.
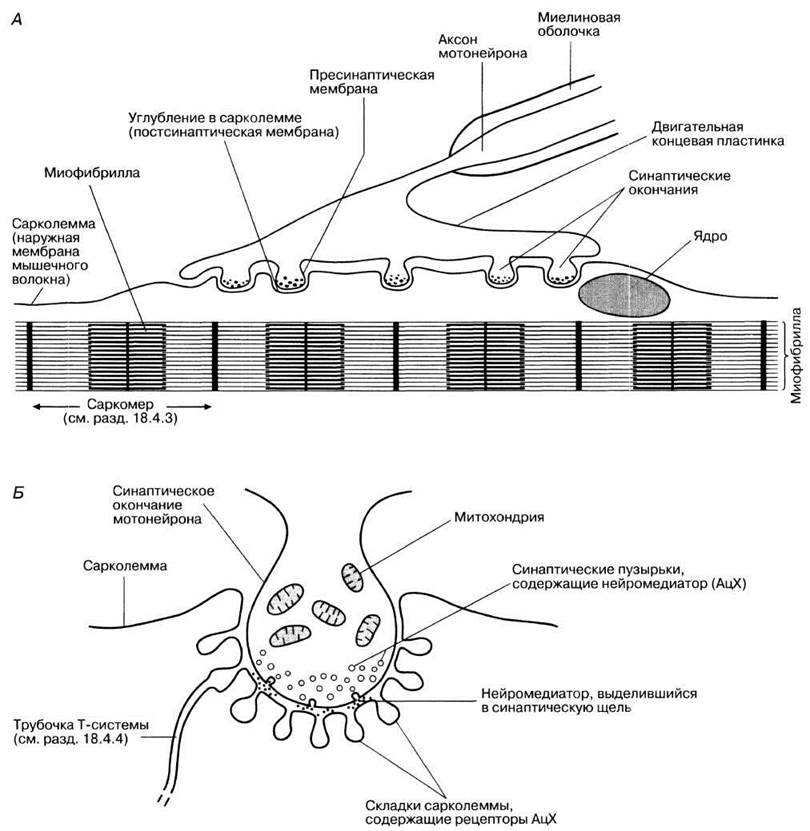
Рис. 17.13. Структура нервно-мышечного соединения. А. Картина, видимая с помощью светового микроскопа. Б. Картина, видимая с помощью электронного микроскопа. АцХ — ацетилхолин.
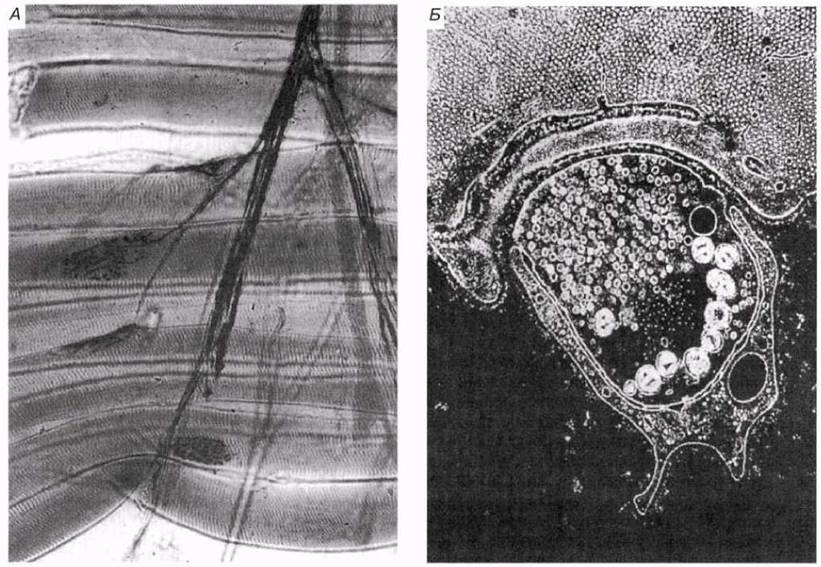
Рис. 17.14. Строение нервно-мышечного соединения, наблюдаемое с помощью светового (А) и просвечивающего электронного (Б) микроскопов. Нервное окончание (в центре) тесно связано с мышечным волокном. Внутри нервного окончания вблизи мышечного волокна сосредоточены мелкие пузырьки, содержащие нейромедиатор.
Функции синапсов
Поскольку в описанных выше химических синапсах происходит задержка нервных импульсов продолжительностью около 0,5 мс, можно предположить, что этот их недостаток компенсируется создаваемыми преимуществами. Каковы же эти преимущества? Резюмировать их можно следующим образом.
1. Однонаправленность передачи. Высвобождение нейромедиатора только пресинаптической мембраной и локализация рецепторов для него только на постсинаптической мембране допускают передачу нервных импульсов поданному пути только в одном направлении. Это обеспечивает надежность работы нервной системы, т. е. «доставки по назначению» передаваемых ею сигналов.
2. Усиление. Каждый нервный импульс вызывает в нервно-мышечном синапсе высвобождение достаточного количества ацетилхолина, чтобы деполяризация постсинаптической мембраны обусловила сокращение мышечного волокна. Таким образом, нервные импульсы, приходящие к нервно-мышечному соединению, как бы слабы они ни были, могут вызвать реакцию эффектора, и это повышает чувствительность системы.
3. Адаптация и утомление. При непрерывной стимуляции количество высвобождаемого нейромедиатора будет постепенно уменьшаться до тех пор, пока его запас полностью не исчерпается; тогда говорят, что синапс утомлен. Дальнейшая передача им сигналов станет возможной только после некоторого восстановительного периода. Адаптивное значение утомления состоит в том, что оно предотвращает повреждение эффектора в результате его гиперстимуляции. Этой же цели служит адаптация на уровне рецептора, о чем пойдет речь в разд. 17.4.2.
4. Интеграция, конвергенция и пространственная суммация. Благодаря особенностям своих рецепторов постсинаптический нейрон может получать сигналы одновременно от большого числа возбуждающих и тормозных пресинаптических нейронов. Это явление называется конвергенцией. Происходящая пространственная суммация всех стимулов (простой пример приведен на рис. 17.12) позволяет постсинаптическому нейрону выступать в качестве одного из центров интеграции сигналов от различных источников и выдавать координированные ответы на них.
5. Облегчение. Это явление, наблюдаемое в ряде синапсов, означает, что после каждого стимула синапс становится более чувствительным к следующему. В результате потенциал действия рано или поздно может вызываться даже слабым, ранее недостаточным для такой реакции сигналом. Облегчение не эквивалентно временной суммации, поскольку связано с химическими изменениями пресинаптической мембраны (усилением выброса нейромедиатора), а не простой электрической суммацией постсинаптических мембранных потенциалов.
6. Дискриминация (фильтрация) сигналов и временная суммация. Временная суммация в синапсах позволяет отфильтровывать слабые фоновые стимулы, не пропуская их в центральную нервную систему. Например, рецепторы кожи, глаз и ушей постоянно получают из окружающей среды сигналы, не имеющие существенного значения для нервной системы; это — так называемый фоновый шум. Важную роль играют лишь изменения интенсивности сигналов, приводящие к увеличению частоты импульсов, которое обеспечивает их передачу через синапс и надлежащую реакцию.
7. Торможение. Передачу информации через синапсы и нервно-мышечные соединения можно затормозить определенными блокирующими агентами, воздействующими на постсинаптическую мембрану (см. ниже). Возможно и пресинаптическое торможение. Оно происходит в синаптическом окончании, контактирующем с тормозными синапсами других нейронов. При стимуляции этих тормозных синапсов снижается число синаптических пузырьков, высвобождающих нейромедиатор в возбуждающем синапсе. Такая система позволяет данному окончанию давать разные ответы в зависимости от активности окружающих его тормозных и возбуждающих синапсов.
8. В головном мозге синаптическая передача происходит посредством нескольких нейромедиаторов. Это химическое усложнение системы позволяет более тонко регулировать процессы, связанные с высшей нервной деятельностью.
Нейромедиаторы и другие влияющие на синаптическую передачу вещества
За пределами головного мозга главными нейромедиаторами являются ацетилхолин и норадреналин, а из самого головного мозга выделено более 50 других веществ с такими же функциями, причем все они специфически связаны с теми или иными нервными путями. На синапсы влияют многие другие вещества как природного, так и синтетического происхождения. Их действие проявляется на уровне головного мозга и, следовательно, поведения, и некоторых других уровнях, в частности на уровне нервно-мышечных соединений. Несколько таких веществ и их свойства описаны ниже и обобщены в табл. 17.3.
Таблица 17.3. Вещества, влияющие на синаптическую передачу
Вещество |
Место действия |
Функция/эффект |
|
Ацетилхолин (АцХ) |
Разные области нервной системы |
Возбуждение или торможение |
|
Глутаминовая кислота |
Головной мозг |
Возбуждение |
|
Глицин |
Постсинаптические мембраны в головном и спинном мозге |
Торможение Мышечное расслабление |
|
Стрихнин |
Головной и спинной мозг (блокада глициновых рецепторов) |
Антагонист глицина Мышечное сокращение без расслабления |
|
Гамма-аминомасляная кислота (ГАМК) |
Головной мозг |
Торможение |
|
β-Эндорфины Энкефалины |
Опиатные рецепторы в постсинаптических мембранах головного мозга |
Анальгетическое действие и стумуляция системы «поощрения» |
|
Морфин Героин |
Опиатные рецепторы в постсинаптических мембранах головного мозга |
Имитируют действие эндорфинов и энкефалинов |
|
Норадреналин |
Головной мозг и СНС |
Возбуждение |
|
Дофамин |
Головной мозг |
Возбуждение, контроль сложной мышечной активности, ряд эмоциональных реакций |
|
Серотонин |
Головной мозг |
Возбуждение, контроль настроения, галлюцинации |
|
ЛСД (диэтиламид лизергиновой кислоты) Мескалин |
Головной мозг |
Имитируют действие серотонина? Вызывают галлюцинации |
|
Амфетамин |
Головной мозг и СНС |
Ингибирует моноаминоксидазу, повышая уровень норадреналина |
|
Кокаин |
Головной мозг и СНС |
Как амфетамины (см. выше) Другие эффекты |
|
Прозак |
Головной мозг и СНС |
Блокирует реабсорбцию серотонина, усиливая его эффект |
|
Никотин |
Постсинаптические мембраны СНС и пне |
Имитирует действие АцХ на никотиновые рецепторы |
|
Мускарин |
Постсинаптические мембраны ПНС |
Имитирует действие АцХ на мускариновые рецепторы |
|
Кофеин |
Головной мозг |
Стимулирует дофаминовое проведение |
|
Атропин |
СНС и ПНС |
Блокирует действие АцХ на мускариновые рецепторы |
|
Кураре |
СНС, ПНС, нервно-мышечные соединения, постсинаптические мембраны |
Блокирует действие АцХ на никотиновые рецепторы |
|
Столбнячный токсин |
Пресинаптическая мембрана |
Блокирует высвобождение тормозных нейромедиаторов |
|
Ботулинический токсин |
Пресинаптическая мембрана |
Блокирует высвобождение АцХ |
|
Фосфорорганические пестициды, некоторые нервнопаралитические газы |
Постсинаптическая мембрана |
Инактивируя ацетилхолинэстеразу, препятствуют расщеплению АцХ |
|
Психотропные вещества выделены жирным шрифтом. СНС — симпатическая нервная система; П НС — парасимпатическая нервная система. |
|||
АМИНОКИСЛОТЫ. Главный возбуждающий нейромедиатор в головном мозге — глутамат (глутаминовая кислота). Ряд веществ имитирует его действие, связываясь с глутаматными рецепторами. Некоторые из этих рецепторов являются основной мишенью для психотропного средства фенциклидина (фенилциклогексилпиперидина), запрещенного сейчас во многих странах и известного у подпольных торговцев в Англии под названием «ангельская пыль» (angel dust).
Аминокислота глицин представляет собой тормозный нейромедиатор, открывающий хлоридные каналы в постсинаптической мембране и приводящей к ее гиперполяризации (внутри клетки увеличивается отрицательный заряд). Глицин играет важную роль в спинном мозге, где способствует контролю движений скелетных мышц, поддерживая их расслабление (предотвращая стимуляцию). О том, каково значение глицина, можно судить по действию стрихнина, который блокирует глициновые рецепторы, подавляя тем самым эффект глицина. В этом случае даже очень слабая стимуляция вызывает мышечное сокращение. Пострадавший от стрихнинового отравления задыхается, поскольку не способен расслабить мышцы, участвующие в дыхании.
γ-Аминомасляная кислота (ГАМК) — важнейший тормозный нейромедиатор головного мозга. Она участвует в контроле мышечных сокращений, действуя на уровне мозжечка (отдел мозга, рассматриваемый в разд. 17.2.4). Недостаток ГАМК приводит к неупорядоченным движениям при хорее Гентингтона (разд. 25.7.5). Ее активность усиливается противотревожными лекарствами, в частности валиумом (диазепамом).
ОПИОИДЫ, ЭНДОРФИНЫ И ЭНКЕФАЛИНЫ. Опиоидами (опиатами) называют алкалоиды опия, т. е. млечного сока мака снотворного, и близкие к ним вещества. Это типичные наркотические вещества, столетиями применявшиеся в качестве обезболивающих средств (анальгетиков). Среди них наиболее широко известны морфин и его синтетическое производное — героин. В головном мозге содержатся природные пептиды со сходным действием, которые в 200 раз сильнее морфина. Они реагируют с так называемыми опиатными рецепторами головного мозга, открытыми в 1973 г., и называются эндорфинами (т. е. эндогенно синтезируемые морфиноподобные соединения, или «эндогенные морфины»). Их известно довольно много, но лучше всего изучены небольшие пептиды под названием энкефалины, например мет-энкефалин и β-эндорфин. Молекулы энкефалинов образованы пятью аминокислотными остатками. Они ослабляют боль и повышают настроение, а нарушения их активности связаны с рядом психических заболеваний. Эндорфины действуют на постсинаптическую мембрану, подавляя нервное проведение, которое в норме ведет к ощущению боли. Другими словами, это эндогенные анальгетики. При введении извне они оказывают лишь кратковременное действие, но способны вызывать зависимость. Выброс β-эндорфина отмечен у женщин во время родов.
Опиоиды и эндорфины поднимают настроение (вызывают эйфорию) и, возможно, связаны с внутренними процессами «поощрения», усиливающими некоторые типы поведения. Поскольку при физической нагрузке уровень β-эндорфина повышается, не исключено, что это объясняет появление «второго дыхания» у бегунов и ощущение ими своеобразного «кайфа».
Изучение таких веществ позволило по-новому взглянуть на некоторые стороны функционирования головного мозга. Пол ученные результаты помогли, в частности, объяснить механизм обезболивания при таких различных воздействиях, как гипноз, иглоукалывание (акупунктура) и «заговаривание» боли. Считается, что в организме присутствует еще много неизвестных веществ сходного типа, которые предстоит выделить, идентифицировать и определить их функции.
МОНОАМИНЫ. Норадреналин, один из гормонов надпочечников, является одновременно нейромедиатором симпатической нервной системы, подготавливающим организм к быстрой реакции (разд. 17.2.3). Он обнаружен также в головном мозге, где он способствует улучшению внимания и поддержанию бодрствующего состояния. Таким образом, в целом он усиливает реакцию на новые стимулы. Стимулирующие таблетки, содержащие амфетамины, повышают содержание норадреналина в головном мозге, ингибируя фермент моноаминоксидазу (МАО). В норме моноаминоксидаза окисляет норадреналин, реабсорбированный синаптическими окончаниями, предотвращая таким образом гиперстимуляцию. Другой эффект амфетаминов — стимуляция высвобождения дофамина и в результате стимуляция системы «поощрения» (см. ниже). Кроме того, повышая уровень норадреналина в симпатических синапсах, они стимулируют симпатическую нервную систему.
Некоторые антидепрессанты являются ингибиторами МАО, и их способность улучшать настроение предположительно связана с продлением действия норадреналина. Клиническая депрессия представляет собой психическое расстройство, характеризующееся угнетением нервного проведения в головном мозге. Ингибиторы МАО повышают активность всех моноаминовых нейромедиаторов и могут привести к отрицательным побочным эффектам. Сравнительно новый препарат прозак специфически блокирует реабсорбцию серотонина пресинаптическими аксонами, и, следовательно, усиливает только его действие (см. ниже). Сейчас это средство широко применяется для лечения депрессии.
Дофамин по своей структуре очень сходен с норадреналином (рис. 17.15). Этот нейромедиатор связан с «дофаминовой системой» головного мозга, которая участвует в произвольном контроле сложной мышечной активности. Недостаток дофамина приводит к паркинсонизму (болезни Паркинсона). Кроме того, он связан с формированием эмоциональных реакций в коре больших полушарий и развитием шизофрении. Дофамин также стимулирует «центр удовольствия» в гипоталамусе. Высвобождение этого нейромедиатора индуцируется амфетаминами.
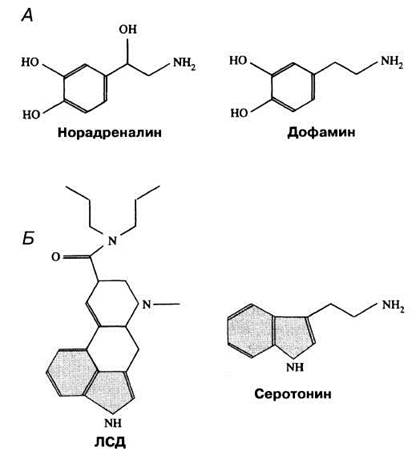
Рис. 17.15. Структурные формулы, демонстрирующие химическое сходство между нейромедиаторами норадреналином и дофамином (А) и между ЛСД и природным нейромедиатором серотонином (Б). Многие психотропные, т. е. влияющие на поведение, вещества, в частности ЛСД, близки по структуре молекулы к природным нейромедиаторам.
Серотонин участвует в контроле настроения, и при нарушении его активности могут развиваться депрессии, эйфории и мании. В гипоталамусе он связан также с зонами, контролирующими сон, сенсорное восприятие и терморегуляцию. Структурная формула серотонина (рис. 17.15) свидетельствует о некотором его сходстве с ЛСД (диэтиламидом лизергиновой кислоты). ЛСД представляет собой такой же сильный галлюциноген, как и мескалин. Считается, что это их действие объясняется имитацией некоторых функций серотонина. Структурное сходство психотропных веществ с нейромедиаторами — широко распространенное явление, означающее, по-видимому, что все эти вещества распознаются одними и теми же рецепторами. Это позволяет с помощью внешних агентов усиливать или блокировать синаптическую передачу в головном мозге, вызывая изменения его активности.
НИКОТИН. Никотин имитирует действие ацетилхолина на определенные постсинаптические рецепторы, которые так и называются — никотиновыми. Эти рецепторы находятся в симпатической и парасимпатической нервной системе (разд. 17.2.3). Активация этих рецепторов ведет к деполяризации (возбуждению) постсинаптических нейронов, или эффекторов. Никотин вызывает сильное «симпатическое» сужение кровеносных сосудов в органах брюшной полости (например, в кишечнике) и конечностях; одновременно он обусловливает такие парасимпатические эффекты, как усиление активности пищеварительного тракта и иногда замедление работы сердца.
Никотиновые рецепторы обнаружены и в нервно-мышечных соединениях. Если произвести аппликацию никотина непосредственно на это соединение, то мышца сократится, иными словами, никотин имитирует эффект ацетилхолина. Никотиновые рецепторы имеются в некоторых зонах головного мозга, однако их связь с психотропным действием никотина неясна. Многие из них стимулируют высвобождение дофамина и, следовательно, системы «поощрения» и «удовольствия». Однако поведенческие эффекты никотина по сравнению с другими психотропными средствами очень слабые.
АТРОПИН. Холинергические, т. е. связывающие ацетилхолин, рецепторы бывают двух типов — никотиновые (см. выше) и мускариновые. Эти последние рецепторы получили свое название от ядовитого алкалоида мускарина, содержащегося в некоторых грибах, например в мухоморах, и находятся в парасимпатической нервной системе, регулирующей, в частности, работу сердца и пищеварительного тракта. Атропин блокирует действие ацетилхолина на мускариновые рецепторы. Этот нейромедиатор замедляет работу сердца и стимулирует перистальтику кишечника; таким образом, атропин оказывает противоположное действие, поскольку он блокирует рецепторы, предотвращающие связывание ацетилхолина.
Атропин выделен из растения под названием красавка или белладонна (Atropa belladonna), получившего свое название из-за того, что в Средние века знатные дамы применяли его экстракт в качестве глазных капель для расширения зрачков — это считалось весьма привлекательной чертой внешности. Как выяснилось, атропин и другие алкалоиды красавки тормозят парасимпатическую стимуляцию кольцевых мышц радужки, сужающих зрачок. Сейчас эти вещества широко применяются в медицине. Атропин используют для расширения зрачков при исследовании глазного дна, для подавления секреции слизи в дыхательных путях перед общей анестезией и подавления секреции кислоты в желудке у пациентов с гастритом, вызванным повышенной кислотностью, а также в качестве антидотов (противоядий) при отравлениях фосфорорганическими пестицидами и некоторыми нервно-паралитическими ядами, которые усиливают эффект ацетилхолина.
КУРАРЕ. Кураре (точнее, алкалоиды курарины в его составе) специфически блокирует никотиновые рецепторы ацетилхолина, т. е. выступает в роли антагониста ацетилхолина и никотина. Эффекты кураре наиболее выражены в нервно-мышечных соединениях: мышцы теряют способность сокращаться, и все тело быстро парализуется. Пострадавший умирает от того, что не в состоянии дышать. Впрочем, спасти его может искусственное дыхание, применяемое до тех пор, пока не кончится действие кураре. Парализующие свойства этого препарата используют некоторые южноамериканские индейцы — они смазывают им наконечники стрел, и в результате даже легко раненому животному не удается скрыться от охотника. Курареподобные агенты применяются как миорелаксанты («расслабители» мышц) при проведении операций, поскольку это облегчает работу хирурга. Дыхание в данном случае поддерживается искусственно.
КОФЕИН. Подобно никотину, кофеин является стимулятором, но по силе действия он уступает даже никотину. Считается, что он способствует высвобождению дофамина в головном мозге, т. е. активирует систему психологического «поощрения».
КОКАИН. Кокаин — сильный стимулятор, по действию очень сходный с амфетаминами, но не эквивалентный им. Он блокирует реабсорбцию моноаминов пресинаптическими аксонами. Это приводит к гиперстимуляции дофаминовой и других моноаминовых систем, обусловливающей самые разнообразные эффекты. Кокаин — алкалоид, содержащийся в листьях кустарника коки, которые жевали для поднятия настроения местные жители высокогорных Анд. Примерно до 1900 г. его добавляли в напиток «Кока-Кола», но впоследствии это было запрещено. В качестве наркотика его используют как средство, снимающее усталость, вызывающее состояние эйфории и помогающее пережить стрессовые ситуации (сейчас особенно распространена его высокоочищенная форма — так называемый крэк). Опасность кокаина связана с развитием психической зависимости от него, которая ведет к злоупотреблению с целым комплексом отрицательных последствий — от депрессивных состояний и распада личности до поражения сердца и почек и, наконец, передозировок с летальным исходом. Вместе с тем это вещество до сих пор применяется в медицине как местный анестетик при хирургическом лечении глаз, носа, ротовой полости (в стоматологии) и глотки.