ГЕТЕРОФІЛІЯ У РОСЛИН - О.М. НЕДУХА - 2011
РОЗДІЛ ДРУГИЙ МЕХАНІЗМИ ПРОЯВУ ГЕТЕРОФІЛІЇ У РОСЛИН

2.2. ЕНДОГЕННІ МЕХАНІЗМИ ПРОЯВУ ГЕТЕРОФІЛІЇ У РОСЛИН
2.2.3. Са2+ як вторинний посередник регуляторних процесів
У вищих водних рослин, для яких характерна гетерофілія, перехід однієї форми листка до іншої відбувається переважно при виході стебла з води на водну поверхню й характеризується фенотипічною пластичністю анатомічних й ультраструктурних ознак листків, а також посиленням інтенсивності фіксації СО2, збільшенням синтезу хлорофілів і АБК (Некрасова и др., 2003; Mommer, Visser, 2005). У підводних листках зниження активності карбоксилюючих ферментів і вмісту продуктів фотосинтезу супроводжується змінами структури кутикули оболонок епідерми, що сприяє транспорту СО2 і НСО3- по апопласту (Rascio, 2002). Більшість вищезазначених процесів є кальційзалежними.
Контроль за ростом та розвитком рослин, а також відповіддю рослинних організмів на дію факторів оточуючого середовища здійснюють вторинні посередники, включаючи циклічний ГМФ, ліпіди, Са2+ та ін. Проте лише іони кальцію миттєво відповідають майже на всі стимули. Са2+ бере участь у регуляції численних процесів в усіх рослинних тканинах, в яких Са2+-залежні білки (кальцієві сенсори) активуються, чи інгібується в залежності від вмісту цитоплазматичного кальцію [Са2+]с(Sanders et al., 1999; Bush, 1995). Це відбувається завдяки здатності цих іонів координувати численні (від 2 до 8) зв'язки з доменами білків та змінювати їхню конформацію (див. огляд: Бєлявсмя, 1994). У фотосинтезуючих клітинах Са2+ накоплюється в стромі та тилакоїдах хлоропластів: у стромі він активує НАД-кіназу, яка каталізує перетворення НАД у НАДФ; у тилакоїдах - активує ферменти циклу Кальвіна та бере участь у репарації реакційних центрів ФСІІ (Charles, Halliwell, 1980; Moore, Akerman, 1984; Matoo et al., 1989; Grove, Brudvig, 1998; Sai, Johnson, 2002). Встановлено, що тилакоїди хлоропластів можуть накопичувати до 30 нМ Са2+ на 1 мг хлорофілу (Ettinger et al., 1999).
Потенційна роль Са2+-потоків в регулюючих процесах всередині хлоропласта та їхній зв'язок із регуляцією транспорту цитозольного Са2+ є дуже важливою. Показано, що ізольовані хлоропласти при освітленні поглинають кальцій, який, очевидно, транспортується через оболонку хлоропласта. Світло-індуковане поглинання кальцію спостерігали й в експерименті in vitro. Це було показано на клітинах харової водорості Nitellopsis sp. Встановлено, що вміст цитозольного кальцію в клітинах ставав меншим при освітленні; цей феномен залежав від фотосинтетичного транспорту електронів (Sai, Johnson, 2002).
У клітинних оболонках іони кальцію, зв'язуючись із залишками галактуронової кислоти пектинів, приводять до конформаційнихзмін пектинів, утворюючи димерні чи мультимерні форми пектину (Jarvis, 1982). Крім цього, іони кальцію в клітинних оболонках можуть зв'язуватись з полімерами ксиланів, індукуючи кристалізацію останніх та їхнє зв'язування з молекулами лігніну (Jarvis, 1982), що призводить до зміцнення оболонки. Встановлено, що робота продихів також регулюється кальцієм поряд з дією інших ендогенних та екзогенних факторів, таких як іони калію, вмістом СО2 і АБК, вологістю грунту й повітря (Kearns, Assmann, 1999; Xi-Qing et al., 1998). Автори, досліджуючи роль кальцію в роботі продихів Vicia faba L., встановили, що мілімолярна концентрація іонів кальцію (від 0.1 до 1 мМ) інгібувала на 60% відкриття продихів на нижній поверхні листків, та на 45% - на верхній поверхні (Xi-Qing et al., 1998).
При дії різноманітних стимулів, таких як зміна освітленості, осмотичний та оксидативний стрес, підвищення температури, засолення та ін., відбувається збільшення вмісту цитоплазматичного кальцію (Bush, 1995; Knight, 2000; Knight et al., 1997). Зміни кальцієвого балансу, який забезпечує пристосування рослини до навколишнього середовища, очевидно, стосуються як клітин епідермісу, так і мезофілу. Враховуючи вищевідмі- чене, можна припустити, що фотосинтезуючі клітини рослин, що зростають під водою, будуть відрізнятися за вмістом іонізованого кальцію від таких, які зростають у повітрі (над водою).
У фотосинтезуючих клітинах іонізований кальцій, як один із вторинних посередників, бере участь у регуляції фотодихання й фотосинтезу, зокрема, у відновленні реакційних центрів ФСІІ, активації ферменту D-рибулозо-1,5-дифосфаткарбоксизи й регуляції синтезу хлорофілів (Hiedema, Prins, 1992; Sai, Johnson, 2002). У клітинних оболонках листків мезофітів іони кальцію, зв'язуючись з пектинами й структурними білками, знижують пластичність оболонок та інгібують водний транспорт по апопласту (Mommer, Visser, 2005; Virk, Cleland, 1988). Участь іонів кальцію у вище зазначених процесах у листках гідрофітів, що зростають за оптимальних умов або умов помірного водного дефіциту, майже не досліджена. Раніше були встановлені певні відмінності в структурі клітин мезофілу підводних і надводних листків S. latifolium, а також в ультраструктурі епідермісу листків Alisma plantago-aquatica, що зростали в різних умовах водопостачання (Кордюм и др., 2003; Недуха, 2005). Ми висунули припущення, що відмінності в ультраструктурі клітин мезофілу підводних і надводних листків S. latifolium опосередковані перерозподілом іонів кальцію в клітинах і змінами кальцій-залежного синтезу хлорофілу (Недуха, 2010, б). Подальше вивчення розподілу іонів кальцію в клітинах мезофілу й епідермісу різних листків S. latifolium у фазі вегетативного росту (у травні) залежно від умов його зростання показало наступне.
Sium latifolium повітряно-водна екоформа у віргінальній стадії онтогенезу (у травні) характеризувалася розвитком підводних і надводних листків різних за формою. Ми дослідили розподіл іонів Са2+ в органелах, оболонках і цитоплазмі клітин мезофілу й епідерми підводних і надводних листків (Недуха, 2010, б). Аналіз локалізації іонів кальцію в присутності специфічного флуоресцентного індикатора (Fluo-4) в клітинах мезофілу підводних і надводних листків показав рівномірну зеленого кольору люмінесценцію досліджуваних іонів у хлоропластах, ядрах, клітинних оболонках і цитоплазмі досліджуваних клітин (рис. 2.2.3.1, а-г; див. вставку XV). Використання програми «Pascal» для побудови відповідних гістограм (рис. 2.2.3.1, є, є', ї, ї') дозволило визначити відносний вміст іонів Са2+ в органелах і клітинних оболонках листків, що були оброблені флуоресцентним індикатором.
Порівняння інтенсивності флуоресценції іонів кальцію в клітинах мезофілу двох типів листків S. latifolium показало, що в підводних листках інтенсивність флуоресценції іонів кальцію в хлоропластах, ядрі й клітинних оболонках мезофілу була в 1,7; 1,5 та 1,4 раза нижчою, у цитоплазмі - більшою в 1,4 раза порівняно з відповідними органелами й клітинними оболонками надводних листків (табл. 2.2.3.1). Вивчення люмінесценції комплексу fluo-4+кальцій у клітинних оболонках верхньої й нижньої епідерми підводних і надводних листків показало, що в зовнішніх оболонках основних епідермальних клітин кальцій флуоресціював у вигляді окремих зелених зерен.
Флуоресценція іонів кальцію в антиклінальних оболонках тих самих клітин і оболонках замикаючих клітин продихів була рівномірною (рис. 2.2.3.1, ж, з).
В замикаючих клітинах продихів досліджували клітинні оболонки, що утворювали продихову щілину. У підводних листках розподіл інтенсивності флуоресценції іонів кальцію в оболонках верхньої й нижньої епідерми відрізнялися. У верхній епідермі її інтенсивність була достовірно вищою: у 3,3 раза - у зовнішніх оболонках, у 1,7 раза - в антиклінальних оболонках і в 2,2 раза - в оболонках клітин продихів порівняно з відповідними оболонками клітин нижньої епідерми (табл.2.2.3.2). У надводних листках також відмічена подібна тенденція щодо розподілу іонів кальцію в клітинах верхньої епідерми: збільшення його вмісту в 1,3 раза в антиклінальних оболонках та в 1,12 раза - в оболонках замикаючих клітин продихів порівняно з клітинами нижньої епідерми (табл. 2.2.3.2).
ТАБЛИЦЯ 2.2.3.1. Розподіл іонів Са2+ у клітинах мезофілу листків Sium latifolium, зібраних у травні
Відносний вміст іонів кальцію, ум. од., x ± Sx- |
||||
Структура |
Листки повітряно- водних рослин |
Листки суходільних рослин |
||
клітини |
підводні |
надводні |
з цілісною |
пірчасторозсічені |
пластинкою |
||||
Хлоропласт |
125 ± 9,0 |
211±12** |
95 ± 5,2 |
109 ± 7,1 |
Ядро |
83 ± 2,7 |
124 ± 5,7** |
87 ± 2,9 |
151 ± 9,1** |
Клітинна оболонка |
35 ± 2 |
50 ± 2,4* |
33 ± 1,9 |
41 ± 1,5* |
Цитоплазма |
60 ± 3,7 |
48 ± 2,4* |
53 ± 2,3 |
114 ± 1,2** |
Позначення: * - Р ≤ 0,01 ; ** - Р ≤ 0,001 (При порівнянні даних двох типів листків у кожної екоформи S.latifolium)
ТАБЛИЦЯ 2.2.3.2. Розподіл іонів Са2+ в клітинах епідермісу листків Sium latifolium, зібраних у травні
Відносний вміст іонів кальцію, ум. од., x ± Sx- |
||||
Епідерма / тип оболонки |
Листки повітряно- водних рослин |
Листки суходільних рослин |
||
підводні |
надводні |
з цілісною пластинкою |
пірчасто- розсічені |
|
Верхня епідерма: зовнішня болонка |
87 ± 4,3 |
49 ± 2,1*** |
91 ± 3,2 |
57 ± 4,4*** |
антиклінальна оболонка |
157 ± 10,2 |
133 ± 11 |
101 ± 9,3 |
105 ± 10,1 |
оболонки продихів |
174 ± 12,9 |
120 ± 8,9** |
110 ± 8,9 |
190 ± 13,2*** |
Нижня епідерма: зовнішня оболонка |
26 ± 1,7 |
43 ± 7*** |
90 ± 7,0 |
47 ± 2,9*** |
антиклінальна оболонка |
90 ± 4,9 |
99 ± 4,4 |
89 ± 7,8 |
100 ± 9,9 |
оболонки продихів |
79 ± 6,7 |
107 ± 9,7* |
97 ± 8,0 |
140 ± 12,7** |
Позначення: *- Р ≤ 0,05; ** - Р ≤ 0,01; *** - Р ≤ 0,001 (При порівнянні даних двох типів листків у кожної екоформи S. latifolium)
ТАБЛИЦЯ 2.2.3.3. Вміст фотосинтезуючих пігментів у листках Sium latifolium, зібраних у травні
Пігмент, мг/г сирої маси |
Вміст пігментів, x ± Sx |
|||
Листки повітряно- водних рослин |
Листки суходільних рослин |
|||
підводні |
надводні |
з цілісною пластинкою |
пірчасто- розсічені |
|
Хлорофіл а |
1,43 ± 0,08 |
2,16 ± 0,08** |
1,76 ± 0.2 |
1,59 ± 0,10 |
Хлорофіл b |
0,95 ± 0,02 |
1,18 ± 0,04** |
1,14 ± 0,11 |
1, 21 ± 0,08 |
Сума хлорофілів а+b |
2,38 ± 0,08 |
3,34 ± 0,09** |
2,89 ± 0,12 |
2,79 ± 0,12 |
Відношення хлорофілів а/b |
1,5 |
1,83 |
1.46 |
1,3 |
Каротиноїди |
0,55 ±0,02 |
1,01 ±0,05* |
0,78 ±0,05 |
0,88 ± 0,06 |
Позначення: *- Р ≤ 0,05; ** - Р ≤ 0,001 (При порівнянні даних двох типів листків у кожної екоформи S. latifolium)
Порівняння вмісту іонів кальцію в оболонках верхньої й нижньої епідерми підводних і надводних листків S. latifolium показало, що ріст листків над водою супроводжувався зниженням відносного вмісту іонів у зовнішніх оболонках основних клітин і оболонках клітин продихів верхньої епідерми, а також збільшенням вмісту іонів кальцію у відповідних оболонках клітин нижньої епідерми.
Паралельне визначення вмісту фотосинтезуючих пігментів у підводних і надводних листків, у яких вивчали локалізацію та вміст іонів кальцію, засвідчило, що в підводних листках вміст хлорофілу а та b і каротиноїдів був достовірно менший, ніж у надводних листках (табл. 2.2.3.3).
S. latifolium суходільна екоформа. Листки рослин веху широколистого при зростанні на суходолі в травні (у фазі вегетативного росту) також мали різну форму пластинки: цілісну (перший-третій листок) і пірчасторозсічену (четвертий-п'ятий листок) (рис. 2.2.2.1, б; див. вставку XIII). Флуоресценція іонів кальцію в клітинах мезофілу листків S. latifolium з різною формою пластинки була ідентична такій у листкових пластинках повітряно-водної форми S. latifolium (рис. 2.2.3.1, д, е; див. вставку XV). Порівняння розподілу інтенсивності флуоресценції іонів кальцію в клітинах мезофілу листків, різних за формою показало наступне: в ядрі, клітинних оболонках і цитоплазмі клітин листків з цілісною пластинкою інтенсивність флуоресценції Са2+ була нижчою відповідно в 1,7; 1,3 та 2,1 раза, ніж в ідентичних структурах клітин мезофілу пірчасторозсічених листків (табл. 2.2.3.1). Водночас відносний вміст іонів кальцію в хлоропластах мезофілу в листках з різною формою пластинки достовірно не відрізнявся. Крім того, розподіл іонів кальцію в клітинних оболонках верхньої й нижньої епідерм перших трьох листків із цілісною пластинкою суходільної екоформи S. latifolium також не відрізнявся (табл. 2.2.3.2).
У пірчасторозсічених листків відносний вміст іонів кальцію в оболонках епідерми різнився: у зовнішніх оболонках основних епідермальних клітин верхньої епідерми був в 1,2 раза, в оболонках замикаючих клітин продихів - у 1,4 раза більшим, ніж в оболонках нижньої епідерми (табл. 2.2.3.2). Порівняння вмісту іонів кальцію в клітинних оболонках епідерми двох типів листків суходільної екоформи веху широколистого показало наявність суттєвої відмінності між зовнішніми оболонками та оболонками клітин продихів (табл. 2.2.3.2).
Визначення вмісту фотосинтезуючих пігментів у перших листках з цілісною пластинкою й наступних пірчасторозсічених листках суходільної екоформи виду засвідчило відсутність достовірної відмінності щодо вмісту хлорофілів a, b, їхньої суми (а + b) і каротиноїдів (табл. 2.2.3.3). Одержані дані щодо відсутності суттєвих змін у розподілі іонів кальцію в хлоропластах мезофілу й вмісті фотосинтезуючих пігментів у двох типів листків суходільної екоформи S. latifolium, очевидно, свідчать про те, що ці ознаки в листках суходільної форми у фазі вегетативного росту залишаються відносно стабільними.
Отже, цитохімічним методом і лазерно-конфокальною мікроскопією доведено, що листки двох екологічних форм S. latifolium у фазі вегетативного росту залежно від умов зростання рослини характеризуються певним розподілом іонів кальцію. Ми встановили, що відносний вміст Са2+ в хлоропластах мезофілу надводних листків повітряно-водних рослин вищий, ніж у хлоропластах підводних листків. Як відомо, швидкість фотосинтезу, активність карбоксилюючих ферментів і вміст продуктів фотосинтезу в затоплених листках багатьох видів диких і культурних рослин значно нижчі порівняно з такими в надводних листків тих самих видів (Bowes, Salvucci, 1989; Ронжина, Пьянков, 2001; Некрасова и др., 2003; Ронжина и др., 2004). Крім того, встановлено, що активність Рубіско та синтез фото- синтезуючих пігментів залежать від вмісту іонів кальцію в хлоропласті (Sai, Johnson, 2002; Lechowski, Biatczyk, 1993). Враховуючи наведені вище дані літератури й наші експериментальні результати, можна припустити, що в підводних листках S. latifolium зміни в синтезі хлорофілів опосередковані меншим вмістом іонів кальцію в хлоропластах.
Порівняльний аналіз вмісту хлорофілів і каротиноїдів підводних і надводних листків повітряно-водної форми S. latifolium показав, що їх вміст був достовірно нижчим у підводних листках. Аналогічні дані низького вмісту хлорофілів в підводних листках описані іншими авторами при порівнянні підводних і плаваючих листків Ranunculus vulgaris L., Marsilea quadrifolia та інших видів рослин, для яких характерна гетерофілія (Bowes, Salvucci, 1989; Некрасова и др., 2003; Ронжина и др., 2004; Mommer, Visser, 2005). Інгібування синтезу фотосинтезуючих пігментів під водою відбувається внаслідок низької освітленості, збільшення далекого червоного світла й повільної дифузії СО2 у воді (Некрасова и др., 2003; Mommer, Visser, 2005).
Порівняння відносного вмісту іонів кальцію в хлоропластах надводних листків повітряно-водної екоформи Sium latifolium і вмісту цих іонів у хлоропластах мезофілу двох типів листків суходільної форми цього виду показало, що хлоропласти мезофілу надводних листків містили вдвічі більше іонів кальцію, ніж хлоропласти мезофілу листків веху широколистого суходільної форми. До того ж, надводні листки повітряно-водних рослин містили більше фотосинтезуючих пігментів, ніж листки суходільної форми. Раніше подібна кореляція вмісту пігментів та іонів кальцію виявлена в сім'ядолях огірків, коли концентрація іонів кальцію в поживному середовищі не перевищувала 10 мМ (Tanaka, Tsuji, 1980).
Відомо, що синтез хлорофілу є кальцій-залежним процесом (Sai, Johnson, 2002; Charles, Halliwell, 1980). У хлоропластах Са2+ активує НАД-кіназу та ферменти циклу Кальвіна (Charles, Halliwell, 1980; Grove, Brudvig, 1998). Аналіз даних літератури по вивченню механізмів транспорту іонів кальцію із цитозолю в хлоропласт свідчить, що такий транспорт залежить від інтенсивності освітлення та інтенсивності зв'язування іонів Са2+ з білками ФСІІ (Etting et al., 1999; Johnson et al.,1995; Roh et al., 1998).
У результаті експериментальних робіт, проведених із хлоропластами трансгенного тютюну, у яких відбулась експресія цитозольного аквори- ну - Са2+-зв'язуючого білка, люмінесценція якого визначає концентрацію іонізованого кальцію, встановлено, що після перенесення проростків тютюну з темряви на світло починався швидкий транспорт іонів Са2+ з цитоплазми в хлоропласти (рис. 2.2.3.2, а). Відмічено, що зі збільшенням тривалості перебування на світлі проростків вміст іонів Са2+ у хлоропласті зростав. При перенесенні проростків у темряву вже через 5 хв. наступав зворотний транспорт - відкачка іонів кальцію з тилакоїдів у строму хлоропласта, а зі строми - у цитоплазму (рис. 2.2.3.2, б) (Sai, Johnson, 2002).
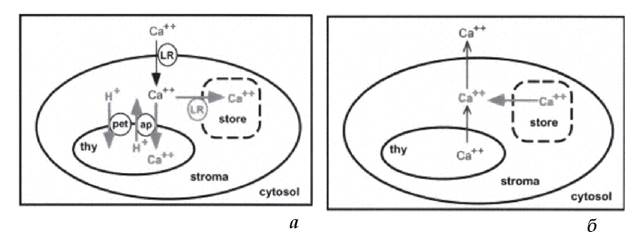
Рисунок 2.2.3.2. Схема надходження (а) іонів Са2+ з цитоплазми у хлоропласт (при освітленні) та відкачки іонів Са2+ (б) з тилакоїдів та із строми хлоропластів у цитоплазму (в темряві). Позначення: thy - порожнина тилакоіду, LR - регуляція освітленості, pet - фотосинтетичний електронний транспорт, ap - антипорт Са2+/Н+ (Sai, Johnson, 2002).
Іони Oa2+, які знаходяться в тилакоїдах, відіграють суттєву роль у роботі ФСІІ, а саме, в утворенні молекулярного кисню в процесі фото- окислення води. На модельній системі - хлоропластах листків шпинату - показано (Shi Hua, et al., 1998), що регуляція цього процесу відбувається за рахунок насичення чи вичерпання іонів Са2+ у ФСІІ: іони кальцію, зв'язуючись з білками D1 та D2 (з молекулярною масою 17 та 23 кДа), активують їх. Серцевина цих білків утворює гетеродимер, до складу якого входить тетраядерний кластер із чотирьох атомів марганцю (Mn4) та двох кофакторів: Са2+ та Cl- .
Дж. Вретос і Г. Брудвіг запропонували схему (Vrettos, Brudvig, 2002), згідно якої перенос електронів по ланцюгу у ФСІІ (від So фази до S4 фази) відбувається лише при наявності іонів Са2+ (рис. 2.2.3.3). Дослідники допускають, що іони Са2+ можуть зв'язуватись із залишками Glu та Asp основного ланцюга пептидів та з молекулами води тетраядер- ного Mn-кластера (Shi Hua et al., 1998; Taka-aki Ono et al., 2001; Vrettos, Brudvig, 2002). Методом рентгеноструктурного аналізу показано, що кристалічна структура молекул ФСІІ, які залучені до фотохімічного виділення кисню, змінюється при відсутності іонів Сa2+, і процес окислення Mn-кластера від фази S2 чи S3фази обривається, а фотоокислення припиняється (Taka-aki Ono et al., 2001). Крім того, показано, що зміни вторинної структури білків ФСІІ (з α-спіральної до пластинчастої) відбуваються при фотоінгібуванні, яке супроводжується зменшенням вмісту у тилакоїдах іонів Сa2+, зв'язаних із світлозбираючим комплексом ФСІІ (Shi Hua et al., 1998).
Виявлено, відносний вміст Сa2+ у хлоропластах мезофілу листків суходільних рослин S latifolium змінюється в залежності від фази онтогенезу й місця зростання виду (Nedukha, 2010, в): у фазі бутонізації його вміст збільшується в 1,5 раза, а у фазі плодоношення - зменшується в 1,4 раза порівняно з хлоропластами листків повітряно-водних особин веху.
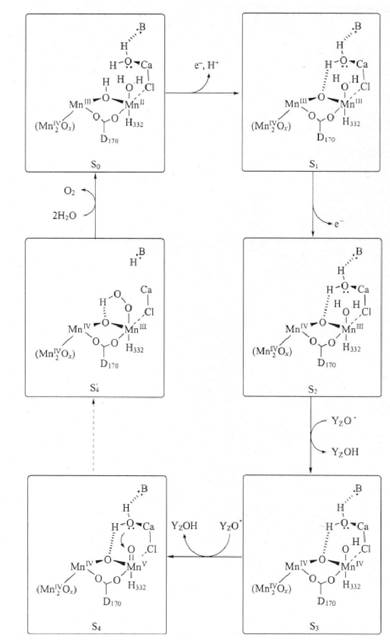
Рисунок 2.2.3.3. Схема зв'язування іонів Са2+ у Mn-утримуючому кластері ФСІІ при фотоокисленні за Дж. Вретос та І. Брудвігом (Vrettos, Brudvig, 2002), згідно якої перенос електронів по ланцюгу у ФСІІ (від S фази до S4 фази) відбувається лише при наявності іонів Сa2+. При інгібіторному аналізі (хелатуванні іонів Са2+) виділення кисню при фотоокисленні води не відбувалося
На підставі одержаних нами результатів та даних літератури припускаємо, що у стадії бутонізації S. latifolium більш високий відносний вміст іонів Oa2+у хлоропластах мезофілу листків суходільних рослин порівняно з хлоропластами листків повітряно-водних рослин сприяє підвищеному синтезу хлорофілів та активації ФСІІ в клітинах листків за умов зростання рослини на суходолі. Очевидно, що активність транспортних систем мембран оболонки хлоропластів для іонів Са2+ (антипорт Са2+/Н+ та кальцієві канали) змінюється у клітинах мезофілу веху широколистого в залежності від стадії росту й умов зростання рослини. Враховуючи вищевідмічені дані літератури та отримані нами суттєві зміни відносного кальцію у хлоропластах мезофілу листків суходільних рослин веху широколистого у фазі плодоношення, дають можливість припустити наступне. Очевидно, в процесі онтогенезу (зокрема, у стадії плодоношення) веху широколистого, що зростав на суходолі, зміна кальцієвого балансу, за рахунок інгібування транспорту іонів Са2+ з цитоплазми у хлоропласти, призводить до суттєвого зменшення вмісту іонів Са2+ в хлоропластах та зниження вмісту пігментів.
Крім цього, виявлено збільшення відносного вмісту іонів кальцію в клітинних оболонках продихів пірчасторозсічених листків суходільної екоформи S. latifolium при порівнянні з надводними листками повітряно- водних особин цього виду. За даними дослідників (Кордюм и др., 2003) в регуляції величини тургору замикаючих клітин продихів і в процесі відкриття / закриття продихової щілини активну участь беруть іони кальцію, вміст яких регулюється як запасами апопластного кальцію, так і запасами кальцію, зв'язаного з ендомембранами. Враховуючи наші результати та наведені вище дані літератури, можна припустити інтенсифікацію роботи продихів верхньої та нижньої епідерми верхніх листків S. latifolium суходільної форми при порівнянні з надводними листками повітряно-водної екоформи виду.
Нами також виявлена відмінність розподілу іонів кальцію в клітинних оболонках верхньої й нижньої епідерми підводних листків S. latifolium: більший вміст Са++ в оболонках клітин верхньої епідерми порівняно з нижньою епідермою. Раніше встановлено, що підводні листки Potamogeton lucens і Elodea sp. є полярними: на нижньому боці листка відбувається поглинання НСО3-, а на верхньому - вивільнення гідроксилів та іонів водню (Bowes, Salvucci, 1989). В нижньому епідермісі підводних листків вищезазначених рослин активується Са2+-залежна карбоангідраза, що бере участь в утворенні СО2 з НСО3-(Bowes, Salvucci, 1989; Rascio, 2002). До того ж відомо, що іони Са2+, з'єднуючись з атомами кисню вільних карбоксильних груп пектинів і з гідроксильними групами білків, знижують еластичність, механічну міцність оболонки та її адсорбційну здатність (Preston, 1979; Virk, Cleland, 1988). Враховуючи наші експериментальні дані про збільшення вмісту іонів кальцію в оболонках верхньої епідерми підводних листків веху й вище відмічені дані літератури, мож-
на зробити припущення, що оболонки верхнього й нижнього епідермісу підводних листків S. latifolium також проявляють полярність функціонування, в якому задіяні незв'язані іони кальцію.
Відмічені відмінності щодо відносного вмісту іонів кальцію в клітинах епідерми надводних листків повітряно-водної форми S. latifolium та розсічених листків суходільної форми цього виду (Недуха, 2010, б). Відомо, що зовнішні клітинні оболонки верхньої й нижньої епідерми листків беруть участь в кутикулярній транспірації, швидкість якої залежить від структури оболонки, вмісту кальцію, зв'язаного із пектинами, і наявності кутикулярних пор (Schreiber, 2005; Virk, Cleland, 1988). Питання про зв'язок і вплив іонізованого кальцію на формування кутикулярних пор і відповідно на кутикулярну транспірацію через зовнішні клітинні оболонки епідермальних клітин поки лишається відкритим.
Таким чином, одержані дані щодо розподілу іонів кальцію в різних типів листків повітряно-водних і суходільних рослин S. latifolium, свідчать про те, що вміст іонів кальцію відіграє суттєву роль в пластичності рослин веху широколистого до змін навколишнього середовища. Подальші дослідження слід спрямувати на встановлення механізмів перерозподілу іонів кальцію в клітинах мезофілу й епідерми листків у відповідь на зміну водного режиму.