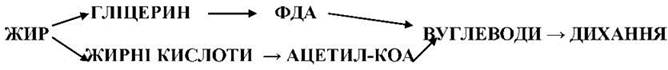ФІЗІОЛОГІЯ РОСЛИН З ОСНОВАМИ БІОХІМІЇ - Притуляк Р. М. - 2016
Опорний конспект лекцій
ТЕМА № 2. БУДОВА І ФУНКЦІЇ БІОМАКРОМОЛЕКУЛ
План
1. Хімічний склад рослинної клітини.
2. Амінокислоти.
3. Білки.
4. Структура білків.
5. Нуклеїнові кислоти.
6. Ферменти.
7. Ліпіди.
8. Вітаміни.
9. Вітаміни як складова частина ферментів.
10. Вуглеводи.
11. взаємозв’язок між обміном вуглеводів і ліпідів.
1. Хімічний склад рослинної клітини.
Висока активність органоїдів рослинної клітини пояснюється як структурними особливостями, так і їхнім хімічним складом. Цікаво зазначити, що з відомих у земній корі та атмосфері 100 елементів лише обмежену кількість відібрала природа у процесі еволюції. Так, 85-90% маси живих тканин становить вода, а 99% маси цитоплазми складають 6 елементів: вуглець, кисень, водень, азот, сірка, фосфор. Всі ці елементи входять до складу найважливіших типів органічних сполук клітини.
Найбільш специфічними речовинами живої рослинної клітини є біополімери: білки, нуклеїнові кислоти, полісахариди та складові частини цих молекул (амінокислоти, нуклеотиди, прості вуглеводи, жирні кислоти).
В клітині міститься, %: води - 85, білка - 10, ДНК - 0,4, неорганічної речовини - 1,5. На 1 молекулу ДНК приходиться 44 молекули РНК, 700 молекул білка і 7000 молекул ліпідів.
Вода в клітині знаходиться в двох формах: вільна і зв’язана. Вільна вода становить 95% всієї води клітини, використовується як розчинник і як дисперсійне середовище колоїдної системи протопласта. Зв’язана вода складає 4-5% - це молекули води, які зв’язані водневими зв’язками або іншими типами зв’язків з білками. До зв’язаної відноситься також іммобілізаційна вода, що входить до складу фібриллярних структур макромолекул.
2. Амінокислоти.
Амінокислоти - це клас органічних сполук, що поєднують в собі властивості кислот і амінів, тобто містять поряд з карбоксильною групою і аміногрупу.
За кількістю карбоксильних і аміногруп амінокислоти класифікуються наступним чином:
· Моноаміномонокарбонові Н - CHNH2 - СООН - аланін.
· Моноамінодикарбонові НООС - СН2 - СHNH2 - СООН - аспарагінова кислота.
· Гетероциклічні амінокислоти.
Відомо понад 200 амінокислот, але до складу рослинних білків входить лише 20 протеїногенних амінокислот та два аміди (аспарагін СОNH2CH2CHNH2COOH та глутамін CONH2CH2CH2CHNH2COOH).
З 20 амінокислот 8 є незамінними тобто не синтезуються в організмі людини: валін, ізолейцин, лейцин, лізин, метіонін, треонін, триптофан та фенілаланін, а для дитячого організму крім цих ще й аргінін та гістидин.
Амінокислоти утворюються наступними способами:
- Амінування кетокислот: RCOCOOH + NH3 → RCHNH2COOH + H2O. Таким чином синтезуються три основні амінокислоти: аланін, аспарагін, глутамін.
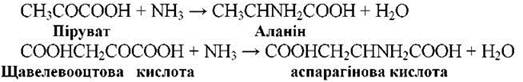
В біосинтезі глутамінової кислоти бере участь £-кетоглутарова.
- Переамінування між амінокислотами та кетокислотами:
![]()
Решта амінокислот утворюються шляхом ряду перетворень.
Вторинний шлях утворення амінокислот - гідроліз білка.
Аміди (аспарагін CONH2CH2CHNH2COOH та глутамін CONH2CH2CH2CHNH2CОOH утворюються шляхом амідування аспарагінової і глутамінової амінокислот:
![]()
Амінокислоти можуть бути похідними жирних і ароматичних кислот. Вони мають амфотерні властивості, тому що карбоксильна група виявляє кислотні властивості, а аміногрупа - основні. Тому амінокислоти можуть реагувати як з кислотами, так і з лугами, можуть вступати в реакції одна з одною. При цьому карбоксильна група однієї амінокислоти взаємодіє з аміногрупою іншої з утворенням пептичного зв’язку і виділенням молекули води. Сполука, що утворюється при взаємодії двох амінокислот, називається дипептидом. Вільна аміногрупа або карбоксили на група може вступати у взаємодію з відповідними групами іншої амінокислоти. Так утворюються поліпептиди. Якщо до складу поліпептиду входить більше 100 амінокислотних залишків, то така речовина належить до білкових сполук.
Вільні амінокислоти піддаються дезамінуванню. Є три види дезамінування - окислювальне, відновлювальне та гідролітичне. У всіх випадках утворюються органічні кислоти та аміак.
- У вищих рослин основним є окислювальне дезамінування, що йде у два етапи з утворенням спочатку амінокислоти, а потім - кетокислоти та аміаку:
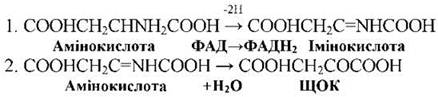
Окислювальне дезамінування іде за участі оксидаз амінокислот.
- У результаті відновлювального дезамінування утворюється аміак і відповідна жирна кислота:
![]()
- При гідролітичному дезамінуванні з амінокислоти і води утворюється кетокислота і аміак:
![]()
Фізіологічна роль амінокислот:
· Беруть участь у біосинтезі білка.
· Знешкоджують токсичну дію аміаку.
· Є резервом азоту у рослинному організмі.
3. Білки.
Білки характеризують будь-яку живу систему. Протеїни в рослинному організмі є запасними білками, а складні білки - протеїни - основними компонентами цитоплазми і відіграють важливу роль в організації клітинних структур.
Елементарний склад білкових речовин наступний, %:
С - 55-65; N - 15-18; Н - 6,5-7,5; S - 0,3-2,5; О - 20-25.
Як говорив Д.Н. Прянішніков, без азоту немає білка, без білка немає протоплазми, без протоплазми немає життя.
Білки різняться як по амінокислотному складу, так і за формою молекул. За формою молекули всі білки діляться на фібрилярні (ниткоподібні) та глобулярні (шаровидні).
Розрізняють дві великі групи білків:
Протеїни - прості білки, до складу яких входять лише залишки амінокислот.
Протеїди - складні білки, до складу яких крім амінокислот входять і інші сполуки.
Протеїни різняться за розчинністю у воді і водних розчинах.
· Альбуміни - розчинні у воді. До них відноситься: овальбумін - білок яєць, лейкози - міститься у зародках пшениці, легумелін - в насінні гороху. Альбумінів багато у зелених частинах рослин.
· Глобуліни - розчинні у слабких водних розчинах різних солей. У квасолі - фазеолін, у коноплях - есте дин, у сої - гліцини.
· Проламіни - розчинні у 60-80% водному розчині етилового спирту. У пшениці - гліадин, у ячменю - гордеїн, у кукурудзи - зеїн, овес - авенін, сорго - кафірин.
· Глютеліни - містяться у насінні злаків і зелених частинах рослин. Розчинні у 0,2% основах.
В групу протеїдів входять наступні білки:
· Ліпопротеїди - як небілкову частину містять ліпіди, складають основу всіх мембранних структур клітини.
· Хромопротеїди - простетична група представлена пігментами. Сюди відноситься гемоглобін крові, де білок глобін зв’язаний з простетичною групою гемом, що містить залізо. Також білки цієї групи мають велике значення у реакціях рослин на світло (фітохроми), його поглинанні і перетворенні.
· Глікопротеїди - містять як простетичну групу високомолекулярний вуглеводень або його похідні, ковалентно зв’язаний з залишками аспарагіну, треоніну, серину і молекули білка. До них відноситься деякі ферменти, білок квасолі віцилин.
· Нуклеопротеїди - одна з найбільш важливих груп протеїдів, молекули яких складаються з білка та нуклеїнової кислоти. Знаходяться в клітинному ядрі та цитоплазмі.
· Металопротеїди - білкова частина зв’язана з атомом металу. Більшість білків цієї групи мають ферментативні властивості.
Функції білків:
Структурна функція - білки входять до складу усіх органів і тканин. Вони беруть участь в утворенні структурної основи клітин і їх органел - мембранних структур, мітохондрій, рибосом, цитоплазми.
Каталітична функція - усі ферменти - біологічні каталізатори, які зумовлюють перебіг хімічних реакцій в організмі, мають білкову природу. Вони є необхідними для життєдіяльності кожного живого організму. За участю ферментів у клітинах одночасно проходить багато різних хімічних реакцій, які забезпечують синтез і розпад різноманітних сполук з досить великою швидкістю при звичайних t і тиску.
Гормональна функція. Значна кількість гормонів також є білками або продуктами білкового обміну. Це, зокрема, такі гормони, як інсулін, тетелін, тиреотропін, окситоцин, вазопресин та ін. Гормони, беруть активну участь в регуляції обміну, впливають на проникність клітинних мембран, регулюють активність ферментів, діють на процеси трансляції і транскрипції.
Захисна функція здійснюється в основному за участю білків γ-глобулінів, з якими пов’язані імунні реакції організму. Антитіла, які утворюються в організмі при несприятливій дії на нього різних факторів мають білкову природу. Зв’язуючись з мікроорганізмами чи токсинами, вони інактивують їх, гальмують патогенну дію і знешкоджують токсичні продукти. Відомо ряд інших процесів, в яких білки також виконують захисну функцію, наприклад у процесах зсідання крові, оберігаючи організм від надмірної втрати її при різних травмах.
Транспортна функція. Білки виконують також важливу транспортну функцію. Для нормальної життєдіяльності кожного організму необхідне постійне забезпечення його органів і тканин поживними речовинами. Транспорт різних груп ліпідів і жиророзчинних вітамінів до різних органів і тканин здійснюється за участю складних ліпідів - ліпопротеїдів.
Механічна функція. Білки беруть участь в забезпеченні різних форм механічного руху - скороченні і розслабленні м’язів, роботі внутрішніх органів - серця, легень, шлунка і т. д. Ці процеси здійснюються за участю таких білків, актин, міозин, тропоміозин і ряду ін.
Енергетична функція. Білки, як і вуглеводи і ліпіди, є також важливим джерелом енергії для організму. За рахунок білків організм людини одержує 10-15% енергії.
4. Структура білків.
Функціональні властивості білків визначаються їх структурною організацією, під якою розуміють кількісний і якісний амінокислотний склад молекули, її конфігурацію. Відомо чотири рівні структурної організації молекули білка - первинна, вторинна, третинна і четвертинна.
- Первинна структура характеризується кількістю і послідовністю амінокислотних залишків у поліпептидних ланцюгах білкової молекули, що зв’язані пептидними зв’язками. Заміна навіть однієї амінокислоти у молекулі може різко змінити функцію білка і викликати зміни у життєдіяльності всього організму. Первинна структура закріплена генетично.
- Вторинна структура білка обумовлена додатковими зв'язками ("водневими місточками"), які утворюються між амінокислотними залишками даної молекули або сусідніми поліпептидними ланцюгами і які надають просторову конфігурацію білковому ланцюгу. У пептидному ланцюзі "водневі місточки" утворюються між атомом водню >NH - групи одного пептидного зв'язку та атомом кисню >СО - групи другого пептидного зв'язку. Якщо водневі місточки утворюються у межах одного пептидного ланцюга, то виникають гвинтоподібні, спіральні структури. При утворенні водневих місточків між двома пептидними ланцюгами утворюється структура складчастого типу. Поєднанням слабких сил зв'язку багатьох водневих місточків забезпечується висока стабільність і міцність білкової молекули. У структурах складчастого типу багато поліпептидних ланцюгів розміщуються у паралельних площинах.
- Третинна структура характерна для глобулярних білків. Вона створюється при взаємодії бічних груп амінокислот і підтримується іонними, водневими і дисульфідними зв'язками. Вторинна і третинна структури білкової молекули залежать від первинної.
- Четвертинна структура білків утворюється при об'єднанні кількох (3-4 і більше) просторово організованих поліпептидних ланцюгів за допомогою гідрофобних взаємодій, водневих та іонних зв'язків. Ця структура властива глобулярним і фібрилярним білкам.
Структура білка має велике значення для каталітичної активності і регуляторної дії ферментів. Якщо порушується вторинна, третинна і четвертинна структури молекули, тобто відбувається денатурація білка, то змінюється його функція.
Денатурацію можуть викликати висока температура, ультрафіолетове випромінювання, ультразвукові хвилі, дуже високий тиск, поверхневі сили, іони Н+ і ОН-, органічні розчинники та ін. При цьому втрачається здатність білків до набубнявіння і фізіологічна активність, зменшується розчинність, а в екстремальних умовах білки випадають у осад і скручуються - коагулюють.
Причиною денатурації є порушення зв'язків, що стабілізують вторинну, третинну і четвертинну структури білків. Наприклад, органічні розчинники спирт і ацетон порушують гідрофобні взаємодії. Під впливом іонів Н+ і ОН- порушуються іонні зв'язки. Найбільш стійкими до денатурації є дисульфідні зв'язки, які можуть бути порушені при зміні окиснювально-відновного стану системи.
Денатурація білків може відбуватись на поверхні водної фази або на межі водної чи ліпофільної фаз внаслідок зміни орієнтації бокових ланцюгів. При цьому полярні бокові ланцюги будуть повернені до водного середовища, а гідрофобні (неполярні), навпаки, розмішуються на поверхні або ж занурюються у ліпофільну фазу. Таке спотворення структури у глобулярних білків може супроводжуватись втратою третинної структури.
Подібні процеси відбуваються у живій клітині на межі протоплазми і на внутрішніх мембранах. Проте, за рахунок постійного руху протоплазми відбувається постійна заміна білкових молекул на внутрішніх мембранах.
Біосинтез молекул білка відбувається у рибосомах.
Етапи біосинтезу білка:
· Транскрипція (синтез іРНК на матриці ДНК).
· Активація амінокислот за допомогою енергії АТФ і відповідного ферменту.
· Взаємодія тРНК з активованою амінокислотою.
· Утворення пептичного зв’язку в рибосомах.
5. Нуклеїнові кислоти.
У клітині існують два типи функціонально різних нуклеїнових кислот: дезоксирибонуклеїнова кислота (ДНК), що міститься у хромосомах, хлоропластах і мітохіндріях, і рибонуклеїнові кислоти (РНК), які зустрічаються майже в усіх структурних компонентах живої клітини. ДНК і РНК належать до макромолекулярних сполук. Макромолекула ДНК - це подвійна спіраль із специфічним паруванням азотистих основ за принципом комплементарності і максимальної міцності: у ній аденіну одного ланцюга завжди відповідає тимін другого, а гуаніну - цитозин. Кожний ланцюг спіралі має вуглеводно-фосфатний скелет. До цього скелета приєднані азотисті основи.
Основи бувають чотирьох видів: тимін і цитозин (піримідинові), аденін і гуанін (пуринові).
Подвійний ланцюг ДНК утримується разом завдяки водневим зв'язкам, що виникають між парами аденін-тимін і гуанін-цитозин. Парування має суворо комплементарний характер, завдяки чому обидва ланцюги молекули ДНК комплементарні один одному на всій ЇЇ довжині.
У структурі ДНК закодована генетична інформація синтезу всіх специфічних білків клітини. Чергування основ у ДНК є своєрідним для кожного організму і забезпечує видову специфічність білків. Чим складніший організм, тим більше інформації містить ДНК, тим більша її молекулярна маса і складніша структурна будова.
Передавання спадкової інформації здійснюється завдяки реплікації ДНК, тобто здатності до самовідтворення, яке здійснюється шляхом матричного синтезу одного ланцюга ДНК з іншого. Сама структура подвійної спіралі ДНК забезпечує можливість її точного копіювання: тобто послідовність азотистих основ у одному ланцюзі визначає їх послідовність у іншому ланцюзі. Тому макромолекули ДНК є матрицею для власного синтезу і для синтезу білкових макромолекул.
При реплікації подвійна спіраль, внаслідок розривання водневих зв'язків, які утримують пари основ, поділяється на два полінуклеотидні ланцюги. В міру розкручування ланцюгів молекули ДНК метаболічний апарат клітин забезпечує утворення поряд з нею комплементарної копії таким чином, що до моменту закінчення реплікації з'являються дві ідентичні спіралі.
Ланцюги нуклеїнових кислої складаються з мономірних одиниць - нуклеотидів. Нуклеотиди ДНК і РНК відрізняються складом азотистих основ і типом вуглеводу.
Піримідинові азотисті основи є похідними ароматичної органічної сполуки - піримідину.
До складу ДНК входять тимін і цитозин, до складу РНК - цитозин і урацил.
Пуринові основи - це гетероциклічні системи (аденін і гуанін), які входять до складу нуклеїнових кислот обох типів.
Нуклеотиди ДНК, крім названих азотистих основ, містять цукор дезоксирибозу і залишок фосфорної кислоти. Нуклеотиди РНК відрізняються наявністю рибози, замість дезоксирибози. Модель ДНК є подвійною правозакрученою навколо загальної осі спіраллю з максимально можливим числом водневих зв'язків між парами пуринових і піримідинових основ: аденін - тимін, гуанін - цитозин.
Однією з найважливіших функцій ДНК є передавання спадкової інформації від клітини до клітини, від покоління до покоління. Ця функція здійснюється шляхом реплікації, тобто подвоєння хромосоми, що забезпечує передачу від материнської до дочірньої молекули повної структурної, а отже і функціональної копії ДНК.
Загальна кількість ДНК у одній клітині постійна і практично не змінюється протягом її життєвого циклу. Але на час клітинного поділу кількість ДНК подвоюється. Після закінчення поділу в кожній дочірній клітині вміст ДНК залишається таким, яким він був початково у материнській клітині.
На період поділу ДНК водневі зв'язки між ланцюжками розриваються, останні розкручуються і розходяться. Потім, за участю ферментів, здійснюється синтез комплементарних ланцюжків попереднього складу. Обмін ДНК відбувається тільки при поділі клітини у процесі редуплікації.
Доказом генетичної функції ДНК є постійна кількість її у клітині і стабільність нуклеотидного складу ДНК, незалежно від віку, умов живлення і ряду інших факторів зовнішнього середовища, у яких відбувається ріст і розвиток рослини.
У клітині будь-якого організму є три основні типи РНК: рибосомна (рРНК), транспортна (тРНК) і матрична, або інформаційна (мРНК). Вони мають односпіральну структуру молекули і синтезуються на ДНК-матриці. Вміст рРНК становить 80% усієї РНК клітини, тРНК - 15%, мРНК 5-10%. Синтезована молекула мРНК надходить до рибосоми, де слугує матрицею для синтезу білка: ДНК→мРНК→білок. Цей процес відбувається за участю рибосомної і транспортної РНК. Рибосомна РНК забезпечує процес реалізації генетичної інформації шляхом приєднання відповідних амінокислот, які переносяться до рибосом транспортною РНК. У клітині зустрічається до 80 видів тРНК, кожна з яких може транспортувати певну амінокислоту до місця синтезу білка.
Першим етапом на шляху реалізації генетичної інформації є процес транскрипції, тобто передавання інформації ДНК на матричну РНК. Транскрипція відбувається на матриці ДНК за участю універсального ферменту - РНК-полімерази. Матрицею для синтезу РНК можуть слугувати всі без винятку ДНК. При цьому послідовність розміщення чотирьох нуклеотидів з азотистими основами (аденін, гуанін, цитозин, тимін) у РНК повторює послідовність відповідних дезоксирибонуклеотидів одного з двох ланцюгів ДНК, але в молекулі РНК на місце тиміну включається азотиста основа - урацил. На відміну від реплікації, транскрипція відбувається не на всій ДНК-матриці, а лише на певних ділянках, де розміщується структурний ген відповідного білка транспортної або рибосомальної РНК. З кожного гена-матриці ДНК може зніматися практично необмежена кількість копій.
Таким чином, транскрипція - це перший процес, з якого починається реалізація спадкової інформації. Цей етап можна умовно поділити па чотири стадії:
1) асоціація -зв'язування ферменту РНК-полімерази з матрицею ДНК; 2) ініціація, тобто утворення фосфодіефірних зв'язків при приєднанні нуклеотидів; 3) елонгація - подовження ланцюжка, поступове утворення гібрида РНК-ДНК, початок відділення РНК-продукту від ДНК; 4) термінація - закінчення процесу.
Наступний етап - трансляція, тобто синтез білка. У рибосомі здійснюється "переклад" інформації про синтез білка з матричної РНК у вигляді нуклеотидів на амінокислотний склад.
При цьому в рибосомі знаходиться відносно короткий відрізок ланцюжка мРНК, який взаємодіє з молекулами тРНК за принципом комп-лементарності: якщо відрізок розміщеної в рибосомі мРНК має послідовність азотистих основ УГГ, то до цього триплету приєднується ланцюжок тРНК, що несе на своїй контактній ділянці комплементарний триплет ЦЦА. Акт приєднання молекули тРНК до триплету мРНК призводить до взаємної орієнтації між амінокислотним залишком і ланцюжком білка, який синтезується, і утворення між ними ковалентного зв'язку. У результаті тРНК вивільнюється з рибосоми, а білковий ланцюжок подовжується на один амінокислотний залишок. На місце вивільненої тРНК надходить нова тРНК, а ланцюжок іРНК буде просунутим відносно рибосоми на один триплет праворуч. При цьому в рибосомі виявиться наступний вакантний триплет і до нього негайно за комплементарним принципом приєднається відповідна тРНК з амінокислотою. Після чергового переміщення іРНК між першою і другою амінокислотою утворюється пептидний зв'язок, а їхні тРНК вивільнюються, виходять до цитоплазми. Таким чином, послідовно, триплет за триплетом, здійснюється черговий етап синтезу білка - елонгація, нарощування білкового ланцюжка.
Щоб відбулась термінація ланцюжка, необхідні дві умови. По-перше, у молекулі мРНК повинен бути специфічний кодон, який визначає (обмежує) елонгацію поліпептидного ланцюжка. По-друге, необхідна наявність фактора вивільнення, який "зчитує" термінуючий кодон. Коли термінуючий кодон досягає рибосоми, то білоксинтезуючий комплекс складним шляхом розпадається на складові частини: мРНК, тРНК, поліпептиді обидві рибосомні субодиниці. Сигналом про закінчення синтезу поліпептидного ланцюга служать спеціальні термінуючі кодони у матричній РНК - УАГ, УАА і УГА. До цих кодонів жодна транспортна РНК не може приєднатися.
Після видалення з рибосоми поліпептидний ланцюг набуває просторової структури відповідно до розміщення в ньому амінокислот.
6. Ферменти.
У рослинній клітині досить легко і швидко відбувається багато найскладніших біохімічних реакцій, які супроводжуються синтезом і розкладанням білків, жирів, вуглеводів і ряду інших сполук. Більшість таких реакцій поза організмом практично не можлива або вимагає певних умов. Проходження багатьох процесів у рослині при звичайних фізіологічних умовах з високою швидкістю пояснюється наявністю у живих клітинах численних біологічних каталізаторів, що називаються ензимами, або ферментами, і які здатні різко збільшувати швидкість хімічних реакцій і залишатися при цьому кількісно і якісно незмінними.
Ферменти - це високоспецифічні біологічні каталізатори. Будь-яка клітина містить тисячі ферментів, кожний з яких регулює відповідну хімічну реакцію або групу взаємопов'язаних реакцій. У цьому полягає одна з основних властивостей ферментів - специфічність дії.
Фермент визначає не можливість здійснення реакції, а лише її швидкість. У зв'язку з тим, що каталітичні властивості ферментів реалізуються лише у біологічних системах, їх прийнято називати біокаталізаторами.
Назва ферменту складається звичайно з кореня латинської назви субстрату, на який діє фермент, або назви процесу, що каталізується даним ферментом, і суфікса "аза".
В основі номенклатури ферментів лежить назва субстрату, на який діє фермент.
Систематична класифікація ферментів розроблені і затверджені Комісією з ферментів Міжнародного біохімічного союзу у 1961 році. Відповідно до цієї класифікації, усі ферменти поділені на шість основних класів залежно від типу реакції, яку каталізують:
- Оксидоредуктази - ферменти, що беруть участь у окисно- відновних реакціях. Вони каталізують перенесення водню або електронів від одного субстрату до іншого: А1Н2 + В → ВН2 + А1
· Анаеробні або піридинові дегідрогенази - окислюють субстрат та передають водень на інший фермент або іншу речовину. Мають у своєму складі коферменти НАД і НАДФ (вітамін РР.)
· Аеробні дегідрогеназа - акцептують водень і передають його на кисень повітря. До складу їх коферменту входить похідні рибофлавіну (вітаміну В2) представниками коферментів є флавінаденіндинуклеотид (ФАД) та флавінмононуклеотид (ФМН).
· Оксидази - каталізують перенесення електронів безпосередньо на кисень. До складу входить залізо (пероксидаза, каталаза, цитохромоксидаза) та мідь (поліфенолоксидаза, аскорбіноксидаза).
· Оксигенази - каталізують пряме впровадження кисню в молекулу субстрату. Таке окислення, частка якого в загальному окисленні близько 5%, можуть здійснювати поряд з оксидазними функціями, пероксид аза і поліфенолоксидаза.
- Трансферази - ферменти переносу (метилтрансферази, трансальдолази, фосотрансферази, амінотрансферази). Вони прискорюють реакції перенесення окисних радикалів, частин молекул або навіть цілих молекул від однієї сполуки до іншої: Ах + В → А + Вх. Наприклад, фосфогліцераткіназа.
- Гідролази - каталізують реакції розкладання різних складних органічних сполук до більш простих за участю води: АВ + НОН → АН + ВОН. Ліаза - каталізує розщеплення жирів, амілази - розщеплення крохмалю до мальтози та декстринів, інвертаза - сахарозу на глюкозу і фруктозу, протеази - розщеплення білків.
- Ліази - ферменти, що каталізують реакції відщеплення від субстрату або приєднання різних груп негідролітичним шляхом за місцем подвійного зв'язку: СН3СОСООН → СН3СОН + СО2. Піруваткаркарбоксилаза відщеплює СО2 від піровиноградної кислоти, альдолаза активує розпад фруктозодифосфату на тріози.
- Ізомерази - каталізують реакції ізомеризації різних органічних сполук: глюкозо-6-фосфат → фруктозо-6-фосфат. Тріозофосіатізомераза каталізує взаємоперетворення ФГА і ФДА.
- Лігази або синтетази - каталізують реакції синтезу складних органічних сполук з більш простих за участю АТФ або інших енергетичних носіїв. Ацетил-КоА-синтетаза, утворення ацетил-коферменту А.
Названі шість класів ферментів у свою чергу поділяють на підкласи і ще менші групи через відповідні шифри. Згідно прийнятої класифікації, шифр кожного ферменту складається з чотирьох чисел, розділених крапками. Перша цифра позначає клас ферменту; друга - підклас; третя -підпідклас і четверта - номер конкретного ферменту.
Властивості ферментів поділяються на загальні і специфічні.
Загальні властивості
· ферменти, як і неорганічні каталізатори, не витрачаються у процесі каталізу, не входять до складу кінцевих продуктів реакції, а виходять з неї у початковому вигляді;
· ферменти прискорюють лише ті реакції, які можуть відбуватися і без них;
· не каталізують реакцій, що суперечать законам термодинаміки;
· ферменти не зміщують положення рівноваги реакції, а лише прискорюють її досягнення.
Специфічні властивості:
· всі ферменти за своєю природою є білками;
· ефективність ферментів набагато вища, ніж неорганічних каталізаторів. Наприклад, для розкладання перекису водню без каталізаторів необхідна енергія активації не менше 75 кДж/моль. У присутності каталізатора колоїдної платини вона зменшується до 48, а у присутності ферменту каталаза - до 5,4 кДж/моль;
· ферменти мають дуже вузьку вибіркову дію на субстрати, тобто специфічність;
· ферментам властива регульованість. Саме завдяки цьому можлива координація всіх метаболічних процесів клітини і рослини в цілому у просторі і часі.
Завдяки білковій природі, ферменти утворюють колоїдні розчини. Це має особливо важливе значення для забезпечення життєдіяльності організмів, оскільки колоїдні розчини не зазнають дифузії, а залишаються локалізованими у певних клітинних компартментах. Таким чином, незважаючи на розчинність більшості ферментів у воді, значна частина їх міцно закріплена у таких клітинних органелах, як ядро, пластиди, мітохондрії, рибосоми.
Ферменти, подібно до мінеральних каталізаторів, при зворотних реакціях прискорюють як прямий, так і зворотний процеси. При цьому напрям процесу за даних температурних умов повністю визначається концентрацією вихідних і кінцевих його продуктів.
Ферменти чутливі до температур. У звичайних умовах з підвищенням температури на 10° швидкість ферментативних реакцій зростає приблизно удвічі. Це спостерігається з підвищенням температур до 35-40°. Прим більш високій температурі активність ферментів помітно зменшується, а при 90-100° повністю втрачається. Настає інактивація ферментів, яку викликає коагуляція білків, тобто порушення їх четвертинної структури.
Ферменти володіють специфічністю. На відміну від неорганічних каталізаторів, вони мають високу субстратну специфічність до певного субстрату. Наприклад, сахараза розщеплює тільки сахарозу і не діє на споріднені цукри, наприклад мальтозу. Завдяки специфічності дії, кожен фермент з великої кількості реакцій, що відбуваються у клітині, впливає лише на певну.
За будовою ферменти є однокомпонентними і двокомпонентними. Однокомпонентні складаються лише з білка. Молекула двохкомпонентних ферментів, крім білкової частини, має простетичну групу, яка є активною частиною ферменту і може бути іоном металів або низькомолекулярною органічною сполукою (наприклад, тіамін, рибофлавін, нікотинова кислота, піридоксин). Активна група органічної природи двохкомпонентного ферменту називається коферментом, або агоном, а білкова - апоферментом, або фероном. Розміри кофермента у багато разів менші за білкову частину. При дисоціації молекули ферменту ні апофермент, ні кофермент окремо не виявляють каталітичної здатності, але вона може відновитись повністю, якщо обидва вони знову сполучаються.
В однокомпонентних ферментів активними групами є певні хімічні угруповання, що входять до складу білка і мають назву активного, або каталітичного центру. Саме за допомогою активного центру молекули ферментів взаємодіють із субстратом і виявляють каталітичні властивості.
Молекула ферменту може мати один або два активні центри. Каталітична властивість ферменту зумовлена третинною і четвертинною структурою білкової молекули, порушення якої при дії високих температур веде до втрати активності ферменту (інактивації).
Прискорення біохімічних реакцій під дією ферментів досягається завдяки зниженню енергії активації. Для того, щоб між молекулами відбувалася хімічна реакція, вони повинні перебувати в активному стані. Відомо, що атоми у молекулах утримуються хімічними зв'язками, які зумовлюються певною кількістю енергії. Ця енергія визначається типом атомів і природою зв'язків. Для розриву зв'язків необхідна більша кількість енергії. Завдяки такому енергетичному бар'єру стримується довільний розпад зв'язків. Кількість енергії, необхідної для подолання енергетичного бар'єру, називається енергією активації. Вона може бути значно зменшеною при участі у біохімічних реакціях відповідних ферментів.
Завдяки ферментам у клітині з великою швидкістю відбуваються реакції при звичайних умовах - відносно невисоких позитивних температурах і нормальному атмосферному тискові.
Зменшення енергії активації досягається здатністю молекули ферменту вступати у взаємодію з молекулою субстрату й утворювати нестабільну проміжну сполуку - фермент-субстратний комплекс, у якому молекула субстрату зазнає певної внутрішньої перебудови при взаємодії з активним центром ферменту. Викликані у молекулі субстрату зміни призводять і о зниження енергетичного бар'єру. Проміжна сполука (комплекс) швидко розпадається з вивільненням ферменту, який знову може здійснювати свої каталітичні функції, а активовані молекули субстрату, залежно від типу реакції, розкладаються або вступають у реакцію з іншим компонентом.
А + В → АВ
1) А + Ф → АФ (фермент-субстратний комплекс).
2) АФ + В → АВ + Ф.
3) АФВ → АВ + Ф
Для активного проходження ферментативної реакції структурна будова молекули субстрату повинна збігатися з будовою активного центру ферменту. Відповідність збігання повинна бути не лише просторовою, але й у розподілі електричних зарядів, розміщенні груп атомів. Остаточна нідгювідність ферменту і субстрату досягається у процесі їх взаємодії Причому, субстрат за своїми розмірами значно менший за фермент. Із субстратом у процесі реакції контактують лише близько 20 амінокислотних залишків молекули ферменту. Ці залишки і становлять каталітичну зону - активний центр. Найчастіше до каталітичної зони входять амінокислоти - аспарагін, аргінін, гістидин, глютамін, серин, треонін, цистеїн. Амінокислоти, що не входять до активного (каталітичного) центру, теж мають важливе значення. Вони зумовлюють специфічне розміщення білкової молекули (наприклад, четвертинну структуру), завдяки чому віддалені амінокислотні залишки можуть просторово наближатися і теж утворювати активний центр.
Швидкість біохімічних реакцій пов'язана з кількістю ферменту. При достатній кількості субстрату швидкість ферментативних реакцій прямо пропорційна його кількості. Із зростанням концентрації субстрату вона також зростає.
Активність ферментів часто змінюється під дією різних хімічних сполук, що знаходяться в середовищі. Речовини, які підвищують активність ферментів, називаються активаторами, а ті, що знижують їх активність - інгібіторами.
Активаторами є різні сполуки - мінеральні солі і кислоти, органічні речовини, іони металів. Наприклад, соляна кислота активує дію пепсину. Вплив катіонів металу на активність зумовлений тим, що вони можуть виступати як складові компоненти активного центру ферментів, сприяти утворенню фермент - субстратних комплексів. Отже, цілий ряд катіонів металів є необхідною складовою частиною ферментів для нормального їх функціонування.
Інгібітори викликають гальмування ферментативних процесів. Гальмування може бути зворотним і не зворотним. При зворотному гальмуванні інгібітор утворює з ферментом слабкий комплекс, який має здатність розпадатися, в результаті чого фермент вивільняється і набуває знову каталітичної активності. Незворотне гальмування характеризується тим, що інгібітор міцно зв'язується з ферментом, а комплекс, який утворюється за цих умов, не розкладається. Отже, відбувається поступове зв'язування ферменту і вилучення його з середовища.
Механізм дії інгібіторів досить різний, проте в більшості випадків він зводиться до двох типів гальмування - конкурентного і неконкурентного. При конкурентному гальмуванні інгібітор має структуру, подібну до субстрату. Тому між ними виникає конкуренція за взаємодію з ферментом. Оскільки інгібітор є структурним аналогом, то він зв'язується з активним центром ферменту і кількість утвореною фермент - субстратного комплексу зменшується, тобто знижується і ферментативна активність. Однак, дане гальмування є зворотним, так як при видаленні інгібітору здатність ферменту взаємодіяти з субстратом відновлюється.
Між субстратом і інгібітором існує певне кількісне співвідношення. Якщо концентрація інгібітору більша за концентрацію субстрату (І > S), то інгібітор, зв'язуючись з ферментом, виключає його з відповідної реакції, і субстрат не розщеплюється. Якщо має місце зворотне явище, тобто концентрація субстрату більша, ніж концентрація інгібітору (S > І), то з ферментом буде зв'язуватись субстрат, який буде розкладатися з утворенням продуктів реакції — Р1 і Р2. Отже, дія конкурентних інгібіторів може бути послаблена або зовсім усунута при підвищенні концентрації субстрату в середовищі.
7. Ліпіди.
Жири і жироподібні речовини, об’єднані під загальною назвою ліпіди, - один з головних компонентів клітин живих організмів. Ліпіди відіграють важливу роль у протопласті, вони беруть участь в адсорбційних процесах і регулюванні проникності цитоплазми для речовин, що надходять до клітини. Тільки в присутності ліпідів та деяких інших речовин (навіть у мізерних кількостях) можливе підтримання структури протопласту, що необхідна для життя клітини.
Ліпіди розчиняються в органічних розчинниках та нерозчинні у воді. Залежно від хімічної природи, ліпіди поділяються на жири та ліпоїди.
Жири є основною групою ліпідів. Це складні ефіри триатомного спирту гліцерину і жирних кислот. Хімічні і фізико-хімічні властивості жирів значною мірою визначаються співвідношенням насичених і ненасичених жирних кислот, що входять до складу жирів. Жири, що містять насичені кислоти, які не мають подвійних зв’язків (стеаринова, пальмітинова) мають тверду консистенцію. Якщо ж у складі жирів переважають ненасичені жирні кислоти з подвійними зв’язками (олеїнова, лінолева, ліноленова) то вони є рідкими. Рослинні жири рідкої консистенції називають оліями. Рідкі рослинні жири перетворюють в тверді шляхом гідрогенізації - приєднання водню по місцю подвійних зв’язків у ненасичених жирних кислот. Гідрогенізовані рослинні жири входять до складу маргарину.
Властивості жирів характеризують такі показники, як кислотне число, йодне число, число омилення.
- Йодне число - це кількість грамів йоду, що зв’язується 100 грамами жиру. Приєднання йоду відбувається по місцю подвійних зв’язків, що мають місце в ненасичених жирних кислотах, тому йодне число дає уяву про вміст у жирі ненасичених жирних кислот. Чим вище йодне число, тим рідший жир і більш придатний для виготовлення лаків, фарб та оліфи. Жири гіркнуть головним чином в результаті окислення ненасичених жирних кислот киснем повітря і стають непридатними для споживання.
- Кислотне число - кількість міліграм лугу, необхідна для нейтралізації вільних жирних кислот, що містяться в 1 г жиру.
- Число омилення - показує, яка кількість міліграм лугу потрібна для нейтралізації всіх жирних кислот (вільних і зв’язаних з гліцерином) в 1 г жиру.
Ліпоїди - це жироподібні речовини (ліпіди, стеарини, стероїди, терпени, воски), у молекулі яких один залишок жирної кислоти заміщений іншою сполукою. Особливо велике значення мають ліпіди, молекули яких містять гідрофільну групу - залишок фосфорної кислоти, азотисті речовини, сахариди (фосфоліпіди, фосфатиди, гліколіпіди).
Полярні молекули ліпідів можуть легко взаємодіяти з полярними і неполярними молекулами. При цьому утворюються впорядковані структури на межі будь-якого середовища. Таке впорядковане розміщення гідрофільних і гідрофобних кінців молекул має першорядне значення для формування біологічних мембран.
Воски рослин - складні ефіри високомолекулярних спиртів і вищих жирних кислот за фізичними і хімічними властивостями вони нагадують жири. Віск утворюється в клітинах епідермісу у вигляді маслянистих крапель, які через тонкі канальці клітинних оболонок виділяються на поверхню і відкладаються на ній, кристалізуючись у вигляді тонких паличок або пластинок. Воски вкривають листки і плоди вищих рослин, роль їх - захисна.
Значення жирів для рослин:
· Ліпіди є складовою частиною біологічних мембран.
· Є джерелом енергії.
· При їх окисленні виділяється велика кількість води.
· Виконують функцію запасної речовини.
8. Вітаміни.
Серед інших органічних речовин, які містяться в клітині, вітаміни займають особливе місце (від латинського vita - життя). Це група органічних сполук різної хімічної природи, які необхідні для тварин і людини в дуже малих кількостях у порівнянні з основними поживними речовинами. Вітаміни не є джерелом енергії або пластичним матеріалом для формування структурних компонентів організму, вони виконують каталітичні функції, забезпечують хід процесів обміну та перетворення енергії і пластичних речовин, є компонентами різноманітних ферментних систем.
Відкриття вітамінів пов’язано з роботами М.І. Луніна у 1880 році, а вперше виділив у чистому вигляді і дав назву «вітаміни» у 1912 році Функ (виділив вітамін Ві - тіамін. Відкриття вітамінів є одним з великих досягнень біологічної науки кінця ХІХ століття.
Вітаміни мають відносно невелику молекулярну вагу, позначаються буквами. Класифікація вітамінів ґрунтується на фізико-хімічних властивостях, хімічній природі. Залежно від розчинності розрізняють жиророзчинні і водорозчинні вітаміни. Усі вітаміни відзначаються значною термостабільністю, крім аскорбінової кислоти (вітамін С), яка при нагріванні у присутності кисню руйнується.
Водорозчинні вітаміни: входять аскорбінова кислота, вітаміни групи В, нікотинова кислота (вітамін РР), вітамін Р, фолієва кислота та ін. Характерною особливістю вітамінів, які розчиняються у воді, є здатність більшості з них брати участь у будові молекул коферментів. Майже всі вони не синтезуються в організмі людини і тварин.
- Вітамін С (аскорбінова кислота, хімічна формула - С6Н8О6) - це кристалічна речовина, має окислювально-відновні властивості, завдяки чому перетворюється у дегідрогеназу при відщепленні двох атомів водню. Тому у тканинах рослин вітамін С перебуває у двох формах. Синтезується у рослинах аскорбінова кислота з вуглеводів. Накопичення її залежить від умов вирощування. При вирощуванні рослин у північних районах вміст аскорбінової кислоти нижчий, ніж у рослин південних зон вирощування. Одні й ті ж рослини на легких ґрунтах містять більше аскорбінової кислоти, ніж на важких. Збільшенню кількості вітаміну С сприяють фосфорні добрива, а азотні - навпаки, зниженню. Найбільший вміст вітаміну С у плодах шипшини, ягодах чорної смородини і зелених плодах грецького горіха. Під час зберігання плодів та овочів вміст аскорбінової кислоти знижується. Найбільшими є втрати під час варіння. Добова норма споживання вітаміну С для людини становить 50-100 мг, нестача його у їжі веде ю захворювання на цингу.
- Вітамін В1 (тіамін) свою назву отримав завдяки наявності в ньому атома сірки. Це гетероциклічна сполука, молекула якої складається з двох компонентів - похідних піримідину і тіазолу. Вітамін В1 утворюється на світлі лише в рослинному організмі і деяких мікроорганізмах. Молоді листки містять багато вітаміну В1. При дозріванні насіння відбувається його відтік із листків і стебел. Найбільше вітаміну міститься у зовнішніх оболонках насіння злакових і бобових культур. На накопичення вітаміну В, суттєво впливають умови кореневого живлення. Добова норма вітаміну В, для людини складає 2-3 мг. Нестача його викликає тяжкі нервові і серцеві захворювання.
- Вітамін В2 (рибофлавін, вітамін росту) за хімічною природою є азотистою основою У сполученні з фосфорною кислотою вітамін В2 входить до складу флавінових коферментів (ФМН, ФАД), які беруть участь у окисленні багатьох органічних сполук, перенесенні водню від відновлених НАД-Н і НАДР-Н на цитохромну систему. Нестача вітаміну В2 веде до порушення обміну речовин. Синтезується рибофлавін у молодих органах рослин і деяких мікроорганізмах. Добова норма його для людини складає 2-4 мг. Основним джерелом вітаміну В2 є зелені овочі, м'ясні (особливо печінка і нирки), молочні та рибні продукти, дріжджі.
- Вітамін В3 (пантотенова кислота) входить до складу коферменту А, який каталізує численні реакції синтезу. Сам вітамін В3 синтезується лише у рослинному організмі, тому його нестача в організмі людини і тварини веде до серйозних порушень обміну жирів і вуглеводів. Зовнішніми проявами цих порушень можуть бути шорсткість шкіри, випадання волосся. Добова норма вітаміну В3 для людини становить 10-20 мг. Найбільш багаті на його вміст дріжджі, деякі м'ясні продукти, оболонки насіння зернових.
- Вітамін В6 (піридоксин) є похідним піридину. Піридоксин входить до складу активних груп ферментів, що каталізують реакції трансамінування, декарбоксилювання та інші перетворення амінокислот. Тому його нестача викликає порушення білкового обміну в рослин, людини і тварин. Вітамін В6 синтезується в рослинному організмі і деяких мікроорганізмах. Людині протягом дня необхідно отримувати 2-4 мі вітаміну В6.
- Вітамін В12 (ціанокобаламін). Попереджує захворювання анемією, підвищує використання організмом рослинних білків. В рослинних продуктах його немає. Головним джерелом є тваринні продукти, печінка та нирки.
- Біотин (вітамін Н). Біотинові ферменти каталізують два типи реакцій - декарбоксилювання (при участі АТР) і транскарбоксилювання, які мають важливе значення у синтезі вищих жирних кислот, білків, нуклеїнових кислот та ін. У рослин біотин синтезується головним чином у листках. Його нестача викликає уповільнення росту, у людини пошкоджується шкіра, волосяний покрив. Добова норма біотину для людини - 10 мг. Звичайно його нестача спостерігається рідко, тому що вітамін Н у достатній кількості міститься у харчових продуктах (картопля, цибуля, томати). Так, наприклад, 1 л молока містить до 50 мг біотину.
- Вітамін РР (нікотинова кислота) - є похідним піридину. У рослинах міститься головним чином у вигляді кислоти, яка перетворюється в амід і бере участь у синтезі найважливіших окислювально-відновних ферментів (дегідрогеназ) з активною групою нікотинамідаденіндинуклеотид (НАД) або нікотинамідаденіндинуклеотидфосфат (НАДР). Синтезується нікотинова кислота у рослинах на світлі. її нестача порушує активність обмінних процесів. У людини при нестачі вітаміну РР розвивається пелагра (хронічне захворювання шкіри, психіки та ін.). Добова норма споживання для людини становить 15-25 мг. Найбільше нікотинової кислоти містять дріжджі, пшеничні зародки, висівки, печінка і нирки тварин.
- Вітамін Вс (фолієва кислота) уперше був виділений з листків шпинату. Він бере участь у біосинтезі нуклеотидів, реакціях взаємних перетворень амінокислот, перенесенні формальдегідних, метальних і оксиметильних груп. Його похідна (тетрагідрофолієва кислота) виконує роль коферменту відповідних реакцій. Нестача фолієвої кислоти в організмі людини зумовлює розвиток різних захворювань крові (анемії, лейкопенії).
Жиророзчинні вітаміни. Групу вітамінів, які розчиняються у жирах і розчинниках жирів, складають вітаміни груп А (А1, А2), Д (Д2, Д3, Д4, Д5, Д7), Є, К.
- Вітаміни групи А (ретинол). Відомі два вітаміни групи — А1 і А2, відповідно ретинол і дегідроретинол, нестача яких в організмі людини викликає захворювання очей (ксерофтальмію). Ці вітаміни зустрічаються тільки у тваринному організмі. У рослин синтезуються провітаміни А (каротиноїди), які в організмі тварин перетворюються у вітамін А. Провітамін А (каротиноїди) - це група жовтих і червоних пігментів, які дуже поширені у рослинному світі. У хімічному відношенні вони є ненасиченими вуглеводами терпенового характеру. В організмі тварин каротиноїди зазнають окислювального розпаду на місці центрального подвійного зв'язку й утворюють вітамін А. Каротиноїди містяться практично в усіх тканинах і органах рослин і виконують різноманітні функції, беручи участь у процесах фотосинтезу, окислювально-відновних реакціях, процесах розмноження. Вміст каротиноїдів різний у різних органах рослин: у листках їх більше, ніж у стеблі, коренях і бульбах, за винятком коренеплодів моркви, батату. Кількість каротиноїдів залежить від фази розвитку рослин, умов вирощування (світло, опади, добрива). Найбільше каротиноїдів міститься у листкових овочах, червоній моркві, томатах, перці і деяких фруктах. Добова потреба людини у вітаміні А становить 2 мг.
- Вітаміни групи Д - це поліциклічні сполуки спиртового характеру класу стеролів. Стероли під дією світла здатні перетворюватися у вітаміни групи Д. З великої кількості рослинних стеролів найбільш важливим є ергостерол, який у значних концентраціях міститься в листках, коренях і плодах; багато його у дріжджах. Високим вмістом вітаміну Д відзначається жир печінки морських риб. Для людини основним джерелом вітаміну Д у зимовий період є коров'яче молоко, яйця. У літній період, як правило, необхідна кількість вітаміну Д утворюється в організмі людини з рослинних стеринів під дією сонячних променів. Середньодобова потреба людини у вітаміні Д становить 0,02 мг. Нестача цього вітаміну веде до порушення сольового обміну і захворювання рахітом.
- Вітамін Є (токоферол) - це група гетероциклічних сполук. У рослинах зустрічається часто, особливо в зародках, дуже чутливий до ультрафіолетового світла. У тваринних організмах вітамін Є захищає від окислення ряд речовин. У рослинах токофероли беруть участь у окислювально-відновних реакціях. Потреба людини у вітаміні Є точно не встановлена, але добовою нормою вважається 10-50 мг.
- Вітамін К дуже поширений у рослинах, особливо у надземних органах, тому що на його біосинтез значно впливає світло. Він бере участь у реакції фотосинтезу. В організмі тварин вітамін К забезпечує згортання крові.
9. Вітаміни як складова частина ферментів.
Багато вітамінів та їх похідних у поєднанні з різними речовинами утворюють ферменти.
Так, при зв’язуванні вітаміну В1 (тіаміну) у вигляді фосфорного ефіру з білком утворюється фермент піруватдекарбоксилаза, який розщеплює піровиноградну кислоту до оцтового альдегіду та СО2.
Вітамін В2 (рибофлавін) утворює з фосфорною кислотою флавінмононуклеотид, який при взаємодії з аденіловою кислотою (нуклеотид аденозинмонофосфат) дає флавінаденіндинуклеотид, що в сполученні з різними білками входить до складу ряду окисно-відновних ферментів.
Вітамін РР (нікотинова кислота) у вигляді аміду входить до складу окисно - відновних ферментів дегідрогеназа, котрі каналізують реакції окислення органічних сполук з виділенням водню.
Пантотенова кислота є складовою частиною коферменту А, що активує синтез лимонної кислоти, жирних кислот та стеролів.
До складу великої кількості двокомпонентних ферментів входить також фосфорильовані похідні вітаміну В6 (піридоксин) - піридоксальфосфат або фосфопіридоксин.
10. Вуглеводи.
Термін вуглеводи вперше був запропонований у 1844 р. К. Шмідтом. Ці речовини, за своїм складом можна розглядати як сполуки вуглецю з водою Сn(Н2О)m. Хоча назва вуглеводи і не повністю відповідає хімічному складу речовин, які до них відносяться, Але вона збереглася до цього часу і стала тривіальною. Вуглеводи ще часто називають сахаридами.
Вуглеводи - основні поживні і структурні компоненти клітин і тканин рослин, вони забезпечують організм необхідною енергією та проміжними продуктами для підтримання процесів життєдіяльності і біосинтезу складних сполук. Саме вуглеводи виконують роль попередників органічних речовин рослинного організму. Вони складаються з вуглецю та кисню і на їх долю припадає 75-80% сухої речовини рослин. За хімічною будовою вуглеводи є альдегідами чи кетонами багатоатомних спиртів або продуктів їх конденсації.
Вуглеводи діляться на три основні класи:
Моносахариди або прості цукри мають від 3 до 7 атомів вуглецю, гідроксильну (-ОН) і альдегідну (-СОН) або кетонну (СО) групи. До них відносяться біози (гліколевий альдегід (СН2ОНСОН), тріоди С3Н6О3, тетрози С4Н8О4, пентоди С5Н10О5, гексози С6Н12О6 і гептоди С7Н14О7.
Моносахариди з 5 і більше атомами вуглецю мають циклічну будову. Моносахариди зберігають окислювальну здатність карбонільної групи, і тому часто визначаються як відновлювальні цукри. Вони добре розчиняються у воді, мають велику кількість варіантів структури і тому використовуються рослинами для регуляції росту і розвитку. Для обміну речовин найбільш важливі фосфорильовані похідні моносахаридів, у тканинах рослин вони є ключовими проміжними продуктами вуглеводного обміну.
Олігосахариди є невеликими полімерами, які складаються з n моносахаридних залишків. Найменше їх число дорівнює 2, найбільше - 10. Олігосахариди не становлять клас певних вуглеводів. У багатьох випадках це просто короткі молекули - проміжні ланки під час синтезу або розпаду полісахаридів. Залежно від числа сахаридних субодиниць їх поділяють на ди-, три-, татрасахариди і т.п. До даної групи вуглеводів відносяться сахароза, мальтоза, лактоза, рафіноза, стахіоза.
- Сахароза (тростинний цукор) - зустрічається в листках, стеблах, бульбах, плодах. В цукрових буряках - до 27%, в тростині - до 25%. В розчинах легко гідролізується з утворенням глюкози і фруктози:
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6
Глюкоза відхиляє площину поляризації вправо, а фруктоза - вліво. Суміш глюкози і фруктози називають інвертним цукром з зворотною площиною поляризації.
- Мальтоза або солодовий цукор розкладається при гідролізі на дві молекули глюкози.
- Целобіоза утворюється при гідролітичному розщепленні целюлози ферментом целюлозою, зустрічається у вільному стані в соці деяких рослин. Як і мальтоза, складається з двох молекул глюкози.
- Рафіноза - трисахарид (С18Н32О16), є в насінні бавовни, цукрового буряка та ін. При гідролізі утворює галактозу, глюкозу і мальтозу.
В слаболужних розчинах моносахариди глюкоза, маноза і фруктоза можуть взаємно перетворюватися: глюкоза в занозу, фруктоза в занозу і глюкозу.
Полісахариди. Вони подібні до олігосахаридів тим, що утворюються при конденсації моносахаридів, однак їх молекула набагато більша. Число залишків моноцукрів у молекулі може досягати кількох тисяч. Представниками полісахаридів є крохмаль, целюлоза. Емпірична формула - (С6Н10О5)n.
- Целюлоза - найбільш поширений у природі полісахариди. Її молекули нагадують пласку витягнуту стрічку. У клітинній стінці вони утримуються міжмолекулярними водневими зв’язками і спаковані у паралельні ланцюги.
- Крохмаль, подібно до клітковини, є полімером глюкози, але складається з двох компонентів: лінійного полімеру амілози і амілопектину. У складі амілози міститься до 1000 залишків глюкози, а амілопектину - до 15000. на відміну від целюлози, яку вважають структурним вуглеводом, крохмаль легко розпадається і тому є джерелом енергії для життєдіяльності рослин. Амілоза (вміст у крохмалі 15-25%) розчиняється у воді і дає з йодом синє забарвлення. Амілопектин (вміст у крохмалі 75-85%) не розчиняється у воді, а з йодом дає забарвлення від червоно-коричневого до лілового. Крохмалю міститься, %: у зерні пшениці - 75, кукурудзи - 72, рису - 80, картоплі - до 24. За дії ферментів відбувається поступовий гідроліз крохмалю до декстринів, мальтози і кінцевого продукту - целюлози.
- Інулін - складається з залишків фруктози, міститься у великій кількості в бульбах земляної груші та в кореневищах жоржини.
11. Зв’язок між обміном жирів і вуглеводів.
Між обміном жирів і вуглеводів існує тісний взаємозв’язок, що здійснюється за схемою Іванова: