ФІЗІОЛОГІЯ ТА БІОХІМІЯ РОСЛИН
Опорний конспект лекцій
5. ФОТОСИНТЕЗ
Пігменти пластид
Пігменти - найважливіший компонент апарату ф/с. Дослідження пігментів прискорилося завдяки відкриттю російським фізіологом _ принципово нового методу дослідження — адсорбційної хроматографії. Через колонку із сорбентом пропускають розчин речовин. Речовини з різною величиною адсорбції з різною швидкістю рухаються по колонці і таким чином розподіляються. Так уперше були розділені пігменти зелених листків.
Пігменти пластид належать до 3-х класів речовин: хлорофілів, фікобілінів, каротиноїдів.
Хлорофіли
Структура і склад
Французькі хіміки П. Пельт’є і Ж. Каванту 1817 року виділили з листків зелений пігмент і назвали його хлорофілом (зелений листок).
Польські біохіміки М. Ненцький і Л. Мархлевський (1897 р.) виявили, що в основі молекули хлорофілу, як і гема (простетичної групи) гемоглобіну, лежить порфіринове кільце.
Німецький хімік Р. Вільштеттер у 1914 році встановив елементарний склад хлорофілу а - C55H72O5N4Mg і хлорофілу б - C55H70O6N4Mg; а німецький біохімік Г. Фішер у 1930-40 роках повністю розшифрував структурну формулу. В 60-х рр. було здійснено штучний синтез хлорофілу.
Хлорофіл — складний ефір дикарбонової кислоти хлорофіліну (C32H30ON4Mg(COOH)2), у якої одна карбоксильна група етерифікована залишком метилового спирту (CH3OH), а інша - залишком одноатомного ненасиченого спирту фітолу (C20H39OH).
Структурна формула хлорофілу
Чотири пірольні кільця (І-IV) з'єднані між собою метиновими містками (α, β, γ, δ) і утворюють порфіринове ядро. Зовнішні атоми вуглецю: 1-10. Атоми азоту пірольних кілець чотирма координаційними зв'язками взаємодіють з атомом Mg. Циклопентанове кільце (V) містить хімічно активну карбонільну групу біля С9 і метильовану карбоксильну групу біля С10. Бічний ланцюг IV пірольного кільця складається з пропіонової кислоти, поєднаної складноефірним зв'язком із поліізопреновим ненасиченим спиртом фітолом (С20Н39ОН).
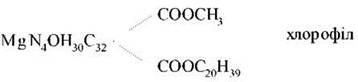
1, 3, 5 і 8-й вуглеці пірольних кілець мають метильні групи, 2-й — вінільну, 4-й — етильну. Порфіринове кільце - це система із дев'яти пар кон’югованих подвійних і одинарних зв'язків, що чергуються, із 18-тьма делокалізованими п-електронами. Хлорофілід - структура хлорофілу без фітолу.
При заміщенні Mg на протони утворюються феофітини.
Усі фотосинтезуючі рослини і ціанобактерії містять хлорофіл а; вищі рослини, зелені водорості та евгленові — хлорофіл b, бурі й діатомові водорості — хлорофіл с, червоні водорості — хлорофіл d.
Біосинтез хлорофілів
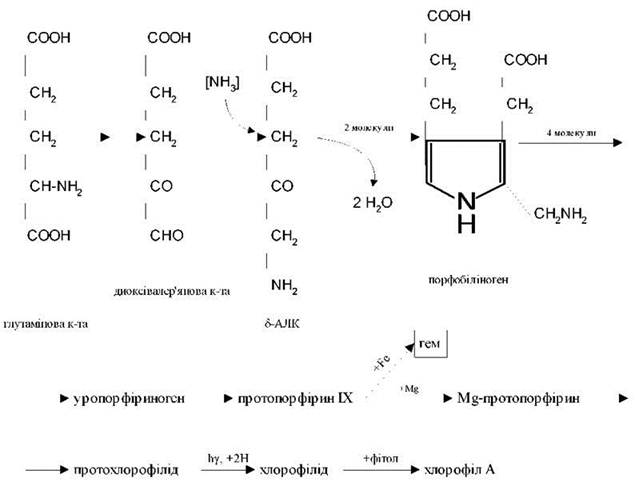
Перший етап біосинтезу хлорофілів у рослин - утворення δ-амінолеву-лінової кислоти (АЛК) із С5-дикарбонових кислот.
Циклізація 2-х молекул АЛК призводить до утворення пірольної сполуки - порфобіліногена. З 4-х пірольних кілець формується уропорфіриноген, який перетворюється у протопорфірин IX. Подальший шлях перетворення протопорфірину може бути різним. З участю заліза формується гем, який входить до складу цитохромів, каталази, пероксидази, гемоглобіну. При залученні Mgутворюється протохлорофілід, який на світлі перетворюється в хлорофіл а. Усе це відбувається в хлоропластах.
Фізико-хімічні властивості хлорофілів
У твердому вигляді хлорофіл а є аморфною речовиною синьо-чорного кольору. Температура плавлення хлорофілу а - 117-120 °С. Хлорофіли добре розчинні в етиловому ефірі, бензолі, хлороформі, ацетоні, етил. спирті; погано — в петролейному ефірі і нерозчинні у воді.
Різко виражені максимуми поглинання хлорофілів перебувають у червоній (хл. а — 660-663 нм; хл. б — 642-644 нм.) і в синій (хл. а — 428-430 нм.; хл. б — 452-455 нм. ) частинах спектра (дані для розчинів хлорофілів у етиловому ефірі). Хлорофіли слабо поглинають оранжеве й жовте світло і зовсім не поглинають зелених та інфрачервоних променів.
Поглинання в синьо-фіолетовій частині спектра зумовлене системою кон’югованих одинарних і подвійних зв'язків порфіринового кільця. Інтенсивність поглинання в червоній ділянці пов'язана з гідруванням подвійного зв'язку С7-С8 у четвертому пірольному кільці при переході від протохлорофіліду до хлорофіліду і наявністю Mg в порфіриновому ядрі.
На розміщення максимумів спектра поглинання впливає природа розчинників і взаємодія молекул хлорофілу з іншими пігментами та органічними речовинами.
Розчини хлорофілів у полярних розчинниках мають яскраву флуоресценцію (люмінесценцію) і здатні до фосфоресценції (в інфрачервоній частині спектра). Нативний хлорофіл флуоресціює слабо.
Ці явища залежать від різних шляхів використання енергії (Е) електронного збудження.
Як відомо, найбільш стійкими є ті стани атомів, в яких валентні е займають найнижчі енергетичні рівні і розподілені по них згідно з принципом Паулі (не > 2 - х ē із антипаралельними спінами на кожній орбіталі). Такий стан молекули називають основним синглетним (S0) енергетичним станом. Коли молекула поглинає квант світла, то за рахунок цієї енергії ē переходить на більш високі вакантні орбіталі. Коли у збудженого ē зберігається той же напрямок спіна, то молекула знаходиться в синглетному збудженому стані (S*), коли спін ē змінюється, то таке збудження називається триплетним (Т*).
Поглинання молекулою хлорофілу кванта червоного світла призводить до переходу з основного синглетного енергетичного стану (S0) до синглетного збудженого стану (S*1); поглинання синього світла з більшою Е призводить до переходу ē на більш високу орбіту (S*2).
Збуджена молекула хлорофілу повертається до основного стану різними шляхами. При цьому відбувається виділення теплоти, флуоресценція, фосфоресценція. Нарешті, Е збудженого стану може бути використана на фотохімічні реакції. В останньому випадку флуоресценції чи фосфоресценції не спостерігається.
Структура молекули хлорофілу в процесі еволюції чудово пристосована до своїх функцій сенсибілізатора фотохімічних реакцій. До її складу входять 18 делокалізованих π ē, що робить молекулу хлорофілу легко збудливою при поглинанні квантів світла.
Одночасно хлорофіл здатний до окисно-відновних перетворень. Хлорофіл, розчинений у піридині, в анаеробних умовах під впливом світла відновлюється аскорбіновою кислотою або іншими донорами електронів. Після вимкнення світла реакція відбувається у зворотному напрямку. Фотовідновлений хлорофіл у свою чергу може відновлювати різні акцептори електронів (НАД+, рибофлавін, хінон, Fe3+, кисень). Таким чином, молекула хлорофілу може бути не лише первинним акцептором електрона, але і його первинним донором. Виходячи з цього можна зробити висновок, що молекула хлорофілу завдяки структурним і фізико - хімічним особливостям здатна виконувати 3 важливі функції:
1) вибірково поглинати Е світла;
2) запасати її у вигляді Е електронного збудження;
3) фотохімічно перетворювати Е збудженого стану електронів у хімічну Е фотовідновлених і фотоокиснених станів.
Просторова організація хлорофілу:
магній-порфіринове кільце - утворює гідрофільну пластинку, яка розміщується над мембранами;
фітол знаходиться під кутом до порфіринового кільця і утворює гідрофобний полюс, який взаємодіє з мембранними структурами.
Фікобіліни
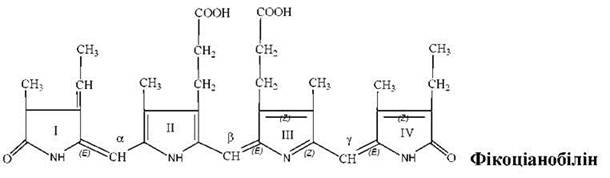
Найпоширеніші представники фікобілінів - фікоеритробіліни (переважають у червоних водоростей) і фікоціанобіліни (переважають у синьозелених).
Структура і властивості
Належать до жовчних пігментів - білінів. Це тетрапіроли з відкритим ланцюгом без металу. Містять систему кон’югованих подвійних і одинарних зв'язків. Пірольні кільця з'єднані між собою метиленовими чи метиновими містками. І і IV піроли мають по одній карбонільній групі. Містять бокові радикали: 4 метильних (С1, 3, 6, 7), вінільну (С2), етильну (С8) і два залишки пропіонової кислоти (С4, 5).
Фікобіліни - це хромофорні групи фікобіліпротеїнів (ковалентний зв'язок). Фікобіліпротеїни діляться на 3 групи:
1) фікоеритрини - білки червоного кольору (498-568 нм);
2) фікоціаніни - синьоголубі білки (585-630 нм);
3) аллофікоціаніни - сині білки (585-650 нм).
Загальний спектр поглинання - 490-650 нм (зелені та жовто оранжеві промені). Розчинні у воді. Локалізовані у фікобілісомах - гранулах, що розміщені на зовнішній поверхні фотосинтетичних ламел.
Значення
Максимуми поглинання світла у фікобілінів знаходяться між двома максимумами поглинання у хлорофілів: в оранжевій, жовтій і зеленій частинах спектра. Це пов'язано з оптичними властивостями води, яка перш за все поглинає довгохвильові промені. Тому до різних глибин доходить якісно різне світло. На глибині 36 м у воді повністю зникають червоні промені, 177 м - жовті, 322 м - зелені, на глибину 500 м не проникають навіть сині промені. В результаті у верхніх шарах океанів живуть переважно зелені водорості, глибше — синьо- зелені, а ще глибше — червоні (явище хроматичної комплементарної адаптації).
У водоростей фікобіліни — це додаткові пігменти, які замість хлорофілу виконують функції світлозбирального комплексу. Приблизно 90 % Е світла ними передається на хлорофіл а. У всіх рослин є фітохром — фікобілін, що є фоторецептором і виконує регуляторні функції.
Каротиноїди
Каротиноїди — жиророзчинні пігменти жовтого, оранжевого, червоного кольору, які наявні в хлоропластах усіх рослин. Вони також входять до складу хромопластів у незелених частинах рослини. Синтезуються бактеріями й грибами. Циклічні чи ациклічні ізопреноїди.
Структура і властивості
До каротиноїдів належать три групи сполук:
1) оранжеві чи червоні каротини (С40Н56);
2) жовті ксантофіли (С40Н56О2, С40Н56О4);
3) каротиноїдні кислоти - продукти окислення каротиноїдів, наприклад, кроцетин С20Н24О4 має вкорочений ланцюг і дві карбоксильні групи.
Каротини і ксантофіли добре розчинні у хлороформі, бензолі, сірковуглеводі, ацетоні. Каротини добре розчинні в ефірах і майже не розчиняються у спиртах; ксантофіли — навпаки.
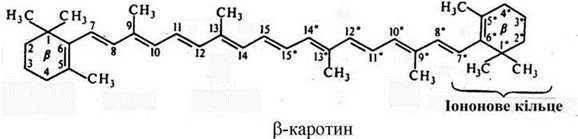
Усі каротиноїди - полієнові сполуки. Каротиноїди перших двох груп складаються із восьми залишків ізопрену (ланцюг кон’югованих подвійних зв'язків). Каротиноїди можуть бути ациклічними (аліфатичними), моно- і біциклічними. Цикли на кінцях молекул каротиноїдів є похідними іонона.
Ациклічний каротиноїд → лікопін. Циклічний α-каротин містить β-іононове кільце та ε-іононове кільце (С4=С5). β-каротин містить два β-іононових кільця (С5=С6). При гідролізі β-каротину по центральному подвійному зв’язку утворюються дві молекули ретинолу (вітаміну А).
Основні каротиноїди вищих рослин і водоростей — β-каротин, лютеїн, віолаксантин, неоксантин, зеаксантин.
Синтез каротиноїдів починається з ацетил-СоА через мевалонову кислоту, геранілгеранілпірофосфат до лікопіна, який є попередником усіх інших каротиноїдів. Спектри поглинання каротиноїдів характеризуються двома смугами у фіолетовій і синій ділянках від 400 до 500 нм.
Каротиноїди, як і хлорофіли, нековалентно зв'язані з білками і ліпідами мембран.
Роль каротиноїдів у процесах ф/с
Каротиноїди — обов'язкові компоненти пігментних систем усіх фотосинтезуючих організмів. Головні їхні функції це:
1) участь у поглинанні світла як додаткові пігменти;
2) захист молекули хлорофілу від незворотного фотоокиснення;
Можливо беруть участь у кисневому обміні при фотосинтезі.
Значення каротиноїдів стає зрозумілим, коли ми розглянемо розподіл Е в спектрі сумарної сонячної радіації на поверхні Землі, максимум якої припадає на синьо-голубу і зелену частини спектра (480-530 нм). У модельних дослідах показана висока ефективність перенесення Е світла від каротиноїдів до хлорофілів. Цю здатність мають каротини, але не ксантофіли.
Цілим рядом експериментів (біохімічними у пробірках, на безкаротиноїдних мутантах - хламідомонада, кукурудза) доведена захисна роль каротиноїдів. Вони захищають молекули хлорофілів від руйнування (окислення).
У світлочутливих «очках» одноклітинних і на верхівках пагонів вищих рослин каротиноїди, контрастуючи на світло, сприяють визначенню його напрямку. Каротиноїди зумовлюють колір пелюсток і плодів деяких рослин (у більшості випадків це залежить від вакуольних антоціанів).