БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
6. ФИЗИОЛОГИЯ ОБМЕНА ВЕЩЕСТВ
6.11. Образование структурных и запасных липидов
Построение растительных клеток и поддержание компартментации требуют постоянного синтеза структурных липидов, которые используются в качестве основного элемента при построении мембран. Кроме того, растительные клетки запасают в форме липидов восстановленный углерод, запасающие жир семена — до 50 %. По сравнению с резервными полисахаридами запасание углерода в форме липидов позволяет вдвое уменьшить массу запасных веществ и тем самым облегчает распространение летучих семян. Другие структурные липиды (воска) откладываются во внеклеточных слоях на наружной кутикуле или пропитывают стенки определенных растительных клеток: кутин (например, пояски Каспари) или суберин (основное вещество, содержащееся в пробке). Кутин является к тому же составной частью кутикулы. О биосинтезе восков, кутина и суберина известно мало, поэтому в дальнейшем эта тема затрагиваться не будет.
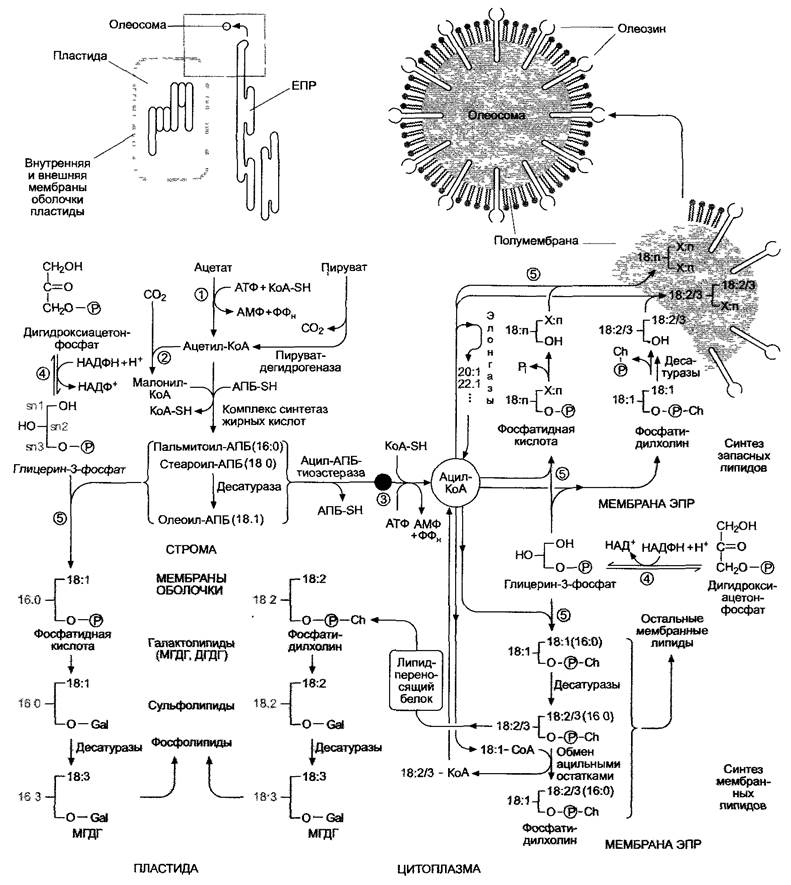
Мембранные липиды и запасные липиды являются глицеролипидами (см. 1.5, рис. 1.12). Они представляют собой сложные эфиры и состоят из трехатомного спирта глицерина и трех ацильных остатков (запасные липиды — триацилглицерины или триглицериды). Мембранные липиды соответственно содержат два ацильных остатка, в то время как третья гидроксильная группа несет полярный заместитель (фосфолипиды, гликолипиды). Липидный обмен в растительной клетке представляет собой сложный ряд реакций, в которых принимают участие пластиды, цитоплазма и эндоплазматический ретикулум (рис. 6.101). Об этих реакциях подробнее рассказано в следующих главах.
6.11.1. Биосинтез жирных кислот
Согласно современным представлениям, биосинтез de novo жирных кислот в растениях протекает исключительно в пластидах, в зеленых клетках — в хлоропластах, в незеленых — в хромо- и лейкопластах, или пропластидах. У некоторых водорослей (например, у Euglena gracilis) наряду с пластидной функционирует цитоплазматическая синтетаза жирных кислот, грибы синтезируют жирные кислоты в цитоплазме. Исходной молекулой синтеза является молекула ацетил-КоА, к которой в результате конденсации последовательно присоединяются двууглеродные единицы, поставляемые от малон ил-КоА. Ацетил-КоА в пластидах возникает либо из пирувата под воздействием пластидной изоформы пируватдегидрогеназы или (большей частью) из ацетата, чье цитоплазматическое происхождение; до конца не выяснено. Ацетил-КоА-синтетаза (см. рис. 6.101) переносит на ацетат остаток адени- лата с отщеплением пирофосфата от АМФ, в результате чего образуется фосфорный ангидрид с карбоксильной группой уксусной кислоты. На втором этапе остаток аденилага замещается коэнзимом А. Малонил- КоА появляется в результате карбоксилирования ацетил-КоА мультиэнзимным комплексом ацетил-КоА-карбоксилазы и биотина в качестве простетической группы (рис. 6.102).
Рис. 6.101. Схема обмена жирных кислот и глицеролипидов в растительной клетке. Отдельные реакции описаны в тексте, строение различных классов липидов и их сокращенные названия можно найти на рис. 1.21. Реакции, протекающие на мембранах, изображены на сером фоне. (1) — ацетил-КоА-синтетаза; (2) — ацетил-КоА-карбоксилаза; (3) — ацил-КоА-синтетаза; (4) — глицерин-3-фосфатдегидрогеназа; (5) — ацилтрансферазы. Gal — галактоза; Ch — холин; АПБ-SH — ацилпереносящий белок. Обозначение жирных кислот: 18:1 — 18 атомов углерода, 1 двойная связь; Х:n — любая жирная кислота. Ацильные остатки указывают на то, что синтез глицеролипидов шел либо по прокариотическому пути (16 : n в позиции 2, как у синезеленых водорослей), либо по эукариотическому пути (18 : n в позиции 2). Глицерин-З-фосфат, по определению, записывается в L-кон- фигурации (ОН-группа располагается слева от асимметрично замещенного среднего атома углерода) и нумеруется по аналогии с похожим по строению 3-фосфоглицериновым альдегидом. Речь идет о стереоспецифической нумерации (sn), атомы углерода обозначаются sn-1, sn-2 и sn-З. В полусхе- матических формулах отдана дань традиционному пространственному изображению расположения ацильных остатков. На рис. 1.21 мы от этого отказались. Расположение заместителей на нем дает более четкое представление о фактической пространственной структуре глицеролипидов и тем самым облегчает понимание формирования мембранных структур. С- и N-концы олеозина располагаются на цитоплазматической стороне полумембраны и формируют домен гидрофильных головок, большая центральная часть белка образует липофильный домен, который, предположительно, содействует наполнению олеосомы триглицеридами
Рис, 6.102. Процесс синтеза жирных кислот de novo в строме пластиды. Простетическая группа ацетил-КоА-карбоксилазы (биотин) связана с апоферментом посредством лизинового остатка. Структура биотина и карбоксибиотина представлена в прямоугольнике слева. Образование ацетил-КоА и малонил-КоА из соответствующих коэнзим-А-предшественников протекает без затрат либо выработки энергии, это обратимая реакция. Декарбоксилирование с конденсацией двух двууглеродных единиц (3-кетоацилсинтазная реакция) идет с выделением большого количества энергии, следовательно, эта реакция необратима. Как эта, так и последующие реакции декарбоксилирования задают определенное направление реакций течения биосинтеза, поскольку остальные ферменты катализируют в каждом случае только обратимые реакции. Связанные с АПБ метаболиты присутствуют в виде тиоэфира. Тиоловая группа принадлежит остатку пантетеина (так же как в коэнзиме А, см. рис. 6.93), который при помощи АПБ соединяется через фосфатную группу с серином апофермента в результате реакции этерификации (см. прямоугольник внизу). АПБ — ацилпереносящий белок; АПБ-SH — свободный АПБ с незанятой тиоловой группой (-SH)
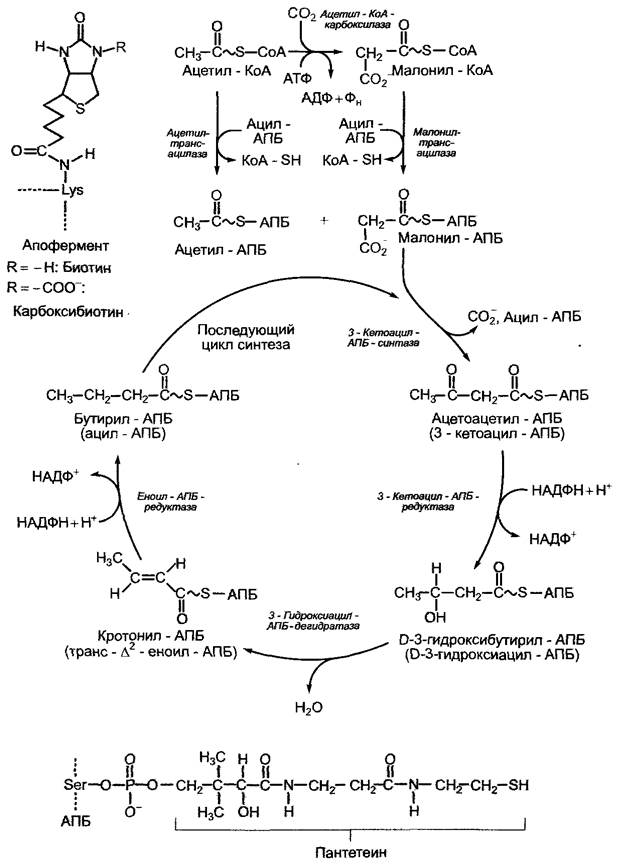
Комплекс синтетаз жирных кислот (ЖК- синтетаз), в данном случае также мультиэнзимный, состоит из отдельных ферментов, которые, в отличие от ЖК-синтетаз у грибов и животных, можно выделить в чистом виде и четко разделить по функциям, и свободного растворимого ацилпереносящего белка АПБ (10—14 кДа, англ, acyl carrier protein, ACP). Он присоединяет как исходные соединения — ацетат или малонат, так и промежуточные продукты, возникающие в результате удлинения углеродных цепочек — ацильные остатки. ЖК-синтетаза реагирует только на связанные с АПБ метаболиты. АПБ и компоненты ЖК- синтетаз растений по строению очень сходны с соответствующими структурами бактерий. Следовательно, растительная ЖК- синтетаза имеет прокариотическое строение. Последовательность реакций представлена на рис. 6.102. Синтез прекращается, когда длина углеродной цепи достигает 16 или 18 С-атомов, т. е. появляется либо пальмитоил-АПБ-комплекс (16:0-АПБ), либо стеароил-АПБ-комплекс (18:0-АПБ). В данной форме записи число перед двоеточием обозначает количество атомов С в молекуле жирной кислоты, а число после двоеточия — количество двойных связей.
Еще в строме пластиды растворимая десатураза формирует из стеароил-АПБ олеоил-АПБ (18:1-АПБ), содержащий одну ненасыщенную связь. Некоторая часть продуктов пластидного синтеза жирных кислот служит для построения мембранных липидов самой пластиды, остальное экспортируется в цитоплазму (см. рис. 6.102). При этом непосредственно перед или во время прохождения комплекса жирной кислоты и ацилпереносящего белка сквозь мембрану оболочки пластиды АПБ отщепляется ацил-АПБ-тиоэстеразой. Однако достаточно больших количеств свободных жирных кислот в цитоплазме не встречается, так как локализованная на наружной мембране оболочки пластиды ацил-КоА- синтетаза формирует из них с помощью АТФ ацил-КоА.
Итак, вновь синтезированные ацилко- ферменты А (пальмитоил-КоА, стеароил- КоА и олеоил-КоА) могут разными способами вступать в дальнейшие реакции (см. рис. 6.101).
✵ В эндоплазматическом ретикулуме углеродные цепи удлиняются при помощи связанных с мембраной элонгаз. Так синтезируются жирные кислоты с 20 и более С-атомами, которые, в частности, встречаются в запасных липидах.
✵ Кроме того, в ЭПР происходит встраивание в мембранные или запасные липиды.
✵ Ненасыщенные жирные кислоты с двумя и более двойными связями (например, линолевая (18:2) и линоленовая
(18:3), которые не синтезируются в организме человека, являются незаменимыми и должны поступать с пищей) часто формируются в ЭПР только на этапе синтеза глицеролипидов при участии связанных с мембранами десатураз и освобождаются посредством ацильной замены олеоил-КоА (18:1-КоА) на линолеил-КоА (18:2-КоА) или линоленил-КоА (18:3-КоА) (см. рис. 6.101).
6.11.2. Биосинтез мембранных липидов
Как упоминалось ранее, синтез мембранных липидов (см. рис. 6.101) проходит на мембранах оболочки пластид и в ЭПР. Структурный элемент глицерин возникает в цитоплазме посредством восстановления дигидроксиацетонфосфата в виде конечного продукта глицерин-3-фосфата (под воздействием глицерин - 3 -фосфатдегидрогеназы). Ацильные остатки переносятся ацил- трапсферазой либо от ацил-АПБ (в случае пластид ного синтеза), либо от ацил-Ко А (в случае синтеза в ЭПР). Специфичность ферментов различна. Для глицеролипидов пластидного происхождения характерно обязательное наличие С 16-ацильного остатка в sn2-позиции, в то время как у глицеролипидов, синтезированных в ЭПР, в этой позиции постоянно находится С18- ацильный остаток.
Сначала образуется диацил глицерофосфат (фосфатидная кислота), из которого пластиды производят особый гликолипид — моногалактозилдиглицерид (МГДГ — см. рис. 1.21). Последний, при необходимости, после образования двойных связей в ацильных остатках является исходным соединением для образования гликолипидов, сульфолипидов и фосфолипидов в пластидах (см. рис. 6.101; рис. 1.21, табл. 1.4). Однако только одна часть пластидных мембранных липидов синтезируется непосредственно в органелле, другая образуется в результате метаболизма, импортированного из ЭПР глицеролипида фосфатидилхолина.
В ЭПР из глицерин-3-фосфата посредством двукратного переноса ацильных остатков также сначала образуется фосфатидная кислота, а из нее в результате присоединения главной группы (холинфосфата, полученного из цитидиндифосфохолина) синтезируется фосфатидилхолин, т.е. фосфолипид. При необходимости после воздействия десатуразами из фосфатидилхолина производятся прочие мембранные липиды эндоплазматического ретикулума (см. табл. 1.4). Некоторая часть фосфатидилхолинча, преимущественно дилинолеилфосфатидилхолин (содержит 2 остатка лино- левой кислоты (18:2)), транспортируется липидпереносящими белками к мембранам оболочки пластид, где преобразуется в МГДГ и при необходимости после воздействия десатуразами используется для синтеза остальных мембранных липидов. Ли- пидпереносящие белки могут также принять участие в доставке липидов к другим мембранам, где эти липиды не синтезируются (мембраны тилакоидов, митохондрий, глиоксисом, пероксисом).
Состав жирных кислот в мембранных липидах влияет на физические свойства мембран (например, на текучесть при определенной температуре). Она, предположительно, является важной составляющей холодостойкости растений либо их чувствительности к низким температурам. Особая роль здесь отводится фосфатидилхолину, имеющему различный состав у холодостойких и чувствительных к холоду растений. В первом случае увеличено количество ненасыщенных жирных кислот, во втором — насыщенных. Посредством изменения липидного состава мембран методами генной инженерии удалось повлиять на холодостойкость модельного растения Агаbidopsis thaliana (резуховидки Таля, см. раздел 7.1).
6.11.3. Биосинтез запасных липидов
Все клетки запасают некоторое количество триацилглицеринов (триглицеридов, нейтральных жиров), большинство клеток — в очень малых количествах. В жирозапасающих семенах содержание триглицеридов может достигать 50 % массы семени (арахис, лен). Наряду с ними в ткани плодов некоторых видов растений (олива, авокадо) содержится большое количество нейтральных жиров, которые, однако, служат не для повторного использования, а для повышения привлекательности плодов для консументов, т. е. для распространения семян. У многих видов большие количества триглицеридов производит тапетум, после растворения которого oни поступают в полость пыльников и образуют внеклеточный липидный слой вокруг созревших зерен пыльцы. Пыльцевые зерна могут содержать до 20 — 30 % (от своей массы) внутриклеточных запасных липидов. Триацилглицерины, которые содержат высокий процент насыщенных жирных кислот и остаются твердыми при комнатной температуре, называют жирами. Триацилглицерины, содержащие высокий процент ненасыщенных жирных кислот, жидкие при комнатной температуре, называются маслами.
Биосинтез запасных липидов происходит в ЭПР и начинается с ацил-КоА и глицерин-3-фосфата. При этом существует два пути биосинтеза. Первый путь начинается с образования фосфатидной кислоты, ее дефосфорилирования до диацилглицерина и заканчивается переносом третьего ацильного остатка на оставшуюся свободную гидроксильную группу. Второй путь — преобразование фосфатидилхолина в диацил- глицерин, а затем в триглицерид (см. рис. 6.101). По второму пути, предположительно, проходит синтез в основном тех запасных липидов, в составе которых присутствуют ненасыщенные жирные кислоты с двумя и более двойными связями.
Следует отметить, что неполярные триацилглицерины, скапливаясь между мембранными поверхностями двойного липидного слоя ЭПР, отделяют их друг от друга, пока липидная капля, окруженная «половинчатой» элементарной мембраной (одинарным липидным слоем), не будет окончательно изолирована (см. рис. 6.101). Готовая запасающая липиды органелла называется олеосомой (иногда сферосомой). Олеосомы сильно высыхающих семян содержат большое количество амфипатических белков, олеозинов, которые синтезируются в ЭПР и локализуются в полумембране во время изоляции олеосомы (см. рис. 6.101). Олеозины отсутствуют в олеосомах бога
тых липидами тканей плодов, невысыхающих семян и олеосомах пыльцы. Олеозины, очевидно, препятствуют «слиянию» олеосом в крупные образования во время прорастания сухих семян, когда происходит поглощение воды, и таким образом облегчают мобилизацию запасных липидов (за счет сохранения большой площади поверхности).