БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
7. ФИЗИОЛОГИЯ РАЗВИТИЯ
7.2. Генетические основы развития
Тотипотентность растительных клеток подтверждает, что все клетки организма независимо от степени их дифференцировки — у покрытосеменных различают около 70 типов клеток — обладают одной и той же генетической информацией, и она в принципе может быть востребована. Так как в ходе развития новые носители наследственности не появляются, а имеющиеся не изменяются, в качестве основы процесса дифференцировки нужно рассматривать дифференциальную активность генов при развитии как в пространстве, так и во времени. Она лежит также в основе развития одноклеточных. Дифференциальная активность генов выражается в различном составе фракций мРНК или набора белков различно дифференцированных клеток. Ее можно исследовать особенно точно путем анализа активности промоторов генов (см. 7.2.2.1) в трансгенных растениях (см. боксы 7.3 и 7.4). Такой анализ можно провести даже in vivo, т.е. в живом растении.
Высшее растение обладает более чем 25 000 генов (подробнее об этом в разделе 7.2.1; о номенклатуре генов и их продуктов — см. бокс 7.2). Многие из них (точное число неизвестно) экспрессируются конститутивно (постоянно); продукты этих генов выполняют основные функции, в которых нуждаются все клетки (англ. housekeeping genes; сюда относятся гены белков цитоскелета, таких, как актин или тубулин, а также гены многих ферментов первичного метаболизма). Кроме того, в зависимости от физиологического состояния или в рамках процесса развития активируются соответствующие характерные гены, в то время как другие гены репрессируются (снижают свою активность). По некоторым оценкам, активность более половины всех генов регулируется, и каждый тип клеток отличается сотнями дифференциально (специфично для данных клеток) экспрессирующихся генов, причем спектр активности генов во время процесса развития динамически и комплексно изменяется.
7.2.1. Генетические системы растительной клетки
Суммарная ДНК клетки, содержащая все гены, а также все межгенные области, называется геномом. Прокариоты обладают одной, как правило, кольцевой молекулой ДНК, которая в клетке прикреплена к клеточной мембране в виде нуклеоида и представляет весь геном или большую его часть. Наряду с этим часто имеются дополнительные кольцевые молекулы ДНК — плазмиды, отвечающие за специальные функции. Так, плазмиды могут кодировать гены, которые обеспечивают устойчивость к антибиотикам или соответственно разложение токсичных химикатов. Некоторые плазмиды играют роль при половом процессе. Все эукариоты обладают в качестве субгенома ядерным геномом (нуклеом) и митохондриальным (хондром, или хондриом) геномом. Несущие пластиды растения (водоросли и высшие растения) обладают в качестве третьего субгенома дополнительно еще пластидным геномом (пластом), который, однако, отсутствует у грибов и животных. Из соображений экономии места в дальнейшем рассматриваются исключительно эукариоты (о прокариотах, см. учебники по микробиологии).
Термин «геном» в литературе используется по-разному и иногда в качестве синонима «ядерного генома». В этом случае пластом и хондриом, объединенные в «плазмон», противопоставляются «геному».
Ядерный геном, пластидный геном и митохондриальный геном (см. 7.2.1.1 — 7.2.1.3) характеризуются соответственно различными структурами и специфическим набором генов; они взаимодействуют в клетке разнообразными способами (в деталях эти взаимодействия недостаточно изучены).
7.2.1.1. Ядерный геном
Содержащаяся в клеточном ядре ДНК состоит из нескольких различных линейных молекул двухцепочечной ДНК и имеет ровно одну молекулу в каждой хромосоме (см. 2.2.3.2) в нереплицированном состоянии (или две идентичные молекулы после репликации, по одной на каждую дочернюю хроматиду, см. рис. 1.9). В гаплоидном (1n) наборе хромосом каждая хромосома встречается один раз, в диплоидном (2n) наборе хромосом — по две похожие гомологичные хромосомы (3n, триплоидный, — по три гомологичные хромосомы и т.д.). Молекулы ДНК гомологичных хромосом диплоидных (триплоидных и т.д.) клеток практически идентичны только у облигатных самоопылителей, или соответственно при постоянном самоопылении селекционером (гомозиготность). У перекрестноопыляющихся растений гомологичные хромосомы одинаковы по основному строению и составу генов, однако по последовательности оснований ДНК существуют многочисленные отклонения (гетерозиготность).
Общее количество ДНК (рис. 7.4) ядерных геномов семенных растений разных видов может различаться более чем в 200 раз, от -125 мегабаз (125 млн п.н., 1 млн п.н. = 1 000 000 пар нуклеотидов) у Агаbidopsis до более 30000 млн п.н. у некоторых лилейных. По определению, данные всегда относятся к гаплоидному набору хромосом в нереплицированном состоянии (содержание ДНК равно 1С). Ядерные геномы водорослей и грибов заметно меньше, размеры самых маленьких перекрываются с размерами самых больших геномов прокариот. Многочисленные геномы прокариот и некоторых эукариот, среди них ядерный геном резуховидки Таля (Аrabidopsis thaliana, Brassicaceae, бокс 7.1), которая обладает самым маленьким известным до сих пор ядерным геномом среди семенных растений, уже были полностью секвенированы (табл. 7.2) и поэтому очень точно известны их строение и состав их генов.
Рис. 7.4. Размеры геномов митохондрий, пластид и ядра различных организмов. Данные в парах нуклеотидов (п. н.) приведены для нереплицированного гаплоидного генома (1C, 1n). Значение С дает обычно количество ДНК в пикограммах (nг), но можно также выразить в п.н. (1 пгДНК = 0,96 • 109п.н.). Обозначенные серыми буквами геномы полностью секвенированы (см. табл. 7.2). Сокращения: А — Arabidopsis thaliana; Е — Escherichia coli; Н — Haemophilus influenza; Hs — Homo sapiens; Hv — Hordeum vulgare; Hw — Hansenulawingei; L — Lycopersicon es- culentum; M — Mycoplasma; Mp — Marschantia polymorpha; N — Nicotiana tabacum; О — Oryza sativa; P—Podosporaanserina; S — Synechocystis; Sc — Saccharomyces cerevisiae; T — Tulipa; Z — Zea mays. Светло-серые прямоугольники — геномы органелл и прокариот, темно-серые — ядерные геномы
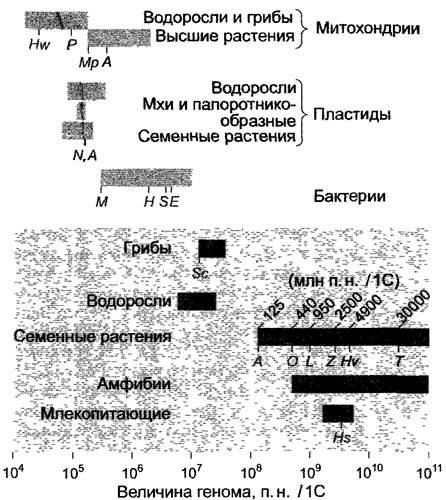
Таблица 7.2. Величины некоторых полностью секвенированных геномов
Вид |
Число нуклеотидов 1С |
Число генов |
Вид |
Число нуклеотидов 1C |
Число генов |
Хондриомы: |
Бактериальные геномы: |
||||
Prototheca wickerhamii |
55 328 |
63 |
Mycoplasma pneumoniae |
816 394 |
677 |
Saccharomyces cerevisiae |
85 779 |
35 |
Haemophilus influenza |
1 830138 |
1709 |
Podospora anserina |
94 192 |
43 |
Synechocystis PCC 6803 |
3 573 470 |
3 169 |
Marschantia polymorpha |
186 608 |
66 |
Escherichia coli K12 |
4 639 221 |
4 397 |
Arabidopsis thaliana |
366 924 |
58 |
Ядерные геномы: |
||
Геномы пластид: |
Saccharomyces cerevisiae |
= 13 469 000 |
6 327 |
||
Nicotiana tabacum |
155 939 |
127 |
Arabidopsis thaliana |
» 125 000000 |
25 498 |
Arabidopsis thaliana |
154 478 |
128 |
Все данные касаются гаплоидного нереплицированного генома (1С, ср. рис. 7.4). Число пар нуклеотидов (п.н.) для ядерных геномов (нуклеомов) эукариот нельзя точно привести из-за повторяющихся последовательностей и теломерных участков (см. 7.2.1.1). Приведенное число генов хондриомов и пластидных геномов касается только идентифицированных кодирующих белок генов, а также генов рРНК и тРНК. Оно не охватывает потенциальные гены, предсказанные исключительно на основе общих структурных критериев, и кодирующие белок интронные области. Для бактериальных геномов и ядерных геномов, однако, были суммированы все известные и потенциальные гены. Следовательно, число генов в этих случаях нужно понимать, как примерное, однако наглядное для сравнения число.
Бокс 7.1. Резуховидка Таля (Arabidopsis thaliana)
В качестве модельного цветкового растения в молекулярной биологии и биологии развития уже несколько десятков лет интенсивно используется резуховидка Таля (Arabidopsisthaliana (L.) Heynh., Brassicaceae, Capparales; англ. Thals Cress) (рис. А; см. также рис. 7.65).
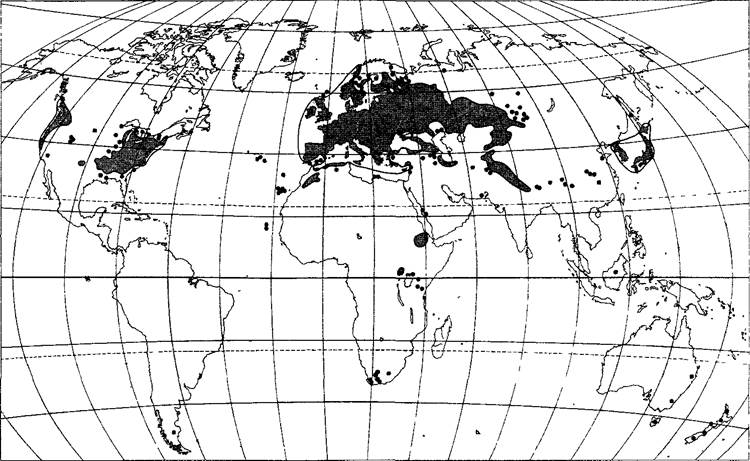
Распространение
Карта ареала (рис. В) позволяет предположить, что резуховидка Таля происходит из евроазиатского/североафриканского центра распространения; кроме того, в Патагонии, Северо-Западной и Северо-Восточной Америке, Японии, а также на побережье Юго-Восточной Африки и Юго-Восточной Австралии присутствуют отдельные очаги, которые указывают на антропогенное распространение растения в ходе колонизации этих земель европейцами. Крупнейшая в мире коллекция форм резуховидки Таля различного географического происхождения находится в Arabidopsis Biological Resource Center, Michigan State University (штат Огайо, США), где к тому же имеется коллекция мутантов, а также обширные банки генов и банки данных о резуховид- ке Таля (доступно в Интернете по адресу www.arabidopsis.org, стартовая страница TAIR. The Arabidopsis Information Resource, с которой можно обратиться ко всем банкам данных no Arabidopsis).
Рис. А. Цветок резуховидки Таля (Arabidopsis thaliana)

Жизненный цикл и выращивание.
Arabidopsis thaliana — это однолетнее травянистое растение; оно образует сначала прикорневую розетку листьев, из которой через 6 — 8 недель появляются вытянутые побеги и на них начинают образовываться цветки. Время цветения этого факультативно длиннодневного растения (см. 7.7.2.2, табл. 7.6) при соответствующей продолжительности фотопериода (обычно ≥16 ч освещения) смешается на более ранние сроки. Как правило, происходит самоопыление; многочисленные семена прорастают на свету. Сначала они находятся в состоянии умеренного (физиологического) покоя, который может быть прерван с помощью стратификации (обычно 5 дней при 4 — 6°С) (см. 7.7.1.2). Полный жизненный цикл резуховидки Таля в естественных условиях обитания составляет -10 —12 недель; он может быть сокращен в эксперименте примерно 6 недель, что дает преимущества в первую очередь для генетических исследований. В климакамерах создают оптимальные условия для культивирования Arabidopsis thaliana: ночную температуру 16 — 18 °С, дневную температуру 22 — 24°С, относительную влажность воздуха 50 — 70 % и интенсивность освещения (ФАР, см. бокс 6.2) 100 — 200 мкмЕ м 2 с-1; в качестве источника света используют белые неоновые лампы.
Строение генома и мутагенез
Arabidopsis thaliana, демонстрируя типичный для покрытосеменных пластом (154478 п.н.) и хондриом (366924 п.н.) (см. табл. 7.2), обладает, напротив, необычайно маленьким ядерным геномом, распределенным по 5 хромосомам (1 n, гаплоидный набор), самым маленьким из всех известных до сих пор у высших растений. Нуклеотидные последовательности всех трех генетических систем полностью известны, нуклеотидная последовательность (опубликована в 2000 г., адрес в Интернете: www.aims.cps.msu.edu/aims) была первой полностью установленной последовательностью ДНК генома высшего растения. Она включает в нереплицированном гаплоидном наборе хромосом 125 млн п. н. и содержит около25 000 генов. Около половины последовательностей всех генов предсказаны исключительно на основе общих критериев строения генов (см. 7.2.2.1, рис. 7.8), однако функционально до сих пор не были охарактеризованы, поэтому можно привести лишь приблизительные данные о числе генов. Это относится также к точному числу оснований ядерного генома, так как участки с высокоповторяющимися последовательностями, например, в теломерной области (см. 7.2.1.1), нельзя точно секвенировать. Точно определенная последовательность (115 409 949 п.н.) охватывает все кодирующие области генов вплоть до области на хромосомах 2 и 4, которая содержит гены, кодирующие высокоповторяющуюся рРНК, а также высокоповторяющиеся теломерные и центромерные участки всех хромосом (рис. С).
Рис. В. Географическое распространение Arabidopsis thaliana. Основная область распространения представлена серым цветом. Черные точки — отдельные места находок
Из-за небольшой величины ядерного генома гены расположены очень плотно на хромосомах (рис. С). Около 80% ядерной ДНК Аrabidopsis thaliana состоит из уникальных последовательностей, которые преимущественно представляют собой последовательности генов, лишь 20 % представляют средне- и высокоповторяющиеся последовательности (см. 2.2.3.2; например, теломерные и центромерные последовательности, а также участки рРНК хромосом 2 и 4). Средняя величина гена (включая промоторы, см. рис. 7.8) составляет около 4 тыс. п.н. Если бы напечатали последовательность ДНК ядерного генома в этой книге с нормальной величиной букв, то она заняла бы 2 000 страниц.
Высокая плотность генов позволяет проводить эффективный мутагенез. Часто для выключения генов применяются инсерции Т-ДНК (см. бокс 9.2). Интеграция Т-ДНК в ген часто нарушает его рамку считывания. Это ведет, как правило, к образованию укороченных мРНК (появление стоп-кодонов), которые либо не транслируются, либо производят нефункциональные белки. Наряду с этим используют химический мутагенез с помощью этилметан- сульфоната (EMS) (рис. D), и его предпочитают в первую очередь тогда, когда полная потеря функции мутировавшего гена в гомозиготе дала бы летальный фенотип (что наблюдается, как правило, вследствие инсерции Т-ДНК). Напротив, благодаря точечным мутациям, аналогично тем, которые появляются при химическом мутагенезе с помощью алкилирующих агентов, функция гена, как правило, нарушается лишь частично, так что можно исследовать и те гены, полная потеря которых имела бы летальные последствия.
Рис. С. Ядерный геном Arabidopsis thaliana. Кариотип пяти хромосом гаплоидного набора хромосом (вверху). Размер отдельных хромосом дан в млн п.н. молекулы ДНК, содержащейся в них (1C, нереплицированное состояние). Генетические единицы (сМ = сантиморганы) дают максимальную частоту рекомбинации генных локусов в процентах, которая получается при сложении частот рекомбинации между соседними генными локусами вдоль хромосомы. Фрагмент хромосомы 4 Arabidopsis thaliana (внизу): охватывает 100 тыс. п.н. и соответствует участку на хромосоме 4. На обеих цепях молекулы ДНК кодируются гены. Гены тРНК, как на рис. 7.5, надписаны однобуквенным кодом аминокислоты, переносимой соответствующей тРНК, а также 5' —> 3'-последовательностью оснований ее антикодона В выбранном участке ДНК расположен ретротранспозон. Транспозоны — это мобильные генетические элементы. Ретротранспозоны меняют свое место в геноме при участии промежуточной стадии РНК, которая служит для обратной транскриптазы в качестве матрицы для синтеза ДНК-формы ретротранспозона, которая в конце концов интегрируется в хромосомную ДНК. В интеграции участвуют длинные повторы последовательности на концах ретротранспозона (LTR — англ. long terminal repeat). У ретротранспозонов имеется (как, например, у похожих на них ретровирусов) «обратный» поток генетической информации (РНК —> ДНК) (лат. retro — обратно, назад)

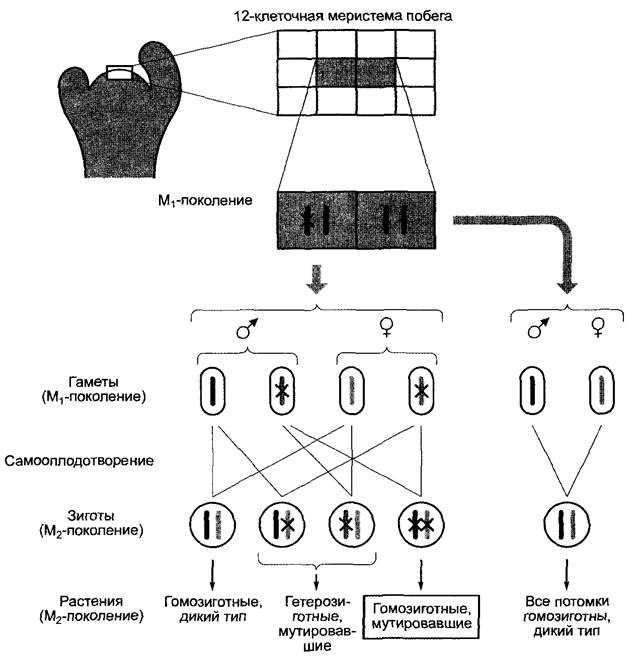
Химический мутагенез часто проводят на семенах, Т-ДНК-инсерционный мутагенез — погружением соцветий в культуру Аgrobacterium tumefaciens, которые содержат подходящие Тi-плазмиды (часто в сочетании с вакуумной инфильтрацией) (вставка 7.3, 7.4, 9.2)1. Трансформация растительных клеток (в том числе в зоне меристемы) происходит за счет естественного процесса внедрения Т-ДНК бактерий в ядерный геном растений (см. бокс 9.2); однако благодаря применению специальных Тi- плазмид, у которых отсутствуют гены метаболизма фитогормонов (см. бокс 7.3), опухоли не образуются. В связи с тем что всего лишь 12-клеточная меристема побега Агаbidopsis thaliana содержит только две клетки, которые образуют соцветия, мутация в одном гене одной из этих двух клеток — даже в случае рецессивности мутировавшего признака — ведет в поколении М2 к фенотипическому расщеплению 7:1 (дикий тип : гомозиготный мутировавший). Таким образом, высокое процентное содержание мутантов очень удобно для практического использования (рис. Е). Это сделало возможным получение обширных коллекций мутантов, которые охватывают уже более половины всех генов.
1 Разработаны также методики инерционного Т-ДНК-мутагенеза с использованием семян Агаbidopsis thaliana. — Примеч. ред.
Рис. D. Химический мутагенез с помощью этилметансульфоната (EMS). Черные точки — точки соединения алкилирующих мутагенов с основаниями ДНК, в случае EMS происходит этилирование. Строение ДНК см. рис. 1.4

Рис. Е. Распределение мутаций в меристеме побега Агabidopsis thaliana. Обе обозначенные серым цветом клетки 12-клеточной меристемы побега образуют позже соцветия. Крестики — мутировавший аллель
Дальнейшая информация о Arabidopsis thaliana в этой книге
Во многих местах книги приведены схемы, которые либо основаны на данных исследований Arabidopsis thaliana, либо показывают само растение:
✵ общий вид (см. рис. 7.65, в сравнении с мутантом с дефицитом брассинолидов: см. рис. 11.265, А, В, общий вид диаграммы цветка);
✵ сравнение величин геномов (см. рис. 7.4);
✵ контроль клеточного цикла (см. рис. 7.19);
✵ строение корня (см. рис. 7.26; 9.2, С);
✵ клеточная детерминация в корне (см. рис. 7.26);
✵ эмбриогенез (см. рис. 3.1; 7.27);
✵ разметка трихомов (см. рис. 7.28);
✵ формирование органов во флоральной меристеме и диаграмма цветка (см. рис. 7.29);
✵ сигнальный путь этилена (см. рис. 7.63); мутанты по биосинтезу этилена (см. рис. 7.62);
✵ мутант с дефицитом брассинолидов сЬЪЗ (см. рис. 7.65);
✵ эндогенный суточный ритм (см. рис. 7.79);
✵ семейство фитохромов (см. рис. 7.84) и спектр действия фитохромов (см. рис. 7.85, А, В);
✵ фитохромный контроль активности генов (см. рис. 7.86).
Причины больших различий в величинах геномов у растений разнообразны.
✵ Отчасти дело в числе или величине генов. Даже самые большие ядерные геномы в сравнении с самыми маленькими имеют лишь в два-три раза больше генов, благодаря главным образом более крупным семействам генов, и в меньшей степени — благодаря большему числу различных кодирующих функций. Средняя величина гена у больших геномов также незначительно больше, чем у маленьких геномов.
✵ Из-за авто- или соответственно аллополиплоидизации (см. 10.3.3.4) величина генома может увеличиться. Так, табак (Nicotiana tabacum) — аллотетраплоиден, пшеница (Тгiticumaestivum) — аллогекса- плоидна.1
1Предполагают, что современная мягкая пшеница возникла путем гибридизации Тriticum monococcum (2n = 14) с эгилопсами: Aegilops speltoides и Аеgilops squarrosa. Таким образом, из 42 хромосом Triticum aestivum только 1/3 ДНК принадлежит собственно пшеницам, а 2/3 ДНК — эгилопсам. — Примеч. ред.
✵ К увеличению количества ДНК (и числа генов) в процессе эволюции привели также дупликации внутри генома. Подробно это исследовано у Arabidopsis thaliana (см. бокс 7.1). Здесь дуплицированные сегменты, которые часто относятся к участкам хромосом величиной в несколько мегабаз, составляют почти 60 % ядерного генома. Это объясняет гораздо большее число генов Arabidopsis thaliana (25 498 генов, см. табл. 7.2) в сравнении с животными одноуровневой сложности, у которых такого рода обширные дупликации в геноме отсутствуют (плодовая мушка Drosophila melanogaster имеет 13 601 ген, круглый червь Caenorhab- ditis elegans — 19099 генов).
✵ Главная причина различий в величине ядерных геномов заключается, однако, в доле высокоповторяющейся и большей частью некодирующей ДНК, которая у очень больших геномов может составлять больше 90 %. Таким образом, в маленьких ядерных геномах гены расположены на меньшем расстоянии друг от друга, чем в больших. Они не равномерно распределены на молекуле ДНК хромосомы, а сконцентрированы в определенных областях, между которыми расположены более или менее обширные области некодирующей ДНК.
Бокс 7.2. Правила обозначения генов, белков и фенотипов
Обозначение генов и белков экономичным способом записи себя вполне оправдало. При этом со временем для различных организмов утвердились различные традиции. Поскольку речь идет не об исторически закрепившихся обозначениях, в этой книге для всех эукариотических организмов употребляется единообразная терминология, аналогичная той, которая была принята для Аrabidopsis thaliana (см. бокс 7.1).
Немутировавшие аллели генов (называемые также генами дикого типа) обозначаются тремя наклонными прописными буквами, мутировавшие — тремя наклонными строчными. Кодируемые генами белки обозначаются тремя прямыми прописными буквами (только для белков мутировавших аллелей не используют никаких традиций). Если речь идет о голопротеине, то только для апопротеина используют прописные буквы, голопротеин обозначается тремя прямыми строчными буквами. Если имеется семейство генов, то его члены обозначаются либо арабскими цифрами (1,2, 3, ...)1 либо прописными буквами (A, В, С, ...). Шрифт при этом не наклонный. Пример — фитохром (см. 7.7.2.4):
РНYА — обозначает ген фитохрома А дикого типа;
рhуА — обозначает мутировавший аллель гена фитохрома А;
РНУА — обозначает апопротеин фитохрома А;
рhуА — обозначает голопротеин фитохрома А (апопротеин + связанная группа, в данном случае светопоглощаюшая группа фитохрома, фитохромобилин).
1 Из этого правила есть исключения. Так, если гены АР1 и АР2 принадлежат к разным семействам транскрипционных факторов, то гены AG и AGL1, AGL2 и др. — к одному семейству. — Примеч. ред.
Часто гены называют по фенотипу мутантов, которые привели к их открытию. Обозначение фенотипа мутанта пишется наклонными строчными буквами. Пример: у мутанта nonphototropic hypocotil соответствующий (мутировавший) аллель называется nphI1, немутировавший ген NPH1. Он кодирует апопротеин NPH1 фоторецептора nph1, для которого позже было предложено название фототропин (см. 8.3.1.1).
1 Если получено несколько разных мутаций в одном и том же гене, для их обозначения используют арабские цифры через дефис: ар 2-1, ар 2-6 или аg-1 ag-4 и т.п. — Примеч. ред.
У прокариот для обозначения генов дикого типа также используется трехбуквенный код с наклонными строчными буквами, при этом гены одного оперона снабжаются часто одним и тем же кодом и добавленными прописными буквами для различения отдельных генов (например, laс-гены, это гены лактозного оперона Escherichia coli; lacZ кодирует энзим ß-галактозидазу, lacl кодирует ре прессорный белок для lacZ; lac-оперон, ср. также бокс 7.3, рис. С и учебники по микробиологии или молекулярной генетике). Гены дикого типа снабжаются верхним индексом в виде знака «плюс» (например, lac+); для обозначения, мутировавшего аллеля, однако, не употребляется знак «минус». Обозначение белков у прокариот следует, как правило, также другой традиции: трехбуквенный код, но только первая буква прописная (пример: VirA — это белок, кодируемый virA). Фенотипы также снабжаются трехбуквенным кодом, но с прописной начальной буквой и без наклона (например, His+ для штамма, который способен к биосинтезу гистидина). Мутантные фенотипы могут снабжаться верхним индексом в виде знака «минус» (например, His~ для мутанта, который уже не может образовывать гистидин).
Обозначение мутировавших или соответственно немутировавших аллелей пластидного генома и хондриома следует традиции для прокариот.
Бокс 7.3. Создание трансгенных растений
В середине 70-х гг. XX в. с открытием рестрикционных эндонуклеаз (ферменты прокариот, которые гидролизуют двухцепочечные молекулы ДНК в строго определенных местах последовательности ДНК (рис. А, В)) в биологических науках наступила фаза генетической инженерии. Под этим термином понимают спектр методов направленного изменения наследственной информации. Если рекомбинантная ДНК внедряется в живую клетку и там стабильно интегрируется в геном (как правило, в ядерный геном, у эукариотических растений, однако, смотря по обстоятельствам, также и в пластидный геном), то возникает генно-инженерно измененная клетка, у прокариот или соответственно одноклеточных — непосредственно генно-инженерно модифицированный организм. У многоклеточных из первоначальной генно-инженерно модифицированной клетки сначала нужно регенерировать организм, все клетки которого несут генно-инженерное изменение. Независимо от того, идет ли при этом речь о гене из того же вида, из другого вида, гибридном гене (ген, составленный из участков различных организмов) или о синтетическом гене, говорят о трансгенном организме.
Рис. А. Ферментативный гидролиз ДНК. Рестрикционные эндонуклеазы II типа распознают короткие участки последовательностей в двухцепочечных молекулах ДНК и гидролизуют («режут») обе молекулы ДНК, чаще внутри последовательности узнавания, в строго определенном месте. Рестрикционная эндонуклеаза EcoRI (Есо от Escherichia coli) «узнает» палиндромную (т.е. идентичную, находящуюся соответственно в направлении 5’ —> 3’ на обеих цепях ДНК) последовательность GAATTC и гидролизует специфично в обеих цепях между гуанозином и аденозином (стрелки) соединение между З’-ОН-группой рибозы и фосфатной группой. В результате этого симметричного расщепления ДНК-рестриктаза EcoRIпроизводит два одноцепочечных комплементарных конца, которые характеризуются выступом, включающим 4 нуклеотида на обоих образовавшихся 5'-концах. Такие выступающие концы можно использовать, например, для гибридизации с другими молекулами ДНК, также «разрезанными» с помощью EcoRI (см. рис. В)
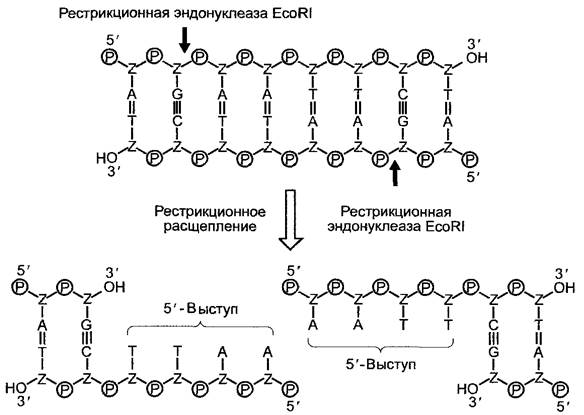
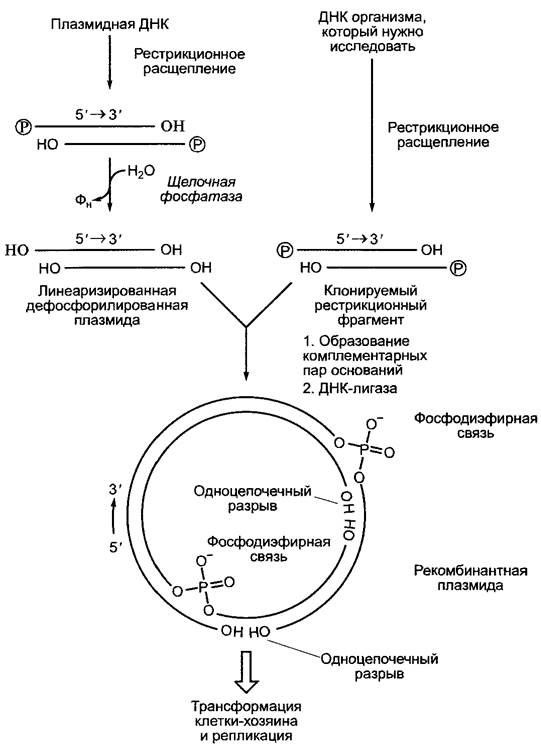
Рис. В. Принцип клонирования целевой ДНК с использованием плазмидного вектора. Кольцевая двойная цепь ДНК плазмиды гидролизуется с помощью той же рестрикционной эндонуклеазы, которая использовалась для получения клонируемого фрагмента ДНК («рестрикционный фрагмент»). На образовавшихся 5'-концах возникают короткие фосфорилированные нуклеотидные выступы (см. рис. А). В то время как открытый (линеаризированный) плазмидный вектор дефосфорилируют, на клонируемом рестрикционном фрагменте оставляют 5’-фосфатные группы. После смешивания линеаризированного вектора и рестрикционного фрагмента образуются комплементарные пары оснований (англ, annealing) между плазмидным вектором и клонируемым рестрикционным фрагментом (наряду с образованием собственных пар внутри плазмидной ДНК и ДНК рестрикционного фрагмента). Благодаря ферменту ДНК-лигазе при отщеплении воды фосфатные группы соединяются с соседними З’-ОН-группами с образованием фосфодиэфирных связей (рис. 1.4) («лигирование»). Там, где напротив друг друга стоят две ОН-группы, лигирование не происходит. Тем не менее образовавшаяся рекомбинантная плазмида довольно стабильна, чтобы выдержать внедрение в бактериальную хозяйскую клетку (трансфекция, чаще путем электропорации). В последующих циклах репликации хозяйская клетка образует полноценные замкнутые плазмидные молекулы без одноцепочечных разрывов. В качестве плазмидных векторов используются производные бактериальных плазмид устойчивости, которые наряду с точкой начала репликации несут также ген устойчивости к антибиотикам. Поэтому те бактериальные клетки, которые содержат рекомбинантные плазмиды, растут в присутствии антибиотика, в то время как нетрансформированные клетки погибают. Показанная очень простая система не позволяет вставить клонируемый рестрикционный фрагмент в определенной ориентации в плазмидном векторе. Однако если при линеаризации плазмиды и получении рестрикционного фрагмента последовательно используют соответственно две различные рестрикционные эндонуклеазы, так, чтобы возникли различные выступы последовательностей на обоих концах, то можно достичь правильно ориентированной вставки рестрикционного фрагмента в вектор для клонирования
Трансгенные растения со времени их внедрения в середине 80-х гг. XX в. стали в биологии очень важными объектами исследований, на которых можно изучать прежде всего вопросы физиологии обмена веществ и развития и выявлять функции генов. В многочисленных местах в этом учебнике приводятся данные, полученные на трансгенных растениях. Одновременно трансгенные растения имеют большое значение для сельского хозяйства и селекции культурных растений. С середины 90-х гг. XX в. трансгенные культурные растения начали возделывать на больших площадях — преимущественно в Северной Америке, Южной Америке, Австралии, а также все больше в Азии. Идет острая дискуссия о рисках и перспективах использования генно-инженерно модифицированных культурных растений. Прежде всего заслуживают тщательного исследования экологические последствия использования этих растений в мире.
Создание трансгенных растений — многоступенчатый процесс. Он состоит из следующих этапов:
✵ Выделение и точная характеристика молекулы ДНК, которую нужно перенести. При этом речь может идти об участке генома, отдельном гене или так называемой кДНК (англ. copyDNA). кДНК образуется с помощью обратной транскриптазы в присутствии мРНК-матрицы и 2'- дезоксирибонуклеотидов (см. рис. 1.4).
✵ Конструирование вектора для клонирования, с помощью которого ген, который нужно перенести в подходящий организм, как правило, в бактериальный хозяйский штамм, можно сохранить и реплицировать в большом количестве копий («клонирование»). В качестве векторов для клонирования используются, как правило, производные бактериальных плазмид устойчивости (R-плазмиды, см. учебники по микробиологии). Хозяйские штаммы являются безонасными штаммами (чаще всего это Escherichia coli), которые из-за многочисленных мутаций растут только на специально составленной питательной среде, но уже не могут расти вне лаборатории.
✵ Конструирование вектора для трансформации (чаще речь идет о плазмиде для восприятия клонированной ДНК) и введение вектора в бактерии, способные к трансформации растительных клеток. Сегодня для трансформации растений применяется почти исключительно Agrobacterium tumefaciens, возбудитель опухолей корончатого галла (см. бокс 9.2). В качестве векторов для трансформации используют производные Ti-плазмиды этой бактерии. Чаще используют плазмиды, которые реплицируются как в Escherichia coli, так и в Agrobacterium tumefaciens, и служат одновременно как векторы для клонирования и как векторы для трансформации (рис. С). Определенная область Ti-плазмиды, область Т-ДНК (Т-ДНК = переносимая — англ. transferierred — ДНК), переносится в растительную клетку и стабильно интегрируется в любом месте в ядерный геном растения (см. бокс 9.2).
Рис. С. Строение вектора для трансформации, пригодного для клонирования в Escherichia coli, и для внедрения в Agrobacterium tumefaciens, который может использоваться для переноса Т-ДНК (см. бокс 9.2) в растения. Вектор несет признаки бактериальных плазмид устойчивости и одновременно содержит все требующиеся для интеграции в ядерный геном элементы Т-ДНК Ti-плазмиды Agrobacterium tumefaciens (бокс 9.2), однако в одиночку не может вызывать трансформацию растительной клетки, так как отсутствуют существенные генные элементы полной Ti-плазмиды (например, vir-область). Поэтому чтобы стать способными к трансформации растений, агробактериальные штаммы должны нести вспомогательную плазмиду (так называемая хэлперная Ti-плазмида без области Т-ДНК), которая содержит генные элементы, отсутствующие у вектора для трансформации. Показанный для примера вектор несет следующие элементы: точку начала репликации для репликации плазмиды в Escherichia coli (Е. coli oriv) и точку начала репликации для репликации плазмид широкого спектра бактерий-хозяев (среди прочих Agrobacterium)\ ген устойчивости для селекции в бактериях-хозяевах (например, npt-ген: он кодирует неомицинфосфотрансферазу и вызывает устойчивость к антибиотикам неомицину и канамицину); правую и левую границы области Т-ДНК Ti-плазмиды (о структуре и функции этого участка ДНК см. бокс 9.2). Эти пограничные участки, а также все фрагменты ДНК между ними переносятся в ядерный геном растения. Внутри области Т-ДНК находится ген устойчивости для селекции трансформированных растительных клеток (1). Часто используют уже упоминавшийся npt-ген под контролем промотора нопалинсинтазы А. tumefaciens(рnos) с сайтом терминации транскрипции гена нопалинсинтазы (tnos). Нопалинсинтазный промотор распознается растительной РНК-полимеразой II и содержит цис-элеметы, усиливающие транскрипцию (см. 7.2.2.3). Полилинкер (или «сайт множественного клонирования» MCS — от англ. multiple cloning site) (2) — это участок ДНК, который несет расположенные тесно друг с другом и даже частично перекрывающиеся последовательности узнавания для множества рестрикционных эндонуклеаз. Полилинкер пригоден для интеграции разнообразных рестрикционных фрагментов. В показанном примере в сайт множественного клонирования вносится целевой ген, который, с одной стороны, фланкирован участком терминатора транскрипции нопалинсинтазы, а с другой стороны — промотором 35S-MPHK вируса мозаики цветной капусты (p35S; см. бокс 9.1). Промотор 35S очень сильный и активен почти во всех растительных клетках. В показанном примере последовательность полилинкера находится внутри кодирующей области бактериального гена lacZ, перед которым помещен ген lacl. Это расположение применяется также во многих других плазмидах для клонирования чужеродной ДНК, так как в этом случае возможно очень простое доказательство успешной вставки ДНК («бело-голубая селекция») в бактериальные хозяйские клетки. В основе метода лежит следующий принцип. Ген IacZ несет 5'-участок кодирующей последовательности фермента ß-галактозидазы бактериального гена /acZ. Подходящие бактерии-хозяева содержат в хромосомной ДНК З’-участок этого гена, но не полный ген IacZ. В присутствии кодируемого плазмидой гена lacZ в клетке оба «неполных фермента» ß-галактозидазы образуются раздельно. Однако они могут ассоциироваться в функциональную ß-галакто- зидазу, которую можно гистохимически выявить совершенно так же, как ß-глюкуронидазу (см. бокс 7.4), с использованием субстрата 5-бром-4-хлор-3-индолил-ß-галактопиранозида (голубое окрашивание бактериальных колоний). Вставленная последовательность полилинкера выбрана так, что она не нарушает рамку считывания гена IacZ и не мешает функционированию фермента. Однако если из-за вставленного фрагмента ДНК рамка считывания гена lacZ' нарушается, то хозяйские бактерии больше не образуют функциональный N-терминальный неполный фермент ß-галактозидазы и отсутствующая ß-галактозидазная активность проявляется в виде бесцветных колоний. На чашке Петри с агаром многочисленных колоний можно очень легко отличить те, которые несут вставку ДНК (белые колонии), от тех, где ее нет (темно-серые колонии). К тому же ген IacZ (и соответственно ß-галактозидазная активность) индуцируется с помощью /асI. Этот ген кодирует белок-репрессор, который путем связывания с промотор-операторным участком гена /acZ' препятствует транскрипции гена IacZ до тех пор, пока к клеткам не будех добавлен IPTG — изопропилтиогалактозид, IPTG связывается с белком-репрессором, из-за чего тот покидает промотор-операторный участок гена IacZ и может запускать транскрипцию IacZ (о структуре и функции Lас-оперона Escherichia coli см. учебники по молекулярной генетике или микробиологии)

✵ Трансформация растения-хозяина. Она происходит при использовании Agrobacterium tumefaciens либо путем кокультивации растительных эксплантов (например, фрагменты листьев табака) с агробактериями, либо путем вакуумной инфильтрации бактерий в семена или соответственно меристемы цветка (используется прежде всего для Агаbidopsisthaliana, см. бокс 7.1). Проходящие при переносе Т-ДНК процессы подробнее рассмотрены в боксе 9.2.
Для растений, которые нельзя трансформировать с помощью Agrobacterium (например, многие однодольные виды), разработаны другие способы, прежде всего трансфекция(перенос свободных от белков ДНК-молекул в клетку). Так, удается стабильно интегрировать ДНК (например, векторов) путем баллистической трансфекции («обстрел» растительных тканей вольфрам-карбидными или золотыми частицами, на поверхность которых нанесены молекулы ДНК); путем электропорации (кратковременное создание импульса высокого напряжения между двумя электродами, которые погружены в раствор растительных протопластов и молекул ДНК); химическим путем (например, добавлением полиэтиленгликоля к смесям протопластов и плазмид); путем микроинъекции (ДНК целенаправленно инъецируют в определенные клетки).
• Отбор успешно трансформированных (или соответственно трансфицированных) клеток. Это происходит при использовании соответствующих фрагментов генов, которые вводятся с помощью Т-ДНК в растительную клетку и экспрессируются после встраивания в растительный геном (табл. А). Часто применяют гены устойчивости. В примере на рис. С речь идет о бактериальном при гене, кодирующем неомицинфосфотрансферазу. которая среди прочего инактивирует путем фосфорилирования токсичный для растительных клеток антибиотик канамицин, так что успешно трансформированные (или соответственно трансфицированные) растительные клетки в присутствии канамицина выживают, в то время как нетрансформированные клетки погибают.
• Регенерация дифференцированных растений из отобранных клеток. Если для трансфекции использовали протопласты, то клетки, выжившие в присутствии селективного фактора (например, канамицина), могут давать каллусную ткань на подходящей культуральной среде с ауксином и цитокинином (см. 7.6.2.3). Из этих каллусов путем изменения соотношения ауксин/цитокинин можно регенерировать полноценные растения в большом количестве (см. рис. 7.47). Для трансформации с использованием Agrobacterium tumefaciens проводят кокультивирование растительных тканей (например, листовых дисков) с бактериями. Трансформированные клетки можно аналогично протопластам выращивать до каллусов на гормональной питательной среде в присутствии селективного фактора, в то время как нетрансформированная ткань на такой среде отмирает.
Таблица А. Примеры чужеродных генов, которые применяют для трансформации растений
Продукт гена |
Сфера использования гена |
Неомицинфосфотрансфераза (NPT) (канамицинкиназа) Хлорамфеникол- ацетилтрансфераза (CAT) Фосфинотрипинацетилтрансфераза (РАТ) ß-D-глюкуронидаза (GUS) Зеленый флуоресцирующий белок, (GFP) |
Селекция трансгенных растений (устойчивость к антибиотикам) Селекция трансгенных растений (устойчивость к антибиотикам) Селекция трансгенных растений (устойчивость к гербицидам) Репортер генной aктивности (гистохимический цветной тест) Репортер генной активности (прямое визуальное доказательство трансформации in vivo) |
Рис. D. Регенерация побегов табака из листового каллуса. Пересадка каллуса на питательную среду с повышенной концентрацией цитокинина и пониженной концентрацией ауксина индуцирует процесс регенерации побегов
Из каллусов снова регенерируют целые растения (рис. D). Чтобы начать трансформацию клеток с помощью Agrobacterium, часто достаточно начавший цветение побег Arabidopsisthaliana погрузить на короткое время в суспензию бактерий (инфильтрировать), создать вакуум. Если при этом трансформируются те клетки меристемы цветка, которые ответственны за образование семяпочек, то после опыления и оплодотворения наряду с нетрансформированными возникают также трансформированные семена, которые развиваются в присутствии селективного фактора (в нашем примере, канамицина), в то время как нетрансформированные семена погибают. Благодаря самоопылению (Arabidopsisthaliana является самоопылителем) получают гомозиготные трансформированные растения (см. рис. 7.1).
✵ Далее следуют генетическая, биохимическая и физиологическая характеристика регенерированных трансгенных растений и при необходимости дальнейшая селекционная работа.
Здесь мы рассмотрели лишь некоторые технические подробности этого процесса. Дальнейшую информацию можно получить из учебников по молекулярной генетике или молекулярной биотехнологии.
Бокс 7.4. Использование трансгенных растений
Трансгенные растения уже много лет имеют фундаментальное научное значение. Кроме того, в последние годы они находят все большее применение в сельском хозяйстве, после того как трансгенные культурные растения впервые поступили на рынок в США в 1995 г. Разнообразные области применения трансгенных растений проиллюстрируем несколькими примерами. Они охватывают среди прочего:
• Повышение экснрессии (гиперэкспрессия) собственных генов вида, например, путем применения более активных промоторов (особенно 353-промотора вируса мозаики цветной капусты, см. 9.3.2, бокс 9.1).
• Снижение экспрессии собственных генов вида, например, путем антисенс-косупрессии. При этом копия гена, который нужно исследовать (или соответственно его кДНК), соединяется в обратном направлении с подходящим промотором (например, З5S-промотором вируса мозаики цветной капусты), и эту конструкцию, как описано, вводят в геном, так что при транскрипции гена ДНК-зависимой РНК- полимеразой II считывается кодирующая, а не матричная (транскрипция, рис. 7.11, А) цепь. Из-за этого образуется мРНК, которая комплементарна матричной цепи. Но она одновременно комплементарна мРНК, которая производится в клетке в результате транскрипции правильно ориентированного гена, и поэтому называется «антисмысловая» мРНК (англ. «antisense»-mRNА). Комплементарные мРНК образуют, вероятно, двухцепочечные молекулы РНК, которые расщепляются специфическими для двойной цепи РНКазами. Из-за этого «смысловая» мРНК (англ. «sensе»- mRNА) удаляется из клетки и больше не пригодна для трансляции. Первое трансгенное культурное растение, поступившее на рынок, — томат с более твердыми плодами, который получил свое специфическое свойство с помощью антисенс-косупрессии. Благодаря экспрессии «антисмыслового» гена полигалактуроназы в плодах сильно уменьшалось образование этого фермента и тем самым сильно уменьшалось растворение состоящих большей частью из полигалактуроната (пектина) срединных пластинок, которое происходит во время созревания плодов и вносит вклад в размягчение плодов.
• Экспрессия чужеродных для вида генов в растении, например, для введения устойчивости к болезням или для получения, измененного или нового продукта обмена веществ. Среди прочего есть попытки достичь сбалансированного питания при чисто растительной диете благодаря экспрессии чужеродных генов, кодирующих белки с более подходящим для питания человека составом аминокислот в семенах. Недавно удалось ввести в растения риса гены полного пути биосинтеза β-каротина (рис. А) и добиться их экспрессии в эндосперме. Получение трансгенного риса с высоким содержанием β-каротина представляет собой веху в борьбе с дефицитом витамина А, особенно распространенным у детей в населении таких стран, где рис является основным источником питания (β-каротин = провитамин А).
Рис. А. Синтез p-каротина в эндосперме трансгенных зерновок риса.
Экспрессия генов фитоенсинтазы, фитоендесатуразы и ликопинциклазы ведет к образованию более чем 1 мг • кг-1 β-каротина в крахмалистом эндосперме (темно-серая окраска!) трансформированных этим геном растений риса (агробактериальная трансформациия, см. боксы 7.3, 9.2). Рис дикого типа не образует в крахмалистом эндосперме p-каротин, зерновки кажутся бесцветными

• Исследование контроля транскрипции растительных генов. Для этого промотор, который нужно исследовать, присоединяют к кодирующей части легко детектируемого гена, который называют также репортерным геном (или соответственно с кДНК, которая включает кодирующую область такого гена) (см. бокс 7.3, табл. А), и эту генную конструкцию вводят в геном растения, которое нужно исследовать. Активность промотора и его регуляцию в трансгенном растении можно затем анализировать благодаря тому, что образующийся генный продукт легко обнаружить. Часто в качестве репортерного гена используется ген p-глюкуронидазы uidk из Escherichia coli, который можно обнаружить гистохимически (рис. В —D), или ген зеленого флуоресцирующего белка (GFP)1из морской медузы Aequorea Victoria. Белок GFP, возбужденный освещением коротковолновым синим светом, флуоресцирует зеленым светом. Поэтому GFP особенно подходит для исследования активности генов в живых клетках.
1 От англ. Green Fluorescent Protein — зеленый флуоресцирующий белок. — Примеч. ред.
Рис. В. Гистохимическая реакция на β-глюкуронидазную активность. В присутствии O2 происходят самопроизвольное окисление и димеризация образовавшегося индоксила до красителя индиго. Добавление гексацианоферрата (III), [Fе(СH)6]3-, ускоряет эту реакцию. 5-Бром-4-хлор-3-индолильный остаток находит применение также в гистохимических реакциях на наличие других гидролаз, например, β-галактозидазы (соединенной с β-D-галактозой) и фосфатазы (соединенной с фосфатом)

Рис. С. Анализ тканеспецифичности промотора: 1 — гистохимическая реакция на наличие β-глюкуронидазы (синее окрашивание, реакция; см. рис. В) показывает активность промотора белка-транспортера сахарозы SUC2 (англ. sucrose — сахароза), специфичного для клеток в проводящих пучках Arabidopsis thaliana. В самых молодых листьях, которые являются акцепторами сахарозы, активность не выявляется; в листьях, которые содержат как ткани-доноры, так и ткани-акцепторы фотоассимилятов, SUC2-npoмотop в кончике листа (донорная область) активен, в листьях-донорах активность выявляется во всех проводящих пучках листа. Такой характер экспрессии позволяет предположить, что SUC2 участвует в загрузке флоэмы. Анализы промотора и репортерного гена, хотя и говорят кое-что о генной активности, не позволяют сделать вывод, действительно ли образуется соответствующий белок в ткани, которая демонстрирует генную активность; 2 — локализация SUС2-белка в проводящих клетках была показана путем маркирования белка специфичными антителами с флуоресцентной меткой и последующего микроскопического анализа (наложение микрофотографий поперечного среза листа в проходящем свете на снимки того же препарата при флуоресценции). Интенсивно излучающие зеленый свет области показывают иммунофлуоресцию SUC2-белкa в клетках флоэмы. Дополнительно проявляется более слабая желтая автофлуоресценция лигнифицированных клеточных стенок в области ксилемы. В продольном срезе через ось соцветия 3 можно отличить клетки-спутницы по их удлиненной форме и клеточному ядру от безъядерных ситовидных элементов (ДНК была помечена флуоресцирующим красителем DAPI — 4,6-диамидино-2-фенилин- долом, голубое свечение). SUС2-белок, узнаваемый по зеленой флуоресценции антител, выявляется в клетках (Флоэмный транспорт; см. 6.8, рис. 6.72)

Рис. D. Анализ регуляции активности промотора факторами внешней среды. Катализирующий раннюю реакцию биосинтеза жасминовой кислоты фермент алленоксидсинтаза регулируется многочисленными факторами (см. 7.6.6.2, рис. 7.66), которые оказывают влияние на эффективность транскрипции гена алленоксидсинтазы. Активацию промотора алленоксидсинтазы при ранении можно показать в трансгенных растениях, которые экспрессируют β-глюкуронидазу под контролем промотора алленоксидсинтазы. Ранение (стрелка) вызывает через несколько часов сильную локальную активацию промотора, обнаруживаемую по сильной β-глюкуронидаз- ной активности (показано растение табака, которое через 4 ч после ранения подвергли гистохимическому анализу на β-глюкуронидазу). Одновременно активируется промотор вдоль проводящих путей; эта активация быстро распространяется в проводящей ткани растения, а также переходит в неповрежденные ткани. При этом происходит системная индукция. Она является следствием распространения в растении раневого фактора, индуцирующего активность многочисленных генов защиты (см. 9.4.1). У томатов это короткий пептид системин (см. рис. 9.19), у других видов структура раневого фактора еще не выяснена

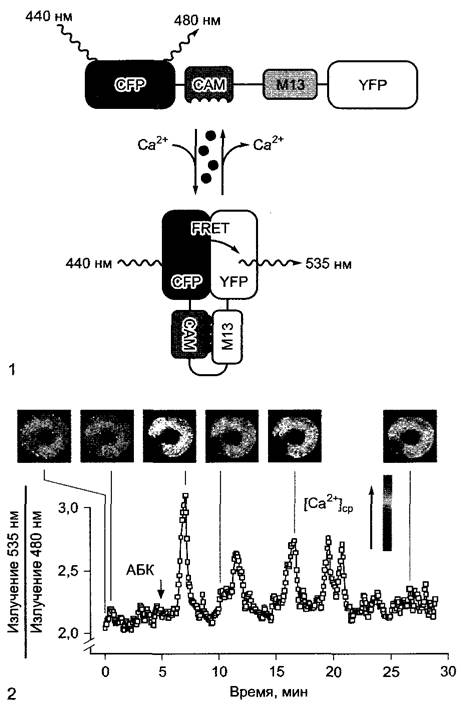
Рис. Е. Технология резонансного переноса энергии флуоресценции (FRET) для исследования изменений цитоплазматического уровня кальция в замыкающих клетках после обработки фитогормоном абсцизовой кислотой (АБК) (1 — no R. Tsien, с изменениями; 2 — по G. Allen, J. Schroeder, с любезного разрешения): 1 — принцип метода. Трансгенные растения Arabidopsis thaliana экспрессируют химерный ген, открытая рамка которого состоит из 4 частей, кодирующих белок с 4 связанными друг с другом функциональными доменами. В клетке этот белок действует как детектор кальция: CFP (от англ, cyan fluo- resent protein); CAM (кальмодулин); M13 (пептид, связывающийся с кальмодулином в присутствии ионов Са2+); YFP (англ. yeilow fluoresent protein). CFP и YFP — полученные путем генных мутаций производные имеющегося в Aequorea GFP (см. текст) с измененными спектрами поглощения и излучения; кальмодулин — Са2+-связывающий белок с 4 местами связывания для ионов Са2+. При низких концентрациях Са2+ в клетке кальмодулин находится в бес- кальциевой форме и химерный детекторный белок обладает открытой структурой. Если клетку освещают синим светом с длиной волны 440 нм, то возбуждается только CFP, и происходит флуоресценция света с длиной волны 480 нм (синий — cyan). Если в клетке повышается концентрация кальция, Са2+ связывается с кальмодулином, а пептид М13 ассоциируется с Са2+-САМ-комплексом, Тем самым YFP-домен оказывается в непосредственной близости к CFP-домену. В этой форме CFP при возбуждении светом с длиной волны 440 нм не флуоресцирует, а переносит свою энергию возбуждения без излучения на YFP, который излучает ее, в свою очередь, в виде флуоресценции с длиной волны 535 нм (желтый); в этом случае говорят о резонанном переносе энергии флуоресценции (FRET). Измеряя соотношение флуоресценции при 535 и 480 нм, можно рассчитать концентрацию ионов Са2+ в цитоплазме; благодаря высокоразрешающей микроспектральной фотометрии можно визуализировать распределение ионов Са2+ в клетке; 2 — FRET-анализ цитоплазматической концентрации Са2+ ([Са2+]ср) в замыкающих клетках устьиц у трансгенных растений Arabidopsis thaliana после добавления АБК (10 мкМ). На фотографиях показано распределение ионов Са2+ в клетках в определенные моменты времени; на графике показана зависимость соотношения интенсивности излучения света при 535 нм:480 нм от времени (среднее значение для двух показанных замыкающих клеток). Анализ показывает, что индукция закрытия устьиц при обработке АБК сопровождается периодическим повышением внутриклеточного уровня кальция в замыкающих клетках (движение замыкающих клеток; см. рис. 8.33)
• Исследование молекулярных процессов в живой клетке. Для этого чаще применяют также зеленый флуоресцирующий белок (GFР) из Аеqиогеа или варианты этого белка с измененными спектрами возбуждения или соответственно флуоресценции. Для исследования субклеточной локализации белков используют химерные гены, у которых до или после области кодирования гена, который нужно исследовать, кодирующая последовательность для GFР поставлена так, что возникает непрерывная рамка считывания. Транскрипция этой рамки считывания дает одну-единственную мРНК, а ее трансляция — химерный белок с GFР, соединенным с 14- или С-концом белка, который нужно исследовать. Внутриклеточное распределение химерного белка можно наблюдать под микроскопом по флуоресценции GFР в живой клетке, можно даже проводить видеосъемку в режиме реального времени. Таким образом, можно следить прямо под световым микроскопом, например, за динамикой цитоскелета или за везикулярным потоком в клетке.
Особенно хорошо разработан метод с использованием трансгенных растений, синтезирующих состоящие из нескольких доменов модульно построенные белки-детекторы, с помощью которых можно селективно и очень чувствительно визуализировать и даже количественно оценить динамические изменения концентрации определенных ионов в клетке (например, ионов Са2+). Кальций является центральным регулятором обмена веществ клетки. Концентрация Са2+ в цитоплазме составляет лишь около 0,1 мкмоль • л-1, однако может в ответ на многие стимулы временно повыситься до нескольких мкмоль л-1, например, в замыкающих клетках после воздействия фитогормоном абсцизовой кислотой (см. 8.3.2.5, рис. 8.33). За этим процессом можно напрямую следить с помощью, показанной на рис. Е технологии FRET (нем. Fluoreszenzresonanzenergie-Transfer, резонансный перенос энергии флуоресценции).
Хотя трансгенные растения давно стали незаменимым вспомогательным средством исследований, их возделывание вызывает опасения у общественности прежде всего в Центральной Европе, в то время как в Америке, Австралии и Азии уже с середины 90-х гг. XX в. они используются в сельском хозяйстве.
Повторяющиеся последовательности находятся, во-первых, в виде блоков многократных тандемных повторов коротких последовательностей или в отдельных, либо немногочисленных копиях, но тогда распределенные по многочисленным участкам на хромосоме (рассеянные повторяющиеся последовательности). Тандемные некодирующие повторы последовательностей находятся в области центромеры и в области теломер (см. 2.2.3.2). Теломеры образуют концы хромосом. У двухцепочечной молекулы ДНК З'-конец немного длиннее, чем 5'-конец (З'-выступ), и гибридизуется в условиях локального плавления двойной спирали теломерного конца с комплементарной последовательностью противоположной цепи. Благодаря этому на конце хромосомы образуется петля (шпилька), с которой связываются, вероятно, специфические белки, стабилизирующие эту структуру. Это дает возможность клетке отличать «настоящие» концы хромосом от ненастоящих, которые возникли вследствие двух-цепочечного разрыва ДНК, и предотвращает объединение хромосом во время репарации ДНК. Кроме того, теломеры имеют значение для правильной репликации концов хромосомы. Специфические белки закрепляются в интерфазном ядре на теломерах и на ядерной оболочке. На центромерах при клеточном делении образуются кинетохоры, с которыми соединяются микротрубочки веретена деления (см. бокс 2.2). У хромосом некоторых немногочисленных видов (например, Luzula, см. 11.2) нельзя локализировать центромеры: здесь нити веретена могут присоединяться ко многим участкам хромосом, тогда говорят о «рассеянных» центромерах. Тандемно расположенные повторы последовательностей характеризуют также некодирующую и неизвестную по функции сателлитную ДНК, названную так, потому что при центрифугировании фрагментов ДНК в градиенте плотности хлористого цезия из-за отличающегося состава нуклеотидных оснований и соответственно из-за немного изменившейся равновесной плотпости эта ДНК появляется в форме сопутствующих полос (сателлитов) вблизи основных полос ДНК — не путать с морфологически определенными сателлитами по соседству с областями ядрышкового организатора (см. 2.2.3.3, рис. 2.25). Расположенные в областях ядрышкового организатора гены рибосомальных РНК (рРНК) представлены более чем 20 000 копиями на геном в виде тандемных повторов практически идентичных последовательностей генов и идентичных межгенных областей. Однако гены робосомальной РНК сосредоточены в одной или нескольких хромосомах (см. бокс 7.1).
Среди расположенных разрозненно в ядерном геноме диспергированных повторяющихся участков ДНК особенно важны транспозоны и ретротранснозоны. В обоих случаях речь идет о мобильных генетических элементах, которые меняют свое расположение в геноме со сравнительно высокой частотой или соответственно интегрируются при репликации в дополнительные места в геноме. Транспозоны характеризуются короткими обратными повторами последовательности на своих границах, которые необходимы для транспозиции.1Автономные транспозоны (например, транспозон Ас кукурузы) несут дополнительно по крайней мере один ген, который необходим для транспозиции и кодирует транспозазу; другие транспозоны (например, Ds-элементы кукурузы) нуждаются для транспозиции в автономном транспозоне, так как они больше не обладают полной внутренней кодирующей областью. Ac-Ds-элементы кукурузы были первыми открытыми В. McClintock в 1940— 1955 гг. мобильными генетическими элементами. В отличие от транспозонов ретротранспозоны перемешаются через промежуточный продукт РНК, который транскрибируется кодируемой самим транспозоном обратной транскриптазой в к-ДНК (англ. copy-DNA, cDNA). Эта ДНК-копия может интегрироваться в геном в другом месте. Для этого служат длинные прямые повторы (LTR, англ. long terminal repeats), которые локализованы на концах ретротранспозона (или соответственно кДНК). Механизм транспозиции имеет большое сходство с процессом размножения у ретровирусов. Ретротранспозоны могут составлять значительную часть ядерного генома, у кукурузы — почти 50 %.
1 Эта особенность характерна для транспозонов, перемещающихся в геноме нерепликативно. При транспозиции последовательность транспозона вырезается из одного участка генома и перемещается в другой. Нерепликативные транспозоны представлены малым числом копий на геном. — Примеч. ред.
7.2.1.2. Пластидный геном
В отличие от ядерного генома субгеном пластид — пластом — находится в форме кольцевой замкнутой молекулы ДНК (плДНК). В зависимости от степени развития фотосинтетического аппарата у хлоропластов имеется 20—200 идентичных копий плДНК на органеллу. Как у прокариот, молекулы ДНК находятся в нуклеоидах. Хлоропласты содержат 10—20 нуклеоидов, прикрепленных к мембране тилакоидов или внутренней мембране оболочки и содержащих 2 — 20 молекул плДНК каждый. Пластиды, таким образом, полиплоидны и полиэнергидны. Так как клетки в ассимилирующей ткани листьев могут содержать более 100 хлоропластов, то в одной такой клетке имеется около 10 000 копий пластома.
Пластомы низших и высших растений имеют похожий размер. Они включают чаще всего 130—150 тыс. п.н.1 (см. рис. 7.5; 7.4) с нижними и верхними границами 70 тыс. п.н. (Еpifagusvirginiana) и соответственно 400 тыс. п.н. (Acetabulariа); многие пластомы полностью секвенированы. Пластомы у семенных растений содержат единый набор -120 — 130 генов, 90 из них кодируют белки. Например, показательный с этой точки зрения пластом табака включает 155 939 п. н. и несет 97 генов известной функции, а также -30 других, возможно, кодирующих белки участков, так называемых открытых рамок считывания (см. 7.2.2.1) еще неизвестной функции (рис. 7.5).
1 В иностранной литературе применяют наименование килобаза (kb, kbp). — Примеч. ред.
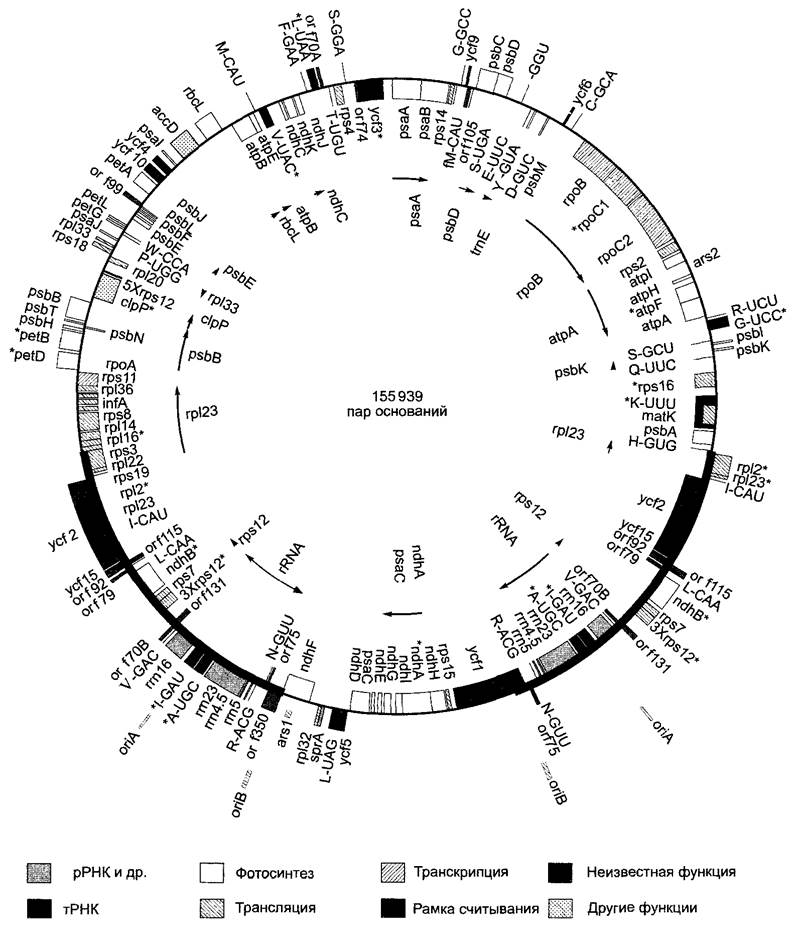
Рис. 7.5. Генетическая карта пластидной ДНК табака (Nicotians tabacum). Положение и протяженность генов обозначены прямоугольниками; гены, названия которых написаны внутри кольца, транскрибируются по часовой стрелке, гены, названия которых написаны снаружи, — против часовой стрелки. Стрелки указывают на полицистронные единицы транскрипции и направление их транскрипции. Обозначенные символом «*» гены содержат интроны. Выделенные толстыми линиями участки ДНК-кольца представляют собой последовательности двух больших инвертированных повторов, которые также содержат точку начала репликации (ог/А, ог/В); окружности, обозначенные тонкой линией, представляют два уникальных участка. Номенклатура пластидных генов соответствует той, которая принята для прокариот (см. бокс 7.2). Некоторые важные гены или группы генов: psa — фотосистема I, psb — фотосистема II, pet — цитохром Ь6//-комплекс, atp — АТФ-синтаза, rbcL (от англ. Large) — большая субъединица рибулозо-1,5-бифосфаткарбоксилазы/ оксигеназы. Далее: гены рибосомальных белков малой {rps) или соответственно большой (гр!) субъединицы рибосом; кодируемая пластидами РНК-полимераза (гро), рибосомальные РНК (ггп). Гены тРНК даны в виде однобуквенного кода (см. рис. 1.11) переносимой аминокислоты, а также последовательности их антикодона, например, H-GUG: tPHKhis, антикодон 5'-GUG-3\ но: fMet-CAU = ген тРНК, связывающей инициаторный кодон 5’-AUG-3' через его антикодон 5'-CAU-3’, несущей N-формилметионин (fMet). Открытые рамки считывания (ORF — open readingframes) обозначены числом их кодонов, например, ORF 350
Пластом большинства растений содержит два больших обратных повтора, отделяющих друг от друга малый и большой уникальные участки. Однако у хвойных и бобовых, а также у отдельных видов других семейств крупные повторы в плДНК не встречаются.
Необычайно маленький пластом найден у динофлагеллят: у Нeterocapsa triquetra плДНК содержит только 9 генов, из которых каждый локализован на собственной миникольцевой хромосоме.
По своей генетической организации плДНК сильно отличается от ядерной ДНК, но она демонстрирует большое сходство с кольцевыми геномами бактерий (эндосимбиотическая теория — см. 2.4). Для прокариотических геномов характерно отсутствие повторяющихся последовательностей. Они отсутствуют также в птДНК, за исключением удвоенных генов в дуплицированном генном участке, к которому относятся гены рРНК.
Пластом содержит полный набор генов тРНК и рРНК, 20 генов рибосомальных белков, а также 4 гена одной из двух пластидных РНК-полимераз (вторая кодируется ядром). К тому же пластом кодирует несколько белков, необходимых для световой реакции фотосинтеза, но только один-единственный фермент цикла Кальвина — рибулозо-1,5-бифосфаткарбокси- лазу/оксигеназу (RubisCO), которая содержит 8 больших и 8 малых субъединиц, образуется при участии иластома. В плДНК содержится ген большой субъединицы RubisCO, который обозначают rbcL (от англ. large — большой). Малые субъединицы (см. 6.5.1) кодируются ядерным геном rbcS (от англ. small — малый).
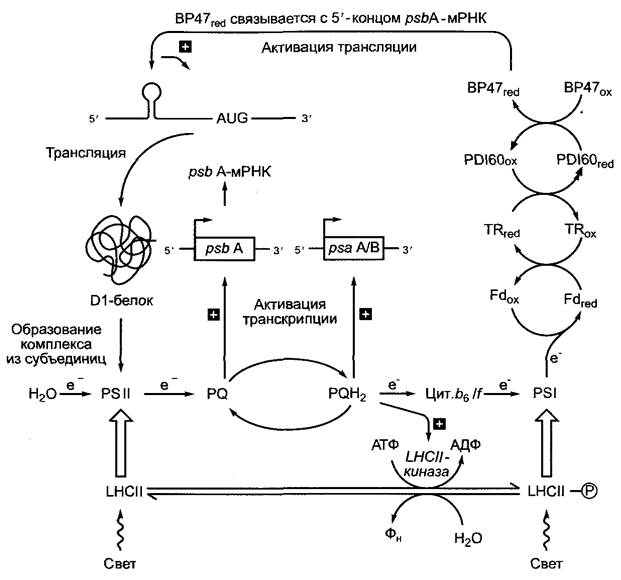
Гены подавляющего большинства пластидных белков кодируются ядерным геномом. По различным оценкам, пластиды содержат -1 900 — 2 300 различных белков, из которых, как упомянуто, только примерно 90 кодируются также пластомом. Хотя пластиды, как и митохондрии, имеют в распоряжении собственный аппарат трансляции и транскрипции; вместе с тем их функции сильно зависят от генетического материала клеточного ядра. Поэтому пластиды и митохондрии называют также полуаэтономными органеллами(эндосимбиотическая теория, см. 2.4). Сегодняшние прокариоты имеют примерно 2 000 — 4 000 генов, редко — меньше или больше (см. рис. 7.4; табл. 7.2). В ходе эволюции пластид (что справедливо и для митохондрий, см. 7.2.1.3) большинство генов первоначальных эндосимбионтов переместились в клеточное ядро, пластидам достался лишь остаточный набор. Сегодня предполагают, что в пластоме сохранились преимущественно гены, кодирующие основные функции (транскрипция, трансляция), а также те, которые подлежат быстрому, прямому, контролю со стороны пластидного метаболизма. Так, например, окислительновосстановительное состояние системы пла- стохинонов (см. 6.4.5) контролирует транскрипцию пластидных генов Dl-белка реакционного центра фотосистемы II (psbA- ген, см. рис. 6.59, рис. 7.5), а также двух белков реакционного центра фотосистемы I (psaА-ген, psaВ-ген; см. рис. 6.61, рис. 7.5), а восстановленный ферредоксин контролирует через прямую дитиол-дисульфидную окислительно-восстановительную регуляцию1 (инициацию) трансляции psbA- мРНК (рис. 7.6).
1 Здесь имеется в виду регуляция через тиоредоксиновую систему.
Рис. 7.6. Окислительно-восстановительный контроль фотосинтеза. Наряду с рассмотренной в разделе 6.4.8 регуляцией распределения энергии через присоединение светособирающего комплекса LНСII кфотосистеме II (ФС II) или фотосистеме I (ФС I), которое зависит от фосфорилирования LHСII активированной восстановленным пластохиноном (РQН2) LНСII-киназой (нижняя часть рисунка), на уровне транскрипции и трансляции действуют другие механизмы окислительно-восстановительного контроля. Окисленный пластохинон (РQ) индуцирует транскрипцию гена, кодирующего белок D1 ФС II (рsbА), восстановленный пластохинон (РQН2) — транскрипцию генов белков А и В реакционного центра ФС I (рsаА, рsаВ). Восстановленный ферредоксин вызывает путем тиол/дисульфидной конверсии (см. рис. 6.71) с помощью тиоредоксина (ТR) и 60-кДа- протеиндисульфидизомеразы (РDI60) активацию РНК-связывающего белка (ВР47), который в восстановленной форме специфично связывается с 5’-концом рsbА-мРНК. Этот конец формирует особую вторичную структуру (шпилька-петля), которая возникает благодаря внутреннему образованию пар оснований в области шпильки. Связывание ВР47геd с мРНК активирует ее трансляцию. Предполагают, что комплексное управление транскрипцией и трансляцией генов белков, несущих фотосинтетические реакционные центры, было причиной того, что в отличие от большинства других эти гены не смогли в ходе эволюции пластид переместиться из генома первоначальных эндосимбионтов в клеточное ядро
Но и активность нуклеома и пластома должны быть точно согласованы между собой. Так, не только RubisCO, но и все белковые комплексы электрон-транспортной цепи фотосинтеза, а также АТФ-синтаза содержат кодируемые как ядром, так и пластидами субъединицы. По механизмам кооперации нуклеома и пластома ясности нет. Однако экспрессия пластидных генов стоит под контролем ядерных регуляторных генов, и, наоборот, активность ядерных генов, например, генов хлорофилл- а/b-связывающих белков светособирающего комплекса LHCII (см. 6.4.3) или находящегося в нуклеоме гена малой субъединицы рибулозо-1,5-бифосфаткарбоксила- зы/оксигеназы, регулируется функциональным состоянием хлоропластов.
7.2.1.3. Митохондриальный геном
Митохондриальные геномы (хондриомы) растений по величине и структуре очень вариабельны и чаще всего намного больше, чем у животных (позвоночные — ~ 16 тыс. п. н.). Вариабельная величина хондриома лишь частично связана с соответствующим увеличением набора генов; в основном она обусловлена различиями в доле некодирующих последовательностей, многие из которых состоят из повторов. Среди них находятся даже фрагменты чужеродной ДНК, которая происходит из пластома или нуклеома. Значительная величина растительного хондриома, таким образом, является результатом вторичных изменений, типичных для растений, а не результатом малых потерь генов в ходе эволюции митохондрий. Хондриомы, как и пластом, полиплоидны и полиэнергидно структурированы. У пекарских дрожжей имеется -100 копий хондриома в нескольких нуклеоидах на митохондрию и - 6 500 на клетку.
Хондриом зеленой водоросли Chlamydomo ñas reinhardtii содержит 16 тыс. п.н. митохондриальной ДНК (мтДНК) и состоит из линейной двухцепочечной молекулы ДНК; хондриомы грибов имеют ≈18 — 180 тыс. п. н. (Saccharomyces cerevisiae: 78 тыс. п. н.), хондриомы семенных растений — от 180 (Brassica oleráceo) до 2 400 тыс. п.н. (Cucumis meló) (см. рис. 7.4). Хондриом семенных растений состоит чаще всего из нескольких кольцевых двухцепочечных молекул ДНК различной величины, способных превращаться друг в друга благодаря процессам рекомбинации в области повторяющихся последовательностей (рис. 7.7), и лишь редко (например, Brassica hirta) хондриом состоит из одной-единственной кольцевой молекулы ДНК. В случае фрагментированного хондриома самую крупную молекулу мтДНК называют мастер-хромосомой (англ. master circle). Из одного-единственного кольца двухцепочечной мтДНК состоит хондриом печеночного мха Marchantía polymorpha, один из митохондриальных геномов с полностью установленной последовательностью оснований (186608 п.н.).
Рис. 7.7. Внутримолекулярная рекомбинация ДНК митохондрий у высших растений. У турнепса (Brassica rapa) в митохондриях имеются 3 кольцевые мтДНК различной величины; в главном кольце (218 тыс. п.н.) содержится прямой повтор (стрелки), так что в результате процессов рекомбинации могут возникнуть два неполных малых кольца ДНК; процесс обратим

Как и в случае пластид, емкости митохондриального генома отнюдь не хватает, чтобы кодировать все необходимые белки; большинство кодируется в ядерном геноме и импортируется в органеллу (см. 7.3.1.4). В отличие от пластид митохондрии должны импортировать даже некоторые транспортные РНК.
Набор генов хондриома разных видов несколько различается и составляет от 12 (Chlamy- domonas reinhardtii) до более 60 генов (например, Arabidopsis thaliana: 58, Marchantía polymor- рhа: 66). Кроме того, из-за рекомбинации от вида к виду различается (в отличие от пластома) и расположение генов в хондриоме. Наряду с компонентами электрон-транспортной цепи и АТФ- синтазы речь идет о генах некоторых рибосомальных белков (которые, однако, отсутствуют у самых маленьких хондриомов) и двух-трех из четырех рРНК. Однако ни один из известных хондриомов не кодирует все тРНК, требующиеся для митохондриальной трансляции (Магchantia: 29, Arаbidopsis: 22, Chlamydomonas: 3), так что кодируемые ядром митохондриальные тРНК должны импортироваться в митохондрии. Механизм импорта неизвестен. РНК-полимераза, также необходимая для транскрипции митохондриальных генов, кодируется у растений полностью в ядерном геноме.
Следствием частых событий рекомбинации, в том числе незаконной рекомбинации в кодирующей части генов, является наличие дефектных копий генов во многих митохондриальных геномах. Из-за этого иногда могут возникнуть ошибочные белки. Подобные белки отвечают за цитоплазматическую мужскую стерильность (ЦМС), которая встречается у многих покрытосеменных, в том числе у важных культурных растений (кукуруза, просо, пшеница, сахарная свекла), и основана на стерильности пыльцы. ЦМС-фенотип наследуется по материнской линии, так как мужские гаметы (спермин) большинства покрытосеменных не передают митохондрии (впрочем, и пластиды тоже). Стерильность пыльцы имеет большое значение при селекции культурных растений. Например, при гибридизации кукурузы, которая основана на строгом исключении самоопыления, можно отказаться от очень трудоемкого ручного удаления мужских соцветий — метелок.1
1 Речь идет о гибридах, которые обладают повышенной урожайностью по сравнению с исходными линиями родителей (явление гетерозиса). Массовое получение гибридов F1основано на ЦМС. — Примеч. ред.
7.2.2. Основы активности генов
Как было показано в предыдущей главе, подавляющее большинство генов растительной клетки, и среди них практически все важные для развития гены, локализованы в клеточном ядре. Также и все белки, регулирующие активность генов пластома и хондриома, кодируются ядром, равно как и все белки, которые участвуют в регуляции биосинтеза белков этих органелл. Поэтому дальнейшее рассмотрение здесь структуры генов и контроля их активности ограничено ядерными генами, в первую очередь теми, которые кодируют белки. По мере необходимости кратко рассматриваются условия работы пластидных генов.
7.2.2.1. Структура гена
Ген — это участок генома, который транскрибируется в РНК. При этом речь может идти о РНК, кодирующей белок, которая в этом случае называется матричной РНК (мРНК, англ, messenger-RNА, mRNA), или о некодирующей РНК (рРНК, тРНК среди прочих РНК, см. 1.2.4). Область гена, кодирующего белок, которая затем транслируется, называется открытой рамкой считывания (англ. Open reading frame, ORF). Принципиальное строение генов у эукариот (животных и растений) одинаково; типичная структура, от которой все же могут существовать отклонения в деталях, представлена на рис. 7.8.
Рис. 7.8. Общее строение интронированного гена клеточного ядра и его промотора. Часто промотор и транскрибирующуюся область вместе обозначают как ген. Отдельные структурные элементы объяснены в тексте. А — аденин; С — цитозин; G — гуанин; Т — тимин; U — урацил; N — любое основание1
1 Нематричное встраивание поли-А-последовательности на рисунке не показано. — Примеч. ред.
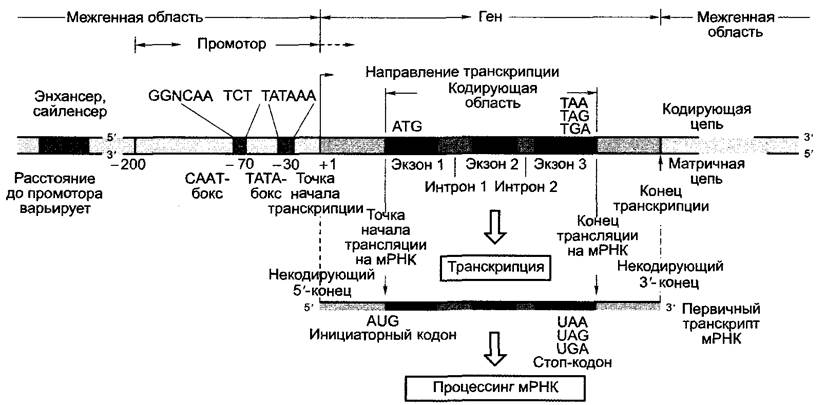
У большинства эукариотических генов открытая рамка считывания прерывается некодирующими последовательностями ДНК — нитронами (англ. intervening regions). Кодирующие белок участки последовательности ДНК называют экзонами (англ. expressed regions), гены эукариот называют мозаичными генами. Транскрипция (см. 1.2.2.2) начинается в точке начала транскрипции, расположенной часто за несколько сотен оснований до начала открытой рамки считывания (первое транскрибируемое основание нумеруется +1); транскрипция заканчивается (иногда также далеко) после конца открытой рамки считывания и включает области экзонов и интронов. Возникающая мРНК называется первичным транскриптом и подвергается как котранскрипционному (т.е. происходящему во время процесса транскрипции), так и посттранскрипционному процессингу.
Область в 5'-направлении перед точкой начала трансляции называется 3'-нетранслируемой областью (англ. leader) мРНК; З'-область после окончания трансляции называется З'-нетранслируемой областью (англ. taller) мРНК. Обе имеют различные частично регуляторные функции.
Образно все участки последовательности в 5'-направлении от рассматриваемого места последовательности нуклеиновой кислоты (например, старта транскрипции гена) называют расположенными «вверх по течению» (англ. upstream), все в З7-направлении от этого места — расположенными «вниз по течению» (англ, downstream).
Транскрипция эукариотического гена происходит, как правило, моноцистронно, т.е. образованная мРНК кодирует один- единственный белок. Участок ДНК, контролирующий транскрипцию гена, называется промотором. Промоторы расположены непосредственно перед началом транскрипции «вверх по течению» и составляют -150 — 200 п.н. Однако они могут захватывать транскрибируемый участок гена и включать интроны и, смотря по обстоятельствам, даже участки ДНК «вниз по течению» от открытой рамки считывания. По этим причинам геном часто называют транскрибируемый участок молекулы ДНК вместе с его промотором (см. рис. 7.8). Наконец, для многих генов найдены участки ДНК, которые часто сильно удалены от собственно гена, однако стимулируют или подавляют его транскрипцию. Эти участки ДНК называются энхансерами (англ. to enhance — усиливать) или сайленсерами (англ. to silence — останавливать, замолкать). В то время как промоторы сочетаются соответственно только с одним геном, энхансеры и сайленсеры влияют, как правило, на несколько генов и — в противоположность регуляторным элементам промотора — часто действуют независимо от позиции и ориентации относительно транскрибируемого участка ДНК.
В отличие от ядерного генома многочисленные гены плДНК, как и у бактерий, контролируются (соответственно в группах по несколько генов) одним общим промотором и транскрибируются в полицистронные мРНК (см. рис. 7.5). Полицистронная мРНК может процессироваться различным образом. При этом в некоторых пластидных генах имеются интроны — у эубактерий они встречаются редко, однако их можно обнаружить у архебактерий.
7.2.2.2. Ход транскрипции
Преобразование генетической информации в структуру и функцию живой клетки обусловливает информационный поток ДНК —> мРНК —> белок. При этом сначала код ДНК переписывается в коллинеарный код мРНК (транскрипция), затем этот код переводится в также коллинеарный аминокислотный код полипептида (трансляция, см. 7.3.1.2). Насколько известно, первичная последовательность полипептида содержит всю информацию об образовании функционального белка (образование вторичных, третичных и, при необходимости, четвертичных структур, см. 1.3.2), хотя нередко образование нативной конформации требует деятельности других белков («помощников по свертыванию», названных шаперонами и шаперонинами, см. 7.3.1.2, 7.3.1.4).
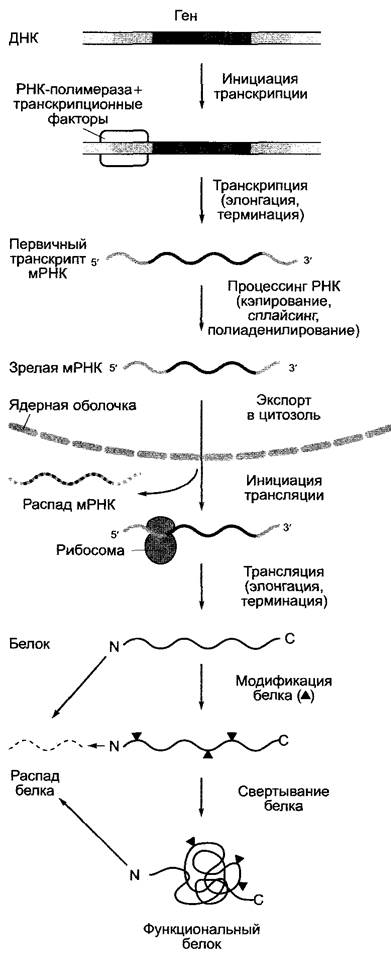
Процесс реализации генетической информации (от гена до белка) многоступенчатый (рис. 7.9) и может быть представлен здесь только в своих наиболее существенных аспектах, причем наиболее важными оказываются контрольные точки.
Рис. 7.9. Поток информации от гена к функциональному белку. Обозначенные серым цветом области нуклеиновых кислот имеют белок-кодирующую функцию. Отдельные этапы протекают в клетке частично параллельно (см. текст) и представлены последовательно только для лучшего обзора. Серые стрелки — главные участки регуляции. Представленная схема справедлива для генов клеточного ядра
Интенсивность экспрессии генов («активность генов») определяется частотой, с которой в точке начала транскрипции гена инициируется успешный синтез мРНК. Скорость синтеза мРНК определяется активностью ДНК-зависимой РНК-полимеразы, она практически постоянна. Гены, кодирующие белок, транскрибируются ДНК-зависимой РНК-полимеразой II. PHК-полимераза I транскрибирует гены больших рРНК (28S-, 18S- и 5,8S-pPHK), а РНК-полимераза III транскрибирует гены малой 5S-pPHK, гены тРНК и гены других малых РНК. В дальнейшем рассмотрим только гены, транскрибируемые полимеразой II.
Из трех фаз транскрипции:
✵ инициация транскрипции,
✵ элонгация мРНК,
✵ терминация транскрипции
регуляции подлежит прежде всего первая фаза. Лежащие в ее основе молекулярные процессы были особенно интенсивно исследованы на животных и пекарских дрожжах, однако открытые закономерности справедливы в принципе и для всех эукариот.
Инициация транскрипции начинается с построения в точке начала транскрипции транскриптосомы, высокомолекулярного мультипротеинового комплекса, с участием РНК-полимеразы II (рис. 7.10). Эта первая фаза транскрипции заканчивается тем, что РНК-полимераза покидает комплекс, после чего начинается элонгация мРНК, транскриптосома снова распадается, чтобы при необходимости образоваться заново.
Рис. 7.10. Отдельные этапы инициации транскрипции для кодирующего белок гена в клеточном ядре. Согласно этому представлению, в области ТАТА-бокса образованный ранее комплекс голоэнзима РНК-полимеразы И связывается с общим транскрипционным фактором D полимеразы II (TFIID) при одновременном взаимодействии с уже образовавшимся комплексом энхансеосомы. Согласно другому представлению, соединение комплекса голоэнзима РНК-полимеразы II с TFIID происходит последовательно путем присоединения отдельных компонентов, затем идет также последовательное построение энхансеосомы. Дальнейшие объяснения в тексте. DBD — ДНК-связывающий домен (от англ. DNA-Bindingdomain); AD — активирующий домен (от англ. Activating domain) регуляторного фактора транскрипции; ТВР — ТАТА-бокс-связывающий белок (от англ. TATA-Box-Binding protein); TAF— ТВР-ассоциированный фактор (от англ. TBP-associated Factor)
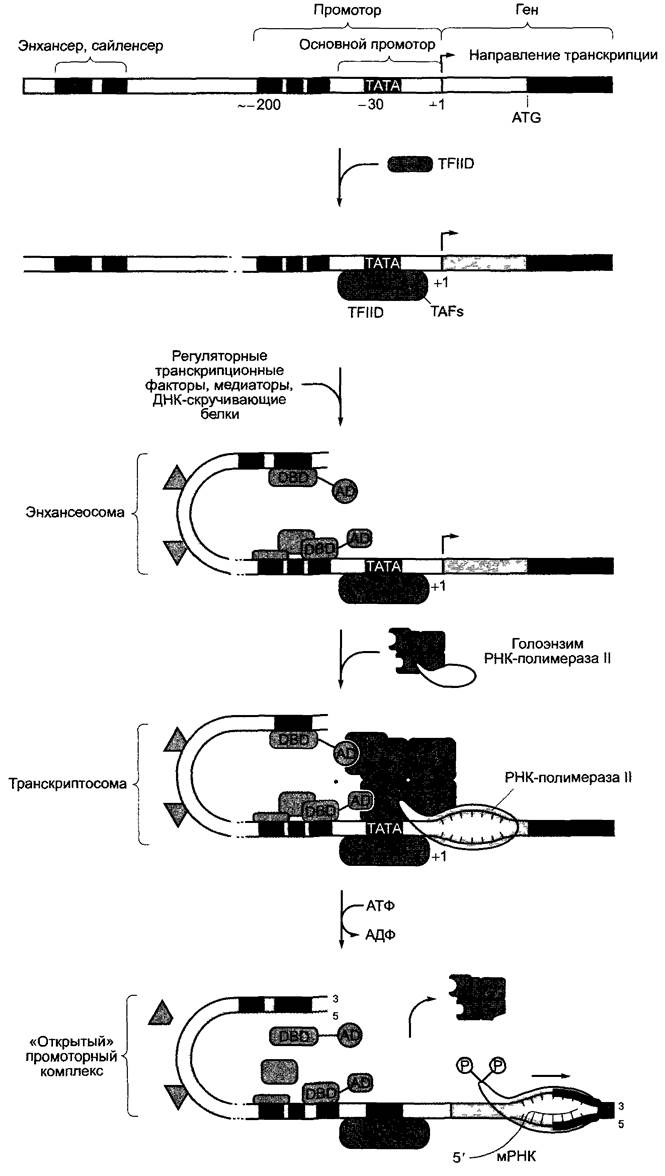
Решающим условием для образования комплекса является доступность промотора для участвующих белков.1 Она регулируется во всем геноме через структуру хроматина, но существуют также ген-специфичные механизмы. Считается, что во время транскрипции гены имеют нуклеосомную структуру (см. 2.2.3.1) и хроматин находится в форме соленоида (структура 30 нм) или в конформации «нитки жемчуга» (см. рис. 2.21; 2.22, А). В интерфазном ядре эти участки расположены в эухроматине. В гетерохроматине (см. 2.2.3) ДНК конденсирована сильнее и не транскрибируется. Индукция образования гетерохроматина является механизмом инактивации более крупных групп генов, позволяющим, например, приостановить (в принципе обратимо) по окончании процесса не требующиеся далее функции. Поэтому гетерохроматиновые участки в различных дифференцированных тканях также отличаются.
1 Эти белки принято называть факторами транскрипции. — Примеч. ред.
ДНК эухроматина образует структурные домены, которые при электронной микроскопии видны как петельные структуры; петли прикреплены через определенные АТ-богатые области последовательности ДНК (англ. scaffold attachment regions, SARs) к структурным белкам ядерного матрикса. Предполагают, что на петлях находятся транскрипционно активные гены. Такие функциональные домены характеризуются «открытой» хроматиновой структурой, которая образуется вследствие ацетилирования гистонацетилазами лизиновых остатков гистоновых белков нуклеосом. Ацетилирование лизина снижает число положительных зарядов гистонов, из-за чего ослабевает их взаимодействие с отрицательно заряженной ДНК. Гистондеацетилазы ответственны за обратный процесс конденсации хроматина, которая идет с частичной или полной потерей транскрипционной активности. Деацетилирование гистона происходит преимущественно на участках метилированной ДНК. Эта типичная для эукариот модификация ДНК катализируется цитозинметилтрансферазами, которые превращают определенные цитозины (они находятся в З'-положении непосредственно рядом или через одно основание от гуанина) в 5-метилцитозин.
У растений до 30 % цитозинов генома могут находиться в метилированном состоянии. При репликации (см. 1.2.3) характер метилирования родительской цепи ДНК копируется на дочернюю цепь; таким образом, состояние конденсации хроматина в геноме может быть передано в дочерние клетки. Возможно, метилированные участки закрываются специфичными связывающими белками, которые, с одной стороны, препятствуют присоединению транскрипционных факторов (см. ниже), а с другой — облегчают присоединение гистон- деацетилаз, начинающих конденсацию хроматина. Повторяющиеся последовательности ДНК и транспозоны часто гиперметилированы и потому находятся в составе гетерохроматина. Степень метилирования рассматривают как механизм инактивации, который предотвращает транспозицию и тем самым действует против нежелательных перемещений ДНК. Кроме того, по- видимому, существуют другие, пока еще подробно не исследованные факторы, которые изменяют позицию нуклеосом в области ацетилированных гистонов.
Можно предположить, что благодаря описанным процессам многочисленные гены генома приводятся в транскрипционно активное состояние, которое является предпосылкой для образования комплекса инициации транскрипции (транскриптосомы).
Сборка транскриптосом на промоторе транскрипционно активного гена включает несколько стадий (см. рис. 7.10):
1. Образование платформы для связывания РНК-полимеразы II с промотором вблизи точки начала транскрипции. Эта функция осуществляется общим транскрипционным фактором TFIID, белковым комплексом из связывающихся с ТАТА- боксом белков (ТВР) и нескольких ТВР- ассоциированных факторов (TAFs, все являются белками). Так как несколько TAFимеют гистонподобные белковые домены, предполагают, что платформа представляет собой нуклеосомоподобную структуру. Область от точки начала транскрипции «вверх по течению» до участка 70, который, как правило (но не во всех случаях), содержит СААТ-бокс (см. рис. 7.8) и прежде всего включает ТАТА-бокс, называют основным промотором(англ. core promoter).
2. Образование энхансеосом в области расположенных далее «вверх по течению» участков промотора, включая, смотря по обстоятельствам, участки энхансеров или соответственно сайленсеров. Эти участки ДНК, как и основной промотор, отличаются короткими характерными последовательностями, которые часто встречаются в большом количестве и с большой плотностью, даже с перекрытием, и представляют собой целевые последовательности для связывания с регуляторными транскрипционными факторами (их следует отличать от основных транскрипционных факторов, таких, как ТFIID и других, относящихся к голоэнзиму РНК-полимеразы II). Эти участки ДНК называют регуляторными цис-элементами, а связывающиеся с ними белки — транс-факторами. Различают несколько классов транскрипционных факторов: одни обладают как ДНК- связывающими, так и белок-связывающими свойствами и через ДНК-связывающие домены вступают в специфическое взаимодействие с соответствующими последовательностями цис-элементов промотора, в то время как с помощью своих белок- связывающих доменов они связывают другие транскрипционные факторы или компоненты голоэнзима РНК-полимеразы II; другие вступают в белок-белковое взаимодействие и обозначаются как медиаторы или коактиваторы; третья группа транскрипционных факторов обладает свойством изменять конформацию ДНК (см. рис. 7.10). Образование состоящей из многих белковых субъединиц энхансеосомы создает многочисленные и тонкие возможности регуляции активности генов (см. 7.2.2.3).
3. Ассоциация с ДНК-зависимой РНК- полимеразой II. Энхансеосома образует вместе с другими медиаторными белками и платформой на основном промоторе структуру, с которой связывается голоэнзим РНК-полимеразы II. Голоэнзим состоит из собственно ДНК-зависимой РНК- полимеразы II (состоящей у дрожжей из 14 субъединиц) и других общих транскрипционных факторов (ТFIIА, В, Е, F, Н), а также многочисленных медиаторных белков. Таким образом, комплекс инициации транскрипции полностью собран.
Транскрипция начинается с локального разделения цепей ДНК в области точки начала транскрипции. Этот процесс может быть облегчен благодаря общему транскрипционному фактору ТFIIН, который обладает ДНК-расплетающей геликазной активностью. Образуется так называемый «открытый промоторный комплекс». ТFIIН обладает дополнительно киназной активностью и фосфорилирует аминокислотные остатки на С-конце РНК-полимеразы II. Фосфорилированный фермент начинает теперь синтез мРНК, покидает (впоследствии распадающийся) комплекс инициации и перемещается вдоль матричной цепи в направлении 3' —> 5' при синтезе мРНК
в направлении 5' —> 3' с последовательностью оснований, комплементарной матричной цепи. Цепь ДНК, идентичная по последовательности образовавшейся мРНК (с той особенностью, что вместо тимина (Т) в ДНК стоит урацил (U) в мРНК, см. 1.2.4), называется кодирующей цепью. По определению, данные о последовательности для промоторных элементов и генов всегда приводятся для кодирующей цепи в направлении 5' —> 3' (рис. 7.11).
Рис. 7.11. Фаза элонгации синтеза мРНК (А — по L.Stryer, с изменениями): А — ДНК-зависимая РНК-полимераза II локально расплавляет двойную спираль ДНК, расплетая ее, и в области транскрипционной петли синтезирует в 5' —> З'-направлении мРНК с последовательностью оснований, комплементарной матричной цепи и идентичной кодирующей цепи, причем вместо Т в ДНК в мРНК встраивается U (см. рис. 1.3; 1.4). В области транскрипционной петли образуется гибридная спираль ДНК-РНК, включающая около 10 — 12 п.н., в которой участвует матричная цепь, комплементарная мРНК. В случае приведенной последовательности нуклеотидов речь идет о кодоне метионина (AUG, см. табл. 7.3), который благодаря своему окружению (5' -ААСА AUG GC-3’) оказывается точкой начала трансляции. Эти и подобные последовательности в области инициаторного кодона трансляции называются последовательностями Козака; В — процесс синтеза мРНК
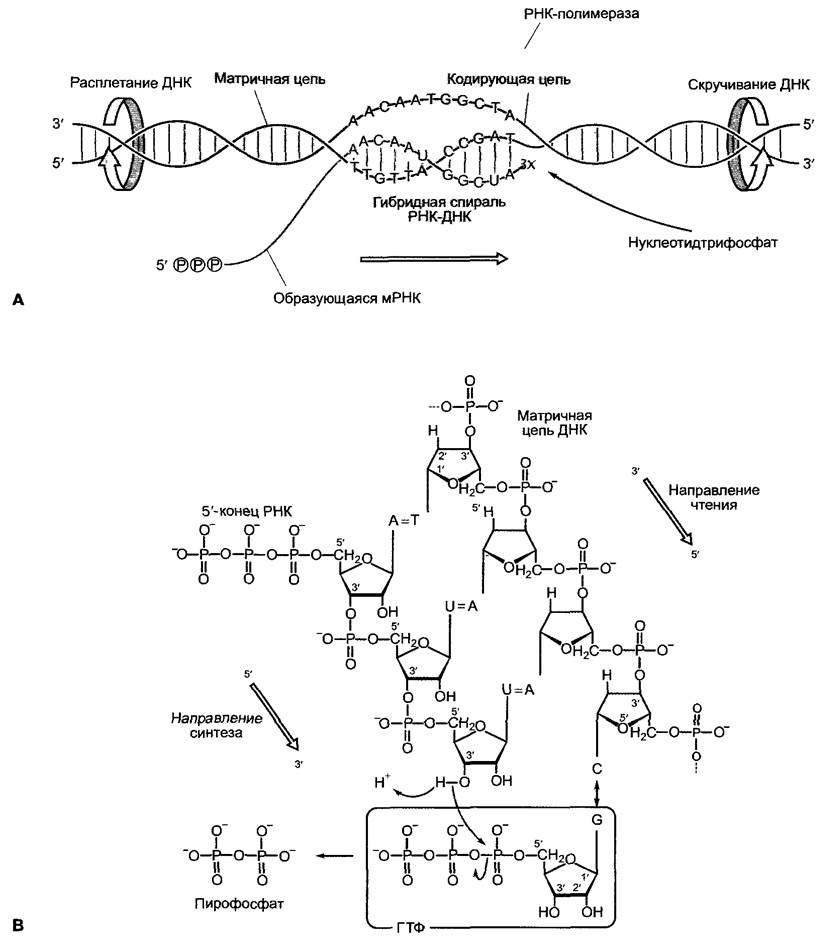
Анализ тонкой структуры интерфазных ядер с помощью антител к белковым компонентам аппарата транскрипции (например, антитела к РНК-полимеразе II) показали, что транскрипционная активность в клеточном ядре распределена не равномерно, а усиленно проявляется в определенных участках. В этих областях, условно названных «фабриками транскрипции», должны образовываться комплексы инициации транскрипции и оставаться полимеразы во время транскрипции, предположительно при связывании с матриксом ядра. Согласно этому представлению, фермент не «бегал» бы вдоль ДНК, а при одновременной полимеризации РНК «продевал» бы ДНК «в ушко». Сходным образом должна проводиться и репликация ДНК закрепленными ферментами («фабриками репликации»), в то время как молекула ДНК движется.
Если у бактерий транскрибированная мРНК получается непосредственно в зрелой форме и даже связывание рибосом и трансляция, т.е. синтез белка, начинаются уже во время идущей транскрипции на образующейся мРНК, транскрипция эукариотических генов дает сначала первичные транскрипты (обозначаемые вместе как гетерогенная ядерная РНК, гяРНК), которые далее процессируются в клеточном ядре. Процессинг включает:
✵ образование кэпа (англ, cap) на 5'-конце мРНК (англ. capping);
✵ удаление нитроновв процессе, который называется сплайсингом (англ. splicing);
✵ добавление полиА-хвоста к 3'-концу подавляющего большинства мРНК.
Процессированная зрелая мРНК покидает клеточное ядро через ядерные поры и транслируется в цитоплазме (см. 7.3.1.2).
Реакции процессинга протекают ко- транскрипционно, т. е. уже во время элонгации РНК-полимеразой II первичного транскрипта.
Структура кэпа образуется, как только PH К-полимераза покидает 5'-конец образовавшейся РНК. Гуанилилтрансфераза переносит ГМФ-остаток от ГТФ на концевую трифосфатную структуру РНК при отщеплении у-фосфатного остатка и образовании 5'-5'-трифосфатного мостика (рис. 7.12). Гуанинметилтрансфераза метилирует далее атом азота 7 присоединенного гуанина. Эта основная структура может быть модифицирована дальнейшим метилированием (по первому основанию РНК, к которому был присоединен остаток ГМФ, а также по 2'-ОН-группе рибоз первого и/ или второго основания РНК). Предполагается, что кэп важен как для экспорта зрелой мРНК из клеточного ядра, так и для инициации трансляции (см. 7.3.1.2) и, при известных условиях, для повышения стабильности мРНК.
Рис. 7.12. Образование 5’-структуры кэпа у первичного транскрипта кодируемых ядром генов. Синтез протекает котранскрипционно, как только 5’-конец синтезируемой мРНК освобождается от РНК-полимеразы. N1, N2 — любые нуклеотиды; р — фосфат (этот способ записи отличается от традиционного для биохимии, но широко употребляется для нуклеиновых кислот)
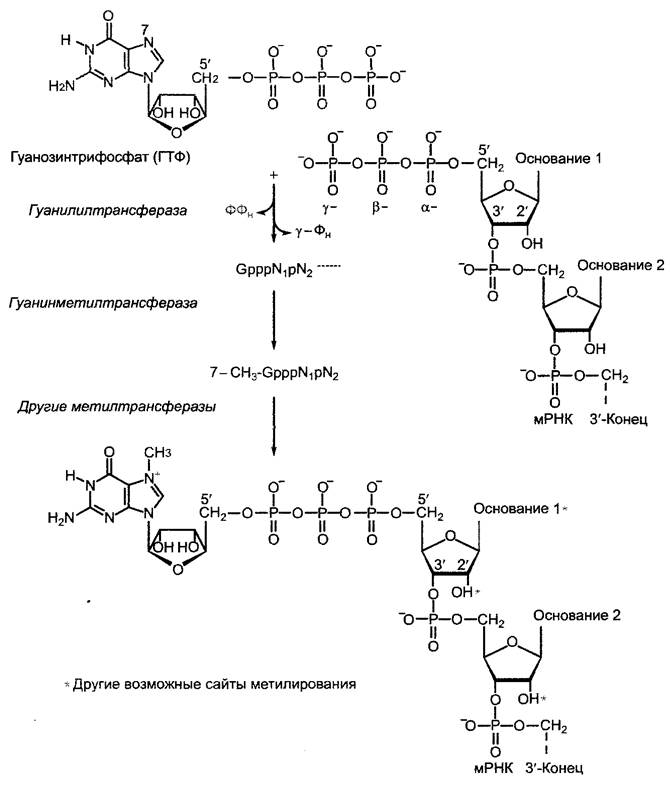
Удаление интронов, которое из соображений экономии места здесь не рассматривается подробнее, происходит очень точно по местам сплайсинга, которые характеризуются консервативными последовательностями (т.е. последовательностями, которые почти у всех генов идентичны)1. Границы интронов почти всех ядерных генов, кодирующих белки, определяются последовательностью оснований:
![]()
(стрелки указывают места сплайсинга). Состав оснований интронов, в целом, обогащен АТ-парами по сравнению с экзонами, следовательно, двойная спираль ДНК
в области интронов может быть легче «расплавлена». В процессе сплайсинга наряду с белковыми факторами участвуют несколько малых ядерных РНК (англ, small nuclear RNAs, snRNAs).
1 Такие последовательности принято называть консенсусами. — Примеч. ред.
Интроны генов рРНК или соответственно тРНК, а также интроны в пластоме и хондриоме, имеют другие структуры и другие механизмы сплайсинга. Так, некоторые из этих интронов вырезаются из РНК самостоятельно (автосплайсинг: они автокаталитически действуют на собственный процесс сплайсинга). Энзиматически активные рибонуклеиновые кислоты называют рибозимами. Предполагают, что рибозимы являются атавизмом «PHК-мира» — очень ранней стадии эволюции жизни, химизм которой был основан преимущественно на реакциях рибонуклеиновых кислот. Также пептидилтрансферазная активность при образовании пептидных связей входе синтеза белков (см. 7.3.1.2), согласно сегодняшним представлениям, катализируется рибозимом, 23S-pPHK большой субъединицы 70S-рибосомы (или соответственно 28S-pPHK у 80S-рибосом, см. 2.2.4).
Полиаденилирование З'-конца мРНК, типичное для эукариотических мРНК (но иногда отсутствующее), связано с терминацией транскрипции этих генов и катализируется независимой от матричной цепи РНК-полимеразой, поли(А)-полимеразой. Реакции предшествует гидролиз мРНК вблизи конца транскрипции, который дает новый З'-конец, к которому присоединяется поли (А)-хвост (последовательное добавление АМФ от АТФ, до нескольких сотен остатков). Место процессинга часто, но не всегда, отмечено короткой последовательностью РНК, которая, однако, у растений может быть довольно вариабельной. Помимо участия в терминации транскрипции полиаденилирование также, по-видимому, оказывает влияние на стабильность мРНК. Является ли оно столь же значимым для инициации трансляции, как предполагали ранее, еще предстоит выяснить.
Крайне редко у кодируемых ядром мРНК, иногда у пластидных мРНК и чаще всего у митохондриальных мРНК последовательность оснований в определенных участках изменяется постгранскрипционно. Этот процесс называется редактированием РНК. При этом цитозины заменяются урацилом (и реже, наоборот, урацил заменяется цитозином), и только так получается правильная мРНК-матрица для трансляции. Редактирование митохондриальных РНК у водорослей и мхов пока не обнаружено, оно типично для кормофитов (папоротникообразных, покрытосеменных и голосеменных). О механизмах редактирования известно мало. Посттранскрипционно происходит также образование редких оснований в рРНК и особенно в тРНК (см. рис. 1.10).
От инициации транскрипции гена до образования зрелой мРНК может пройти несколько минут. При средней активности РНК-полимеразы II -2 000 оснований в минуту одна только элонгация мРНК у гена средней величины (3,5 — 5 тыс. п.н.) продолжается ~ 2 — 3 мин.
Транскрипция пластидных генов осуществляется двумя ДНК-зависимыми РНК-полиме- разами, одним кодируемым пластидами ферментом, который по строению обладает большим сходством с бактериальной РНК-полимеразой и может образовывать комплексы с различными промоторспецифичными сигма-факторами (все они кодируются ядром), и одной кодируемой ядром РНК-полимеразой, устроенной иначе; по строению она имеет сходство с обеими РНК-полимеразами митохондрий, также кодируемыми ядром. Этот второй тип полимеразы обладает сходством с РНК-полимеразами бактериофагов; он отличается, предположительно, очень высокой скоростью синтеза и используется в пластидах для синтеза более длинных транскриптов. Возможно, что еще до вступления в эндосимбиоз (эндосимбиотическая теория, см. 2.4) прокариотические предки хлоропластов и митохондрий были инфицированы фагами. С помощью антибиотиков и токсинов можно сильно подавить процессы транскрипции. Так, рифамицины из Streptomyces (или соответственно полусинтетическое производное рифампицин) подавляют инициацию синтеза РНК путем ингибирования прокариотической, но не эукариотической РНК-полимеразы. Актиномицин D из другого штамма Streptomyces подавляет транскрипцию в про- и эукариотах путем связывания с двойными цепями ДНК, которые из-за этого больше не могут использоваться в качестве матрицы для синтеза РНК. Грибной токсин α-аманитин из Amanita phalloïdes сильно подавляет ДНК-зависимую РНК-полимеразу II (слабо — РНК-полимеразу III, совсем не подавляет РНК-полимеразу I) и блокирует, таким образом, фазу элонгации синтеза мРНК, в первую очередь ядерных генов, кодирующих белки.
Концентрация определенной мРНК в клетке зависит не только от частоты инициации транскрипции на соответствующем промоторе и эффективности процессирования, но также от стабильности мРНК в клетке, т.е. от дальнейшего метаболизма молекулы, причем биологический период полураспада (время, которое требуется при остановке синтеза для распада 50 % молекул) может составлять от нескольких минут до нескольких лет (мРНК в семенах). О распаде растительных мРНК известно очень мало. Он, по-видимому, часто, как у других эукариот, начинается с удаления поли(А)-хвоста и 5'-кэпа и катализируется 5'-экзонуклеазами, энзимами, которые гидролитически высвобождают мононуклеотиды с 5'-конца. Есть данные о том, что распад мРНК может регулироваться, однако конкретные механизмы регуляции еще не изучены.
7.2.2.3. Контроль транскрипции
Хотя на пути от гена к белку присутствуют множественные точки контроля биосинтеза (см. рис. 7.9), которые в целом определяют количество соответствующего белка в клетке, лежащая в основе процессов развития дифференциальная активность генов в значительной степени регулируется через процесс инициации транскрипции. Здесь определяется, какие гены вообще транскрибируются и в каком объеме. Сюда же относятся регуляторные механизмы, затрагивающие ген, которые касаются структуры хроматина (7.2.2.2). Контроль активности отдельных генов осуществляется в основном через образование энхансеосом (см. рис. 7.10). Для этого, с одной стороны, важны соответствующие цис- элементы и их комбинация в области промотора, кроме того, часто необходимы дополнительные энхансеры и сайленсеры (см. рис. 7.8; 7.10) и, с другой стороны, имеющиеся в определенной клетке (или соответственно образующиеся в зависимости от потребности) транскрипционные факторы и состояние их активности. Ядерный геном Arabidopsis thaliana(см. бокс 7.1) содержит более 1700 генов, которые кодируют различные транскрипционные факторы; это более 5 % всех генов. Как транскрипция генов для образования определенных регуляторных траскрипционных факторов, так и состояние активности этих белков контролируются эндогенными и экзогенными факторами. Таким образом, часто проходят многоступенчатые каскады процессов регуляции генов. В пространстве и во времени высокоспецифичный набор активностей регуляторных генов транскрипции способствует в конце процесса регуляции дифференцированному управлению активностями многих клеточных генов, которые кодируют структурные белки и ферменты, осуществляющие в конце концов фенотипическое выражение признаков при развитии организма.
Так, известны реагирующие на гормоны цис-элементы, с которыми при воздействии фитогормона на клетку связываются специфичные активирующие транскрипцию белки или реагирующие на свет цис-элементы, которые способствуют регуляции светом определенных генов (см. рис. 7.86). Индукция образования de novo энзимов через субстраты (пример: нитрат-редуктаза, индуктор: нитрат) или репрессия образования de novo ферментов через продукты (пример: репрессия нитратредуктазы ионами аммония и глутамином, глутаминсинтетазы глутамином) уже были упомянуты в главе, посвященной физиологии обмена веществ; это примеры метаболитного контроля транскрипции. Такие процессы хорошо изучены у прокариот (см. учебники по микробиологии). Однако многие молекулярные процессы контроля транскрипции у эукариот и особенно у высших растений еще неизвестны.
Наряду со специфичными цис-элементами и соответствующими транскрипционными факторами в промоторах генов, способных к регуляции, находятся также цис-элементы, которые имеются во многих различных генах и с которыми связываются соответственно широко распространенные транскрипционные факторы. Это ведет к общей, но не селективной активации транскрипции этих генов, которые только благодаря образованию комплексов со специфичными цис-элементами и их транскрипционными факторами селективно регулируются. Два хорошо охарактеризованных цис-элемента, которые имеются в промоторах многочисленных регулируемых генов в типичной или измененной форме, это G-бокс(5'-CACGTG-3') и GT-1-бокс (5'-GGTTAA-3'), соответствующие связывающие белки которых были выделены и охарактеризоны. Благодаря ген- специфичной комбинации основного промотора с общими регуляторными цис-элементами и придающими специфичность цис-элементами возможен чрезвычайно разнообразный контроль экспрессии генов. Спектр возможностей повышается в результате эволюции семейств генов, члены которых благодаря комбинации с соответствующим собственным промотором могут транскрибироваться и подвергаться действию различных регуляторных факторов. Так, геном табака содержит 9 генов АТФазы Р-типа, служащей для создания протон-движущей силы на плазмалемме (см. 6.1.4.3, рис. 6.4). Каждый из этих генов контролируется собственным промотором, отличающимся по строению от других.
Гены, кодирующие области которых обнаруживают значительное сходство последовательности нуклеотидов, называются гомологичными. Гомологичные гены ортологичны, если они найдены у различных организмов и происходят от общего предка1, и паралогичны. если возникли внутри генома благодаря генной дупликации (дупликациям).
1 Иногда в определение ортологичных генов добавляют требование, чтобы они выполняли одну и ту же функцию. — Примеч. ред.
В отличие от прокариот, ДНК-зависимая РНК-полимераза которых напрямую и очень прочно связывается со своими промоторами, ДНК-зависимая РНК-полимераза II эукариот связывается с основным промотором лишь очень слабо. Поэтому «базовая активность» бактериального промотора очень высокая, эукариотического промотора — очень низкая. Вследствие этого механизмы репрессии для снижения активности генов у прокариот широко распространены, тогда как у эукариот они скорее редки. У эукариот механизмы инициации транскрипции оказывают влияние преимущественно путем повышения выхода инициации при использовании активаторов транскрипции.