БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
9. АЛЛЕЛОФИЗИОЛОГИЯ
9.2. Симбиоз
Наряду с тремя широко распространенными симбиозами — азотфиксирующими симбиозами (см. 9.2.1), микоризой (см. 9.2.3) и лишайниками (см. 9.2.4) — были найдены многочисленные другие живые сообщества симбиотического характера. Эндосимбиоз характеризуется тем, что один из партнеров полностью или частично проникает в клетки другого. В этом случае проникающая структура остается окруженной мембраной хозяина, которая отходит от плазмалеммы и называется симбиосомной мембраной. Она важна для обмена веществ между обоими партнерами, но обеспечивает также подавление защитных реакций хозяина против «иммигранта». Паразитические фитопатогенные грибы (например, облигатный биотрофный оомицет Реrоnоsрога или мучнисто-росяный гриб Еrysiphe graminis) проникают в клетки организма- хозяина специализированными гифами — гаусториями (см. 9.3.2), причем гаустории также окружены клеточной мембраной хозяина, которая имеет все признаки симбиосомной мембраны. Здесь также отчетливо видны тесные структурные и функциональные связи между паразитизмом и симбиозом.
Достойны внимания симбиозы между водорослями и беспозвоночными. Так, в каждой клетке гастродермы Chlorohydra viridissima находится по 15 — 25 клеток Chlorella (на один организм Chlorohydra в общей сложности приходится 1,5 • 105 клеток водоросли), в одной клетке Раramaecium hursaria — около 1 000 клеток хлореллы. Они окружены вакуолярной мембраной клетки хозяина и отдают около 30 — 40 % своих продуктов фотосинтеза животному, вероятно, в форме глюкозы и мальтозы. Также обилен экспорт фотоассимилятов из симбиотических динофлагеллят в морских беспозвоночных, например, в коралл Pocillopora damaecomis и актинию Anthopleura elegantissima (в этом случае экспортируются глицерин и органические кислоты). Скелетообразующая известь коралла — продукт симбиоза. Кораллы часто «дают приют» цианобактериям, которые способны к связыванию молекулярного азота (см. 9.2.1). У некоторых кишечнополостных поставляемое симбиозом питание столь обильно, что рот полипа полностью редуцируется. У морского плоского червя Convoluta roscoffensis личинки должны «захватывать» зеленые водоросли (Platymonas convoluta), если они хотят дорасти до зрелости. Водоросль образует в качестве главного продукта фотосинтеза маннит, но экспортирует в животного хозяина, вероятно, главным образом аминокислоты, амиды, жирные кислоты и стероиды, в то время как сама водоросль получает от него мочевую кислоту. Веслоногий рачок (Acanthocyclops vernaiis) может пропускать усвоенные водоросли через свой кишечный тракт непереваренными. Они при этом еще могут фотосинтезировать и обеспечивать хозяина O2 и, возможно, также продуктами фотосинтеза.
Особенно примечателен симбионт образующей колонии асцидии Didemnum: речь идет об одноклеточной водоросли с прокариотической структурой клетки, но с хлорофиллами а и b,которую относят к самостоятельному отделу Prochioroplyta (см. 11.2).
В некоторых случаях животные клетки получают от водорослей только хлоропласта и, кроме того, они (по крайней мере определенное время) могут быть фотосинтетически активными. Это характерно, например, для клеток, находящихся вблизи пищеварительного тракта некоторых видов прозрачных морских моллюсков, которые содержат хлоропласта кормовых водорослей (сифоновые зеленые водоросли). Elysia viridis с хлоропластами Codium достигает продуктивности фотосинтеза (в пересчете на 1 мг хлорофилла), сопоставимой с продуктивностью свободно живущей водоросли Codium fragile. Эти сохранившиеся до нашего времени симбиозы с водорослями и хлоропластами (пока еще мало что известно об их пользе для водорослей), рассматриваются как возможные модели симбиотического возникновения эукариотической клетки (см. 2.4).
9.2.1. Симбиотическая фиксация атмосферного азота
Способность восстанавливать азот воздуха (N2) до аммиака (NH3) (фиксация азота) найдена у ряда прокариот из группы эубактерий и цианобактерий и связана с наличием фермента нитрогепазы (см. ниже). Биологическая фиксация азота заменяет исчезающий ежегодно из-за денитрификации азот биосферы (см. табл. 6.21; рис. 6.87), поэтому она является неотъемлемым элементом в глобальном круговороте азота. Свободноживущие азотфиксаторы связывают 15 — 20 кг азота/га в год. Симбиотическая фиксация азота продуктивнее: она приносит азота до 50 — 200 кг/га в год (симбиоз Anabaena-Azolla, например, — до 95 кг/га в год, симбиоз Frankia-Alms — до 200, симбиоз Rhizobium-бобовые — до 55 — 140 кг азота/га в год).
Некоторые азотфиксирующие бактерии живут исключительно свободно (например, Azotobacter vinelandii, Clostridium pasteurianum и Rhodospirillum rubrum), другие существуют ассоциированно (например, Klebsiella pneumoniae с растениями, животными и даже человеком) или в симбиозе, с животными, неспособными к фиксации азота (например, Citrobacterfreundii, см. ниже), либо с растениями (например, виды Rhizobium, см. ниже), хотя могут встречаться и свободноживущими, однако в этом состоянии они фиксируют меньше азота или не фиксируют его совсем.
Азотфиксация распространена у Hormogonеае — свободноживуших цианобактерий, образующих гетероцисты (например, виды родов Anabaena, Anabaenopsis, Cylindrospermum, Nostoc, Aulosira, Calot hrix, Tolypothrix, Trichodesmiutn и Mastigocladus); она происходит именно в гетероцистах. Некоторые Hormogoneae, не образу
ющие гетероцисты (см. 11.2, рис. 11.15), фиксируют N2лишь в анаэробных или соответственно микроаэробных условиях, у одноклеточных цианобактерий это встречается лишь в отдельных случаях (Gloeocapsa). В симбиотических ассоциациях цианобактерии живут с грибами, диатомовыми водорослями, мхами, папоротникообразными, голосеменными и покрытосеменными, а также с простейшими и многоклеточными животными. Цианобактерии (речь идет, прежде всего, о родах порядка Nostocales, особенно видах родов Nostoc, Anabaena, Calothrix и Scytonema) заселяют при этом структуры своих хозяев, которые образуются и без присутствия симбионтов. Осуществление симбиоза в значительной мере управляется хозяевами, по-видимому, через выделяемые вещества пока неизвестной химической природы.
Так, Geosiphon pyriforme, родственный с родом Glomus (низший гриб), который своим мицелием пронизывает верхние слои почвы и там образует пузырьки величиной ~1 мм (рис. 9.3), фагоцитирует из среды цианобактерии (Nostoc punctiforme). Они окружаются в цитоплазме симбиосомной мембраной клетки-хозяина и действуют подобно пластидам, которые обеспечивают хозяина продуктами фотосинтеза и восстановленными соединениями азота.
Рис. 9.3. Geosiphon pyriforme, мицелий с двумя более старыми и несколькими молодыми пузырьками, которые содержат эндосимбионты Nostoc. Фрагмент: микрофотография конфокального лазерного сканирования молодого пузырька Geosiphon через 5 дней после внедрения эндосимбионтов (на рисунке Nostoc имеет более светлый оттенок, Geosiphonимеет более темные клетки)

Эндосимбиотическую природу имеют также ассоциации цианобактерий и диатомовых водорослей, например, бентосного вида Rhopalodia gibba и морских планктонных видов (например, родов Rhizosolenia и Hemiaulus). Поэтому указанные диатомовые водоросли в культуре не нуждаются в источнике азота в среде.
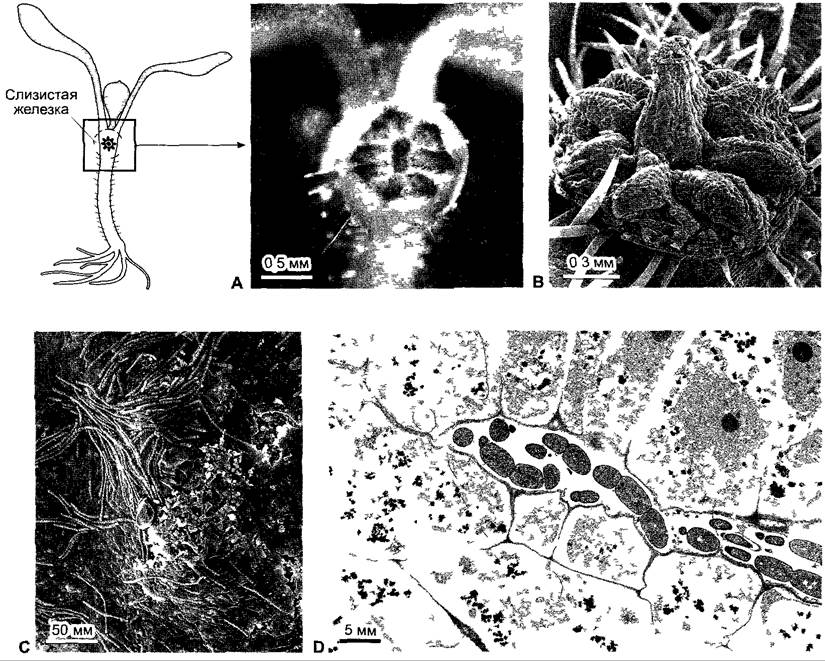
Внутриклеточно (или также окруженные симбиосомной мембраной) цианобактерии-симбионты (Nostoc) находятся также в богатых слизью железках тропических видов Gunnera(Gunneraceae), образующихся у основания черешка листа (рис. 9.4). Симбионты перемещаются в стадии гормогопиев, способных к медленным движениям и размножению нитей из клеток (см. 11.2). Вероятно, привлеченные факторами хозяина, т.е. с использованием хемотаксиса (см. 8.2.1.1), клетки цианобактерий попадают по каналам в слизистые железки и у основания железистых каналов путем фагоцитоза усваиваются железистыми клетками, стенки которых частично растворены. Там Nostос-симбионты усиленно образуют азотфиксирующие гетероцисты.
Рис. 9.4. Симбиоз между Gunnera и Nostoc. А В — одна из двух железок на гипокотиле проростка Gunnera расположенных в крестообразной позиции относительно семядолей и секретирующих слизь С — гормогонии на поверхности железки D — продольный срез через железку с гормогониями Nostoc в железистом ходе, который выложен выделяющими слизь клетками
Во всех остальных случаях симбиотические цианобактерии остаются в своих хозяевах внеклеточно, как, например, Anabaеnа azollае, которая находится в межклеточном пространстве листьев водного папоротника Аzolla и попадает туда через апикальную меристему, т.е. имеется уже во время развития листа; в коралловидных корнях видов рода Масrozamiа семейства саговниковые (Nostoc); в наполненных слизью полостях гаметофитов (но не спорофитов) антоцеротовых мхов (например. Аnthoceros рunctatus, виды Nostoс,рис. 9.5) и печеночников (например, Вlasic рulsilla, виды Nostoс). Талломы Аnthoceros рunctatus выделяют фактор, индуцирующий образование гормогониев, и одновременно привлекают эти подвижные нити делящихся клеток путем хемотаксиса. Проникнувшие цианобактерии, по-видимому, также под контролем растения-хозяина, интенсивно образуют гетероцисты, которые предоставляют в распоряжение растения-хозяина
фиксированный азот большей частью в виде аммиака (NH3). В этом состоянии фотосинтетическая фиксация СO2 цианобактериями сильно подавлена, так что симбионты в обеспечении органическими соединениями (включая аминокислоты!) зависят от растения-хозяина и растут очень медленно. Поэтому польза, которую цианобактерии извлекают из такого симбиоза, едва ли в их присутствии in planta. Она могла бы касаться скорее свободно живущих клеток вблизи (на поверхности) растений-хозяев, которых побуждают к образованию гормогониев и предположительно стимулируют синтез веществ, выделяемых растениями-хозяевами.
Рис. 9.5. Симбиоз Anthoceros Nostoc. А — внешний вид слоевищ Anthoceros punctatus Каждый гаметофит образует стеблеподобныи спорофит В — нижняя сторона гаметофита с темными на фото колониями Nostoc
Известны симбиозы азотфиксирующих бактерий с животными (и с человеком) и покрытосеменными растениями. Так, термиты «дают приют» азотфиксирующим
бактериям в кишечнике (Citrobacter freimdu, Enterobacter agglomerans) и таким образом дополняют свою бедную азотом диету Кишечная флора папуасов (уроженцев Новой Гвинеи) также содержит азотфиксирующие бактерии. Несмотря на однообразное питание, (главным образом это бедный белком батат), папуасы не испытывают недостатка в аминокислотах.
В отличие от цианобактериальных симбиозов существующие у растений азотфиксирующие симбиозы с бактериями связаны с образованием специальных симбиотических структур — корневых клубеньков. Они имеются, например, у ольхи и содержат стрептомицеты Frankia alni. Более 140 других видов из 9 семейств образуют азотфиксирующие корневые клубеньки с актиномицетами в качестве партнера по симбиозу (табл 9.1). Фиксация эффективна и составляет у видов Aînus 50 — 200 кг азота/га в год Однако особенно распространены и хорошо изучены важные для сельского хозяйства корневые клубеньки у представителей Fabales (бобовые), которые представляют собой проявление симбиоза с азот- фиксирующими бактериями очень близко родственных родов Rhizobium, Bradyrhizo- bium, Azorhizobium, Mesorhizobium и Sinorhizo- bium Из семейства Fabaceae корневыми клубеньками обеспечены Caesalpmioideae — менее половины, Mimosoideae — преимущественно, Faboideae — почти все исследованные роды. Бобовые относятся к первым культурным растениям каменного века и до сих пор являются важнейшими куль турными растениями после Роасеае. Их свойство улучшать почву было известно уже в античности (Теофраст, IV в до н. э.).
Таблица 9.1 Роды, включающие виды с корневыми клубеньками, содержащими актиномицеты
Род |
Семейство |
Casuanna |
Casuannaceae |
Муriса |
Myncaceae |
Comptonia |
Myncaceae |
Ainus |
Betulaceae |
Dryas |
Rosaceae |
Cercocarpus |
Rosaceae |
Chamaebatia |
Rosaceae |
Cowania |
Rosaceae |
Purshia |
Rosaceae |
Rubus |
Rosaceae |
Conaria |
Coriariaceae |
Ceanothus |
Rhamaaceae |
Colîetia |
Rhamnaceae |
Discaria |
Rhamnaceae |
Retamila |
Rhamnaceae |
Talguenea |
Rhamnaceae |
Trevoa |
Rhamnaceae |
Eîaeagnus |
Eleagnaceae |
Eippophae |
Eleagnaceae |
Shepherdia |
Eleagnaceae |
Paraspoma |
Ulmaceae |
Daiisca |
Datiscaceae |
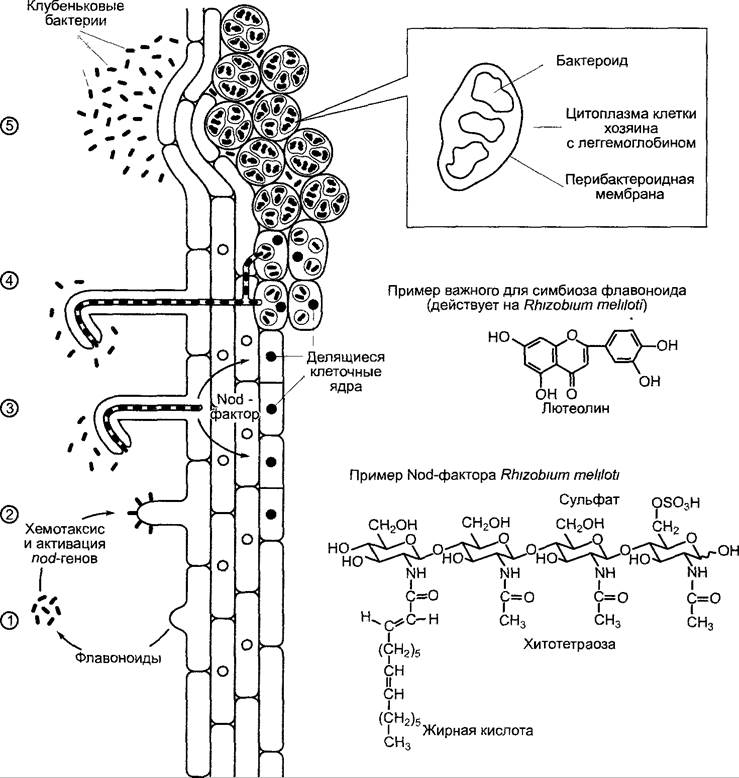
Клубеньковые бактерии широко распространены в почве. Вблизи растения-хозяина они перемещаются путем хемотак сиса к поверхности корня. Веществами, привлекающими бактерии, являются флавопоиды (см 6 16 1). У Rhizobium mehloti, например положительный хемотаксис вызывает лютеолин (рис 9 6) Бактерии прикрепляются к кончикам молодых корневых волосков, причем контакт создается с помощью растительных лектинов (белков, связывающих углеводы см 6 17 4), которые соединяются с поверхностными структурами бактерий Связывание вызывает сгибание корневого волоска и образование инфекционной нити (ее можно рассматривать как обратный, обращенный вовнутрь, рост кончика корневого волоска), которая выстлана клеточной стенкой и растет через корневой волосок вовнутрь В инфекционной нити находятся клубеньковые бактерии. Она прорастает несколько слоев клеток паренхимы коры до образующегося между тем клубенькового примордия,
который закладывается из внешних или расположенных дальше внутрь (см. ниже) клеток паренхимы коры над протоксилемными тяжами, в то время как уже обособленные паренхимные клетки заново вступают в клеточный цикл (см. 7.3.2), и происходит полиплоидизация. Возобновление активных делений полиплоидных клеток индуцируется Nod-факторами, выделяемыми клубеньковыми бактериями (Nod — нодуляция, образование клубеньков). При этом речь идет о липохитоолигосахаридах (см. рис. 9.6), основа которых состоит из 3 — 5 молекул N-ацетилглюкозамина, соединенных, как в хитине, (β1 —> 4)-гликозидной связью. Этот олигосахарид несет также ряд других характерных заместителей. Биосинтез Nod-фактора в клетках ри- зобиев индуцируют также флавоноиды растений-хозяев. Необходимые для этого ферменты биосинтеза кодируются nod-генами, которые чаще расположены в важной для установления симбиоза Sym-плазмиде. Структура Nod-факторов определяет спектр хозяев бактерий и регулирует образование клубеньковых примордиев из внешних или внутренних областей паренхимы коры. Так, Nod-фактор для индуцирующего действия на люцерне должен в положении С-6 остатка N-ацетилглюкозамина на восстановленном конце нести сложный сульфатный эфир (см. рис. 9.6). Для биологической активности имеет значение также наличие средне- и длинноцепочечных (часто редких) жирных кислот на месте ацетильного остатка в первом звене глюкозамина. Nod- факторы, которые несут полиненасыщенные жирные кислоты, диффундируют глубже в паренхиму коры и влияют на образование недетерминированных клубеньков, развивающих собственную меристему на кончике и постоянно растущих дальше (например, у гороха, люцерны). Nod-факторы с насыщенными жирными кислотами диффундируют в паренхиму коры менее глубоко и определяют образование детерминированных клубеньков без собственной меристемы, которые чаще всего через несколько недель перестают функционировать и затем поглощаются растением (например, у фасоли, сои). Клубеньковые бактерии с узким спектром хозяев синтезируют лишь один или несколько Nod-факторов с широким спектром многих различных хозяев. Благодаря генно-инженерной комбинации генов Nod-факторов можно целенаправленно получить клубеньковые бактерии с измененным спектром хозяев.
Рис. 9.6. Схема этапов формирования симбиоза Rhizobium с бобовыми. (1) — при недостатке азота корень выделяет флавоноиды. Они вызывают у живущих в почве жгутиковых палочковидных клубеньковых бактерий положительный хемотаксис и активируют гены нодуляции (nod-гены), (2) — клубеньковые бактерии прикрепляются с помощью растительных лектинов к кончику молодых корневых волосков, (3) — корневой волосок инвагинирует на кончике и образует инфекционную нить, в которой удерживаются и размножаются клубеньковые бактерии, выделяющие Nod-факторы. Их биосинтез осуществляется с помощью ферментов, которые кодируются несколькими из активированных nod-генов Nod-фактсры диффундируют в паренхиму коры и индуцируют клеточные деления. Образуется клубеньковый примордий, (4) — после того как инфекционная нить достигла клубенькового примордия, клубеньковые бактерии фагоцитируются этими клетками; (5) — при значительном увеличении объема клеток хозяина клубеньковые бактерии дифференцируются до бактероидов, причем они также (в десять раз) увеличиваются в объеме. Бактероиды больше не делятся и фиксируют N2. Если структуры Nod-фактора (фрагмент внизу), специфичные для нодуляции у люцерны, отсутствуют, подавляется индукция клубенькового примордия. Если отсутствует сульфатная группа, то Nod-фактор не действует на люцерне, но еще активен на Vicia или Pisum. Если отсутствует жирная кислота, фактор вообще не работает. Дальнейшие пояснения см в тексте
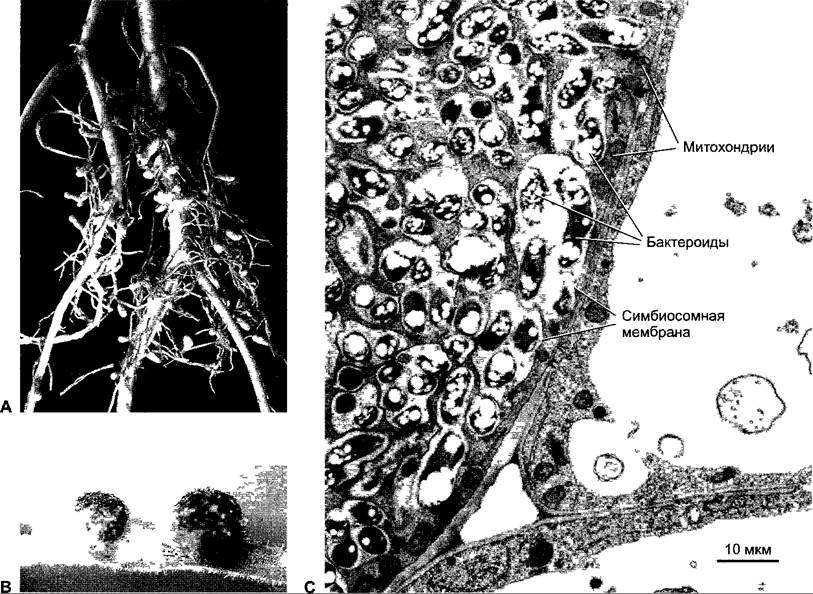
В клубеньковом примордии клеточные стенки полиплоидных клеток и инфекционной нити частично гидролизованы, и клубеньковые бактерии фагоцитируются растительными клетками, причем сначала ризобии еще размножаются при набухании растительных клеток. Клубеньковые бактерии в этот момент обильно выделяют ауксин. Наконец, форма клетки изменяется, клеточная стенка перестраивается, протопласт набухает, и ризобии переходят в так называемые бактероиды, которые больше не делятся и фиксируют азот. Для этого необходимы бактериальные гены nif- или fix-гены (англ. nitrogen fixation). Они кодируют среди прочего субъединицы фермента нитрогеназы (см. ниже). Бактероиды постоянно окружены растительной симбиосомной мембраной, которая обозначается так же, как перибактероидная мембрана. На одной везикуле мембраны может находиться несколько бактероидов, на 1 г ткани их приходится около 1011 — 1012. Перибактероидная мембрана с включенными в нее бактероидами и расположенным между ними пространством называется симбиосомой (рис. 9.7).
Рис. 9.7. Корневые клубеньки люцерны (А) и Lotuspresii (В). На электронно-микроскопической фотографии хозяйских клеток сои (С) видны симбиосомы, которые содержат образовавшиеся из клубеньковых бактерий бактероиды
Азотфиксирующие ткани внутри корневого клубенька можно распознать по их красной окраске. Она объясняется присутствием леггемоглобина, который образуется как совместный продукт партнеров по симбиозу (растение синтезирует миоглобин- подобный белок, бактероиды, по-видимому, образуют гем). Леггемоглобин связывает молекулярный кислород подобно гемоглобину позвоночных, но примерно в 10 раз активнее. Тем самым поддерживается низкое парциальное давление кислорода в месте азотфиксации, так как нитрогеназа очень чувствительна к кислороду и ее гены в присутствии слишком большого количества O2 репрессируются. Одновременно леггемоглобин эффективно поставляет кислород в бактериальную цепь дыхания, которая служит для синтеза АТФ Недетерминированные клубеньки постоянно образуют на кончике новые содержащие симбиосомы клетки, в то время как у основания клетки они отмирают Детерминированные клубеньки прекращают свою азотфиксацию через 4 — 6 недель. Растение поглощает из отмерших клеток ценные органические вещества (особенно, N-, S- и Р-содержащие соединения). Хотя при этом бактероиды гибнут, из отмерших клеток в почву высвобождается больше клубеньковых бактерий, чем вошло первоначально, кроме того, клубеньковые бактерии усиленно размножаются вблизи поверхности корня растения-хозяина, так что обоюдная польза процесса очевидна.
В почве, хорошо обеспеченной азотом (NO-3 или NH+4), корневые клубеньки образуются лишь в незначительном количестве. Однако при недостатке азота корень начинает выделять флавоноиды и закладываются многочисленные корневые клубеньки. Правда, более старые корневые клубеньки подавляют еще неизвестным способом образование новых клубеньков, так что и при недостатке азота число образовавшихся клубеньков увеличивается не бесконтрольно. Азотфиксации хватает, чтобы бобовые могли расти на почвах, очень бедных азотом, однако их рост не бывает максимальным. Поэтому сельскохозяйственные бобовые нужно удобрять дополнительно, хотя и в малых дозах. Бобовые возделывают также повсеместно в севообороте для улучшения почвы, а потом запахивают («зеленое удобрение»).
9.2.2. Биохимия и физиология азотфиксации
Перевод молекулярного азота в аммиак является экзергоническим процессом:
N2 + ЗН2 —> 2NН3 (∆G0' = -33,5 кДж/моль);
однако из-за высокой энергии активирования реакции он происходит лишь при очень высоком давлении и температурах 400 — 500 °С в присутствии катализатора — мягкого железа (способ Габера —Боша). Этот метод, используемый для производства искусственных удобрений, является одним из важнейших глобальных технологических синтезов (см. табл. 6.21).
Катализируемая нитрогеназой реакция также является очень энергозатратной:
N2 + 4НАДН + 4Н+ + 16АТФ —> 2NH3 + Н2 + 4НАД+ + 16АДФ + 16ФН.
Для реакции требуется 8 электронов, из которых 6 используется для восстановления N2 и 2 — для восстановления 2 Н+ до Н2 (побочная реакция, значение которой неясно)1. НАДН + Н+ и АТФ поставляются циклом Кребса и дыхательной цепью (см. 6.10.3). Электроны переходят от НАДН сначала на ферредоксин. Восстановленный ферредоксин является поставщиком электронов для нитрогеназы (рис. 9.8).
1 Существует гипотеза, согласно которой восстановление водорода происходит при недостатке молекулярного азота и является одной из побочных реакций, катализируемых нитрогеназой. Это свойство нитрогеназы предлагают использовать для получения водорода из воды с помощью цианобактерий в промышленных масштабах. — Примеч. ред.
Рис. 9.8. Обмен веществ симбиосом и хозяйских клеток в корневых клубеньках бобового растения. Стехиометрия дана только для нитрогеназной реакции. Дальнейшие объяснения см. в тексте

Нитрогеназа является сложно устроенным ферментным комплексом и состоит из 2 компонентов — собственно динитрогеназы и динитрогеназоредуктазы. Последняя представляет собой димер с единственным, образуемым обеими субъединицами, Ре484-центром (железосерные центры, см. рис. 6.56). Этот одноэлектронный переносчик берет от восстановленного ферредоксина один электрон и передает его дальше при связывании и гидролизе двух АТФ на динитрогеназу (последовательный
перенос 6 электронов на N2 требует, таким образом, 12 АТФ; облигатно связанное с этим восстановление 2Н+ —> Н2 требует 2 электронов и потребляет тем самым еще 4 АТФ).1
1 Соотношение между восстановленным N2 и полученным Н2 на самом деле не всегда эквимолярно. Оно меняется в зависимости от поступления азота из атмосферы. — Примеч. ред.
Нитрогеназа является тетрамерным комплексом с α2β2-структурой; субъединицы α и β очень похожи. Тетрамерный комплекс имеет два работающие независимо друг от друга каталитических центра. Каждый состоит из одного железомолибденового кофактора, связанного 4 субъединицами белка (FeMoCo). Железомолибденовый кофактор состоит из Fe4S3-кластера и Fe3MoS3-клacтepa. Вероятно, N2 связывается через 3 атома железа из каждого такого кластера и восстанавливается до 2NH3 без высвобождения промежуточных продуктов.
Нитрогеназа не является строго субстрат-специфичной и восстанавливает наряду с N2 и Н+ in vitro и другие субстраты (например, N2О —> N2 + Н2О; С2Н2 —> С2Н4). Восстановление ацетилена (С2Н2) до этилена (С2Н4) служит для определения активности нитрогеназы методом газовой хроматографии.
При недостатке молибдена некоторые азотфиксаторы (например, Azotobacter vinelandii) экспрессируют альтернативные нитрогеназы, содержащие ванадий или железо, к тому же они имеют другое строение.
Симбиосомы характеризуются активным обменом веществ через бактероидную и перибактероидную мембраны (рис. 9.8). Бактероиды экспортируют восстановленный азот преимущественно в форме ионов аммония (NH+4), так как они не могут производить глутаминсинтетазу и с ее помощью переводить аммиак в глутамин (образование глутамина см. на рис. 6.88). Ризобии получают аминокислоты для своего собственного синтеза белков от клеток- хозяев. Клетки корневого клубенька экспортируют излишек восстановленного азота преимущественно в форме аминокислот глутамина и аспарагина. Некоторые корневые клубеньки, например, у сои, сначала переводят азот из глутамина и аспарагина через биосинтез пуринов (см. 6.14) в инозинмонофосфат и далее через ксантин и мочевую кислоту образуют аллантоин и аллантоиновую кислоту, которые служат транспортными молекулами для азота. Экспорт из корневых клубеньков в растение-хозяина, как и поступление питательных веществ к клубенькам, происходит через проводящий пучок, который заложен по периферии клубеньков (экспорт идет через ксилему, импорт — через флоэму).
Бактероиды получают восстановленный углерод в форме малата, который клетки- хозяева образуют из импортированной сахарозы (через гликолитическое разложение гексоз до фосфоенолпирувата (см. 6.10.1), карбоксилирование фосфоенолпирувата до оксалоацетата ФЕП-карбоксилазой, имеющейся в корневых клубеньках в высокой концентрации (реакция, см. рис. 6.79), и восстановление оксалоацетата до малата). Окисление малата в цикле Кребса (см. рис. 6.94) поставляет НАДН+Н+ и ФАДН2. Часть НАДН и образовавшийся ФАДН2 вовлекаются через бактероидную дыхательную цепь в образование АТФ, часть НАДН служит для восстановления ферредоксина и поставляет электроны для нитрогеназного комплекса. Имеющийся в цитоплазме хозяйских клеток в высокой концентрации (-3 мМ) леггемоглобин (см. 9.2.1) эффективно связывает О2 и понижает тем самым концентрацию свободного кислорода настолько, что нитрогеназа не повреждается. Бактероидная цитохром- а/а3 -терминальная оксидаза (см. 6.10.3.3) обладает очень высоким сродством к кислороду; низкой концентрации кислорода хватает и для нужд дыхательной цепи, тем более что потребленный кислород быстро восполняется за счет О2-буферности леггемоглобина.
У свободно живущих азотфиксаторов для защиты чувствительной к кислороду нитрогеназы служат различные механизмы. Многие образуют фермент только в анаэробных или микроаэробных условиях. Облигатно аэробные азотфиксаторы (например, Azotobacter) имеют специальные защитные белки, которые связываются с нитрогеназой. Нитчатые цианобактерии образуют много гетероцист, в которых происходит азотфиксация. У них толстые, богатые липидами клеточные стенки, которые препятствуют вхождению О2 и не производят О2, так как фотосистема II отсутствует (см. 6.4.5).
Азотфиксация энергозатратна. Для корневых клубеньков характерно потребление 5 — 20 мг углеводов на 1 мг восстановленного азота. Выход фиксации составляет при этом 30 — 100 мг азота на грамм сырой массы клубеньков в день, т. е. один клубенек может ежедневно переработать азота примерно в 3 — 10 раз больше, чем содержится в нем самом.
Совместное существование корней и грибов в области ризосферы (особо значимый в природе симбиоз) называется микоризой. Такой симбиоз существовал уже в девоне, т. е. 400 млн лет назад. К образованию микоризы способны 90 % всех наземных растений и около 6 000 видов грибов (см. бокс 11.4).
В соответствии с формой строения различают типы микоризы.
Самой распространенной является везикулярно-арбускулярная (VА)-микориза. Она названа так по внутриклеточной форме грибных гиф в клетках коры, которые набухают до пузырьков (везикул) или образуют древовидные разветвления — арбускулы (рис. 9.9). В эпидермис, апикальную меристему и корневой чехлик VA-микориза и другие микоризные грибы не внедряются.
Рис. 9.9. Везикулярно-арбускулярная (VA)-миориза (А — с любезного разрешения S. Dickson; В — с любезного разрешения S. Smith): А — арбускулы Glomus coronatum в клетках корня Allium роггит (снимок сделан с помощью лазерного сканирующего микроскопа, растительные клеточные стенки не видны); В — везикулы Glomus mosseae в клетках корня Alliumроггит (ок. 45х)
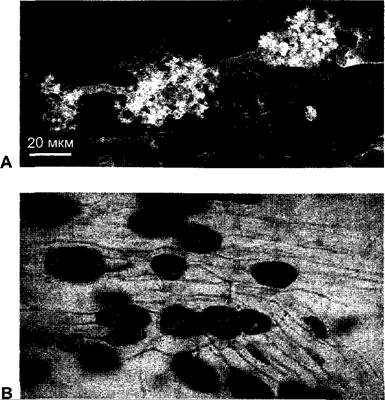
В случае VA-микоризы все грибные симбионты относятся к порядку Endogonales класса зигомицетов (см. 11.2), большей частью к роду Glomus; они облигатно симбионтны. В качестве партнера служат виды из почти всех семейств покрытосеменных. Не образуют VA-микоризу или она очень слабо развита, например, у представителей семейств Сурегасеае, Amaranthaceae и Brassicaceae. У деревьев в умеренной зоне образуется преимущественно эктотрофная микориза (см. ниже), но у тропических деревьев, насколько это исследовано, формируется большей частью VA-микориза. У голосеменных VA-микориза наблюдалась только у Taxus baccata, Sequoia sempervirens, S. gigantea и Ginkgo biloba.
В VA-микоризе гриб поставляет минеральные вещества (прежде всего фосфат и микроэлементы), причем значительно эффективнее, чем замененные им корневые волоски. Растительный партнер отдает прежде всего углеводы. Формирование VA-микоризы повышает, например, у культурных растений рост, причем наряду с лучшим обеспечением питательными веществами может также возникнуть повышенная устойчивость к патогенным грибам и нематодам. Усваивание растительных углеводов способствует повышению силы акцепторов («source-sink» — отношения, см. 6.8) грибного партнера в области корня. Это приводит к увеличению растительного нетто-выхода фотосинтеза, что вносит вклад в усиление роста микоризованных растений. Улучшенная устойчивость таких растений к вредителям, предположительно, объясняется, среди прочего, тем, что создание микоризного симбиоза активизирует изначально слабую защиту от патогенов со стороны растения-хозяина (см.
9.3.4).
VA-микориза имеет определенное сходство с симбиозом с клубеньковыми бактериями (корневые клубеньки, см. 9.2.1, 9.2.2). Арбускулы отделены от растительной цитоплазмы симбиосомной мембраной, отходящей от плазмалеммы хозяйской клетки, — периарбускулярной мембраной, сходной по составу и функции с перибактероидной мембраной. О сходстве, по крайней мере определенных шагов в проявлении обоих симбиозов, говорит также тот факт, что у всех известных до сих пор мутантов, потерявших способность к образованию корневых клубеньков, микоризация не наблюдается.
Между тем, есть многочисленные указания на то, что при формировании VA- микоризы происходит интенсивный обмен сигнальными веществами между обоими партнерами, однако их химическая природа пока невыяснена.
При эктомикоризе слой грибных гиф охватывает короткие и толстые боковые корни второго и третьего порядка (рис. 9.10) и замещает функционально отсутствующие корневые волоски. При этом распространяющиеся гифы микоризных грибов проникают в почву значительно интенсивнее. Грибы образуют между клетками первичной коры, преимущественно внеклеточно, густую сеть — сеть Гартига.
Рис. 9.10. Растровая электронно-микроскопическая фотография корня ели (Abies alba) с эктомикоризой: А — общий вид; В — отдельные боковые корни
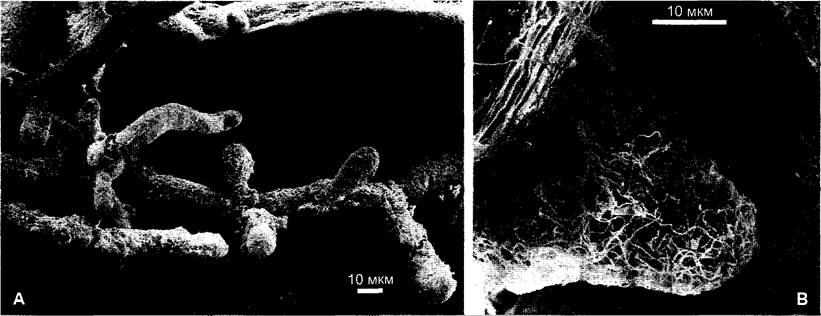
Эктомикоризы имеют ~3 % всех семенных растений. Среди них (частично облигатно) много лесных деревьев, например, сосна, ель, лиственница, дуб, бук (рис.
9.11). Без грибов они, как правило, отстают в росте.
Рис. 9.11. Эктомикориза: А — фрагмент поперечного среза через молодой корень бука (ок. 50х); В — электронно-микроскопическая фотография фрагмента сети Гартига микоризы между Lactarius decipiens и елью (Abies alba)
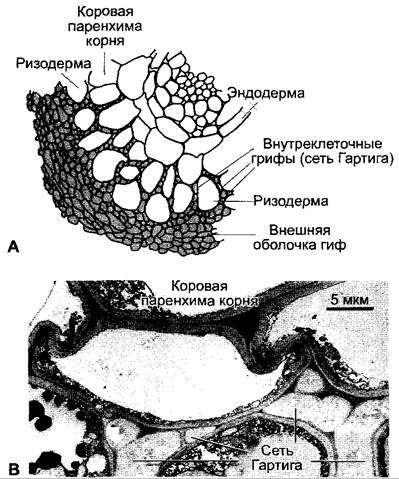
Примерно у 65 родов грибов, преимущественно аско- и базидиомицетов, уже была показана способность к образованию эктомикоризы. Грибы некоторых родов, например, сыроежки (Russula), мухоморы (Amanita), белые грибы (Boletaceae), млечники (Lactarius), живут почти исключительно симбиотически и образуют плодовые тела только в соединении с корнем дерева. (Из-за этого, например, белый гриб в отличие от сапрофитного шампиньона нельзя в культуре довести до образования плодового тела.) Некоторые грибы предпочитают более или менее строго специфично особых хозяев. Деревья, кажется, напротив, не специализируются на определенных грибах (Pinus sylvestris, например, может образовывать эктомикоризу по крайней мере с 25 различными грибами), но, возможно, какие-то виды грибов стимулируются сосной сильнее других. Интродуцированные виды деревьев, например, Pinus strobus или Pseudotsuga taxifolia, образуют в Европе нормальные микоризы с местными видами грибов.
Польза, которую деревья извлекают из эктомикоризы, видится в улучшении питания минеральными солями и обеспечения влагой, усиленной доставке азота и фосфатов через растворение гумуса грибами, обеспечении гормонами через грибы, а также в защите от проникновения патогенов, которая более действенна, чем при VA-микоризе. Грибы получают от хозяина углеводы и, возможно, другие органические соединения. Вследствие того, что специально для образования плодового тела нужны большие количества веществ, их образование начинается чаще только после окончания интенсивного роста побега, в фазе запасания деревьев (август—октябрь).
У представителей родов Picea и Pinus широко распространена экто-эндомикориза, при которой к нормальной форме образования эктомикоризы присоединяются внутриклеточные образования. Переходы от экго- через экто-эндо- до чистых эндомикориз находят у различных представителей порядка Ericales. Благодаря высокоразвитой микотрофии для них становится возможен рост на почвах, бедных Р и N; он является предпосылкой для дальнейшего распространения вересковых на торфяниках, верховых болотах и в хвойных лесах.
Конечным звеном этого рада развития внутри Ericales являются представители семейства Monotropaceae (например, Monotropa hypopitys, вертляница), бесхлорофилльные паразиты. Через гифы облигатной экто-эндомикоризы эти растения прямо связаны с эктомикоризован- ными лесными деревьями (хвойные, буковые). Переход 14С-меченых сахаров от деревьев через грибы в Monotropa и 32Р-меченых фосфат-ионов обратно от Monotropa в деревья доказан экспериментально. Между растениями, которые связаны микоризными грибами, в зависимости от доноро-акцепторных отношений (source-sink) идет обмен значительными количествами углеродных соединений. Но они, по-видимому, остаются в грибе и не переходят в растения-хозяев.
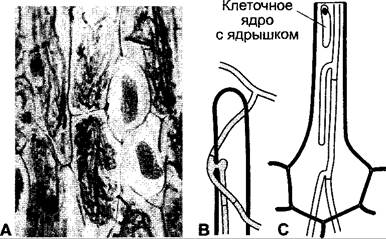
Эндомикоризы имеются, например, почти у всех орхидей (рис. 9.12). Их мелкие семена (масса одного семени 0,3 — 15 мкг) имеют мало собственных запасных веществ и нуждаются для прорастания и развития до независимых автотрофных растений в симбиотических грибах (базидиомицеты), которые дают им наряду с водой и питательными солями органический материал и частично также гормоны («грибы-кормильцы»). И во взрослых растениях во внешних клетках коры находятся грибные гифы (исключение — воздушные корни). Но в глубоких слоях ткани гифы перевариваются или разрываются. У тех орхидей, которые и в проросшем состоянии не способны или едва способны к фотосинтезу, например, гнездовка (Neottia), ладьян (Corallorhiza), надбородник (Epipogium), высшее растение должно все необходимые полезные вещества и гормоны, как паразит, забирать у гриба.
Рис. 9.12. Эндомикориза орхидеи Platanthera chlorantha: А — фрагмент тангенциального среза через паренхиму коры с внутриклеточными грибными гифами, а также двумя слизистыми клетками с рафидами (115х); В — внедрившаяся инфекционная гифа снаружи на кончике корневого волоска. Преодоление растительной клеточной стенки происходит с образованием аппрессории (проникающей гифы). Процесс очень похож на внедрение фитопатогенного гриба в растительные клетки, но подавляется защитная реакция растения; С — инфекционные гифы, растущие от корневого волоска в направлении паренхимы коры (В, С — 235х)
Лишайник — это симбиоз, в котором грибы с водорослями или цианобактериями объединяются в новый организм, внешне чаще действующий как единое целое. При этом для узнавания партнера служат лектины (см. 6.17.1.2). Гриб — микобиоит — различным образом, иногда и с помощью гаусторий, вступает в связь с фотобионтом1 — водорослью или соответственно цианобактерией. У фотобионтов сохраняется и частично даже усиливается специфический метаболизм — фотосинтез, а у Nostoc также азотфиксация (см. 9.2.1).
1 В отечественной литературе чаще употребляют термин фикобионт, который подчеркивает водорослевую природу партнера по симбиозу. — Примеч. ред.
Примерно 25 % из известных ок. 65 000 видов грибов участвуют в образовании лишайников. Лишайниковые грибы есть во всех родственных кругах царства грибов.
Так как лишайники могут содержать 28 различных цианобактерий или соответственно родов водорослей, неудивительно, что природа ассимилятов, переходящих от фотобионтов к микобионту, варьирует. До сих пор в качестве транспортных метаболитов были идентифицированы глюкоза (у всех фотобионтов-цианобактерий) и сахароспирты (у всех фотобионтов, представленных зелеными водорослями). Если лишайник содержит как зеленце водоросли, так и цианобактерии (например, в цефалодиях, у Peltigera aphthosa), то гриб получает от первых сахароспирт, от вторых — глюкозу; обе группы веществ микобионт превращает в маннит, главное запасное вещество грибов. Обмен происходит обильно и быстро: уже через 2 мин от начала фотосинтеза в атмосфере меченого 14СO2 в грибе имеются детектируемые количества меченых ассимилятов.
Экспорт органических азотных соединений от азотфиксирующего Nostoc-симбионта к микобионту также происходит быстро, причем, например, у Peltigera aphthosa, цианобактерии в цефалодиях обеспечивают азотом гриб, но не зеленые водоросли в лишайнике. Есть данные, что грибной партнер стимулирует азотфиксацию симбиотических цианобактерий.
Предположительно; и фотобионты в лишайниках получают от грибов жизненно необходимые вещества, например, минеральные соли и воду; иначе лишайники нельзя было бы рассматривать как симбиотические системы. О подробностях обеспечения водорослей грибом мало что известно. Иногда связь между партнерами по лишайнику расценивается как умеренный паразитизм грибов на фотобионтах.