БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
6. ФИЗИОЛОГИЯ ОБМЕНА ВЕЩЕСТВ
6.2. Минеральное питание
6.2.1. Химический состав тела растения
Фотоавтотрофное растение поглощает (помимо энергии света) самые разнообразные неорганические вещества из окружающей среды: СО2 из атмосферы, значительное число прочих элементов из почвы. Анализ химического состава растения показывает характерное распределение элементов, которое не соответствует таковому ни атмосферы, ни гидросферы, ни литосферы и таким образом ясно показывает химическую автономность биосферы (рис. 6.16).
Рис. 6.16. Распространение элементов в биосфере, гидросфере, литосфере и атмосфере Земли (из расчета на число атомов, в относительных единицах). Литосфера = земная кора (греч. lithos — камень). Содержание воды в атмосфере не учтено
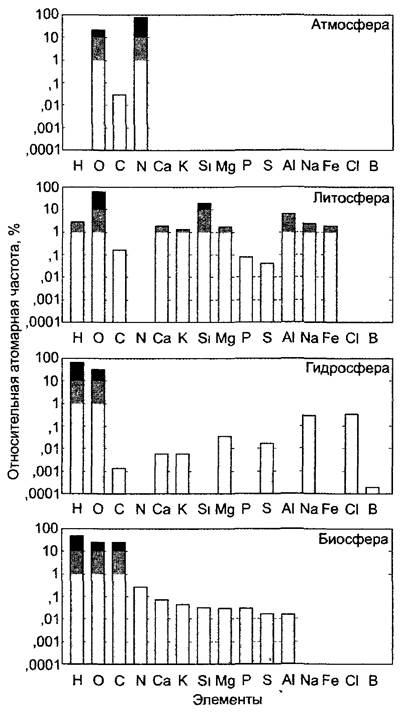
Наибольшую часть сырой массы живых частей растения составляет, как и во всех организмах, вода (о структуре и свойствах воды см. 1.1). Протоплазма содержит в среднем 85 — 90% воды; даже такие богатые липидами органеллы, как митохондрии и хлоропласты, содержат около 50% воды. К наиболее бедным водой органам растения принадлежат семена, в особенности жирозапасающие (табл. 6.5).
Таблица 6.5. Содержание воды
Растение |
Содержание воды, % от сырого веса |
Кочанный салат (внутренние листья) |
94,8 |
Томаты (спелые плоды) |
94,1 |
Редис (корнеплод/главный корень) |
93,6 |
Арбуз (мякоть) |
92,1 |
Яблоко (мякоть) |
84,1 |
Картофель (клубни) |
77,8 |
Древесина (сырая) |
ок.50 |
Кукуруза (сухие зерновки) |
11,0 |
Бобы (сухие семена) |
10,5 |
Арахис (неочищенные плоды с шелухой) |
5,1 |
Pleurococcus(сухопутная водоросль) в сухом, но жизнеспособном состоянии |
5,0 |
6.2.1.2. Сухая масса и содержание золы
Сухую массу тела растения определяют после высушивания при температуре немногим выше 100 °С (обычно 105 °С) до постоянной массы. Сухая биомасса содержит разнообразные неорганические и прежде всего органические компоненты, которые следует рассматривать отчасти как жизненно важные, а отчасти как побочные продукты метаболизма. По многообразию органических соединений автотрофные растения далеко превосходят животных.
Органические соединения построены лишь из немногих элементов. Наиболее существенны среди них шесть «краеугольных камней», основных «строительных компонентов»: С, О, Н, N, S, Р. Количественно преобладает весовая доля углерода (около 50 % органического сухого вещества), в то время как весовая доля -водорода, например, составляет лишь от 5 до 7 % (тем не менее молярные доли С и Н не очень различаются; см. рис. 6.16).
Если нагреть сухую биомассу до высокой температуры при доступе воздуха, то часть основных элементов выделится в форме газов (СO2, Н2O, NН3, SO2), а в золе останутся оксиды или карбонаты многочисленных других элементов. Доля золы в сухом веществе в существенной степени зависит от вида и органа растения, а также от его местообитания. Она низкая у лишайников (0,4 — 7 %), в плодах и семенах (1 — 5 %) и очень высокая в некоторых листьях (например, Zygophyllum stapfii из Юго- Западной Африки — 56,8%). В табл. 6.6 приведены относительные значения общего содержания золы, а также доли отдельных элементов для ряда растений.
Таблица 6.6. Содержание и состав золы в различных частях растительных организмов
Организм |
Зола, % от массы сухого вещества |
В 100 частях золы обнаружено |
||||||||
K2O |
Nа2O |
СаО |
МgО |
Fе2O3 |
P2O5 |
SO3 |
SiO2 |
СI2 |
||
Туберкулезная палочка |
9,56 |
8,2 |
11,5 |
8,6 |
9,8 |
9 |
47,0 |
10,8 |
? |
1,2 |
Белый гриб, плодовое тело |
6,39 |
57,8 |
0,9 |
5,9 |
2,4 |
1,0 |
26,1 |
8,1 |
— |
3,5 |
Рожь, зерновки |
2,09 |
32,1 |
1,5 |
2,9 |
11,2 |
1,2 |
47,7 |
1,3 |
1,4 |
0,5 |
Яблоня, плоды |
1,44 |
35,7 |
26,2 |
4,1 |
8,7 |
1,4 |
13,7 |
6,1 |
4,3 |
— |
Морковь, корнеплоды |
5,47 |
36,9 |
21,2 |
11,3 |
4,4 |
1,0 |
12,8 |
6,4 |
2,4 |
4,6 |
Картофель, клубни |
3,79 |
60,1 |
2,9 |
2,6 |
4,9 |
1,1 |
16,9 |
6,5 |
2,0 |
3,5 |
Табак, стебли |
7,89 |
43,6 |
10,3 |
19,1 |
0,8 |
1,9 |
14,2 |
3,5 |
2,4 |
3,6 |
Табак, листья |
17,16 |
29,1 |
3,2 |
36,0 |
7,4 |
1,9 |
4,7 |
3,1 |
5,8 |
6,7 |
Капуста белокочанная, наружные листья |
20,82 |
23,1 |
8,9 |
28,5 |
4,1 |
1,2 |
3,7 |
17,4 |
1,9 |
12,6 |
В процентном отношении в золе преобладают К, Na, Са и Р. Помимо того, постоянно присутствуют Мg, Fе, Si, СI, S, часто — также АI, Мn, В, Сu, Zn и другие элементы в более или менее значительном количестве. По-видимому, не существует такого химического элемента, который не был бы обнаружен в растении.
Только из анализа золы нельзя сделать вывод о том, является ли обнаруженный элемент для растения в целом жизненно необходимым, нужен ли он в данном количестве или представляет лишь один из случайно приобретенных растением компонентов. Об этом могут дать информацию лишь эксперименты по питанию растений со средами известного состава.
Впервые опробованное Юлиусом Саксом выращивание растений в питательных растворах определенного состава, перенятое теперь в растениеводческой практике, называют гидропоникой (греч. hydor — вода; лат. роnеге — устанавливать, сажать). Путем целенаправленного изменения состава этих питательных растворов можно сделать выводы о необходимости различных питательных элементов для растения: при обеспечении всеми существенными элементами растения развиваются вполне нормально, в то время как при отсутствии или нехватке необходимых элементов они проявляют признаки голодания (рис. 6.17).
Рис. 6.17. Признаки голодания у выращенных в гидропонике 12-недельных растений табака при недостатке отдельных питательных элементов

Растениям в больших количествах (>20мг/л) необходимы следующие 10 элементов, поэтому их называют макроэлементами: С, О, H, N, S, P, Mg, К, Са, Fe1; из них первые три элемента поглощаются в форме СO2 и O2 из воздуха и в виде воды, в то время как последние семь нужно вносить в питательную среду в виде ионов. Железо требуется в намного меньших количествах, чем остальные элементы (около 6 мг/л), и по этой причине его часто относят к группе микроэлементов, название которых выбрано из-за их малых требующихся количеств. Незаменимыми элементами, которые постоянно требуются в малых количествах (<500 мкг/л), являются Mn, В, Zn, Сu, Mo, Cl.
1 Железо занимает «пограничное» положение между макро- и микроэлементами. Здесь авторы не придерживаются какого-либо определенного мнения, указывая Fе и в числе макроэлементов, и в числе микроэлементов (см. ниже). Более того, приведенные данные о потребности в железе противоречивы: >20 мг/л или около 6 мг/л. — Примеч. ред.
Лишь для определенных высших растений требуются такие микроэлементы, как Na, Se, Со, Ni, Si (см. 6.2.2.3).
Несколько отличаются потребности в питательных элементах у низших растений (табл. 6.7). Среди водорослей зеленые водоросли (Chlorophyta) имеют те же потребности, как и высшие растения, однако Са для них является скорее микро-, чем макроэлементом. Многие морские водоросли и водоросли закрытых водоемов нуждаются, как некоторые пресноводные цианобактерии, — в натрии и часто в значительных количествах хлорида (у некоторых видов он может быть замещен бромидом).
Таблица 6.7. Необходимость минеральных элементов для различных организмов («+» — необходим; «-» — необходимость до сих пор не доказана; — необходимость доказана лишь для отдельных видов)
Элементы |
Высшие растения |
Водоросли |
Грибы |
Бактерии |
N, Р, S, Mg, Fе, Мn, Zn, Сu |
+ |
+ |
+ |
+ |
Са |
+ |
+ |
± |
± |
В |
+ |
± |
- |
- |
СI |
+ |
+ |
- |
± |
Na |
± |
± |
- |
± |
Мо |
+ |
+ |
+ |
± |
Sе |
± |
- |
- |
+ |
Si |
± |
± |
- |
- |
Со |
- |
± |
- |
+ |
J |
- |
± |
- |
- |
V |
- |
± |
- |
- |
Ni |
± |
± |
± |
Зеленой водоросли Scenedesmus obliquas необходим ванадий. Ряд водорослей произрастает только лишь при обеспечении витамином В12 (который содержит кобальт); эти виды (например, Ochromonas malhamensis) культивируют также для биологического определения данного витамина.
Среди грибов эумицеты имеют потребность в тех же макроэлементах, что и автотрофные высшие растения, с тем отличием, что калий используется некоторыми представителями лишь в низких концентрациях. То же верно и для кальция, который для некоторых видов даже не является незаменимым. Из микроэлементов бор, по-видимому, грибам не нужен.
Бактерии нуждаются во всех известных макроэлементах высших растений (не включая железо), кроме кальция, который либо не является необходимым, либо необходим лишь в следовых количествах. Среди микроэлементов только железо и марганец представляются необходимыми для бактерий в целом. Фиксирующие атмосферный азот свободноживущие бактерии, например, виды Azotobacter требуют, как и симбиотические азотфиксаторы, молибден как микроэлемент. Молибден является компонентом фермента нитрогеназы, который превращает азот воздуха в аммиак (NH3). Некоторые виды (например, Аzotobасtег) обладают альтернативной нитрогеназой, содержащей ванадий. Для бактерий, продуцирующих газообразные углеводы, клостридиев и метаногенных бактерий незаменим никель. Фермент глутатионпероксидаза у бактерий содержит селен. Целый ряд бактерий, прежде всего морских, являются га- лофилами, и причем в том смысле, что они не только лучше растут на среде с NаСI, но требуют обязательного присутствия поваренной соли. Экстремальные галофилы растут оптимально при концентрации NаСI в растворах примерно 25 % (около 4 М). Соль отчасти действует здесь как осмотик, а отчасти как питательный элемент.
6.2.2.1. Значение минеральных элементов для растения
Минеральные элементы выполняют в клетке, с одной стороны, те функции, которые не являются специфическими, а с другой — такие, которые могут быть выполнены только определенными элементами или ионами (во всяком случае только химически близкородственными). К неспецифическим функциям относят вклад в осмотический потенциал клетки и их роль в поддержании электронейтральности.
Более специфично действие неорганических ионов на гидратацию белков. Как правило, при господствующих в клетке значениях pH белки обладают определенным электрическим зарядом. Заряженные группы притягивают диполи воды (см. рис. 1.2) и формируют гидратные оболочки. В присутствии высоких концентраций неорганических ионов, которые также образуют гидратные оболочки, возникает конкуренция за доступность воды, которая в зависимости от обстоятельств может привести к денатурации белков. Это используется при очистке белков (при высаливании, например, с сульфатом аммония (NН4)2SO4). Отрицательно заряженные белки (они главным образом присутствуют в цитоплазме при господствующих там значениях pH 7,2 —7,4) под влиянием катионов нейтрализуются (разряжаются), и по этой причине происходит дегидратация (как бы «отжим» воды). Способность катиона к нейтрализации зарядов биополимеров возрастает с увеличением заряда и при равном заряде падает с увеличением размера его собственной гидратной оболочки. Са2+разряжает молекулы белков относительно сильнее, чем Mg2+, К+ — относительно сильнее, чем Na+ (рис. 6.18). Влияния такого рода могут оказывать воздействие на конформацию и каталитическую активность белковых молекул. На этом частично основано действие ионов, например, К+, Са2+, Мg2+, на активность ферментов. В живой клетке механизмы гомеостаза обеспечивают значительное постоянство внутриклеточного ионного состава, так что существенных колебаний общего уровня гидратации белков, как правило, не происходит. Под гомеостазом (греч. homoios — равный; stasis — состояние) вообще понимают организованное состояние клетки или организма, которое необходимо для создания их стабильной внутренней среды.
Рис. 6.18. Диаметр некоторых ионов и их гидратных оболочек

Регуляция процессов метаболизма неорганическими ионами, в особенности ионами металлов, во многом основана на высокоспецифичных взаимодействиях ионов со специальными группами белков.
✵ Так, активация Mg2+ рибулозо-1,5-бисфос- фаткарбоксилазы основана на образовании Mg2+-карбаматного комплекса с ε-аминогруппой специального лизина большой субъединицы фермента (6.5.1; см. рис. 6.69). На свету концентрация Mg2+ в строме повышается и таким образом способствует активации энзима в присутствии СO2.
✵ АТФ в основном реагирует не в свободном виде (как кислота), а как комплекс Mg2+-ATO.
✵ Цитоплазматический Са2+ обычно поддерживается в области значений концентрации около 10-7 М. Существуют указания на то, что в растительных клетках в определенных ситуациях эти концентрации, как и у животных, могут повышаться примерно на порядок (>10 6 М). Это ведет к активации, например, Са2+-зависимых
протеинкиназ и через Са2+-связывающий белок кальмодулин к изменению состояния активации многих клеточных белков (среди них — каскада многочисленных протеинкиназ). Таким образом, Са2+ функционирует как элемент клеточных сигнальных цепей.
Высокоспецифично действие металлов как составной части простетических групп. Цитохромы, ферредоксин, липоксигеназы содержат железо; пластоцианин, аскорбат- оксидаза и фенолоксидазы — медь; нитратредуктаза, нитрогеназа, альдегидоксидазы — молибден. Ионы металлов облегчают связывание и активацию субстратов ферментами и играют важную роль при транспорте электронов и переносе атомов и молекулярных групп.
Наконец, минеральные элементы необходимы для биосинтеза органических соединений. Азот, сера и фосфор входят в состав многочисленных биомолекул. Растение поглощает их преимущественно в форме оксоанионов (NO3-, SO42- , Н2РО-4). В дальнейшем отдельные макро- и микроэлементы будут рассмотрены подробнее.
• Азот, как правило, поглощается растением из среды в виде нитрата (NO-3), реже как NH+4. В органических соединениях (аминокислотах, белках, нуклеиновых кислотах, коферментах и т.п.) он присутствует в восстановленной форме. В зеленом растении примерно половина всего азота растения и около 70 % азота листьев находится в хлоропластах. Обычно лишь 10 — 20 % или менее азота присутствует в форме свободных нитратных или аммонийных ионов (подробности азотного метаболизма см. в разделе 6.6). У отдельных растений нитрат накапливается также в клеточном соке («нитрофилы», например, Chenopodium album и Urtica dioica) и играет при этом важную роль в поддержании ионного баланса и осморегуляции.
• Фосфор поглощается в основном как однозамещенный дигидрофосфат (Н2РО-4) и не восстанавливается в клетке, но присутствует как неорганический фосфат в эфирных и ангидридных связях, например, как составной элемент нуклеотидов и их производных, нуклеиновых кислот, сахарофосфатов, фосфолипидов, коэнзимов, в фитине клеток алейронового слоя (т.е. кальций-магниевые соли фитиновой кислоты, гексафосфорного эфира мио-инозитола). Его основная роль заключается, таким образом, в том, что он входит в состав важных структурных компонентах и участвует в энергетическом метаболизме клетки.1
1 Одно- и двухзамещенные фосфаты обладают высокими буферными свойствами, поэтому рассматривают роль фосфора в поддержании внутриклеточного pH. — Примеч. ред.
• Сера поглощается растениями (за исключением нескольких специальных случаев среди бактерий) преимущественно в форме сульфата (SO24- ) и перед включением в органические соединения обычно подвергается восстановлению (см. 6.7); если сульфат и встраивается в органические соединения (например, в сульфолипиды — см. рис. 1.21) или в некоторые вторичные соединения (см. 6.16.4), то за счет включения стабильной кислотной группы повышается растворимость соединений в воде или их полярность. Как и азот, сера составляет приблизительно постоянную долю клеточных белков: на один атом серы приходится примерно 36 атомов азота. Если поступление сульфата превышает потребность в восстановленной сере, то возможно накопление свободного сульфата в растении, при этом часто достигаются даже более высокие концентрации, чем в случае нитрата. В высших растениях восстановленная сера в отличие от азота может снова окисляться и затем запасаться в виде сульфата. Поступление сульфата в клетку регулируется его внутриклеточной концентрацией.
• Калий. К+ — единственный одновалентный катион, необходимый для всех растений; лишь в некоторых микроорганизмах он может быть замещен на рубидий (Rb+). Главную свою роль калий играет как кофактор ферментативных реакций и в силу своей высокой доли в минеральном компоненте клетки (см. табл. 6.6) как осмотик. Высокая концентрация имеет значение и для его действия как кофактора, поскольку К+ имеет относительно низкое сродство к органическим лигандам, в том числе к энзимам, коэнзимам и субстратам энзимов. Концентрация К+ достигает в цитоплазме 100 — 120 мМ, в хлоропластах — 20 — 200 мМ. Как осмотически активному фактору калию принадлежит ключевая роль при осморегуляции в связи с насти- ческими движениями (открывание и закрывание устьичной щели (см. 8.3.2.5), движения сочленений частей растения и др. (см. 8.3.2)). Ионы калия играют важную роль при флоэмном транспорте (см. 6.8), а также в связывании мРНК на рибосомах. В органические соединения в клетке калий не встраивается.
• Магний присутствует в земной коре в основном в виде карбоната. Как составная часть хлорофилла и протопектина, а также компонентов клеточных стенок различных водорослей (например, бурых) магний незаменим. Магний, входящий в состав хлорофилла, составляет более 10% магния листа, в то время как обший магний хлоропластов — часто больше, чем половину. Частично он запасается в виде фитина. Кроме того, магний является кофактором многочисленных ферментативных реакций, в особенности тех, в которых задействована АТФ (как Mg2+-ATФ комплекс). В чистых растворах магний действует как сильный яд и в высоких концентрациях нарушает поглощение калия из среды. С другой стороны, поглощение магния затрудняется другими катионами, например, калием, аммонием, кальцием, марганцем и водородом. Недостаток магния в результате закисления почвы1 в определенных местообитаниях обсуждают как возможную причину плохого роста лесных деревьев. Это еще раз подчеркивает значение сбалансированного состава питательной минеральной среды для роста растений.
1 При закислении почвы карбонаты магния и кальция переходят в растворимые соли, в результате происходит вымывание этих элементов из почвы, ведущее к их дефициту. — Примеч. ред.
• Кальций присутствует в земной коре в виде карбоната, сульфата или фосфата. В клетке кальций как двухвалентный катион может образовывать соли с кислыми компонентами клеточных стенок, подобно магнию (например, с протопектином срединных пластинок, со стенками корневых волосков и пыльцевых трубок или же с альгиновой кислотой клеточных стенок водорослей) и таким образом выступает как существенный структурный компонент. Недостаток кальция затрудняет, например, рост пыльцевых трубок и прорастание пыльцы и приводит к повреждению меристем, в первую очередь корневой меристемы. Однодольные нуждаются в значительно меньших концентрациях кальция для оптимального роста, чем двудольные. Большую роль кальций играет в поддержании структуры и функции всех клеточных мембран. Концентрация свободного кальция в цитоплазме и в хлоропластах низкая и, напротив, высокая в апопласте и частично также в вакуоли. Низкое содержание кальция в цитоплазме определяется низкой проницаемостью плазмалеммы для этого иона и работой энергозависимых насосов (АТФаз) в плазмалемме и эндоплазматическом ретикулуме, которые транспортируют ионы кальция против колоссального градиента (концентрация кальция от цитоплазмы к апопласту возрастает в 10000—1 000 000 раз). Избыточный кальций откладывается в клетке как фитат, оксалат, карбонат или (реже) сульфат, или фосфат, и в форме этих труднорастворимых солей в значительной степени выводится из обращения.1 (О значении Са2+ в клеточных сигнальных путях см. 7.3.3, 8.3.2.5; об определении кальция см. бокс 7.4.)
• Железо входит как обязательный компонент в несколько химических соединений клетки. К ним относятся различные соединения пор- фирина, например, гемовые группы цитохромов и других ферментов, таких, как каталазы и пероксидазы, а также леггемоглобинов (см. 6.15, рис. 6.56). Далее следует упомянуть негемовые соединения железа, например, ферредоксин (см. рис. 6.56). Хотя железо не входит в состав хлорофиллов (см. рис. 6.44), оно абсолютно необходимо для их синтеза: железное голодание приводит к проявлениям недостатка хлорофилла (хлорозам), которые аналогичны проявлениям при магниевом голодании. Учитывая значительную роль железа в биосинтезе хлорофилла и соединений железа в фотосинтетическом транспорте электронов, нетрудно объяснить, что большая часть железа в листе находится в хлоропластах.
1 Обычно труднорастворимые соли кальция образуются в вакуолях. — Примеч. ред.
Недостаток железа нередко возникает на щелочных почвах, где оно преципитируется карбонатами и бикарбонатами («щелочный хлороз»). Избыток марганца или других тяжелых металлов также может приводить к железному голоданию, поскольку эти ионы конкурируют с железом за поглощение и зону действия в физиологических процессах.
В почве Fе3+ и иногда Fе2+ присутствуют в основном в составе комплексов. Корни поглощают преимущественно Fе2+ (исключение составляют злаки), поэтому Fе3+ должен восстанавливаться на поверхности корня (см. 6.2.3).
• Марганец. До сих пор из растений был выделен только один марганецсодержащий белок неизвестной функции («манганин» из арахиса). Марганец играет, однако, важную роль как кофактор многих ферментов, например, в цикле Кребса, как компонент марганецсодержащей супероксиддисмутазы, а также принимает участие в выделении кислорода при фотосинтезе (см. 6.4.5). Недостаток марганца может вызывать хлороз. Так называемая сухая пятнистость листьев овса и других растений, которая встречается прежде всего на болотистых почвах, является следствием недостатка марганца в почве или его присутствия в форме, недоступной
для растения. От недостатка марганца часто страдают также цитрусовые культуры. В марганце нуждаются и грибы, например, Aspergillus niger.
• Бор (виде В(ОН)з) в низких концентрациях жизненно важен для высших растений и некоторых водорослей (но не для многих микроорганизмов или для животной клетки), однако даже при небольшом превышении концентрации он действует токсически. Описан целый ряд диагностических признаков борного голодания, однако механизм действия элемента все же во многом не выяснен; это связано, в частности, с отсутствием пригодного для биохимических анализов радиоизотопа бора. Неизвестно ни одного биоорганического соединения, ни фермента, которые включали бы бор.1
1 В последнее время удалось выделить нестойкие эфиры борной кислоты с веществами клеточной стенки. Предполагают, что образование этих эфиров уменьшает проницаемость для макромолекул, что в свою очередь сказывается на функционировании матрикса клеточной стенки. — Примеч. ред.
Наиболее яркий признак недостатка бора — отмирание меристем («гниль сердечка» у кормовой и сахарной свеклы), в основе чего, возможно, лежит нарушение метаболизма РНК. Кроме того, дефицит бора ведет к подавлению развития цветка, дисбалансу водного режима растения и нарушению экспорта сахаров из листьев по флоэме.
Пыльца томатов, водяных лилий и многих других растений может прорастать или же удлинять пыльцевые трубки исключительно в присутствии малых количеств бората в секрете рыльца пестика. Борат помимо этого способен влиять на окислительный пентозофосфатный цикл (см. 6.10.3.5) за счет образования комплексов с 6-фосфоглюконатом. При недостатке бора этот процесс должен протекать особенно эффективно, приводя таким образом к избыточному накоплению фенольных соединений, характерному для борного голодания растений. Обсуждается также взаимодействие бора с мембранами, которое потенциально может оказывать влияние на АТФ-зависимые транспортные процессы и действие фитогормонов; кроме того, рассматриваются связи бора с образованием лигнина и дифференцировкой ксилемы.
• Цинк встречается в растениях в концентрации, примерно в 10 раз превышающей концентрацию меди, и примерно 1/10 таковой железа. Транспорт цинка осуществляется как по ксилеме, так и по флоэме. Цинк входит в состав более чем 70 ферментов, в том числе алко- гольдегидрогеназы, карбоангидразы, супер- оксиддисмутазы (существуют также медь- и марганецсодержащие изозимы), и, кроме того, является кофактором других ферментов. В высших растениях недостаток цинка ведет к серьезным нарушениям роста, например, мелколистности, ингибированию роста междоузлий. Это связывают в первую очередь с нарушением обмена ростовых веществ при недостатке цинка. Цинк является незаменимым микроэлементом также для многих низших растений (например, для грибов, как Aspergillus niger, и водорослей). Цинк — структурный элемент рибосом (входит в состав), поэтому его недостаток приводит к нарушениям биосинтеза белка. Кроме того, он необходим для поддержания структуры биомембран и, наконец, является компонентом некоторых транскрипционных факторов (белков с «цинковыми пальцами», см. 7.2.2.3).
• Медь связана в почве с гуминовыми и фульвокислотами. В растениях она присутствует в концентрации примерно 3 — 10 мкг/г сухого вещества и также является составной частью разнообразных ферментов (в частности, аскорбатоксидазы, супероксиддисмутазы и цитохром- оксидазы) и окислительно-восстановительных молекул (пластоцианин). В проводящих тканях растения медь преимущественно связана в комплексы (например, с аминокислотами). Недостаток меди влечет за собой так называемую «болезнь целинных земель» на кислых вересковых болотистых почвах с низким выходом зерна (пустозерность). При медном голодании нарушается также синтез лигнина: диаминоксидаза, которая поставляет Н2О2для окисления предшественников лигнина, является медьсодержащим ферментом. Пыльца растений, выросших при недостатке меди, нежизнеспособна. Медь начинает быть токсичной при 20 — 30 мкг/г сухого вещества.
• Молибден входит в состав ферментов азот- фиксации — нитрогеназы (см. 9.2.2), нитратредуктазы (см. 6.6.1), а также сульфитоксцдазы, альдегидоксидазы и ксантиндегидрогеназы. Из- за этого его отсутствие проявляется на растении сильнее при нитратном, а не аммонийном питании. За исключением нитрогеназы, во всех остальных молибденсодержащих ферментах молибден включен в состав специального птерина (молибдоптерин, см. рис. 6.89), который имеет одинаковую структуру у архебактерий, бактерий и эукариот (растений и животных). Этот молибденовый кофактор входит в комбинацию с различными апоферментами, образуя холоэнзим, причем молибден находится в активном центре фермента.
• Хлор присутствует в растении в концентрации 50 — 500 мкмоль/г сухого вещества (или в значительно более высокой у галофитов) в форме хлорида СI-; он накапливается прежде всего в хлоропластах и клеточном соке. Хлор играет роль при фотосинтетическом выделении кислорода.
Хотя в растениях описаны 130 хлорсодержащих органических соединений, ни одно из них не имеет существенного значения для метаболизма. Наиболее значительным в количественном отношении сейчас считается метил- хлорид (СН3СI), который производится морскими водорослями, грибами, разрушающими древесину, и некоторыми наземными растениями в количестве 5 млн т в год на всей Земле. В определенных растениях, например, в кукурузе, кокосовой пальме и репчатом луке, хлорид участвует в осморегуляции устьичных движений (см. 8.3.2.5), а во многих растениях — осморегуляции в целом. Возможно, с этим связано наблюдаемое в эксперименте хлоридное голодание, вызывающее признаки увядания. В естественных условиях недостатка хлорида, вероятно, не может быть, скорее встречаются его избыточные, сверхоптимальные концентрации. Хлорид имеет большое значение для работы протонной АТФазы тонопласта, которая, в противоположность изозиму на плазмалемме, зависит не от К+, а от СI-.
• Кобальт как компонент витамина В12 требуется многим бактериям, водорослям и животным клеткам; у высших растений его действие непрямое и лишь в том случае, если они осуществляют симбиотическую фиксацию азота (см. 9.2.2) (витамин В12 требуется для бактериальных симбионтов). У Escherichia coli и млекопитающих метилкобаламин служит кофактором при синтезе метионина, вместе с другими переносчиками метильных групп — метилтет- рагидрофолатом и S-аденозилметионином. Кобальт входит в состав также некоторых витамин В12-независимых ферментов у бактерий (например, метионинаминопептидазы, нитрилгидратазы, бромпероксидазы и глюкозоизомеразы). Метионинаминопептидаза пекарских дрожжей и фермент альдегиддекарбонилаза водорослей также содержат кобальт.
• Натрий в умеренных широтах присутствует в почвенном растворе в концентрации 0,1 — 1 ммоль/л (подобно калию); в семиаридных или аридных регионах его концентрация равна 50 — 100 ммоль/л (преимущественно в виде NaCl). Как было упомянуто выше, поглощение натрия значительно уступает поглощению калия. Натрий требуется как микроэлемент некоторым С4- и CAM-растениям, но обычно не С3-растениям. Светозависимое поглощение пирувата в хлоропластах мезофилла у некоторых С4-расте- ний (см 6.5.8) (однако не НАДФ-маликэнзим- ного типа), например, Zea mays и Sorghum bicolor, происходит за счет пируват-Na+ симпорта. Если рост галофитов С3- или С4-растений стимулируется высокими концентрациями натрия в среде (10 — 100 ммоль), то это вызвано не специфической необходимостью натрия для определенного процесса жизнедеятельности, а их высокой потребностью в осмотически активных ионах.
• Кремний встречается в земной коре преимущественно в виде Si(OH)4. Его концентрация в почвенном растворе колеблется между 30 и 40 мг/л SiO2-эквивалента. Средняя глобальная концентрация SiO2 в реках составляет 150 мкмоль/л. Диатомовые водоросли нуждаются в кремнии не только для строительства клеточной стенки, но и в качестве микроэлемента для их метаболических процессов, прежде всего для клеточного деления. Среди высших растений различают кремниенакопители (как, например, некоторые злаковые и Equisetun) и не накапливающие кремний (как большинство двудольных). Для первых кремний является существенным фактором роста, как и для диатомовых. Из-за повсеместного присутствия и возможного загрязнения кремнием питательных растворов со стенок культуральных сосудов или за счет пыли проявления голодания для этого элемента трудно доказуемы.
• Селен присутствует в клетках некоторых архебактерий, бактерий и млекопитающих в форме селеноцистеина(SeC). В селеноцистеине SH-группа замешена на SeH-группу. Селеноци- стеин находится, например, в активном центре формиатдегидрогеназы у Escherichia coli и глутатионпероксидазы клеток млекопитающих. Единственный известный сейчас выделенный из растений селенсодержащий белок — это глутатион пероксидаза зеленой водоросли Chlamydo- monas reinhardtii.
Высшие растения, по-видимому, не содержат селенобелков, в геноме пекарских дрожжей Saccharomyces cerevisiae не обнаружено генов белков, содержащих селен, ни генов ферментов, отвечающих за его встраивание. У Escherichia coli во встраивании селена задействованы 4 гена. Трансляция осуществляется за счет использования кодона UGA, который обычно функционирует как стоп-кодон (см. 7.3.1.1). Сульфат (SO24-) и селенат (SeO24-) конкурируют за одну и ту же систему поглощения в корнях. Определенные виды растений родов Astragalus, Xylorrhiza и Stanleya аккумулируют селен (см. 6.2.2.4), в меньшей мере это свойственно некоторым Brassicaceae, как Sinapis arvensis и Brassica oleráceavar. itálica (брокколи). Селен может выделяться растением в атмосферу в форме газа, в частности диметилселенида.
• Никель — составная часть уреазы высших растений, он требуется также некоторым прокариотам (например, как компонент гидрогеназ). Никелевое голодание приводит, например, у растений сои, к листовым некрозам вследствие локального накопления мочевины (до 2,5 %). Дальнейшими проявлениями являются замедленный рост проростков и сниженное образование клубеньков. Содержание никеля в вегетативных частях высших растений варьирует в основном от 1 до 10 мкг/г сухого вещества.1
1 Роль никеля может оказаться более широкой. Так, почвы Новой Каледонии содержат высокие концентрации Ni, а уникальная флора острова в биохимическом отношении практически не изучена. — Примеч. ред.
6.2.2.4. Минеральные соли как факторы мест обитания растений
Как состав, так и количество доступных минеральных солей в среде обитания растений (для наземных растений — это почва, для водных — вода) могут быть весьма различны. Нередко в местах их обитания к необходимым питательным минеральным веществам дополняются сопутствующие вещества, обладающие токсическим действием, в особенности некоторые тяжелые металлы. Избыток необходимых элементов тоже может иметь неблагоприятный побочный эффект. Лишь в редких случаях все минеральные элементы в субстрате присутствуют в смеси в оптимальных пропорциях, которые подбираются при гидропонном выращивании в оптимизированных питательных растворах (табл. 6.8). Большей частью минеральное питание растений в естественных местах их обитания, но прежде всего на культивируемых почвах, ограничивает рост растений. В то время как на землях, не подверженных влиянию человека, устанавливается равновесие питательных веществ, при котором поглощенные организмами минеральные элементы после их отмирания вновь возвращаются в почву. Земли сельскохозяйственного назначения с каждым урожаем теряют значительное количество минеральных веществ. По этой причине необходимо заботиться об их возмещении путем соответственного удобрения почвы, так как от этого зависит также и благосостояние почвенной микрофлоры.
Таблица 6.8 Состав питательного раствора по Кнопу.1 Общая концентрация минеральных веществ — 0,22 %; pH 4,2
Соединение |
Концентрация, г/л |
Соединение |
Концентрация мг/л |
Ca(NO3)2 |
1,00 |
H3PO4 |
3,00 |
KNO3 |
0,25 |
MnSO4 H2O |
3,00 |
KH2PO4 |
0,25 |
ZnSО4 7Н2O |
4,40 |
КСI |
0,12 |
(NH4)6Mo-O24 4Н2O |
1,80 |
MgSO4 7Н2O |
0,50 |
Fe EDTA |
2,75 мл* |
* Содержит 24,9 г FeSO4 7Н2O и 26,1 г этилендиаминтетрауксусной кислоты в 1 л
1 Исходно пропись среды по Кнопу не содержала микроэлементов (они входили в ее состав как примесь в реактивах и воде), а железо использовали в форме хлорида или сульфата. Здесь приведена современная (модифицированная), а не классическая пропись среды по Кнопу — Примеч. ред.
Как в естественных местообитаниях, так и на культивируемых землях действует открытый Юстусом Либихом, основоположником искусственного удобрения, закон минимума,согласно которому рост растения ограничивается именно тем элементом, который присутствует в относительно наименьшем количестве .1 На площадях, используемых в сельском хозяйстве, в почву должны вноситься прежде всего азот, фосфор и калий, что позволяет обеспечить постоянно высокие урожаи Известкование регулирует в почве значения pH и поддерживает комковатую структуру, необходимую для проветривания и обводненности почвы, а также доступности питательных веществ для растений (см 6 2 3 1)
1 Закон Либиха справедлив для гумидного умеренного климата, где элементы выносятся из почвы не только с урожаем, но и с дождевыми и талыми водами В аридном климате на урожай влияет не только недостаток, но и избыток некоторых элементов в почве, например, засоление MgSO4 или NаСI. Здесь закон минимума нужно переформулировать в закон оптимума урожай определяется тем элементом, концентрация которого сильнее всего отклоняется от оптимума (как в большую, так и в меньшую сторону) — Примеч. ред.
Значительные различия в наличии и доступности элементов минерального питания в большой степени сказались на приспособлениях растений к условиям их обитания (см гл 13 6 6) Приведем несколько примеров
✵ Растения засоленных местообитаний. Высокие концентрации соли действуют, с одной стороны, неспецифически осмотически, а с другой, проявляется их специфическое действие в соответствии с типом действующего иона. Отрицательному водному потенциалу богатых солью растворов (морская вода![]() ~ -2 МРа, в изолированных лагунах
~ -2 МРа, в изолированных лагунах![]() вследствие испарения воды может быть еще более отрицательным) приспособленные растения (галофиты) могут противостоять за счет создания соответственно более низких водных потенциалов, что дает им возможность поглощать воду непосредственно из среды обитания. Часто это достигается накоплением в клетке ионов Na+ и СI. Избыточная соль может отделяться в виде друз (см 6 18) или путем отбрасывания частей растения (железистых волосков у Atriplex), либо путем накопления соли в крупных вакуолях (у суккулентов, например, у Sahcornia) может выводиться из метаболизма.
вследствие испарения воды может быть еще более отрицательным) приспособленные растения (галофиты) могут противостоять за счет создания соответственно более низких водных потенциалов, что дает им возможность поглощать воду непосредственно из среды обитания. Часто это достигается накоплением в клетке ионов Na+ и СI. Избыточная соль может отделяться в виде друз (см 6 18) или путем отбрасывания частей растения (железистых волосков у Atriplex), либо путем накопления соли в крупных вакуолях (у суккулентов, например, у Sahcornia) может выводиться из метаболизма.
Подобно соленой воде, засоленные почвы во влажных областях содержат главным образом NaCl, поэтому специфическое действие соли касается либо Na+, либо СI.Чувствительность разнообразных растений к этим ионам очень различна. Галофильные бактерии и водоросли живут в концентрированных растворах поваренной соли. Относительно устойчивы к NaCl ячмень, свекла, шпинат, хлопок табак, лук и редис, далее в этом перечне идут виноград, маслина, финиковая пальма, различные виды сосны, дуб, платан и робиния («белая акация») (по этой причине перечисленные растения меньше страдают от соли, которой посыпают дороги) Чувствительны к соли конский каштан и липа, затем следуют пшеница, картофель, косточковые культуры, лимон и многие бобовые.
• Растения известняков и кремнеземов. Среди папоротников (см 11 2) и покрытосеменных (см 11 2) существуют виды, избегающие известковых почв, и другие, зачастую им близкородственные, которые встречаются исключительно на известковых почвах. Известковые растения приспособлены к почвам, богатым Са2+ и НСО3 с относительно высоким значением pH, водонепроницаемым, теплым и сухим, бедным тяжелыми металлами и фосфатами. На кислых песчаных почвах, состоящих в основном из кремнезема, кальцефильные растения могут повреждаться в первую очередь за счет высоких концентраций ионов железа, алюминия и марганца. Адаптированные к кислым почвам кремнеземные растения обезвреживают избыток ионов тяжелых металлов путем комплек- сообразования.
• Растения-аккумуляторы накапливают определенные элементы. К ним относятся вид Orites excelsa (сем. Proteaceae), накапливающий до 79 % АI2O3 в золе древесины, Symplocosspicata (сем. Symplocaceae) — Al 72 г/кг сухого вещества, Miconia acinodendnon (сем. Melastomataceae) — Al 66 г/кг сухого вещества. Чайный куст Camellia sinensis накапливает до 27 % Al в сухом веществе листьев; так как АI3+ необходим для его развития, он хорошо растает лишь на кислых почвах (pH < 6). Алюминий проникает, по-видимому, в форме AIF4-(аналога ортофосфата) через систему поглощения фосфата растения. Одним из следствий является высокое содержание фторидов в чайном листе (в молодых листьях — до 180 мг/кг, в старых — до 1,5 г/кг сухого вещества). Растениями-аккумуляторами являются также африканское Aeolanthus biformifolius (сем. Lamiaceae), содержащее до 1, 3 % Cu в сухом веществе и Sebertia acuminata (сем. Sapota- сеае) из Новой Каледонии — в сухом веществе 1 — 2 % никеля. Сине-зеленый млечный сок этого растения представляет собой 1 М раствор цитрата никеля (26 % никеля в сухом веществе). Psychotria douarrei (сем. Rubiaceae) родом из Новой Каледонии, содержит 4, 7 % никеля. В сухом веществе листьев May tenus bureaviana (сем. Сеlastrace), также происходящем из Новой Каледонии, содержится 3,2 % марганца. Растениями-аккумуляторами являются также определенные североамериканские виды астрагала (Astragalus), которые накапливают селен, уран и ванадий; Astragalus pattersonï может содержать до 1,2 г селена на 1 кг золы. Ядовитыми для пастбищного скота являются количества селена 1 — 5 мг/кг сухого вещества. Токсичность селена основана на его включении в аминокислоты вместо серы (селеноцистеин, селенометионин), что может приводить к образованию нефункциональных белков. Толерантные к селену виды астрагала синтезируют непротеиногенную (не входящую в состав белков) аминокислоту метилселено- цистеин и запасают ее в вакуолях.
Растения, состав золы которых отражает состав субстрата, могут использоваться как растения-индикаторы. Некоторые из них растут лишь на определенных почвах: например, галмейская фиалка (Viola calaminaria) произрастает лишь на Zn-содержащем субстрате; а лишайник Lecanore vinetorum — только на почвах, богатых медью (например, Weinberggerüste в Южном Тироле.) Растительные сообщества могут указывать также на присутствие определенных элементов или комбинаций элементов. Так, лишайниковое сообщество Acarosporetum sinopicae приурочено к субстрату, богатому тяжелыми металлами, прежде всего железосодержащему, например, выбросам пустой породы на отвалах средневековых железорудных разработок в Гарце (Harz).
Окраска цветков Malcolmia maritima (сем. Brassicaceae) изменяется с розовой на желто- зеленую на Cu-, Zn-, Pb-содержащих почвах (образование комплексов металлов с антоцианами). Сходную смену окраски можно встретить также у Papaver commutatum (за счет действия меди или молибдена) или Leptospermum из сем. Myrtaceae (за счет действия хрома). Учет подобных взаимосвязей может иметь практическое значение для разведки полезных ископаемых, оценки потребности почв в удобрениях, для сельскохозяйственного и лесного районирования, геологического картирования и т.д.
Была предложена даже «фитоэкстракция» благородных металлов с помощью растений. Так, Brassica juncea поглощает золото до 50 мг/кг сухой массы из Au-содержащей руды или песка. Термином «фитосанация» обозначают экстракцию токсичных для человека и животных тяжелых металлов — кадмия или свинца — из загрязненных почв путем культивирования растений-аккумуляторов. Так, выращивание Brassica juncea уменьшает содержание свинца в загрязненных почвах, a Thlaspi coerulescens хорошо подходит для уменьшения содержания в почве цинка и кадмия.
К тяжелым металлам относят металлы, плотность которых превышает 5 г/см3. К ним относятся существенные для растения элементы минерального питания, такие как цинк и медь, а также кадмий, свинец, ртуть, уран и благородные металлы. В высоких концентрациях многие тяжелые металлы действуют токсически на растения, человека и животных, так как их ионы образуют стабильные комплексы с тиольными группами (—SH) и тем самым ингибируют многие ферменты. Те же механизмы, которые отвечают за снабжение растения необходимыми тяжелыми металлами, одновременно служат для ограничения их токсичности при превышении оптимальных концентраций.
У всех изученных групп растений (водорослей, мхов, высших растений) внесение тяжелых металлов индуцирует синтез комплексообразующих пептидов — фитохелатинов. Они образуются из глутатиона (т. е. не за счет трансляции на рибосомах) и имеют следующую структуру: (у-глутаминовая кислота-цистеин) n-глицин (n = 2 — 11) (рис. 6.19). У бобовых (Fabales) вместо фитохелатинов присутствуют гомофитохелатины; здесь остаток глицина замещен на β-аланин.
Рис. 6.19. Структура фитохелатина и гомофитохелатина. Хелатирование металлов происходит через SН-группы с образованием тиолатной связи

Другой группой соединений, связывающих тяжелые металлы, являются металлотионеины. Это небольшие (мол. масса около 10 кДа) богатые цистеином белки, синтез которых (на рибосомах) в растении вызывается тяжелыми металлами и которые, как и фитохелатины и гомофитохелатины, связывают ионы тяжелых металлов за счет своих тиольных групп. Таким образом, с одной стороны, эти ионы оказываются исключенными из обращения, а с другой, при необходимости могут снова вступать в обмен веществ клетки (например, как кофакторы). Нежелательным побочным эффектом этих механизмов является то, что через растительную пищу тяжелые металлы могут попадать в организм человека и животных. Согласно оценкам, примерно половина случаев отравления человека кадмием происходит через растительную пищу.
6.2.3. Поглощение и распределение минеральных элементов в растении
6.2.3.1. Доступность минеральных элементов
За исключением углерода, кислорода и водорода, которые поглощаются в форме СO2, O2, Н2O, все прочие необходимые элементы должны поставляться в ионной форме (табл. 6.9). Их поглощение осуществляется у ризофитов, как правило, через корень, в то время как листья (кроме некоторых специализированных эпифитов, таких, как Tillandsia (см. 11.2)) способны к поглощению ионов лишь в весьма ограниченном количестве. Водные растения, однако, могут поглощать минеральные элементы из воды в виде ионов при помощи своих погруженных органов или плавающих листьев, так как они обладают весьма проницаемой кутикулой или не имеют ее вовсе. Помимо того, и у этих растений осуществляется поглощение ионов из почвы через корни (в случае, если таковые имеются).
Почва (рис. 6.20; см. также 12.5.2.3) представляет собой сложную, многофазную систему, в которой происходят длительные физические, химические и биологические изменения. Твердая фаза почвы состоит главным образом из продуктов эрозии породообразующих минералов (силикатов, глинистых частиц, известняка) и продуктов распада органического материала, гумуса. Пустоты между этими структурами заполнены частично водным раствором (жидкая фаза, почвенная влага, почвенный раствор), а частично газом преимущественно иного состава, чем атмосферный воздух (почвенный воздух). Для роста растений оптимально, если примерно половина пустот заполнена раствором, а другая часть — воздухом для поддержания корневого дыхания. Подходящая для такого соотношения комковатая структура почвы формируется за счет преципитации отрицательно заряженных глинистых частиц известняком, который при этом нейтрализирует гуминовые кислоты, предотвращая закисление почвы.
Таблица 6.9. Перечень минеральных элементов, поглощаемых в ионной форме
Анионы |
Катионы |
||
Элемент |
Форма поглощения |
Элемент |
Форма поглощения |
N S Р СI В Mo |
Нитрат (NO3-) Сульфат (SО24-) Фосфат (РО3-4 Н2РO4-) Хлорид (СI-) Борат (ВО3-3) Молибдат (МоО2-4) |
К Mg Са Fe Мn Zn Сu |
К+ Mg2+ Са2+ Fe2+ (Fe3+) Mn2+ Zn2+ Cu2+ |
Рис. 6.20. Корневые волоски в почве
Гумус состоит из неразрушаемого материала, живых микроорганизмов, гуминовых кислот, фульвокислот и щелоченерастворимого гумина. Гуминовые и фульвокислоты представляют собой сложные макромолекулы, состоящие из фенолкарбоновых и алифатических карбоновых кислот и химически весьма стабильные (длительность существования в природе до 1 400 лет). Они обладают высокими катионообменными и окислительно-восстановительной способностями.
Элементы минерального питания присутствуют в почве в растворенной и связанной форме. Растворена лишь незначительная доля (< 0,2 % от общего количества в виде менее чем 0,01 %-го водного раствора). Примерно 98 % связаны (находятся в преципитированной форме) в минералах, труднорастворимых соединениях (сульфатах, фосфатах, карбонатах), в гумусе и другом органическом материале; они высвобождаются крайне медленно путем эрозии и химического разложения. Оставшиеся 2 % адсорбционно связаны на поверхности коллоидных почвенных частиц с избыточным зарядом. Эти ионы в отличие от растворенных не могут вымываться в раствор без дополнительного воздействия. Они высвобождаются за счет обменной адсорбции с выделяемыми растением ионами (например, Н+, НСО3-) и затем утилизируются. В качестве носителей для таких адсорбционно-связанных ионов рассматривают в первую очередь глинистые частицы и вещества гумуса. Их обменная способность зависит от плотности заряда и активной поверхности, составляющей для береговой глины монмориллонита примерно 600 — 800 м2/г, для гуминовых веществ — 700 м2/г. Заряд у глинистых частиц и веществ гумуса в основном преимущественно отрицателен, так что связанными оказываются главным образом катионы.
В меньшем объеме глинистые частицы могут связывать также и анионы. Прочность адсорбционного связывания падает для катионов в ряду АI3+, Са2+, Mg2+, NH4+, К+, Nа+, а для анионов — соответственно в ряду РО3-4, SO42-, NO3-, СI-. Ион NO3- в почве легко подвижен, К+ — в меньшей степени, а подвижность РО3-4 намного меньше, чем у других ионов. Адсорбционное связывание ионов в почве имеет значение для обеспечения растений элементами минерального питания потому, что оно препятствует вымыванию ионов, а почвенный раствор находится в связи с адсорбированным «резервуаром», из которого непрерывно и дозированно вновь поступают израсходованные ионы (см. 13.6.1).
Наконец, разнообразные соединения, выделяемые корнем (помимо органических кислот и аминокислот, выделяются сахара, витамины и т.д.), изменяют также условия существования для микроорганизмов (грибов, бактерий) в непосредственном окружении корня, ризосфере и таким образом меняют также скорости разрушения почвенных минералов и разложения органического материала этими микроорганизмами.
Существенное влияние на доступность питательных веществ почвы имеет значение pH, которое может сильно колебаться в пределах весьма малого пространства. Действие его может простираться от степени разрушения и минерализации органических веществ (в кислых почвах распад нарушен за счет чувствительности к кислотам бактерий) до структуры почвы и в конечном счете до ее ионоадсорбционных и ионообменных свойств. Различные виды растений предпочитают или выдерживают различные области значений pH почвы. Так, некоторые торфяные мхи могут произрастать лишь на кислой почве (ацидофильные виды с узкой полосой толерантности), вереск (Calluna vulgaris) оптимально растет в кислой области, но переносит также нейтральные и слабощелочные почвы (ацидофильно-базитолерантный вид). К базифильно-ацидотолераптным следует отнести, например, мать-и-мачеху (Tussilago farfara). Большинство высших растений выдерживают в монокультуре значения почвенного pH примерно между 2,5 и 8,5, с различным расположением оптимума. Этот физиологический оптимум часто не совпадает с экологическим оптимумом их распространения, так как из-за конкуренции многие виды вытесняются за пределы своего физиологического оптимума. Виды с широкой областью толерантности при этом, естественно, являются более способными к адаптации.
6.2.3.2. Поглощение минеральных элементов корнем
Корневая система растения, и в особенности кончик корня до зоны корневых волосков включительно (см. 4.4.2.1), вступает в весьма тесный контакт с почвой (см. рис.
6.20). Пронизанностъ почвы корнями достигает удивительных значений. Так, на 1 м2 площади травостоя плевела (Lolium perenne) при глубине корней 70 см масса корней составляет 35 кг, их общая длина — 55,5 км, а корневая поверхность — 50 м2.
Процесс поступления ионов в корень можно подразделить на четыре этапа:
— переход ионов в почвенный раствор путем обменной адсорбции;
— диффузия растворенных ионов в свободно доступное пространство корня (апопласт);
— поглощение ионов клеткой;
— транслокация поглощенных клеткой ионов в ксилему центрального цилиндра.
Так как ионы могут поглощаться корнями лишь в растворенной форме и значительная доля их связана с почвенными коллоидами (см 6.2.3.1), то процесс перехода ионов в почвенный раствор путем обменной адсорбции имеет существенное значение для растения. В качестве обменных ионов корень выделяет главным обра
зом Н+ и НСO3-. Последний образуется из СO2 дыхания клеток и вступает в реакцию с почвенной водой по уравнению СO2 + + Н2O ⇄ Н+ + НСO3. Протоны частично образуются в этом процессе, а частично из выделяемых корнем органических кислот или выкачиваются из клетки за счет действия протонной (Н+-транспортирующей) АТФазы (см. рис. 6.4, 6.5). За счет кислых значений pH в области корня повышается также растворимость фосфатов и карбонатов.
Из почвенного раствора ионы вначале попадают путем диффузии или с током воды в свободно доступный апопласт корня, т.е. в клеточные стенки корневых волосков и клеток коры корня. Этот процесс является пассивным. Передвижение ионов при этом вначале следует градиенту химического потенциала иона между почвенным раствором и апопластом (уравнение 6.9). В области клеточных стенок к этому добавляются адсорбционные процессы. Апопластом, или апоплазматическим пространством, обозначается та часть экстра- целлюлярного пространства, в котором молекулы воды и растворенные в ней низкомолекулярные вещества (например, ионы, метаболиты, фитогормоны) могут диффундировать беспрепятственно. В противоположность этому, совокупность цитоплазматического пространства соединенных между собой плазм одесмами клеток называется симпластом или симплазматическим пространством.1
1 Термины «апоплазматическое» и «симплазматическое» пространство в отечественной литературе не используют. — Примеч. ред.
В связи с нахождением в апопласте водного раствора его называют кажущимся свободным пространством (англ, apparent free space, AFS). Это пространство составляет от 8 до 25 % общего объема ткани. Поступление ионов в кажущееся свободное пространство как процесс неметаболический не может значительно нарушаться при действии низких температур или метаболических ядов; к тому же этот этап поглощения ионов неселективный и обратимый, т.е. вещества, проникшие в кажущееся свободное пространство, могут быть так же легко вымыты из него.
Для заряженных частиц кажущееся свободное пространство можно подразделить на два подпространства: в водном свободном пространстве (англ, water free space, WFS) ионы диффундируют в растворе, находящемся в апопласте; в доннановском свободном пространстве (англ. Donnan free space, DFS) они связываются на неподвижных зарядах апопласта. Таким образом, кажущееся свободное пространство — это сумма водного и доннановского свободного пространства (рис. 6.21, В).
Рис. 6.21. Доннановское распределение: А — возникновение доннановского потенциала. Для катионов (+) доступны компартменты 1 и 2, анионы не могут проникать через мембрану и присутствуют исключительно в компартменте 1. Катионы диффундируют по градиенту концентрации из 1 в 2, пока возникающий электрический потенциал не компенсирует концентрационный потенциал. Тогда не наблюдается дальнейшего направленного перемещения катионов. Создающийся на избирательно проницаемой мембране потенциал получил название доннановского; В — схематическое изображение кажущегося свободного пространства, состоящего из доннановского свободного пространства и водного свободного пространства в апопласте растительных клеток. Рисунок наглядно демонстрирует, что растворенные в воде ионы могут задерживаться в апопласте в доступном для свободной диффузии пространстве (WFS) и связываться далее на поверхностных структурах плазмалеммы или на несущих заряд полимерах клеточной стенки (DFS), при этом возникают доннановские распределения. Оба компартмента образуют кажущееся доступное для ионов пространство апопласта (AFS)

Доннановское распределение возникает в том случае, когда определенный тип ионов не может диффундировать через непроницаемую для него мембрану или он иммобилизован в не способной к диффузии фазе (например, в клеточных структурах) Прочно связанные или медленно диффундирующие анионы, например диссоциированные карбоксильные группы пектинов клеточной стенки на рис 6 21, В, притягивают свободно подвижные катионы из окружающей среды Если этот процесс продлится до нейтрализации фиксированных зарядов, то хотя он и приведет к установлению электронейтральности, но будет существовать концентрационный градиент катиона от ближайшего окружения фиксированного аниона (компартмент 1) к более дальнему (компартмент 2), т е система не находится в равновесии Поэтому катионы будут диффундировать из (1) в (2), пока движущие силы (градиент потенциала, с одной стороны, и концентрационный градиент, с другой) не уравновесят друг друга
Устанавливающееся равновесие получило название «доннановского» Оно отличается тем, что содержащая фиксированные ионы недиффундирующая доннановская фаза характеризуется более высокой общей концентрацией ионов по отношению к внешней фазе и постоянно существует градиент потенциала (доннановский потенциал), направление которого задается характером недиффундируемого иона при фиксированном анионе доннановская фаза в состоянии равновесия постоянно отрицательно заряжена относительно ее окружения.
Кроме карбоксильных ионов пектина в апопласте фиксированные ионы встречаются, возможно, также в виде анионных групп белков и фосфатных групп внешней стороны плазмалеммы В любом случае в кажущемся свободном пространстве преобладают отрицательные заряды, так что катионы оказываются прочно связанными Как правило, вновь поступающие катионы (например, поглощенные из внешнего раствора) не смещают доннановского равновесия, а только вытесняют ранее адсорбированные катионы, т. е. происходит обменная адсорбция Так, корень, выдержанный в растворе Са2+, станет терять адсорбированный Са2+ при переносе в раствор, содержащий ионы К+, но в чистой воде этого не произойдет, т е корень ведет себя как ионообменник.
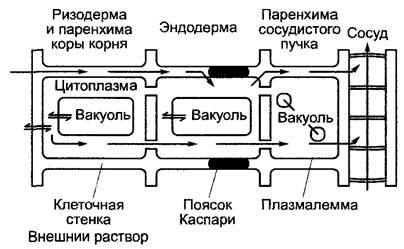
В области корня неспецифическая диффузия и абсорбция ионов из почвенного раствора в радиальном направлении может продолжаться только до эндодермы. Здесь апопластическому потоку препятствуют преимущественно состоящие из отложений лигнина и суберина (структуру см в 6.17 2, 6.17 3) пояски Каспари (см рис 3 18) в радиальных клеточных стенках. Пояски Каспари нарушают беспрепятственное проникновение воды и растворенных в ней компонентов. Самое позднее здесь, а также на всем пути от корневых волосков через ризодерму и кору корня происходит поглощение ионов в симпласт (рис 6.22). При этом плазмалемма является решающим селективным барьером, так как липидная фаза биологических мембран действует как эффективная преграда для неселективного проникновения ионов путем диффузии в центральный цилиндр корня (биомембраны см 1 5 2, 2 2 5).
Рис. 6.22. Упрощенная схема продольного разреза корня, изображающая происходящие в нем транспортные процессы при поглощении минеральных веществ (ионов)
Транспортные свойства мембраны в большинстве случаев определяются включенными в нее трансмембранными белками, которые функционируют как насосы, как переносчики (earner) или как каналы (см рис 6 4) Примеры хорошо охарактеризованных систем поступления ионов, играющих роль в корне вместе с другими, которые важны для дальнейшего изложения, приведены на рис. 6.5 При этом речь идет о вторично активных переносчиках или ионных каналах, так как поглощение ионов минеральных элементов из апопласта в клетки корня, за исключением кальция (см ниже), связано с концентрационной работой и поэтому протекает эндергонически (энергетическое сопряжение, см 6 1 5) Движущую силу этого процесса обеспечивает присутствующая в плазмалемме всех растительных клеток первично активная Н+-транспортируюшая АТФаза (протонная помпа, см рис 6 4, 6 5) сравнительно большой, состоящий из одной-единственной полипептидной цепи фермент (смол, массой около 100—110 кДа) при гидролизе АТФ претерпевает конформационные изменения, в ходе которых Н+-ионы стехиометрически, с затратой АТФ переносятся из цитоплазмы в апопласт. В результате электрогенного транспортного процесса возникает протон-движущая сила (см. 6.1.4.3, уравнение 6.19) около ≤ -240 мВ (∆рН 2, ∆Ем = -120 мВ).
До настоящего времени в плазмалемме охарактеризованы на молекулярном уровне симпортные переносчики для поглощения нитрата, сульфата и фосфата и ионные каналы для транспорта ионов К+, СI- и Са2+. Для изучения ионных каналов были разработаны методы электрофизиологии, которые позволяют в количественной форме изучить поток ионов через одну-единственную молекулу ионного канала (бокс 6.1).
Наиболее важные характеристики процесса поступления веществ в симпласт можно объяснить через взаимодействие пассивных и активных процессов.
Накопление: энергия протон-движущей силы достаточна для совершения значительной концентрирующей работы. Концентрация иона К+, например, в клетках водорослей и высших растений часто может быть выше 1000 и более раз по сравнению с окружающей средой. Концентрирование происходит тем сильнее, чем более разведен внешний раствор. Например, если инкубировать кусочки свеклы в проточной водопроводной воде, то через некоторое время концентрация К+ в клетках установится на уровне свыше 10 000:1 по сравнению со средой, что требует протон-движушей силы величиной не менее -240 мВ (-59 мВ на каждый порядок накопления; см. уравнение 6.19).
Селективность и насыщаемость. Способность клетки к избирательному поглощению определенных веществ по сравнению с другими (например, К+ по отношению к Na+, фосфата по отношению к силикату) велика, однако не абсолютна. С одной стороны, в определенной мере постоянно происходит неселективное, пассивное поглощение веществ, с другой — переносчики и каналы тоже не вполне строго специфичны. Так, ионы рубидия (Rb+) проходят через калиевые каналы; кальциевые каналы проводят в определенном объеме (помимо кальция) также другие двух- и одновалентные катионы. Вероятно, с помощью достаточно чувствительных методов можно обнаружить в растениях все природные элементы. Наконец, помимо высокоаффинных и специфичных, встречаются также низкоаффинные, менее специфичные системы поглощения (см. ниже).
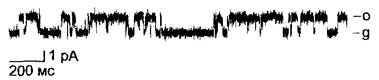
Бокс 6.1. Методы электрофизиологии
Техника «patch-clamp»
К поверхности протопласта (или вакуоли) присоединяется стеклянный микроэлектрод (1). За счет легкого подсасывания клетки (2) образуется очень прочный контакт между границей поверхности мембраны и стеклом, электрическое сопротивление которого лежит в пределах 1 — 100 ГОм. Таким путем фоновый шум сокращается настолько, что можно регистрировать открывание и закрывание отдельных ионных каналов, которые находятся на участке мембраны под пипеткой. Вероятностью состояния открытости канала (Р0) называют ту долю времени в пределах избранного временного интервала, в течение которой исследуемый канал находится в открытом состоянии (пропускает ионы) при определенных экспериментальных условиях (0 ≤ Р0 ≤ 1).
Если в результате дальнейшего подсасывания протопласт открывается внутрь электрода (нарушается целостность мембраны протопласта), то можно регистрировать суммарный ток через общую поверхность протопласта (3). Если, напротив, удалить остатки клетки, то на пипетке останется изолированный сектор клеточной мембраны, который своей цитоплазматической стороной обращен в окружающий раствор (4) (англ, patch — полоска, пятно, clamp — зажим, щипцы). Этот метод исследования в наибольшей степени подходит для изучения регуляции ионных каналов внутриклеточными факторами, так как состав раствора с цитоплазматической стороны мембраны можно свободно варьировать по желанию экспериментатора.
А. Принцип техники «patch-clamp»
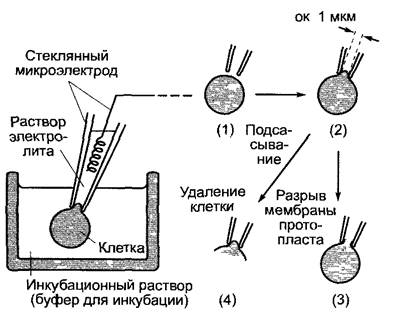
В. Патч-кпамп анализ ионного канала из клетки растения. Регистрация импульсов тока через калиевый канал клеток паренхимы побега брионии (Bryonia dioicа) Конфигурация типа (2) при приложенном напряжении +20 мВ. о — канал открыт, по нему течет ток ионов; g — канал закрыт, тока не наблюдается

С. Принцип техники липидного бислоя

Техника липидного бислоя
Активность отдельных ионных каналов, например, мембранных, которые невозможно изучать методом «patch-clamp», может быть измерена с помощью принципиально сходной электрической схемы, при которой два электрода погружаются в кювету, разделенную перегородкой на две камеры. Посередине перегородки располагается отверстие (≤ 0,2 мм), в котором находится плоский двойной слой липидов (lipid bilayer). В него могут быть встроены ионные каналы, чью активность изучают, прикладывая напряжение. Для анализа достаточно одной-единственной молекулы белка ионного канала.
D. Активность отдельного канала в липидном бислое. График активности во времени отдельного встроенного в плоской двойной слой липидов кальциевого канала из эндоплазматического ретикулума клеток брионии при приложенном напряжении +50 мВ
Если отобразить на графике поглощение ионов корнем растения (или другими тканями, например, запасающей или тканями листа) при возрастающей концентрации ионов во внешней среде, то можно получить кривые, которые формально подчиняются закономерности Михаэлиса—Ментен (рис. 6.23), действующим применительно к многим ферментам (см. рис. 6.9). Так, скорость поглощения К+ корнем ячменя достигает максимума приблизительно при 0,2 ммоль л-1. КСI во внешнем растворе, и этот максимум не будет превзойден даже при повышении концентрации до 0,5 ммоль • л-1. Если, однако, повысить концентрацию КСI до весьма высоких значений (1—50 ммоль л-1), то вновь произойдет повышение скорости поглощения.
Рис. 6.23. Скорость поглощения (v) калия в зависимости от концентрации KCI в среде. Ось абсцисс разорвана в интервале между 0,2 и 0,5 ммоль л-1KCI Сплошная линия при низких концентрациях—фаза 1 поглощения (продолжена пунктирной линией) рассчитана по уравнению Михаэлиса—Ментен с Кm = 0,021 ммоль л-1, Vmax = 11,9 мкмоль/г (сырого веса) в час
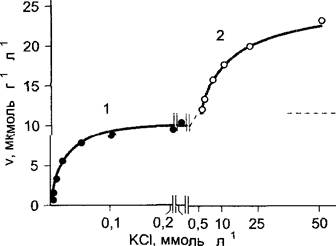
Форма кривой указывает на два различных механизма поглощения ионов К+. Механизм 1 работает при низких концентрациях иона (< 1 ммоль л1 которые соответствуют естественным концентрациям иона в почве), специфичен для К+ (и Rb+) и не зависит от природы и скорости поглощения соответствующего аниона. Такие свойства указывают на то, что за данный транспорт отвечает калий-специфический ионный канал. Механизм 2 имеет низкое сродство к субстрату и поэтому работает эффективно только при высоких концентрациях иона; относительно неспецифичен (с калием конкурируют, например, Na+и Са2+) и подвержен влиянию со стороны сопутствующего иона. Это свидетельствует о том, что в основе процесса лежит другая транспортная система.
Подобная двухфазная кинетика поглощения наблюдалась и для других катионов и анионов. Так, к примеру, при богатом сульфатном питании в корне имеется лишь одна, низкоаффинная и конститутивная (т. е. постоянно присутствующая) система поглощения. Как только содержание сульфата в среде становится ниже определенного порогового значения, индуцируется синтез второго, высокоаффинного переносчика сульфата, который эффективно работает даже при м икромолярных концентрациях иона.
Перед растением возникает здесь особая проблема, так как поглощенные анионы нитрата и сульфата восстанавливаются (см. 6 6, 6.7) и таким образом удаляются из электрохимического равновесия. Для сохранения электронейтральности катионы, лишившиеся своего противоиона (например, К+ при поглощении K2SO4 или же KNO3) должны быть нейтрализованы другими анионами. Для этого растение использует органические анионы, главным образом малат и оксалат.
Избирательное поглощение ионов из почвы может приводить к физиологически значимым сдвигам pH. Например, если вносят NН4СI, то растение будет поглощать за счет обменной адсорбции с протонами предпочтительно NН+4, что приводит к накоплению в почве ионов водорода и, следовательно, к ее закислению. Поэтому хлорид аммония является физиологически кислой солью.
Хотя железо в большинстве почв присутствует в достаточных количествах, все же для растений оно является фактором голодания, в особенности на щелочных почвах, так как лишь небольшое количество этого элемента находится в растворенном состоянии (как Fe3+). Дело в том, что в щелочной среде в соответствии с уравнением 2Fe(OH)3 —> Fe2O3ЗН2Oобразуется нерастворимый оксид железа(III). К тому же корни поглощают железо предпочтительно в виде двухвалентных ионов, Fe2+. Концентрация растворенного железа, однако, значительно повышается за счет выделения почвенными бактериями и грибами органических соединений с хелатирующими Fe3+свойствами, так называемых сидерофоров (греч. sideros — железо; pherem — нести). Двудольные и однодольные растения (за исключением злаков, Роасеае) выделяют ионы водорода для улучшения растворимости Fe3+и органические кислоты — для снижения pH в ризосфере. Они восстанавливают ионы Fe3+, диффундирующие по апопласту к поверхности клетки, на плазматической мембране клеток паренхимы корня до Fe2+, которые поглощаются клеткой с помощью специфического транспортного белка.
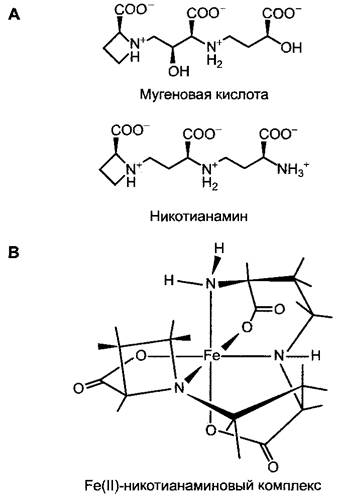
Поглощение железа у злаковых (Роасеае) происходит с помощью, выделяемой через корни мугеновой кислоты, которая образует хелатные комплексы, специфичные для Fe3+. Мугеновую кислоту и родственные соединения поэтому обозначают также как фитосидерофоры. Комплекс между Fе3+ и мугеновой кислотой через специфический транспортный белок поглощается клетками корня, где и происходит восстановление до Fе2+. Синтез мугеновой кислоты индуцируется лишь при недостатке железа и останавливается при достаточном обеспечении железом.
В пределах самого растения транспорт Fе2+ также осуществляется в форме хелатных комплексов. Хелатором является структурно родственный мугеновой кислоте, также синтезируемый из метионина никотианамин (рис. 6.24), который образует стабильные комплексы, но не с Fе3+, а с Fе2+ (и Мn2+, Zn2+, Со2+, Ni2+). Никотианамин
присутствует во всех растениях. У мутанта томата сhloronerva с дефектом по синтезу никотианамина наблюдаются сильные нарушения в распределении железа, которые могут быть устранены путем добавления никотианамина.
Рис. 6.24. Структура: А — фитосидерофоров мугеновой кислоты (специфична для Fе3+) и никотианамина (специфичен для Fе2+); В — Fе(II)-никотианаминового комплекса (атомы, задействованные в связывании железа, показаны серым)
В грамотрицательных бактериях, например, Escherichia coli, комплексы Fe(III) с сидерофорами Fе(III)-феррихромы) активно транспортируются в периплазму высокоаффинными пронизывающими внутреннюю мембрану переносчиками и накапливаются там, превышая содержание в окружающей среде. Энергия для этого обеспечивается электрохимическим потенциалом цитоплазматической мембраны, который влияет на активность переносчика с помощью пересекающего периплазму комплекса белков.
Ионы, поступившие в симпласт в области корневых волосков или клеток паренхимы коры корня, далее передаются от клетки к клетке (см. рис. 6.22) с помощью плазмодесм. Транспорт от клеток эндодермы в центральный цилиндр из-за поясков Каспари может происходить только по симпласту. Процессы загрузки ионов в водопроводящие пути центрального цилиндра еще недостаточно ясны. Вероятно, в выходе ионов в апопласт центрального цилиндра задействованы преимущественно активные и селективные процессы в эндодерме или в паренхиме ксилемы (рис. 6.22).
Клетки паренхимы коры корня запасают в своих больших вакуолях минеральные питательные вещества, которые таким образом хотя и извлекаются из непосредственного паренхиматического транспорта, но при необходимости всегда могут вновь высвобождаться. Это позволяет смягчить колебания в обеспечении растения минеральными веществами. Аналогичное сглаживание колебаний концентрации минеральных веществ происходит при связывании ионов (прежде всего катионов) заряженными группами, входящими в структуру стенок, проводящих воду сосудов ксилемы; при падении концентрации ионов в ксилемном соке они могут вновь высвобождаться (см. 6.3).
На всем протяжении проводящих воду сосудов минеральные соли могут поступать из транспортного тока в апопласт или симпласт (и в конце концов также в вакуоли) соседних тканей, механизм этого процесса принципиально тот же, что и в корне. В местах интенсивной транспирации (например, на кутикуле замыкающих клеток устьиц) это может привести к накоплению минеральных веществ.
Часть неорганических ионов может поступать из ксилемы или паренхимы в пути транспорта ассимилятов флоэмы и распространяться вместе с ассимилятами. Подвижность во флоэме других ионов ограничена, наконец, третьи ионы практически неподвижны (табл. 6.10).
Таблица 6.10. Подвижность минеральных элементов во флоэме
Подвижны |
Умеренно подвижны |
Неподвижны |
Калий |
Железо |
Литий |
Рубидий |
Марганец |
Кальций |
Цезий |
Цинк |
Стронций |
Натрий |
Медь |
Барий |
Магний |
Молибден |
Алюминий |
Фосфор |
Кобальт |
Свинец |
Сера |
Бор |
Полоний |
Хлор |
Серебро Фтор |
К ионам первой группы, которые могут перераспределяться в растении в зависимости от потребности, например, транспортироваться из старых в молодые листья и другие органы, относится К+, как наиболее важный катион. Предполагают, что калий может выполнять специфические функции при флоэмном транспорте (см. 6.8). В то время как азот и сера перемещаются во флоэме в абсолютном преимуществе в составе органических соединений, хлорид и, прежде всего, фосфат транспортируются в значительных количествах как свободные анионы. Относительно высокие концентрации свободного фосфата в ситовидных трубках (около 2 — 4 ммоль • л-1) обусловливают то, что катионы, входящие в состав труднорастворимых фосфатов (например, кальций, барий, свинец), во флоэме практически неподвижны.
Это имеет ряд далеко идущих последствий в первую очередь для кальция. Так, существуют предположения, что низкая концентрация Са2+, который играет в клетке значительную роль в поддержании структуры мембран, может стать причиной глубоких изменений цитологии ситовидных элементов (например, дегенерации тонопласта и клеточного ядра, отчасти сильных структурных видоизменений органелл — см. 3.2.4.1). Единственная биомембрана ситовидного элемента, плазмалемма, могла бы получать необходимый Са2+ из граничащего с ней апопласта.
Другое следствие неподвижности Са2+ во флоэме, с одной стороны, и его способности к передвижению вместе с транспирационным током, с другой стороны, состоит в том, что соотношение Са/К в золе органа тем ниже, чем более его флоэмное питание превалирует над ксилемным. Оно очень низкое, например, для клубней картофеля и плодов арахиса, которые снабжаются почти исключительно через флоэму. (Они растут в почве, поэтому у них не существует падения водного потенциала между корнем и органом и, следовательно, невозможно обеспечение за счет транспирационного тока.) По соотношению Са/К можно различить растительных ксилемных и флоэмных паразитов; у первых (например, Viscum, омела) это соотношение высокое и может доходить до более чем 3:1, у последних (например, у Cuscuta, повилика) низкое — около 1:17.
В конечном счете, отсутствие флоэмного транспорта кальция и других неподвижных элементов ведет к тому, что они непрерывно накапливаются в органах транспирации, прежде всего листьях, и в отличие, например, от калия и фосфата и перед листопадом не переходят в другие органы (например, в ствол). Постоянное необратимое накопление кальция и других неподвижных во флоэме элементов, вероятно, является причиной того, что даже так называемым «вечнозеленым» растениям приходится время от времени обновлять листву. Так, продолжительность жизни листьев сосны (хвои) составляет 2 — 3 года, у ели при росте на малой высоте над уровнем моря (<300 м) — 5 — 7 лет, а у растущих на большей высоте (1 600 — 2 000 м) __ 11 — 12 лет, у пихты — 5 — 7 лет, у горной сосны (Pinus mugo) — 6 — 8 лет. Возраст листьев вечнозеленого лавра не превышает 6 лет, а у плюща и падуба (Ilex) листья редко живут более 2 лет.
Если растения, выросшие на среде, богатой кальцием, перенести на среду без кальция, то уже имеющиеся листья будут показывать избыток кальция, тогда как новые листья имеют все симптомы его недостаточности.