БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
6. ФИЗИОЛОГИЯ ОБМЕНА ВЕЩЕСТВ
6.4. Фотосинтез. Световые реакции
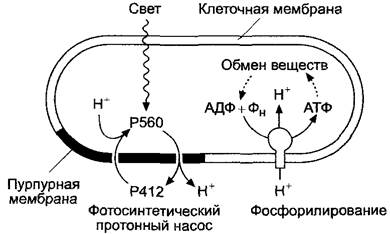
Способность синтезировать органические соединения из неорганических с помощью энергии солнечного света — отличительная черта фотоавтотрофных организмов (см. табл. 6.1); этот процесс в целом называется фотосинтезом. С одной стороны, в процессе фотосинтеза из углекислого газа атмосферы образуются углеводы (ассимиляция углерода, см. 6.5). С другой стороны, солнечная энергия служит для образования аммонийного азота из поглощенного нитрата (ассимиляция нитрата, см. 6.6) и для превращения сульфата в сульфид (ассимиляция сульфата, см. 6.7). Углерод, азот и сера при этом восстанавливаются, причем в случае зеленых растений, цианобактерий и прохлоробактерий1 необходимые электроны отнимаются от воды, а в случае некоторых фотосинтетически активных бактерий они поступают из других источников (см. табл. 6.1). В световой фазе фотосинтезапосле поглощения кванта света в фотосинтетических реакционных центрах, связанных с мембраной, высвобождаются электроны пигмента хлорофилла, а затем переносятся по электрон-транспортной цепи на ферредоксин. Восстановленный ферредоксин служит донором электронов при ассимиляции азота и серы или для восстановления окисленных пиридин- нуклеотидов (у цианобактерий, прохлор- бактерий и зеленых растений — НАДФ+, у обычных фотосинтетически активных бактерий — НАД+), образуя восстановительный эквивалент НАДФН + Н+ (или НАДН+ + Н+). Фотосинтетический транспорт электронов сопряжен с направленным транспортом ионов водорода через мембрану, что используется в синтезе АТФ.
1 Прохлоробактерий (Prochlorales) по пигментному составу и структурной организации близки к хлоропластам зеленых растений: содержат хлорофилл b, имеют граны и т.д. Иногда их объединяют с цианобактериями, но здесь, чтобы подчеркнуть роль прохлоробактерий в качестве «предков- хлоропластов, их рассматривают отдельно. — Примеч. ред.
Положительный заряд реакционных центров высших растений, цианобактерий и прохлоробактерий восполняется электронами воды. АТФ, образованная в световую фазу, и восстановленный НАДФН (или НАДН) используются для ассимиляции углерода. Синтез углеводов из СO2 (см. 6.5) часто называют темновой фазой фотосинтеза, потому что он напрямую не зависит от света, а при наличии АТФ и НАД(Ф)Н мог бы протекать в темноте. Световые реакции фотосинтеза у зеленых растений и цианобактерий происходят на мембранах тилакоидов. Они находятся в строме хлоропластов зеленых растений (см. 2.2.9.1; рис. 2.83). Мембраны тилакоидов цианобактерий состоят из складок плазматической мембраны и лежат в цитоплазме (см. рис. 2.89). У других фотосинтезирующих бактерий световая фаза протекает на плазматической мембране.
Среди автотрофов наиважнейшую роль играют фотоавтотрофы, которые покрывают свою потребность в энергии за счет энергии светового излучения; хемоавтотрофы (см. табл. 6.1 и разд. 6.9), получающие необходимую им энергию от окисления неорганических соединений, отстают в количественном отношении. Таким образом, фотосинтез представляет основу для жизни на Земле. Это подтверждается и расчетами: несмотря на существенно меньшее количество видов (примерно 400 000 видов растений по сравнению с более чем 2 млн видами животных), общая произведенная растительная биомасса (фитомасса) почти в 1 000 раз больше животной биомассы (зоомасса, включая человека). Фитомасса, со своей стороны, более чем на 99 % образована наземными растениями (табл. 6.16). Глобальная фиксация СО2 растениями на Земле составляет около 275 млрд т в год.
Таблица 6.16. Биомасса Земли и ее распределение на суше и в океанах (сухой вес в 109 т)
Биомасса |
Континенты |
Мировой океан |
Фитомасса |
1837 |
3,9 |
Зоомасса |
1,005 |
0,997 |
Человек |
0,052 |
|
Суммарная биомасса |
1 838,057 |
4,897 |
6.4.1. Свет и световая энергия
Основой всех фотосинтетических процессов является поглощение пигментами энергии излучения световых квантов. Следовательно, в природе фотосинтез зависит от солнечного света. Электромагнитное излучение Солнца происходит при превращении атомов водорода в атомы гелия:
4Н —> 42Не + 2β+ + ∆Е, (6.40)
где β+ — положительно заряженные частицы — позитроны.
Дефект масс, возникающий при слиянии ядер (атом гелия на 0,029 массовых единиц легче, чем четыре атома водорода), приводит к высвобождению энергии в форме магнитного излучения ∆Е.
Ежедневно Солнце излучает около 3 -1031 кДж энергии, из которых поверхности Земли достигают примерно 1,5 • 1019 кДж. Согласно формуле Эйнштейна Е = m • с2, каждые 9 • 1013кДж соответствуют 1 кг солнечной материи, превращенной в энергию. Таким образом, количество энергии, поступающее на Землю в течение дня, соответствует примерно 165 т вещества (в год около 60 000 т). Половина этой энергии достигает поверхности Земли, и только малая часть (около 0,01%) требуется растениям для фотосинтеза, в целом в год 3,6 • 1038 кДж, соответственно 40 т вещества. За счет этой энергии растения синтезируют в год около 2 • 1011 т биомассы.
Электромагнитное излучение имеет двойственную природу: его можно представить, как в виде волн, так и в виде потока частиц, состоящих из квантов. Энергию одного кванта (∆Еq) можно вывести из формулы
![]()
где h — постоянная Планка, 6,626 1034Дж с; с — скорость света, 3 108 м с-1;![]() — длина волны, нм; v — частота, с-1.
— длина волны, нм; v — частота, с-1.
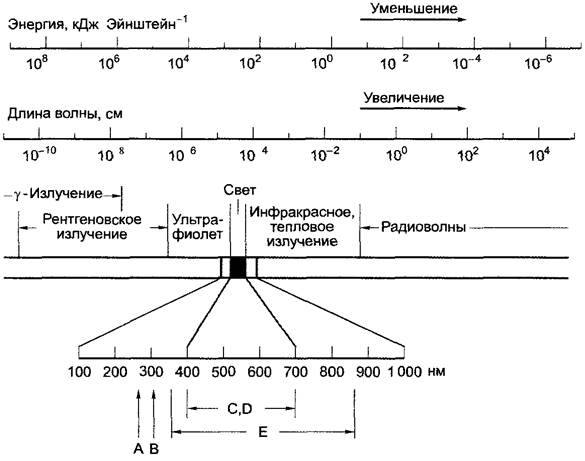
Рис. 6.41. Спектр электромагнитного излучения В области длин волн 100 — 1 000 нм происходят биологически важные процессы: А — гибель бактерий (максимум), В — солнечный ожог кожи (максимум): С — область фотосинтеза: D — видимый человеческому глазу свет, Е — область бактериального фотосинтеза. Область ультрафиолетового света в диапазоне 250 — 280 нм называется УФ-С; 280 — 320 нм — УФ-В, 320 — 390 нм — УФ-А С увеличением длины волны квантовая энергия уменьшается
Благодаря поглощающим свойствам атмосферного озона в ультрафиолетовой области (рис. 6.42), а углекислого газа и воды атмосферы — в инфракрасной, спектр поступающих на поверхность лучей сужается до 340 — 1100 нм. В воде инфракрасная область уменьшается с глубиной особенно быстро, потому что идет поглощение в красной, оранжевой, желтой и зеленой частях спектра, а диапазон голубого света сужается так, что в этой области остается лишь узкое «окошко» (рис. 6.43). Водные растения должны приспосабливаться к меняющемуся качеству света с увеличением глубины.
Согласно уравнению 6.41, энергия электромагнитного излучения увеличивается пропорционально частоте излучения. Она обратно пропорциональна длине волны, т.е. количество энергии уменьшается с возрастанием длины волны излучения.
Область электромагнитного спектра, видимую человеческим глазом, называют светом, а световые кванты — фотонами (от греч. рhos — свет). Свет охватывает область с длиной волны примерно 400 — 700 нм (рис. 6.41), весь солнечный спектр 225 — 3 200 нм, следовательно, он тянется от ультрафиолетовой до инфракрасной зоны электромагнитного спектра.
Рис. 6.42. Спектр поглощения для озона и ДНК, а также биологический спектр действия уничтожения бактерий. Спектр биологического действия немного сдвинут в область длинных волн по отношению к спектру абсорбции ДНК вероятно потому, что разрушаются также белки бактерий, которые активно поглощают в области около 280 нм. Стрелка указывает на максимум излучения (254 нм) УФ-ламп для стерилизации

Поглощение ультрафиолетового излучения в длине волны от 290 нм, которое происходит в озоновом слое, имеет решающее значение для жизни на Земле, потому что это излучение фотохимически очень активно и может разрушать нуклеиновые кислоты и белки. Его даже часто используют для уничтожения вредных микроорганизмов (см. рис. 6.42). Поэтому озоновый слой защищает нуклеиновые кислоты и белки биосферы от фотохимического повреждения. Фторохлористые углеводороды (фреоны), используемые в холодильных установках в качестве холодильного агента или как газообразующее средство в аэрозольных балло нах, ответственны за нарушение равновесия между процессами образования и разрушения озонового слоя.1
1 Озоновый экран разрушается в том числе и по другим причинам, например, под действием газов, выделяющихся при вулканических процессах. Ведущая роль фреонов (фтор-хлорзамещенных углеводородов) корректно не доказана и является одной из гипотез, объясняющих возникновение «озоновых дыр» в атмосфере.
Рис. 6.43. Изменение спектра солнечной радиации по мере прохождения лучей через атмосферу и воду. Сплошная линия — максимальная интенсивность излучения; пунктирная линия — коротковолновая и длинноволновая границы спектра (данные границы можно рассматривать как приблизительные средние величины) Зеленые, бурые и красные водоросли имеют максимум распространения в море на различной глубине
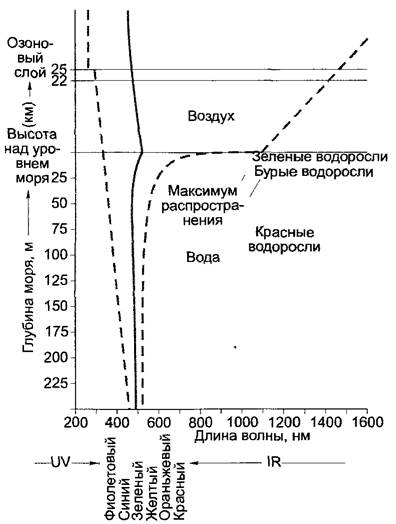
Таблица 6.17. Зависимость энергии (или свободной энтальпии реакции) и электрохимического потенциала на 1 Эйнштейн фотонов от различной длины волны
Длина волны, нм |
Цвет |
∆G. кДж Эйнштейн |
∆Е, В |
400 |
Фиолетовый |
297,5 |
-3,08 |
500 |
Сине-зеленый |
238,0 |
-2,47 |
600 |
Желтый |
198,3 |
-2,05 |
650 |
Красный |
183,1 |
-1,90 |
700 |
Пурпурный красный |
170,0 |
-1,76 |
800 |
Инфракрасный |
148,7 |
-1,54 |
900 |
Инфракрасный |
132,2 |
-1,37 |
Для характеристики биохимических процессов в качестве единиц измерения часто используются моли (1 моль = 6,023 1023 молекулы — число Авогадро, NА). Фотохимические процессы часто также рассчитывают на молекулярной основе. Энергия одного моля квантов (1 Эйнштейн) и максимальная свободная энтальпия фотохимической реакции, которая необходима при поглощении энергии 1 Эйнштейна фотонов, выражены следующим уравнением:
![]()
Используя постоянные для![]() , получаем
, получаем
![]()
Применив уравнение 6.23, ∆G = -zF∆Е (z=1) для окислительного потенциала, эквивалентного 1 Эйнштейну поглощенного протона (![]() в нм), имеем
в нм), имеем
![]()
Некоторые рассчитанные значения представлены в табл. 6.17.
6.4.2. Фотосинтетические пигменты
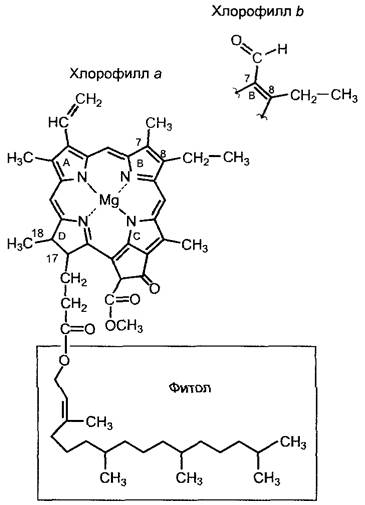
Процесс фотосинтеза начинается с поглощения фотонов фотосинтетическими пигментами, которые при этом переходят в возбужденное состояние. Основное значение для фотоавтотрофных организмов имеет хлорофилл. Главную роль для всех организмов, у которых процесс фотосинтеза протекает с выделением кислорода, возникающего при фотоокислении воды, играет хлорофилл а (рис. 6.44). У высших растений и некоторых групп водорослей (см. табл. 11.3) встречается еще и хлорофилл b. Соотношение хлорофилл а : хлорофилл b составляет 3:1'. Вместо хлорофилла b у некоторых водорослей можно обнаружить хлорофилл с. Цианобактерии и красные водоросли обладают исключительно хлорофиллом а. Вместо хлорофилла а у фотоавтотрофных бактерий встречается так называемый бактериохлорофилл (рис. 6.45).
Рис. 6.44. Структура хлорофиллов а и b (внизу— делокализированная п-электронная система)
Особое значение хлорофилла а для организмов, обладающих фотосинтетической активностью, заключается в том, что он находится в реакционных центрах, т.е. в местах первичных реакций фотосинтеза. Большая часть молекул хлорофилла входит в состав светособирающих комплексов, которые служат реакционным центрам как антенны и отвечают за более эффективное поглощение света. Другие пигменты антенн — каротиноиды. В целом пигменты антенн называются также дополнительными фотосинтетическими пигментами. Светопоглощающие фотосинтетические пигменты присутствуют не в свободном состоянии: они связаны с белками (см. рис. 6.53). В случае хлорофиллов и каротиноидов эти связи нековалентны. Дополнительными пигментами цианобактерий и красных водорослей являются также фикобилины — хромопротеиды с ковалентно связанными хромофорными грунпами.
1 Приведенное значение нельзя рассматривать как константу: соотношение хлорофиллов меняется в зависимости от вида, условий освещения, стадии развития, ткани растения. — Примеч. ред.
Хлорофилл представляет собой систему четырех пиррольных колец — порфирина, с магнием в центре и характерными заместителями на кольцах (см. рис. 6.44, 6.45). Четыре пиррольных кольца соединены метановыми мостиками. Магний ковалентно связан с двумя атомами азота и образует с другой парой атомов азота координационную связь.1Хлорофиллы а и b различаются замещенной группой у седьмого атома углерода хлорофилл а несет метиловую группу, хлорофилл b — формильную. На С17 все хлорофиллы имеют пропионовый остаток, с которым эфирной связью соединен липофильный спирт, в случае хлорофилла а и у хлорофилла b это фитол. Он служит для закрепления молекул хлорофилла в липофильной области хлорофиллсодержащих белков антенн или реакционных центров. Фитол — это дитерпен, обладающий 20 атомами углерода (биосинтез терпенов, см 6 16 2).
1 Из-за того, что в порфириновом кольце есть система сопряженных двойных связей, электроны всех четырех атомов азота делокализованы, и все 4 связи с магнием можно считать равноценными. — Примеч. ред.
Рис. 6.45. Структурные соотношения между различными хлорофиллами и бактериохлорофиллом
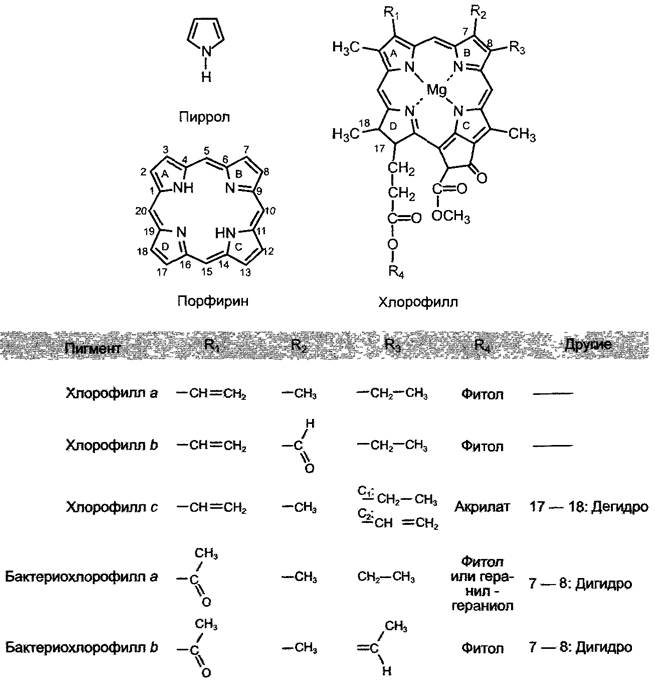
Рис. 6.46. Спектр поглощения и спектр действия (серая линия) фотосинтеза хлореллы в сравнении со спектрами поглощения важнейших фотосинтетических пигментов (в органических растворителях). Спектр действия получают путем облучения клеток монохроматическим светом различной длины волны, но одинаковой интенсивности (мольфотонов м 2), с использованием универсального метода определения необходимых параметров фотосинтеза (например, выделение кислорода). Часто устанавливают максимум наблюдаемого действия, равный 100%, и дают спектр действия как относительную эффективность кванта
Освобожденный от фитола хлорофилл является хлорофиллидом, а хлорофиллид без центрального атома называется феофорбидом. Если из хлорофилла удаляют центральный атом магния (мягко воздействуя кислотой), то получают феофитин. Он является переносчиком электронов, а также входит в состав реакционных центров (фотосистема II, см 6 4 5, реакционный центр у пурпурных бактерий, см 6 4 10). Биосинтез порфиринов обсуждается в гл 6 15
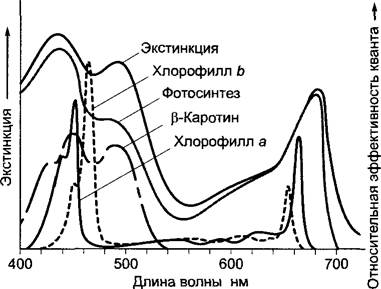
Большая часть хлорофиллов поглощает свет в области 400 — 480 нм (голубой) и 550— 700 нм (от желтого до красного) (рис 6 46). Бактериохлорофилл а пурпурных бактерий поглощает свет в пределах 400 нм УФ-области и в дальней красной и инфракрасной части спектра между 700 — 850 нм. Максимум поглощения бактериофилла b зеленых серных бактерий находится в районе 1000 нм. Между 480 и 550 нм в области зеленого света поглощающая способность хлорофилла очень мала (возникает так называемый «зеленый провал»). Поэтому раствор хлорофилла и хлорофиллсодержащие части растений человеческому глазу кажутся зелеными «Зеленый провал» хлорофилла а частично закрывается благодаря поглощению дополнительных пигментов хлорофилла b и каротиноидов. Цианобактерии и красные водоросли закрывают эту область спектра, открытую из- за поглощения света зелеными водорослями, благодаря своим дополнительным пигментам фикобилинам, к которым относятся фикоэритрин и фикоцианин. Поэтому цианобактерии и красные водоросли могут найти свет для фотосинтеза даже в глубоководной зоне, ниже зарослей зеленых водорослей Бактерии, имеющие в своем составе бактериохлорофилл а или b, в состоянии использовать энергию волн той части спектра, в которой не могут поглощать остальные фотосинтезирующие бактерии (рис. см. 6.46, 6.47).
Рис. 6.47. Спектры поглощения важнейших фотосинтетических пигментов (хлорофиллы и β-каротин — в органических растворителях, фикобилипротеиды — в водном растворе)
Хотя хлорофилл использует солнечный свет не оптимально («зеленый провал»), он образовался на ранней стадии эволюции (бактериохлорофиллу а пурпурных бактерий уже более 3 млрд лет), и с тех пор изменился мало. То, что в процессе эволюции хлорофиллы стали основными фотосинтетическими пигментами, связано со свойствами этих молекул: порфириновое ядро и несколько его заместителей (см. рис. 6.45) образуют систему сопряженных двойных связей. Участвующие в этом п-электроны образуют единую молекулярную орбиталь, в которой электроны не только колеблются, но и могут циркулировать в кольцевой системе. Этот феномен — одна из причин высокой стабильности соединений этого класса. Фактически порфирины относятся к самым стабильным химическим соединениям и, например, в нефти и угле (которым по 400 млн лет) находятся в химически почти неизмененной форме.
Сильно делокализированные п-электроны системы порфириновых колец можно поднять на более высокий уровень только с помощью определенного количества энергии, например, при поглощении фотонов с относительно большой длиной волны (рис. 6.48). При этом молекула переходит в возбужденное состояние, в котором она характерным образом может вступать в дальнейшие реакции.
Рис. 6.48. Возбужденные состояния хлорофиллов (на примере хлорофилла). Основной энергетический уровень дает несколько подуровней, что является следствием колебательных движений внутри молекул, а также из-за вращения определенных групп атомов в молекулах наблюдаются слабые отклонения в энергетическом состоянии (так называемые колебательные и вращательные подуровни). В органических молекулах такие процессы ведут к появлению более или менее широких пиков поглощения вместо спектра, состоящего из узких полос, который характерен для атомов. На схеме показаны спины электронов в возбужденных синглетном и триплетном состояниях в сравнении с основным состоянием, а также часть спектра поглощения хлорофилла а, обусловленная переходом S0 —> S1
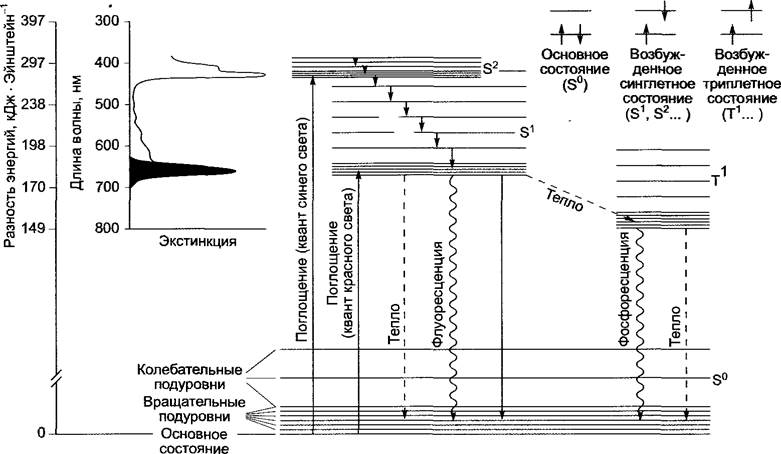
В молекулах с четным числом электронов все орбитали заняты парами (синглетное состояние, S0). После поглощения фотона электрон занимает более высокий энергетический уровень, сохраняя свое направление спина (возбужденное синглетное состояние S1, S2 и т.д., в зависимости от поглощенной энергии). Электроны в таком возбужденном состоянии через короткий промежуток времени снова переходят в свое основное состояние, отдав энергию возбуждения, или же происходит поворот спина возбужденного электрона (триплетное состояние). Таким образом, у неспаренных электронов направления спина будут параллельны (см. рис. 6.48). Поворот спина может произойти тогда, когда электрон находится в возбужденном синглетном состоянии более длительный промежуток времени, чем требуется для процесса оборота спина (около 10-9 с).
Возбужденное состояние, важное для хлорофилла, — это первое синглетное состояние (соответствует поглощению кванта красного света), второе синглетное состояние (поглощение кванта синего света) и первое триплетное состояние, которое достигается только с S1-уровня, так как длительность его существования достаточно велика (около 15 • 10-6с). Возбужденное S2-состояние оказывается слишком короткоживущим (10-12 с) для оборота спина.
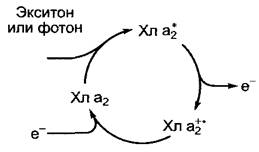
Как показывает рисунок 6.48, отдача поглощенной энергии возбужденного хлорофилла происходит различными способами. Только часть этих процессов можно использовать для производства химической работы. Это связано с переходом S1 —> S0. В данном случае может произойти переход энергии (перенос экситонов) без излучения от одной молекулы хлорофилла к другой, если они находятся достаточно близко друг к другу (расстояние менее 10 нм) и, если максимум поглощения второй молекулы пигмента ниже (более длинноволновая форма), чем способность отдавать энергию у первой возбужденной молекулы (более коротковолновая форма). Этот механизм особенно важен для направленного транспорта поглощенной энергии квантов света внутрь комплекса антенн и для перехода энергии на хлорофилл а реакционного центра. Спектр поглощения молекулы пигмента зависит от ее окружения (в случае хлорофиллов это белковое окружение), поэтому в комплексе антенн, содержащих хлорофилл с различными поглощающими свойствами, экситоны направляются к молекулам пигмента, которые могут поглощать свет более длинных волн, т.е. происходит перенос от молекул хлорофилла b на молекулы хлорофилла а, внутри этой группы — на формы хлорофилла а, поглощающие свет в более длинноволновой области. Конечным пунктом переноса экситонов является хлорофилл а реакционного центра, который окружен особыми белками. Его строение можно представить в виде димера (специальная пара — от англ. special pair, Хл а2), причем он обладает самой низкой энергией возбуждения во всем комплексе. Хлорофилл в реакционном центре чрезвычайно редко возбуждается под действием прямого поглощения фотона, чаще всего это происходит благодаря переносу экситона от расположенных рядом антенн.
В отличие от хлорофиллов антенн димер хлорофилла а реакционных центров передает свою энергию возбуждения не сразу; сначала в возбужденном состоянии он теряет электрон, образуя положительно заряженный радикал (Хл а1+2). При получении электрона он снова переходит в основное состояние (рис. 6.49). При оптимальном освещении этот процесс идет примерно 100 — 200 раз в секунду.
Рис. 6.49. Разделение зарядов после возбуждения димерного хлорофилла а (Хл а2) в реакционных центрах фотосистем и переход в основное состояние при присоединении электрона. При оптимальном освещении этот цикл происходит 100— 200 раз в 1 с
Процесс первичного разделения зарядов
![]()
является решающим этапом фотосинтеза. Кратковременная энергия возбуждения фотонов переводится в значительно более долгоживущий электрический потенциал,
а он может использоваться в химической работе. Усвоенная энергия частично теряется в виде тепла. Это верно для перехода S2 —» S1, так как для переноса экситона время жизни состояния S2 слишком мало. Поэтому в экспериментах по изучению фотосинтеза достаточно воздействовать красным светом, чтобы произвести переход S0 —> S1. Энергия возбужденного S1-состояния может также полностью теряться в виде тепла или же излучаться в виде света флуоресценции. Хлорофилл в триплетном состоянии не играет большой роли. Всегда лишь одна молекула хлорофилла из 10 млн находится в триплетном состоянии при освещении растения.1 При переходе в основное состояние, который происходит очень медленно из-за необходимого в этот момент оборота спина (длительность жизни T1-состояния — 10-4 — 10-2 с), может также излучаться свет (фосфоресценция). Однако хлорофилл в триплетном состоянии может стимулировать переход кислорода в синглетное состояние. Кислород в этой форме химически очень активен и может повредить клетку, поэтому в процессе эволюции возникли разнообразные защитные механизмы (см. ниже каротиноиды, а также 6.48).
1 Образование триплетных состояний зависит от интенсивности освещения, доступности СО2 и (косвенно) от обеспечения водой. В экстремальных условиях триплетных возбужденных молекул хлорофилла будет больше, чем в нормальных физиологических условиях. Чрезмерное образование триплетов хлорофилла может привести к фотодеструкции (см. далее). — Примеч. ред.
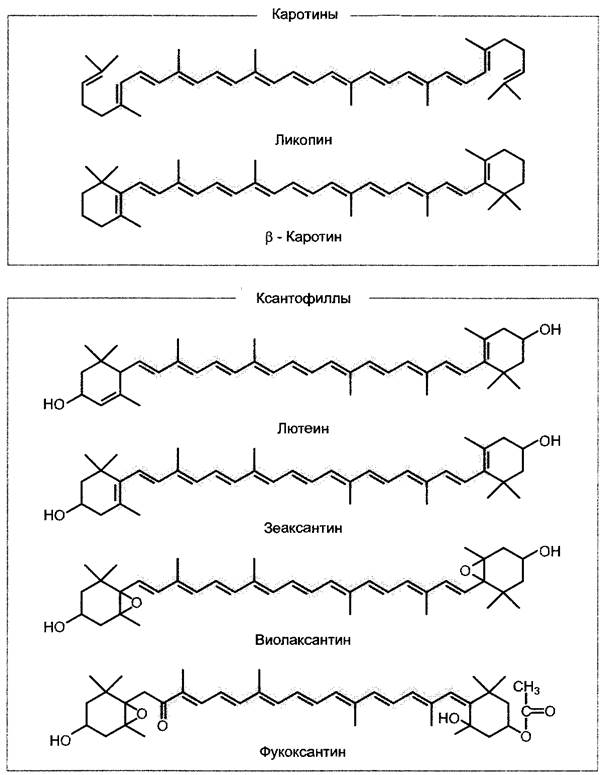
Каротиноиды считаются дополнительными фотосинтетическими пигментами, которые поглощают свет в голубой и зелено-голубой областях спектра и тем самым сужают «зеленый провал» в спектре поглощения хлорофиллов (см. рис. 6.46; 6.47). Существует две группы каротиноидов: каротины (чистые углеводороды, наиболее известен β-каротин2) и окисленные каротины (ксантофиллы), основным представителем которых у высших растений и зеленых водорослей является лютеин. Харак терная окраска бурых и диатомовых водорослей обусловливается ксантофиллом фукоксантином; ликопин1 можно встретить у пурпурных бактерий (рис. 6.50). Каротиноиды относительно плохо переносят энергию, их активность соответствует примерно 20 — 50% эффективности хлорофиллов (этот показатель лишь у фукоксантина бурых водорослей достигает 80%). По этой причине в области поглощения, присущей каротиноидам (примерно 460 — 500 нм), возникает также явное несоответствие между поглощением света и спектром действия фотосинтеза (см. рис. 6.46). Ксантофиллы зеленых водорослей и высших растений не переносят энергию возбуждения на хлорофилл а. Их главная функция в антеннах состоит в том, чтобы предотвратить образование триплетного состояния хлорофилла и тем самым предотвратить образование крайне опасного синглетного кислорода. Каротиноиды — это терпеноиды, такие, как фитол, однако в их состав входят 40 атомов углерода и поэтому они относятся к группе тетратерпенов (см. 6.12.2). Поглощение света в видимой области обусловливается большим числом сопряженных двойных связей, п-электроны которых образуют единую молекулярную орбиталь, где электроны сильно делокализированы и легко переходят в возбужденное состояние.
1 Впервые выделен из плодов томатов (Lycopersicon). — Примеч. ред.
2 Впервые выделен из корнеплодов моркови (Daucus carota). — Примеч. ред.
Рис. 6.50. Строение фотосинтетических пигментов каротиноидов. Каротины не содержат кислород, ксантофиллы являются кислородсодержащими молекулами. В формулах выделена система делокализированных п-электронов
Фикобилипротеиды являются дополнительными фотосинтетическими пигментами цианобактерий, красных водорослей и Cryptophyta. Фикоцианы (голубые пигменты) и фикоэритрины (красные пигменты) присутствуют в этих группах в различных количественных соотношениях и преобладают над хлорофиллом. Светопоглощающие структуры (хромофоры) фикобилинов — это тетрапирролы с открытой цепью (рис. 6.51), подобные желчным ферментам, которые возникают при разрушении гемоглобина (отсюда и название от греч. bilis — желчь). Через виниловую грунпу у кольца А тетрапиррола хромофоры ковалентно связаны с остатком цистеина белков-носителей (тиоэфирная связь). Фикоцианобилин является составной частью фикоцианина и аллофикоцианина, фикоэритробилин — частью фикоэритрина. Фикобилипротеиды входят в состав высокоорганизованных светособирающих структур — фикобилисом (см. рис. 2.89; 6.53). Фикобилисомы лежат на той стороне мембран тилакоидов, которая контактирует с цитоплазмой, и как антенны очень активно абсорбируют свет. Поглощенная энергия возбуждения передается на хлорофилл а реакционных центров практически на 95 % по экситонному механизму. Благодаря этой особенности и поглощающим свойствам фикобилипротеидов (см. рис. 6.47) голубые и красные водоросли способны осуществлять фотосинтез в глубокойтолще воды. У этого явления есть своя «цена»: до 40 % общего веса клеточных белков и до 30 % сухой массы клеток приходится на фикобилисомы.
Рис. 6.51. Строение фикоцианобилина и фикоэритробилина. В формулах выделена система делокализированных п-электронов Хромофоры ковалентно связаны с остатком цистеина апопротеина

При выращивании цианобактерий и красных водорослей в условиях освещения волнами различного спектрального состава наблюдается адаптация к ним фикоби- линов — хроматическая адаптация. Вероятнее всего, она обусловлена различной транскрипционной активностью (см 7 2 2) генов белковой части различных фикобилинов. Несмотря на то что такая адаптация кажется рациональной, с физиологической точки зрения непонятно, существует ли она в естественных условиях и насколько широко распространена.
Эффективность использования света в различных областях спектра, а, следовательно, и вклад различных пигментов в фотосинтез можно выяснить, сравнив спектр поглощения фотосинтетически активных организмов или органов и спектр действия фотосинтеза. У зеленых растений (см рис 6 46) существует значительное расхождение между спектрами поглощения и действия в области, где находятся максимумы поглощения каротиноидов, так как каротиноиды, как упоминалось ранее, обладают ограниченными возможностями переносить энергию на хлорофилл. То, что спектр поглощения неповрежденных клеток или тканей имеет такие же широкие абсорбционные полосы, как и выделенные пигменты (см рис 6 46), объясняется изменением поглощающей способности пигментов вследствие их связи с белками светособирающих комплексов. Благодаря этому же сужается так называемый «зеленый провал» в спектре поглощения. Тонкие различия в спектрах поглощения фотосинтетических пигментов, возникающие из-за находящихся рядом белков, являются основой для направленного переноса экситонов внутри антенн.
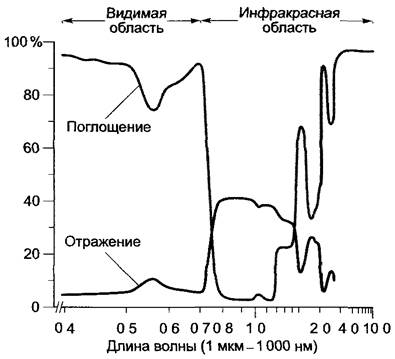
При сравнении спектров поглощения и отражения листовых пластинок (рис 6 52) видно, что абсорбция при отражении не только снижается в зеленой области, но и сильно падает в инфракрасной между 700 и 2 000 нм, в то время как поглощение здесь максимально Так как листовые пластинки отражают в инфракрасной области сильнее, чем иглы хвои, можно легко отличить лиственный лес от хвойного с помощью аэрофотосъемки в инфракрасных лучах Поскольку излучение в инфракрасной области не содержит большого количества энергии, пригодной для фотосинтеза, а с другой стороны, почти половина энергии Солнца, поступающей на поверхность Земли, рассеивается, то использование этой длины волны приводило бы лишь к нагреванию листовых пластинок, т.е. с биологической точки зрения оно нецелесообразно. Не нужна также интенсивная абсорбция в области очень больших длин волн (>3 000 нм), так как они практически не достигают поверхности Земли. Однако в связи с тем, что области наилучшего поглощения являются одновременно и зонами оптимального излучения, лист может быстро отдать тепло, поглощенное вместе с солнечным светом.
Рис. 6.52. Спектры поглощения и отражения листьев тополя (Populus deltoides). Поглощение все еще происходит. Обратите внимание на высокий уровень отражения в инфракрасной области («прохладная тень леса»)
Опушение листьев может значительно увеличить отражение в видимой области и соответственно снизить поглощение. Сильно опушенные листья пустынного растения Encelia farinosaпоглощают, например, лишь 30 % излучения между 400 и 700 нм, а неопушенные листья вида Encelia с таким же содержанием хлорофилла — 84%.
6.4.3. Строение светособирающих антенн
У всех фотосинтезирующих организмов световая энергия поглощается сложно организованными антеннами, в которых фотосинтетические пигменты связаны с белками ковалентными или нековалентными связями. Точная ориентация молекул пигмента обеспечивает переход энергии внутри антенны (транспорт по экситонному механизму), при котором не происходит излучения. Структурная связь антенн с фотосинтетическим реакционным центром делает возможным перенос энергии возбуждения от антенн к реакционному центру также в форме экситонов. В результате светособираюшие антенны повышают эффективность реакционного центра, потому что входящая в него молекула пигмента может перейти в возбужденное состояние лишь в редком случае благодаря прямой абсорбции фотона.
Строение антенн неодинаково у разных групп фотосинтетически активных организмов, но еще не до конца изучено (рис. 6.53). Антенны могут располагаться в фотосинтетически активных мембранах, как у пурпурных бактерий и зеленых растений, могут состоять из маленьких встроенных в мембрану интегральных белков, а также из больших комплексов, расположенных на цитоплазматической стороне мембраны (у цианобактерий и зеленых серных бактерий). Вероятно, большие антенны являются приспособлениями, которые позволяют цианобактериям и серным бактериям использовать для осуществления фотосинтеза свет очень низкой интенсивности, какой, например, проникает в морские глубины.
Рис. 6.53. Схема строения различных светособирающих антенн фотосинтезирующих организмов: А — хлоросома зеленых серных бактерий (Chlorobium), предполагаемое строение; В — фикобилисома цианобактерий и красных водорослей (Rhodophytа). Фикобилисомы ассоциированы с димером фотосистемы II, Состав пигментов антенны может быть различным у разных видов; С — строение антенн пурпурных бактерий, если смотреть на клеточную мембрану сверху; 9-11 LН2-комплек- сов связаны с одним LH1-комплексом; структура реакционного центра пурпурных бактерий более детально изображена на рис. 6.65; D — строение антенны зеленых растений; вид НС на мембраны тилакоидов; СР43 и СР47 образуют внутренние антенны, СР26, СР29 и LHCII — периферические антенны, причем LHCII служит главной антенной. Вероятно, имеется 4 (показано только 2) тримерных LHCII-комплекса антенн на каждую димерную фотосистему II. АР — аллофикоцианин; СР — хлоропластный белок (число обозначает молекулярную массу, кДа); PC — фикоцианин; РЕ — фикоэритрин; LH1 — центральная антенна; LH2 — периферическая антенна LHC (англ. light harvesting complex) (светособирающий комплекс)
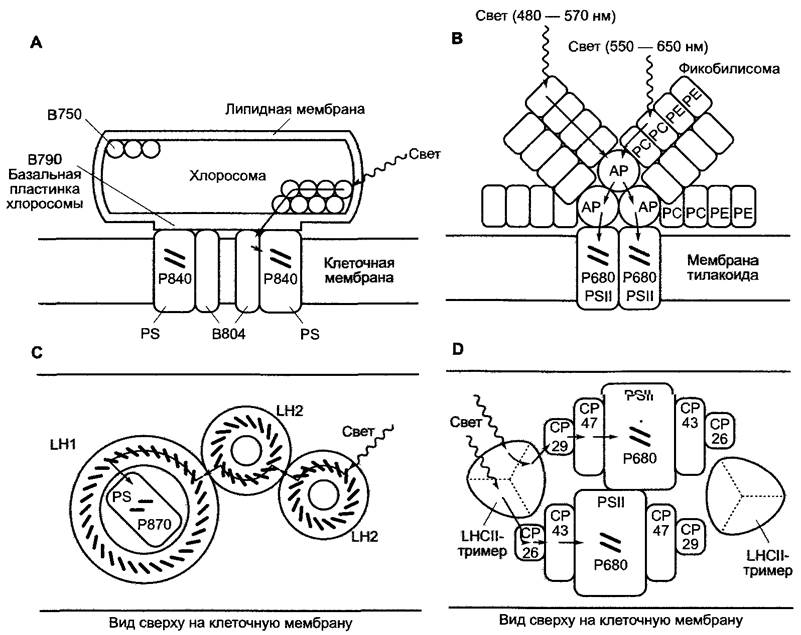
В хлоросомах зеленых серобактерий (рис. 6.53, А) светособирающий комплекс на цитоплазматической стороне мембраны состоит из 10000 молекул бактериохлоро- филла (преимущественно бактериохлоро- филл с), связанных с белками. Они окружены липидными мембранами и контактируют своим основанием (в основании — бактериохлорофилл а) со встроенным в мембрану светособирающим комплексом, окружающим реакционный центр. Перенос экситонов происходит от бактериохлорофилл а с, который поглощает при длине волны около 750 нм (В750) через молекулы бактериохлорофилла а, находящиеся в основании (В790), к бактериохлорофиллу а интегрированного в мембрану светопоглощающего комплекса (В804) и, наконец, к бактериохлорофиллу а реакционного центра (Р840).
Фикобилисомы (см. рис. 6.53, В) лежат на мембране тилакоидов, которая ответвляется от плазматической мембраны. Они располагаются толстым слоем (примерно 400 фикобилисом на 1 мкм2) со стороны цитоплазмы (см. рис. 2.89) и связаны белками с реакционными центрами, встроенными в мембраны тилакоидов. Таким образом, перенос экситонов может происходить от фикоэритринов (поглощение при 480 — 570 нм) через фикоцианин (абсорбирует при 550—650 нм) на аллофикоцианин (поглощает при 600 — 680 нм), а затем на димер хлорофилла а реакционного центра фотосистемы II (см. 6.4.5).
Антенны пурпурных бактерий (рис. 6.53, С) являются интегральными комплексами плазматической мембраны. Центральная антенна (LH1, от англ, light harvesting — светособирающий), вероятно, кольцом окружает реакционный центр, который наряду с пигмент-связывающим белковым комплексом содержит каротиноиды и 32 симметрично расположенные молекулы бактериохлорофилла а. У некоторых видов при каждом реакционном центре присутствуют еще 8 —10 периферических антенн (Н2), которые также построены в виде кольца и на каждом кольце несут 27 молекул бактериохлорофилла а. Они расположены двумя слоями, лежащими один на другом, включающими по 18 или 9 молекул. Так, к каждому реакционному центру присоединены в общей сложности 250— 300 молекул пигмента. Перенос экситонов совершается от LН2 через LН1 к димеру бактериохлорофилла а реакционного центра (Р870).
У зеленых растений к двум типам реакционных центров (фотосистема II и фотосистема I, см. 6.4.4) вплотную присоединены антенны (так называемые коровые антеппы, от англ. core — «центр, ядро», далее — «интегрированные антенны»). В фотосистеме I они состоят примерно из 100 молекул хлорофилла а на каждую фотосистему и обслуживают один реакционный центр (см. рис. 6.61). Интегрированные антенны фотосистемы II — это две субъединицы белкового комплекса (СР43 и СР 47) с 15 ассоциированными молекулами хлорофилла а (см. рис. 6.59). С этими антеннами контактируют периферические подвижные светособирающие комплексы, которые интегрированы в мембраны, причем пигмент-белковые комплексы СР26, СР29 и LHCII находятся в контакте друг с другом. Главную антенну образует LHCII (LHC от англ. light harvesting complex — светособирающий комплекс) (см. рис. 6.53, D). Структурное изучение LHCII показало, что каждый белок связан с 7 молекулами хлорофилла а, 5 молекулами хлорофилла b и 2 молекулами лютеина. Хлорофилл bнаходится в периферической области, а хлорофилл а — в центре белка (рис. 6.54). Молекулы хлорофилла находятся на расстоянии лишь 0,5 — 3 нм друг от друга, благодаря чему обеспечивается эффективный перенос экситонов. LНОII в мембране тилакоидов находится в виде тримера. Считают, что LНСII может взаимодействовать с имеющими сходное строение центральными антеннами фотосистемы I и таким образом регулировать распределение энергии между обеими фотосистемами (см. 6.4.4). Каждый реакционный центр фотосистемы II обслуживается примерно 300 молекулами пигмента в составе антенн. Перенос экситонов происходит от периферического хлорофилла b через молекулы хлорофилла а комплекса на хлорофилл а интегрированных антенн и центральных антенн и, наконец, к реакционному центру фотосистемы II (димер хлорофилла а, Р680). Аналогичным образом может функционировать и светособирающий комплекс фотосистемы I, однако его структура подробно еще не изучена. Одна «фотосинтетическая единица», т.е. одна полная электрон-транспортная цепь, от фотосистемы II до фотосистемы I (см. 6.4.4, рис. 6.55) может обслуживаться примерно 500 молекулами пигментов (хлорофиллы а и А, каротиноиды).
Рис. 6.54. Структурная модель хлорофилл а/b-связывающего белка и пространственное расположение фотосинтетических пигментов в тримерном светособирающем комплексе фотосистемы II (LСНII, см. рис. 6.53, D)

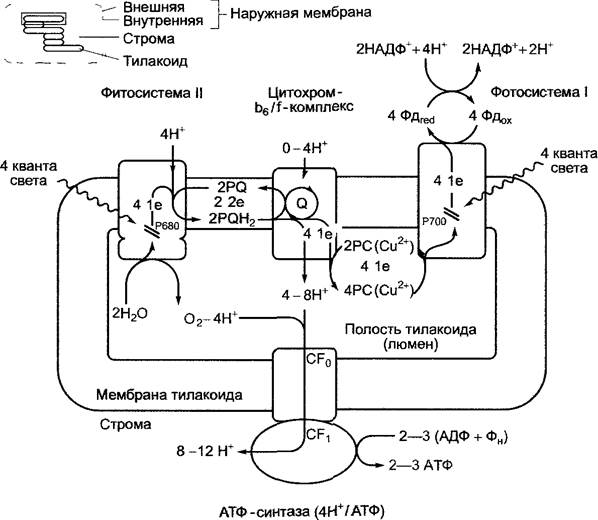
6.4.4. Транспорт электронов и протонов при фотосинтезе
Для лучшего понимания вопроса мы не будем в дальнейшем рассматривать антенны, а остановимся только на выходе экситона из антенн. В данном разделе рассмотрим процессы, происходящие в зеленых растениях (процессы, протекающие в цианобактериях и прохлоробактериях, аналогичны). Остальные световые реакции, присущие бактериям, обсуждаются в разделе 6.4.10.
Рис. 6.55. Общая схема фотосинтетического транспорта электронов и ионов водорода, а также фотофосфорилирования зеленых растений. Дальнейшие комментарии см в тексте, локализация фотосинтетического комплекса и АТФ-синтазы в области гран или стромальной части мембраны тилакоида показаны на рис 6 57 У цианобактерий системы и ход реакций аналогичны. Однако у этих организмов пластоцианин заменен цитохромом. Fd — ферредоксин, РС — пластоцианин, РО — пластохинон, Q — Q-цикл (см. рис. 6.60)
Уже в 1937 г. Хилл наблюдал, что освещаемый экстракт листьев (изолированные мембраны тилакоидов) в присутствии искусственных акцепторов электронов (А), таких, как Fе3+, или восстановленных пигментов, выделяют О2. В реакции Хилла обязательно присутствие Н2О в качестве донора электронов; СО2 в ней не участвует:
![]()
Это означает, что кислород, выделяющийся при фотосинтезе, происходит из молекул воды и что освещаемые мембраны тилакоидов, отнимая электроны от воды, восстанавливают растворенные акцепторы электронов, а не СО2. Следовательно, процесс восстановления СО2 для образования углеводов отделен от световых реакций. Он называется темновой фазой (см. 6.5.1 — 6.5.3).
В естественных условиях акцептором электронов в реакции Хилла, протекающей в хлоропластах, является НАДФ+:
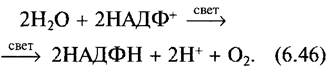
Свободная энтальпия (при pH 7; см. 6.1, уравнение 6.7) для этой окислительно-восстановительной реакции составляет ∆G0' = +218 кДж • моль-1. В этой реакции два моля электронов переносятся от системы с высоким положительным окислительно-восстановительным потенциалом (Н2O/1/2O2 Е0' = +0,82 В) на систему с сильно отрицательным потенциалом (НАДФН + Н+/ НАДФ+ : Е0' - -0,32 В). (∆Е0' = -0,32 В - 0,82 В = -1,14 В на моль электронов; согласно уравнению 6.27, z = 2, ∆G0' = 218 кДж на моль образованного НАДФН + Н+.)
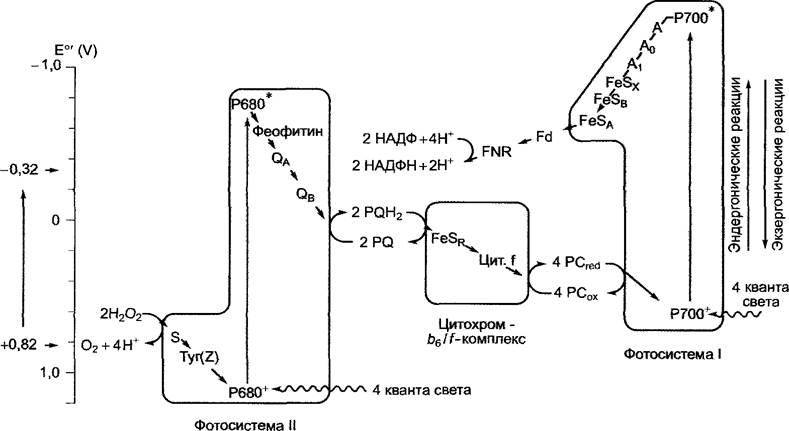
Для восстановления НАДФ+ электронами воды необходимо осуществление серии двух световых реакций, протекающих в фотосистемах I и II (нумерация фотосистем соответствует последовательности их открытия), в которых каждый раз участвуют определенные димеры хлорофиллов а обоих реакционных центров. Эти димеры хлорофилла а двух реакционных центров могут различаться поглощающей способностью: Р680 — реакционный центр, который имеет максимум поглощения при 680 нм и входит в состав фотосистемы II (ФСII); Р700 — реакционный центр в составе фотосистемы 1 (ФСI), максимум поглощения приходится на 700 нм.
Существование двух фотосистем было впервые выявлено при определении квантового выхода (моль O2 произведенного на моль поглощенных квантов) в зависимости от длины волны. Обнаружилось сильное снижение квантового выхода в длинноволновой красной области, при длине волны больше 680 нм (red drop — «красное снижение»), так как спектры поглощения и фотосинтеза здесь сильно различаются (см. рис. 6.46). Напротив, при воздействии короткими волнами красной области спектра (650 нм) получали синергичное увеличение квантового выхода (квантовый выход при одновременном облучении светом 650 и 700 нм существенно выше, чем сумма квантовых выходов при облучении светом длиной волны либо 650 нм, либо 700 нм). Данный эффект был назван по фамилии ученого, открывшего его ученого эффектом Эммерсона. Эммерсон впервые доказал существование взаимодействия двух фотосистем с различной способностью к поглощению света.
Суммарный процесс световой реакции, начиная с воды и заканчивая этапом образования НАДФН + Н+ представлен на рис. 6.55. Понятно, что световая энергия используется не только для транспорта электронов, но и для сопряженного с ним направленного транспорта ионов водорода в полость тилакоида. Химический потенциал иона водорода служит для синтеза АТФ. И наконец, в виде упрощенной схемы представлена сложная последовательность реакций, происходящих в электрон- транспортной цепи. Структура отдельных компонентов окислительно-восстановительных систем, участвующих в световой фазе фотосинтеза, изображена на рис. 6.56.
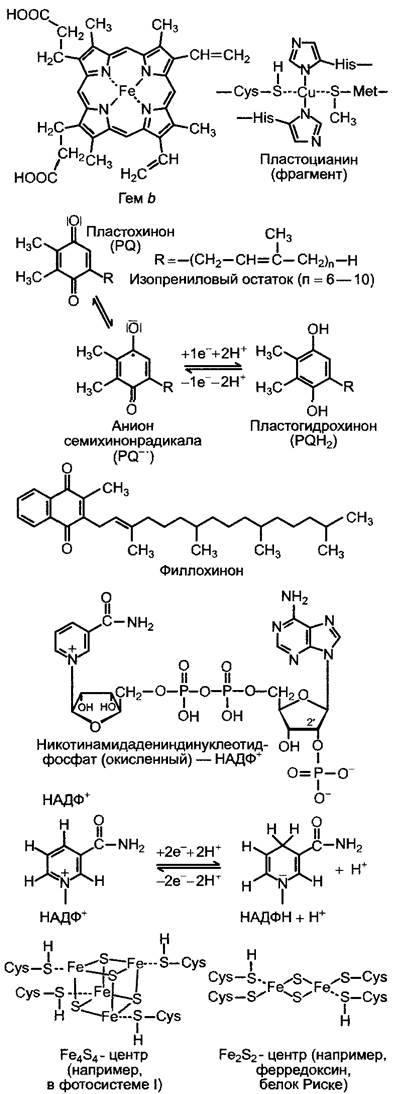
Рис. 6.56. Структура важнейших переносчиков, участвующих в фотосинтетическом электронном транспорте у зеленых растений
Р680, перешедший в возбужденное состояние после переноса экситона (Р680*), отдает электрон, который по внутренней электрон-транспортной цепи фотосистемы II (см. 6.4.5; рис. 6.59) переносится на подвижные молекулы пластохинона (РQ, англ. рlastoquinone). Присоединение другого электрона происходит после повторного возбуждения Р680, одновременно присоединяются два иона водорода из стромы, и возникает пластогидрохинон (РQH2, рис. 6.56).
Окисленный Р680 восстанавливается, отнимая электроны от воды, и таким образом переходит опять в основное состояние. Фотолиз воды1 осуществляет водоокисляющий комплекс, который является составной частью фотосистемы II. Пластогидрохинон выходит из фотосистемы II и диффундирует в мембране тилакоидов. Она содержит пул растворенных молекул пластохинона (их примерно 7 на фотосистему II, не менее 4 молекул на свету существуют в виде РQН2). Пластогидрохинон передвигается ко второму встроенному в мембрану цитохром-b6/f-комплексу (см. рис. 6.60), где РQН2 окисляется до РQ.
1 Термин «фотолиз» недостаточно корректно передает механизм происходящих процессов. Правильнее говорить о фотоокислении воды. Далее в тексте термин исправлен. — Примеч. ред.
Высвобождающиеся при этом два электрона последовательно переносятся по закрепленным в белковом комплексе компонентам электрон-транспортной цепи (см. 6.4.6; рис. 6.60) на молекулы пластоцианина. При этом образуется восстановленный Сu+-пластоцианин. Пластоцианин представляет собой растворимый белок, локализированный во внутритилакоидном пространстве (люмен). Ионы водорода, высвобождаемые при окислении пластохинона, передаются через нигохром - b6/f- комплекс в полость тилакоида. Предполагается, что на цитохром - b6/f- комплексе протекает внутренний цикл окисления-восстановления пластохинона-пластогидрохинона (Q-цикл), в котором электроны, отделенные от молекулы пластогидрохинона, переносятся на пластохинон. При этом из стромы повторно захватываются ионы водорода, а при последующем окислении пластогидрохинона перемещаются в полость тилакоида. Цитохром - b6/f -комплекс работает в Q-цикле как протонный насос и усиливает градиент концентрации ионов водорода между стромой и полостью тилакоида. Благодаря работе Q-цикла на один электрон в полость тилакоида переносится два иона водорода, а без осуществления Q-цикла соотношение теоретически составило бы 1:1.
Возбужденный димер хлорофилла а фотосистемы I (Р700*) по закрепленным в комплексе компонентам электрон- транспортной цепи (см. 6.4.7; рис. 6.61) передает электрон на ферредоксин (Fd) (растворимый белок, содержащий железо и серу), который находится в строме и является донором электронов для НАДФ+. НАДФ+ последовательно принимает два электрона с образованием НАДФН + Н+ (см. рис. 6.56). Недостаток электронов окисленного Р700 снова пополняется за счет восстановленного пластоцианина (Сu+-форма).
Таким образом, в электрон-транспортной цепи содержатся переносчики, передающие один или два электрона. Для восстановления в общей сложности двух молекул НАДФН + Н+транспортируются 4 электрона, при этом образуется одна молекула O2; для обеспечения процесса энергией требуется 8 квантов света. Функционирование подвижных растворимых переносчиков в окислительно-восстановительной системе (в мембранах тилакоидов между ФСII и цитохром-b6/f-комплексом — растворимый пластохинон/гидрохинон, а в полости тилакоида между цитохром - b6/f комплексом и ФСI — растворимый пластоцианин) выгодно по нескольким причинам.
Оно создает локальные условия для работы каждой фотосистемы, когда те находятся в возбужденном состоянии, так как ФСI и ФСII не должны работать синхронно.1 Это было бы крайне затруднительно из-за очень высокой скорости первичных фотосинтетических процессов.
1 Приведенный аргумент недостаточно обоснован. Работу двух фотосистем обычно излагают в форме последовательных реакций, каждая из которой должна идти после предыдущей. Из этого изложения возникает иллюзия, что синхронная работа фотосистем запрещена. На самом деле такого логического запрета нет. — Примеч. ред.
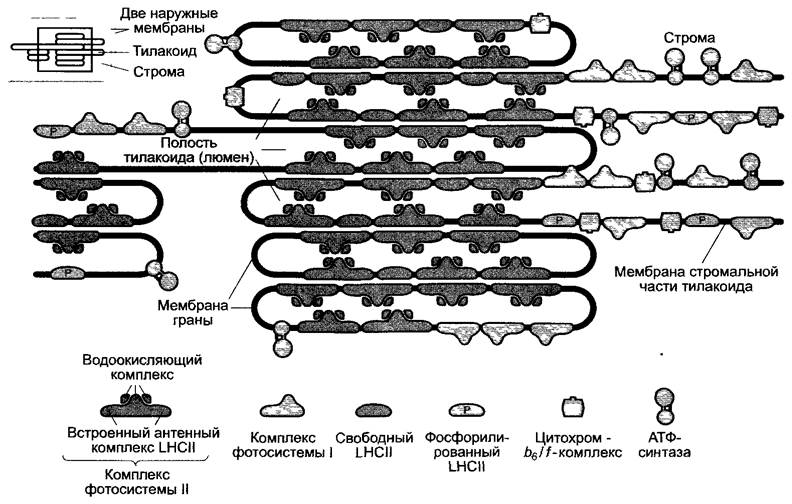
Преодолевается пространственная дистанция между тремя трансмембранными комплексами. Эти комплексы распределены в мембране тилакоида неравномерно. Фотосистема II находится в мембранах гран тилакоидов вместе со своими антеннами. В свою очередь фотосистема I и цитохром- b6/f-комплекс лежат преимущественно в стромальной части тилакоида (рис. 6.57). Светособирающий комплекс LНСII осуществляет объединение тилакоидов в граны (см. рис. 2.83).
Рис. 6.57. Латеральная гетерогенность в размещении фотосинтетических комплексов в мембране тилакоида. На изображении соблюдены пропорции. Вид сбоку представлен на схеме так, как он виден под электронным микроскопом (например, изображение АТФ-синтазы см на рис. 6 63)
Направленный (векторный) транспорт электронов в ходе световой фазы фотосинтеза связан с транспортом ионов водорода в цитохром-b6/f-комплексе, который идет от стромы в полость тилакоида. Дополнительно при фотооксилении воды в полости тилакоида высвобождаются Н+-ионы. В данном случае на одну образованную молекулу О2 приходится 8 Н+-ионов (4 — при фотоокислении воды, 4 иона водорода поставляются из стромы через РQН2).
Если Q-цикл работает с максимальной эффективностью, то поступает еще 4Н+, так что на одну образованную молекулу O2 в полости тилакоида накапливается 8 — 12 Н+. Градиент концентрации ионов водорода, быстро возникающий при освещении, можно вычислить по значению pH: в строме освещенных хлоропластов он составляет около 8, а в полости тилакоидов — 4,5 — 5. ∆рН около 3 — 3,5 единиц соответствует разности концентраций ионов водорода между стромой и полостью, равной примерно от 1: 1 000 до 1: 3 000. Поскольку для выравнивания зарядов одновременно с ионами водорода в тилакоиды транспортируются ионы хлора (предположительно по хлоридному каналу), разность потенциалов на мембранах тилакоидов невелика.
Энергия градиента ионов водорода (протон-движущая сила, уравнение 6.19) запускает фотосинтетический синтез АТФ (хемиосмотическая модель фотофосфорилированияМитчелла). АТФ-синтаза локализуется в области тилакоидов стромы (см. 6.4.9; рис. 6.63) и при образовании одной молекулы АТФ сопряженно переносит 4 Н+-ионов. В зависимости от вклада Q-цикла в полости тилакоида накапливается 8 — 12 Н+ ионов на одну образованную молекулу O2. Этого достаточно для синтеза 2 (без Q-цикла) или максимум 3 (с полным осуществлением Q-цикла) молекул АТФ. Соотношение НАДФ : АТФ в световой реакции равно 1:1 —1:1,5. Для темновой реакции (фиксация СO2 в цикле Кальвина, см. 6.5) требуются НАДФ и АТФ в соотношении 1: 1,5.
Каков же энергетический выход световой фазы фотосинтеза? Свободная молярная стандартная энтальпия образования НАДФ + Н+ составляет ∆G0 = +218 кДж моль1, а при образовании АТФ из АДФ и неорганического фосфата этот показатель равен ∆G0 = = +30,5 кДж моль-1. Следовательно, выход эндогенной световой реакции будет равен минимум 2 моль 218 кДж моль-1 + + 2 моль 30,5 кДж моль-1 = 497 кДж на 1 моль образованного O2. Для этого должны быть использованы 8 моль экситонов энергии возбуждения и поглощены минимум 8 моль фотонов при длине волны 700 нм.1 Это соответствует энергии 8 моль 170 кДж моль-1 = 1360 кДж поглощенной световой энергии. Значит, энергетический выход (=коэффициент полезного действия световой фазы) составляет 497 : 1 360 = 0,36 (36%). Остальная энергия теряется в виде тепла. Такие потери неизбежны, так как являются следствием разделения зарядов. Это гарантия необратимости процесса: рекомбинация электронов, отданных возбужденных димером хлорофилла а и окисленного димера (Хл а2+), не происходит. Для фотосинтеза из-за этих неизбежных потерь энергии в виде тепла необходимы две поочередно функционирующие фотосистемы, чтобы электроны воды использовались для восстановления НАДФ+. Фотосинтезирующим бактериям, которые отбирают электроны из субстрата с относительно невысоким отрицательным стандартным окислительновосстановительным потенциалом (например, Н2S, Е0' = -1,24 В), для восстановления НАД+ достаточно одной фотосистемы, поэтому они могут использовать низкоэнергетический свет более длинноволновой области.
1 Энергии квантов с![]() = 700 нм недостаточно для протекания всей световой фазы Половина поглощенных квантов должна обладать длиной волны
= 700 нм недостаточно для протекания всей световой фазы Половина поглощенных квантов должна обладать длиной волны![]() (см. 6.4.5) Таким образом, энергия поглощенных квантов в данном случае занижена, а КПД завышен — Примеч. ред.
(см. 6.4.5) Таким образом, энергия поглощенных квантов в данном случае занижена, а КПД завышен — Примеч. ред.
Таблица 6.18. Переносчики фотосинтетической электрон-транспортной цепи в растениях; расположены в порядке возрастания величины стандартного окислительно-восстановительного потенциала
Окислительно-восстановительная пара |
Е0′, В |
Окислительно-восстановительная пара |
Е0′, В |
Р700* |
Ниже -1,10 |
Р680* |
Ниже -0,6 |
А0 |
-1,10 |
Феофитин |
От -0,66 до -0,45 |
А1 |
-0,88 |
Пластохинон, связанный |
От -0,25 до -0,05 |
FеSх |
-0,70 |
Пластохикон, свободный |
+0,11 |
FеSв |
-0,59 |
FеSк (белок Риске) |
+0,29 |
FеSА |
-0,53 |
Цитохром f |
+0,35 |
Ферредоксин |
-0,43 |
Пластоцианин (РС) |
+0,37 |
Fd-НАД Ф+-редуктаза (FNR) |
-0,35 |
Р700+e- ⇄ + 700 |
+0,45 |
НАДФ+ + 2Н+ + 2е- ⇄ НАДФН + Н+ |
-0,32 |
O2 + 4Н+ + 4е- ⇄ +2Н2O |
+0,82 |
Цитохром b6 |
-0,02 |
Р680 + е- ⇄ Р680 |
Выше +0,82 |
Если редоксреакция не приведена в таблице, то действительны Е0′-значения для восстановленной формы в равновесии с окисленной. Возбужденное состояние отмечено звездочкой (*).
Кроме нециклического транспорта электронов от воды до НАДФН, показанного на рис. 6.55, в определенных условиях осуществляется также циклический транспортэлектронов, при котором световая энергия через фотосистему I используется только для синтеза АТФ (см. рис. 6.61, В), а также псевдоциклический транспорт электронов, когда электроны фотосистемы I переносятся на кислород (реакция Мелера, см. 6.47).
Если в основу характеристики переносчиков окислительно-восстановительной системы, участвующих в нециклическом транспорте электронов, положить их стандартный окислительно-восстановительный потенциал (табл. 6.18) и их принадлежность к комплексу, то электрон-транспортная цепь будет изображена в виде так называемой Z-схемы (рис. 6.58). Отдельные этапы мы рассмотрим позже, причем остановимся подробнее на структуре фотосистем. Р700* в возбужденном состоянии, имеющий стандартный окислительно-восстановительный потенциал ниже -1,1 В, является самым активным восстановителем живой клетки, известным в настоящее время.
Рис. 6.58. Последовательность переносчиков электрон-транспортной цепи, участвующих в световой реакции фотосинтеза, расположенных в соответствии с их стандартными окислительно-восстановительными потенциалами (Z-схема). Z-схема отражает изменения свободной энтальпии окислительно-восстановительных реакций на отдельных этапах в стандартных условиях, однако в естественных условиях (под влиянием изменений концентрации, температуры и величины pH) в хлоропластах наблюдаются отклонения от стандартных величин. Кроме того, на Z-схеме показано, что переносчики присоединены к мембранным комплексам, но точная пространственная локализация не отражена. Р680*, Р700*: димер хлорофилла а в возбужденном состоянии в реакционных центрах фотосистемы II или I
6.4.5. Фотосистема II
Фотосистема II (рис. 6.59) состоит по меньшей мере из 16 различных белков, из которых два (D1- и D2-белки) образуют собственно реакционный центр и два других (СР43 и СР47) — центральные антенны (см. рис. 6.53, D). Белки D1 и D2 гомологичны друг другу и реакционному центру пурпурных бактерий (см. 6.4.10), это значит, что в процессе эволюции они возникли от одного предшественника. На ге- теродимере связаны 4 — 5 молекул хлорофилла а, 2 феофитина, 2 пластохинона и 1 — 2 каротиноида. На некотором расстоянии белковый D1/D2-комплекс удерживает группу (англ. cluster — «группа»), состоящую, вероятнее всего, из 4 ионов марганца (марганцевый кластер). Ионы марганца направлены к полости тилакоида и удерживаются белками, стабилизирующими кластер (MSP331). Димер хлорофилла а (реакционный центр) связан как с D1, так и с D2-белками.
Рис. 6.59. Схематическое изображение структуры и движения электронов в фотосистеме II. Структура интегрированных (коровых) антенн фактически выглядит несколько иначе, чем на рисунке (см рис. 6.53, D). МSРЗЗ—марганец- стабилизирующий белок (33 кДа), общепринятое сокращение, см. 6.4.5
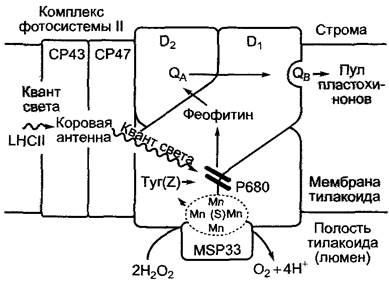
После возбуждения Р680 электроны транспортируются через феофитин D1-белка на пластохинон QA, который прочно связан с В2-белком. Он переходит в состояние семихинон-радикала (см. рис. 6.58) и переносит электрон на QB второй молекулы пластохинона, которая слабо связана с D1-белком. На втором этапе QB получает другой электрон восстановленного QA, который вновь стал семихинон-радикалом, а также 2Н+-иона, диссоциирует в форме PQH2 из центра связывания и переходит в растворенный в мембране тилакоида пул пластохинонов. Неполярная терпеноидная боковая цепь (прениловый остаток) плас- тохинона способствует растворимости в липидной фазе.
1 От английского названия белка: Мn — stabilizing protein массой 33 кДа. — Примеч. ред.
Окисленный Р680+ с нормальным потенциалом выше +1,1 В является очень активным окисляющим соединением. Он покрывает дефицит электронов за счет окисления особого тирозинового остатка (Z) на D1-белке; образованный тирозин- радикал отнимает 1 электрон от марганцевого кластера, о котором уже говорилось ранее. Этот кластер является накопителем 4 электронов, 4 атома марганца в котором могут быть в виде степеней окисления Мn2+, Мn3+ или Мn4+. При последовательной передаче 4 электронов марганцевая группа (также называемая S-системой) последовательно окисляется:
S0 —> S1 (+1) —> (+2) —> S3 (+3) —> S4 (+4).
S4-состояние снова превращается в основное при окислении 2 молекул воды и одновременном поглощении 4 электронов1:
S4 (+4) + 2Н2O —> O2+ 4Н++ S0.
1 Приведенные сведения о работе водоокисляющей системы устарели. По современным данным, происходит последовательное окисление воды, а не только Мn-кластера. Выделение протонов и выделение кислорода из комплекса разобщены во времени (т.е. не являются одновременными событиями). Приведенные уравнения отражают лишь суммарный процесс, но не механизм реакции. — Примеч. ред.
Таким образом, при расщеплении воды исключено вредное воздействие на клетки очень активных кислородных радикалов.
С помощью некоторых ингибиторов можно остановить транспорт электронов в ФСII. Триацины (например, атрацин) вытесняют QВ из его ниш на D1-белке. Подобным же образом действует дихлорфе- нилдиметилмочевина (диурон). Это вещество применяется как гербицид. Уже точечная мутация в D1-белке может препятствовать влиянию гербицида (не повреждая при этом Qв-связь) и таким образом обусловливать устойчивость к гербициду.
Цитохром- b6/f- комплeкс функционирует в фотосинтетическом транспорте электронов как пластогидрохинон-пластохинон- оксидоредуктаза и одновременно как протонный насос. Трансмембранный комплекс, гомологичный цитохром-b/сi комплексу митохондриальной электрон-транспортной цепи (см. 6.10.3.3), состоит из многочисленных составляющих, из которых цитохром f, цитохром b6 и белок Риске функционируют как окислительно-восстановительные системы (рис. 6.60).
Рис. 6.60. Гипотетическая модель строения основных компонентов цитохром-b6/f-комплекса в мембране тилакоида. Процесс движения электронов и ионов водорода при функционирующем Q-цикле изображен поэтапно. На каждый электрон, который переносится на пластоцианин, с участием Q-цикла транспортируются 2 иона водорода в полость тилакоида, без работы Q-цикла это соотношение составляло бы 1 1 РС — пластоцианин

Цитохромы, как и хлорофилл, имеют в своей основе систему порфириновых колец, но в качестве центрального атома тет- рапиррольного кольца содержат не магний, а железо. Порфириновое кольцо (см. рис. 6.45) с атомом железа в центре называется гем, а центральный атом железа — геминовое железо (см. рис. 6.56). При переносе электронов центральный атом меняет свою валентность (Fе3+/Fе2+). По структуре связанных гемов цитохромы разделяют на три основные группы: а, b, с (соответственно гем а, b, с). Они различаются также в зависимости от положения определенных полос спектра поглощения восстановленных форм (а-полосы) и часто характеризуются соответствующими максимумами поглощения (например, цитохром с555). Важную роль в фотосинтезе играют цитохромы b- и с-типов. В цитохромах с-гем ковалентно связан с белком (к двум виниловым группам гема присоединены SН-группы цистеина). Отличительным признаком цитохрома f (от лат. frons — листва) является то, что он присутствует в хлоропластах, с химической точки зрения он принадлежит к c-группе (цитохром с555). Цитохром f преимущественно расположен ближе к полости тилакоида.
Здесь находится также гем с. Белок закреплен гидрофобными последовательностями аминокислот в мембране. Цитохром b6 является внутренним белком мембраны. Он содержит две молекулы гема b, расположенные друг над другом и перпендикулярно мембране.
Белок Риске является периферическим белком, не связанным прочно с мембраной, окислительно-восстановительный компонент его представляет собой Fe2S2- центр, состоящий из двух атомов железа и соединенных с ними двух атомов серы (см. рис. 6.56). Сера может легко вымываться из структуры (например, слабой кислотой), поэтому говорят о кислотолабильной сере (в противоположность кислотостабильной сере цистеина, которую нельзя выделить, воздействуя кислотой). Железо в составе Fe2S2-центpa называется негеминовым железом. Данный центр, как и цитохромы, является переносчиком одного электрона.
Электроны, доставляемые пластогидрохиноном, который соединен с цитохром- b6/f-комплексом, переносятся через Fe2S2- центр белка Риске и цитохром f на окисленный пластоцианин в полости тилакоида. Пластоцианин — маленький белок с молекулярной массой около 10,5 кДа. К его центральному атому Си присоединены остатки цистеина и метионина и два остатка гистидина (см. рис. 6.56). При обратимой смене валентности Cu2+ —> Сu+ пластоцианин либо поглощает один электрон, либо снова его отдает.
Освобождающиеся при окислении РQН2 протоны цитохром - b6/f- комплекс направляет в полость тилакоида. Возможно, замкнутый Q-цикл, который еще детально не исследован, при участии цитохрома b6 способствует продвижению дополнительных Н+-ионов из стромы в полость тилакоида (см. рис. 6.60).1
1 По современным данным, Q-цикл начинается с РQН2, который отдает два электрона один — белку Риске, а второй — цитохрому b6. При этом белок Риске изменяет конформацию всего комплекса, и запасенная энергия позволяет второму электрону идти против электрохимического потенциала. Для переноса электрона с люменальной на стромальную сторону мембраны используются два гема b. Далее электрон переносится на РQ, который полностью восстанавливается за два оборота цикла, захватывая из стромы 2Н+ РQН2 покидает комплекс и диффундирует к люменальной стороне мембраны, где вновь вступает в Q-цикл — Примеч. ред.
6.4.7. Фотосистема I
Третий трансмембранный комплекс, участвующий в световой фазе фотосинтеза, фотосистема I, получает электроны от восстановленного пластоцианина (РС) и переносит их на ферредоксин (Fd). Оттуда, через фермент ферредоксин- НАДФ+ -редуктазу (FNR), они переходят на НАДФ+ с образованием НАДФН + Н+. Фотосистема I гомологична реакционному центру зеленых серных бактерий и состоит из 12 или более различных элементов. ФСI (рис. 6.61) является гетеродимером белков А и В, которые наряду с переносчиками электронов и димером Р700 хлорофилла а содержит интегрированные антенны. Белок А гомологичен белкам D1 + СР43 фотосистемы II, а В — D2 + СР47. Субъединица F взаимодействует с пластоцианином, субъединица D — с ферредоксином, а С отвечает за перенос электронов с реакционного центра на ферредоксин.
Рис. 6.61. Схематическое изображение (А, В) структуры и движения электронов через комплекс фотосистемы I циклического транспорта электронов (по H.W. Heidt).
При циклическом транспорте электронов работают цитохром-b6/f-комплекс и фотосистема I с вовлечением пула пластохинона в качестве «протонного насоса», работающего на свету, для производства АТФ без образования НАДФН + Н (ср. рис. 6.55). Объяснения в тексте
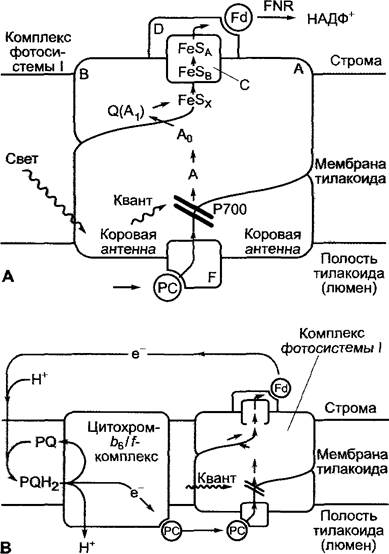
Разделение зарядов после возбуждения Р700 происходит аналогично этому процессу в ФСII. Электрон, потерянный возбужденным Р700, через две мономерные молекулы хлорофилла а (А, Ао) переносится на филлохинон (см. рис. 6.56), который, как и хлорофилл, обладает фитоловым остатком. Филохинон (Q, а также его обозначают А1, рис. 6.61, А) присоединен к субъединице В реакционного центра и соответствует QA фотосистемы II. Он, как и QА, поглощает электрон, образуя форму семихинон-радикала. Следующий этап переноса электрона отличается от процессов в ФСII. Семихинон-радикал через три Fе4S4-центра (см. рис. 6.56) (переносчики, которые обозначают FеSх, FеSв и FеSA) передает энергезированный электрон на ферредоксин. Ферредоксин со стороны стромы через субъединицу D присоединяется к ФСI. Ферредоксин — небольшой белок (мол. масса 11 кДа), который обладает Fе2S2-центром (см. рис. 6.56) и одновременно представляет собой одноэлектронную окислительно-восстановительную систему.
От восстановленного ферредоксина перенос электронов может происходить через цитохром-b6/f- комплекс и пластоцианин назад на Р700+, а не на НАДФ+. Этот циклический транспорт (рис. 6.61, В) при участии цитохром-b6/f-комплекса ведет к перемещению ионов водорода из стромы в полость тилакоида, способствуя синтезу АТФ («циклическое фотофосфорилирование»), хотя при этом НАДФН не образуется. Циклический транспорт электронов происходит тогда, когда соотношение восстановленной формы к окисленной НАДФН + Н+/НАДФ+ достаточно велико и поэтому не хватает субстрата для работы ферредоксин-НАДФ+-редуктазы.
При очень активном восстановлении пула ферредоксина происходит перенос электронов ферредоксина на O2 с образованием Н2O (реакция Мелера, рис. 6.62, А).
Этот процесс называется псевдоциклическим транспортом электронов, так как он сходен с циклическим транспортом тем, что возникает не НАДФН + Н+, а только АТФ. Однако в условиях реакции Мел ера соотношение АТФ/АДФ часто высокое, так что имеющегося количества АДФ не достаточно для синтеза АТФ. Так, в реакции Мелера создается очень высокий градиент ионов водорода на мембране тилакоида.
Рис. 6.62. Превращение O2- в аскорбатглютатионовой системе хлоропластов (А). Ксантофилловый (виолаксантиновый) цикл фотосистемы II для рассеивания энергии возбуждения в форме тепла (В). Ксантофилловый цикл также сопряжен с аскорбатглютатионовой системой. GSH — восстановленный глютатион; GSSG — окисленный глютатион, состоящий из двух молекул глютатиона, которые соединены дисульфидным мостиком (2GSH ⇄ GSSG + 2Н+ + 2е-)
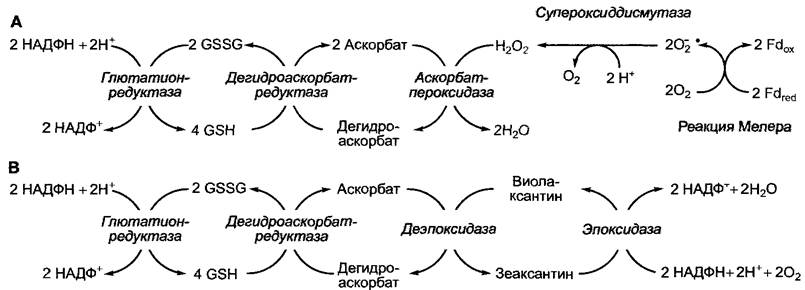
При окислении ферредоксина в реакции Мелера в конечном итоге возникает супероксид-анион-радикал (O-2). Благодаря ферменту супероксиддисмутазе он превращается в O2 и Н2O2. Далее Н2O2 под влиянием нескольких ферментов восстанавливается до воды (рис. 6.62, А), в результате предотвращается образование очень реакционноспособного гидроксильного радикала (ОН). Этот радикал в присутствии ионов металла и O-2 образуется самопроизвольно из Н2O2 и повреждает липиды, белки и нуклеиновые кислоты.
Супероксидцисмутазы (СОД) являются металлоэнзимами. Хлоропласты содержат Fе-СОД, Мn-СОД и СuZn-СОД. Эти ферменты встречаются также в цитоплазме (СuZn-С0Д), митохондриях (СuZn-СОД, Мn-СОД) и пероксисомах (Мn-СОД).
6.4.8. Механизмы регуляции и защиты световой реакции
Пространственное разделение ФСII, ФСI и их антенн (см. рис. 6.57) снижает неконтролируемый отток экситонов от ФСII к ФСI и одновременно способствует динамическому распределению энергии возбуждения по обеим фотосистемам. Если ФСI получает слишком мало энергии возбуждения, то это ведет к накоплению РQН2 в пуле пластохинона (перевосстановление)1. В результате активизируется протеинкиназа, которая фосфорилирует светособирающий комплекс LНСII. Напомним, что благодаря светособирающему комплексу LНСII возникает электростатическая связь между соседними мембранами тилакоидов. Из тилакоидов, уложенных в стопки, формируются граны. Для того чтобы присоединиться к ФСI, LНСII диффундирует из области, где тилакоиды уложены в стопки, в стромальную часть.2 Таким образом, энергия поглощенных квантов направляется от ФСII к ФСI 3 (см. рис. 6.57; 7.6). Дефосфорилирование LНСII приводит к диссоциации ФСI и к новому соединению LНСII-комплекса с ФСII.
1 Такие условия можно создать только в эксперименте, облучая растения монохроматическим светом с![]() = 680 нм. В естественных условиях перевосстановление пула пластохинонов происходит при слишком сильном освещении и/или закрытых устьицах (=голодании по СO2). Причина не в том, что ФСI получает недостаточно квантов света, а в том, что возбужденный электрон невозможно передать на НАДФ+, поскольку он также оказывается в восстановленном состоянии в этих условиях. — Примеч. ред.
= 680 нм. В естественных условиях перевосстановление пула пластохинонов происходит при слишком сильном освещении и/или закрытых устьицах (=голодании по СO2). Причина не в том, что ФСI получает недостаточно квантов света, а в том, что возбужденный электрон невозможно передать на НАДФ+, поскольку он также оказывается в восстановленном состоянии в этих условиях. — Примеч. ред.
2 Фосфорилирование и перемещение LНСII приводит к разборке гран. Таким образом, наличие гран коррелирует с активной работой ФСII, а отсутствие — с низкой активностью этой фотосистемы, уменьшением образования O2 и НАДФН + Н+. — Примеч. ред.
3 Описанное перераспределение энергии квантов света необходимо для переключения работы электрон-транспортной системы из нециклического (ФСII активна, должен образовываться НАДФН + Н+) в циклический режим (активна только ФСI, новые электроны от воды не поступают в пул пластохинонов). — Примеч. ред.
Высокая интенсивность света и одновременно малая потребность в АТФ и НАДФН (например, когда для уменьшения потерь влаги при высоких температурах устьица закрываются и имеется ограниченное количество СO2 для ассимиляции) вызывают чрезмерную активизацию пигментных систем без оттока электронов. Следовательно, существует опасность интенсивного образования триплетных состояний возбужденного хлорофилла, а значит, и синглетного кислорода (см. 6.4.2). Как каротиноиды, так и α-токоферол, находящиеся в большом количестве в мембране тилакоида, опять переводят триплетное возбужденное состояние хлорофилла и синглетный кислород в основное невозбужденное состояние. По-видимому, этой защиты не всегда достаточно в условиях высокой интенсивности света. Часто происходит повреждение фотосистемы II (фотоингибирование), вероятно, из-за интенсивного расщепления и без того коротко живущего D1-белка. Так, обесцвечивание хвои при весеннем повреждении лесных деревьев объясняется фотоокислительными процессами, вызванными резким усилением освещения.
Для уменьшения вредного светового воздействия избыточная энергия поглощенных квантов переводится в тепло. В этом участвует ксантофилл зеаксантин (см. рис. 6.50). Он образуется из ксантофилла виолаксантина, присутствующего в антеннах, при деэпоксидировании (восстановлении) последнего, когда существует высокий градиент ионов водорода между полостью тилакоида (кислая реакция) и стромой (щелочная реакция), что является признаком высоковосстановленного уровня всех компонентов электрон-транспортной цепи в световой фазе (см. рис. 6.62, В).
Поскольку эпоксидирующий фермент, катализирующий обратную реакцию, имеет рН-оптимум в слабощелочной области (pH 7,6), а деэпоксидазы — в кислой (pH
5,0), то при уменьшении градиента водородных ионов на мембране тилакоида зеаксантин снова превращается в виолаксан- тин (ксантофилловый или виолаксантино- вый цикл).
Градиент ионов водорода в 3 единицы pH, образовавшийся на мембране тилакоида при освещении, представляет собой протон-движущую силу (см, уравнение
4.19), которая используется для синтеза АТФ. Этот процесс называется фотофосфорилированием. Изменение молярной свободной стандартной энтальпии для синтеза АТФ из АДФ и неорганического фосфата составляет ∆G0' - 30,5 кДж • моль-1. Однако с учетом фактического соотношения концентраций, участвующих в реакции веществ в клетке, она может составлять ∆G = 45 — 50 кДж • моль-1. Из уравнения 6.19 следует, что свободная энтальпия градиента водородных ионов (∆рН = 3 при 25 °С) равна ∆G = -17 кДж • моль-1. Поэтому для синтеза одной молекулы АТФ по меньшей мере 3 иона Н+ должны были бы двигаться в направлении падения их электрохимического потенциала.
Синтез АТФ в выделенных препаратах мембран тилакоидов происходит также и в темноте при наличии АДФ и неорганического фосфата, если с помощью подхо-
дящей буферной системы создать над мембраной тилакоида градиент концентрации ионов водорода. Этот эксперимент подтверждает хемиосмотическую гипотезу Митчелла.
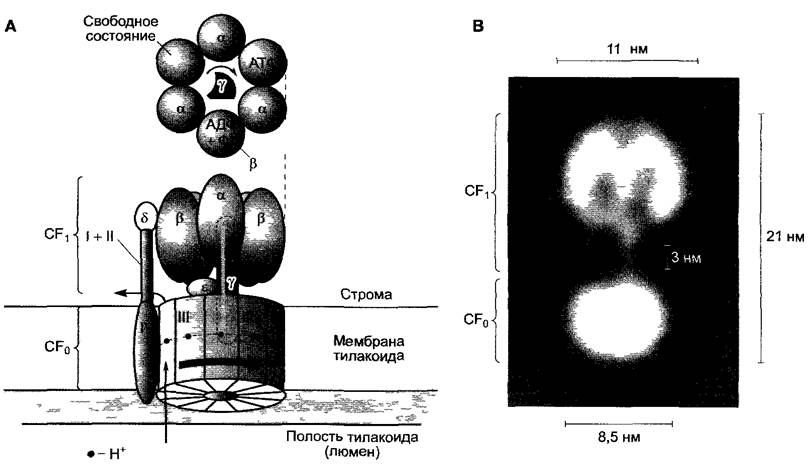
АТФ-синтаза локализована в стромальной части тилакоидов, ее строение сходно с бактериальным и митохондриальным ферментами (см 6.10.3 3). АТФ-синтаза состоит из гетероолигомерной головки, направленной в строму, которую обозначают CF1 (CF от англ. coupling factor — сопрягающий фактор), и еще одной тоже гетероолигомерной, трансмембранной части. Эта часть обозначается CF0 («О» ставится для отражения определенного свойства и указывает на ингибирование F0-чaсти митохондриальной АТФ-синтазы олигомицином. Терминологию используют и для хлоропластного фермента, хотя в этом случае CF0 не чувствительна к олигомицину. Часто вместо буквы «О», как и здесь, в качестве индекса используется нуль). CF0 образует канал, по которому направляются ионы водорода, в то время как CF1 осуществляет синтез АТФ.
АТФ-синтаза представляет собой вращательный механизм, переносящий Н+- ионы. Это самый маленький мотор из всех известных такого рода. Его размеры составляют около 20 нм. При этом асимметричный у-элемент СF1-головки вместе с 12 субъединицами III CFo-части, которые вместе составляют кольцеобразную структуру, будет вращаться со скоростью до 100 об/с. В это время Н+-ионы текут по СF0- каналу. За оборот по каналу проходит 12Н+-ионов (один на каждую субъединицу III). -головка состоит из трех чередующихся α- и β-субъединиц. Благодаря контакту с вращающейся у-субъединицей индуцируются изменения конформации в α- и β-субъединиц, так что при каждом обороте каждый из трех каталитических центров, которые локализированы на β-части, проходит 3 состояния (рис. 6.63, А): 1) свободное от нуклеотидов; 2) АДФ и неорганический фосфат; 3) протекает реакция АДФ + Фн —> АТФ и, наконец, АТФ высвобождается из каталитического центра фермента. Считается, что третье состояние наступает при удалении воды из каталитического центра, чтобы с переносом фосфата на АДФ не конкурировала обратная реакция (гидролиз!) (ср. рис. 6.8). На один оборот мотора синтезируется соответственно 3 молекулы АТФ, из чего следует, что соотношение Н+ : АТФ должно быть равно 4:1. Многие детали механизма реакции синтеза АТФ еще не выяснены.
Рис. 6.63. АТФ-синтаза Вид сбоку Снимок получен с помощью электронного микроскопа и многократно увеличен: А — структурная модель ротационного механизма АТФ-синтазы Субъединицы III CFo-части образуют камеру из 12 частей, а вместе с субъединицами у и ε СF1-части — ротор, α3 β3 — головка вместе с субъединицей 6 части CF1 и I, II, IV CFo-части — статор Ротор поворачивается в неподвижном статоре, причем 12Н+-ионов (по одному на каждую субъединицу III) направляются по протонному каналу, который, вероятно, образуется между субъединицами II) и IV Взаимодействие вращающейся асимметричной у-субъединицы с α- и β-субъединицами головки АТФ-синтазы способствует изменению конформации каталитического центра фермента, расположенного на р-субъединице, который проходит следующие три стадии центр свободен —> АДФ + ФH связан —>АТФсвязан, В — реконструкция АТФ-синтазы
Благодаря переходам дисульфид дитиол на у-элементе (см. рис. 6.71) роторный механизм включается на свету и выключается в темноте. На свету ферредоксин через тиоредоксин восстанавливает дисульфидный мостик в молекуле белка до дитиола, а в темноте вновь образуется дисульфидная форма, что изменяет конформацию у-субъединицы. Этот процесс предотвращает обратную реакцию, которую в темноте катализирует АТФ-синтаза, — она также может переносить ионы водорода в полость тилакоида при расщеплении АТФ. Тиоредоксин — это низкомолекулярный белок (около 10 кДа), встречающийся во всех прокариотных и эукариотных клетках. Известно несколько его изоформ. Все они имеют в каталитическом центре определенную последовательность аминокислот: Сys- Gly-Рго-Суs. Оба цистеина образуют дисульфидные мостики в окисленном тиоредоксине.
Определенные вещества разобщают фотосинтетический транспорт электронов и синтез АТФ: реакция Хилла идет, однако фотофосфорилирования не происходит. К таким разобщителям относятся, например, NH4+-ионы и карбоцианид-пара-трифторметоксифенилгидразон, которые могут проникать через мембрану как в протонированной, так и в депротонированной форме и, таким образом, уменьшают градиент ионов водорода на мембране тилакоида.
6.4.10. Световые реакции бактериального фотосинтеза
Световая фаза, идущая у организмов, способных к оксигенному фотосинтезу, обсуждалась в предыдущих главах. Эта высокоорганизованная последовательность реакций, при которой две поочередно функционирующие фотосистемы используют электроны воды для восстановления НДДФ+. Указанные организмы возникли в процессе эволюции от предков, которые обладали только одной фотосистемой и использовали источники электронов с существенно более низким значением стандартного окислительно-восстановительного потенциала. Такие сравнительно простые световые реакции происходят у существующих сейчас фотолитотрофных и фотоорганотрофных прокариот (см. табл. 6.1). К фотолитотрофам относятся пурпурные серные бактерии (Сhromatiасеае) и зеленые серные бактерии (Сhlorobiасеае), к фотоорганотрофам — пурпурные бактерии (Rhodospirillасеае) и несерные зеленые бактерии (Сhloroflexасеае)).
Все представители этих групп обладают функционирующим на свету циклическим транспортом электронов, который ведет к образованию на мембране тилакоида градиента концентраций ионов водорода. У всех групп он используется для синтеза АТФ, а также — за исключением Сhlorobiасае — для синтеза НАДН. У Сhlorobiасае НАДН образуется в ходе нециклического транспорта электронов через ферредоксин и ферредоксин-НАД+ -редуктазу (рис. 6.64). В этом случае электроны не возвращаются к реакционному центру, поэтому их дефицит должен восполнять донор электронов, в большинстве случаев Н2S:
Н2S —> S + 2Н+ + 2е- (Е0'= -0,24 В).
Рис. 6.64. Световые реакции фотосинтеза у зеленых серных и пурпурных бактерий. Авосст, например, — сукцинат, Аокисл — фумарат
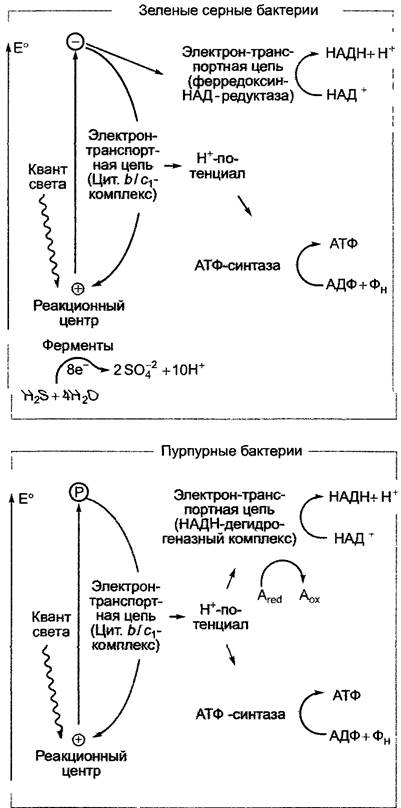
Разница стандартных окислительновосстановительных потенциалов между Н2S/S и НАД+/НАДН+Н+ (Е0' = -0,32 В) очень мала. Поэтому для переноса электронов с Н2S на НАД+достаточно одной фотосистемы и света очень малой энергии (например, реакционный центр фотосистемы у Сhlorobium поглощает кванты с длиной волны![]() = 840 нм, что соответствует примерно 142 кДж на Эйнштейн). Образующаяся молекулярная сера может окисляться до сульфита, а затем до сульфата, так что в распоряжении фотосинтетического электронного транспорта оказывается до 8 электронов:
= 840 нм, что соответствует примерно 142 кДж на Эйнштейн). Образующаяся молекулярная сера может окисляться до сульфита, а затем до сульфата, так что в распоряжении фотосинтетического электронного транспорта оказывается до 8 электронов:
Н2S + 4Н2O —> SO-24 + 10Н+ + 8е-.
Образование НАДН характерно для пурпурных бактерий, которые обладают только циклическим транспортом электронов и НАДН-дегидрогеназным комплексом, функционирующим за счет энергии градиента ионов водорода. Эта энергия расходуется также для синтеза АТФ. Электроны, которые нужны НАДН-дегидрогеназному комплексу, поступают из органических соединений: например, у Rhodospirillum из сукцината, который окисляется до фумарата (Е0' = -0,03В). В этом случае тоже достаточно одной фотосистемы (Р870), поглощающей длинноволновый свет, для того чтобы обеспечивать переход электронов от органического субстрата на НАД+.1
Реакционные центры фотолитотрофных и фотоорганотрофных бактерий очень схожи по строению и гомологичны друг другу. Они произошли от одного предшественника. В то же время у фотосистем существуют характерные черты, присущие организмам с оксигенным типом фотосинтеза: структура реакционного центра пурпурных бактерий соответствует структуре реакционного центра фотосистемы II, а реакционный центр зеленых серных бактерий — таковому фотосистемы I. Цитохром- b/с1-комплекс (см. рис. 6.64), участвующий в циклическом электронном транспорте и сопряженном с ним образовании градиента ионов водорода, гомологичен цитохром-b6/f-комплексу организмов с оксигенным типом фотосинтеза. Система ферредоксин-НАД+-редуктазы и ферредоксин, которые задействованы в нециклическом транспорте электронов зеленых серных бактерий, очень похожи с имеющимися у гомологов зеленых растений, цианобактерий и прохлоробактерий. Очевидно, речь идет о функциональных моделях, возникших на очень раннем этапе эволюции. Они могут комбинироваться разными способами, а некоторые кроме фотосинтеза взяли на себя и другие функции (например, функционирование в митохондриальной дыхательной цепи и при бактериальном дыхании).
1 Нарушение логики: энергия света в этом случае нужна только для создания протонного градиента, прямо использовать ее для восстановления НАД+ нельзя. — Примеч. ред.
Считается, что в процессе эволюции из гетеротрофных прокариот благодаря появлению фотосистемы I (или ее предшественнику) в конечном итоге развились прокариоты, способные к циклическому фотофосфорилированию. Позже появилась способность к нециклическому транспорту электронов от веществ с относительно низким окислительно-восстановитель- ным потенциалом на НАД+, тем самым стала возможной фотоавтотрофность на сравнительно небольших участках (там, где есть такие восстановители, например, H2S). Только с приобретением фотосистемы II стало возможным использование воды, которая распространена повсеместно, в качестве восстановителя. Таким образом, фотосинтез становится процессом, доминирующим в количественном отношении. Кислород, который возникает как побочный продукт фотосинтеза, с этого момента постепенно обогащает атмосферу и создает предпосылки для развития аэробных организмов.
Рис. 6.65. Структура пигментной системы в фотосинтетическом реакционном центре Rhodopseudomonas viridis (Rhodospiniiaceae). Строение белковой цепи субъединиц М, L и Н показаны серыми линиями точно так же как и встроенный в двойной липидный слой бактериальной плазматической мембраны реакционный центр Реакционный центр несет следующие пигменты 4 молекулы бактериохлорофилла b, 2 образуют димер, который ионизируется при возбуждении и отдает дин электрон, два других расположены по сторонам димера (БХлАи БХлв), 2 молекулы бактериофеофитина (БФеоА, БФеов), а также 2 хинона (QA — менахинон QB — убихинон), между которыми находится атом железа (Fe). По соседству с БХлв лежит каротиноид. Поток электронов идет преимущественно по схеме D —> БФеоА —> QA —> QB. По самым последним данным, электроны идут от QAк QBчерез ион железа со сменой валентности (Fe3+ —> Fe2+) Чтобы не загромождать схему, неполярные боковые цепи молекул пигментов даны лишь частично

С приобретением хлоропластами зеленой окраски в ходе фотоморфогенеза (см. 7.7.2.1) образуется сначала фотосистема I и только позднее — фотосистема II.
Реакционные центры пурпурных бактерий Rhodopseudomonas viridis и Rhodobacter sphaeroides ученые смогли кристаллизовать и исследовать их структуру при высоком разрешении с помощью рентгеновской дифракции кристаллов (рентгеноструктурный анализ). Сравнивая их с гомологичными структурами фотосистемы II, исследователи смогли также воспроизвести их структуру (до этих пор атомный состав не определяли). Получены также данные рентгеноструктурного анализа фотосистемы I, однако при худшем разрешении. Способ функционирования фотосистемы лучше всего исследован у пурпурных бактерий.
Реакционный центр Rhodopseudomonas viridis (рис. 6.65) состоит из трех белков: субъединиц L, М и Н. Субъединица L гомологична белку D1, а субъединица М — белку D2фотосистемы II. К белкам L и М присоединены переносчики электронов: 4 молекулы бактериохлорофилла а (из них 2, образующие димер реакционного центра Р870), 2 молекулы бактериофеофитина а, 2 молекулы хинона (1 убихинон, QB, 1 менахинон, QA), 1 атом железа и 1 молекула каротиноида. По последним данным, атом железа участвует в переносе электронов, а каротиноид предназначен для перевода хлорофилла из триплетного состояния в основное. Кроме этого, однако, обсуждают и структурную функцию. Направление потока электронов в реакционном центре показано на схеме 6.65. Обнаружено, что реакционный центр построен симметрично, однако поток электронов идет несимметрично, в основном по А-стороне (это справедливо и для фотосистемы II — см. рис. 6.59). Очень быстрый перенос электрона от димера бактериохлорофилла а на бактериофеофитин прежде всего предотвращает рекомбинацию е- + Р870+ —> Р870, а значит, и переход энергии возбуждения в тепловую. Кинетика этапа переноса электронов в фотосистеме II аналогична. С точки зрения электростатики направление потока электронов по стороне А выгодно, так как имеет больший положительный суммарный заряд в отличие от направления потока по стороне В.
Функционирующий на свету протонный насос не всегда работает с помощью хлорофилла. У нефотосинтезирующих1 Наlobacterium halobium в определенных условиях обитания (низкая концентрация O2) во внешней мембране клетке обнаруживается бактериородопсин — трансмембранный хромопротеид, имеющий сходство с красящим веществом родопсином2; молекулы бактериородопсина располагаются в определенных участках мембраны (пурпурная мембрана).
1 В отечественной литературе преобладает мнение, что галобактерии являются фотосинтезирующими организмами. — Примеч. ред.
2 В светочувствительных клетках сетчатки глаза у животных. — Примеч. ред.
С помощью энергии света, поглощенной бактериородопсином, в конечном итоге формируется градиент ионов водорода между внутренней областью и средой. Выравнивание градиента служит движущей силой синтеза АТФ, усвоения аминокислот и солевого обмена (Na+/K+) (рис. 6.66). Таким образом, этот организм способен осуществлять фотофосфорилирование без хлорофилла и поддерживать свой энергетический режим. В присутствии кислорода через электронный транспорт дыхательной цепи создается протонный градиент, энергия поступает от окисления органических соединений. Синтез АТФ происходит в этом случае как процесс окислительного фосфорилирования (см. 6.10.3.3). Второй действующий на свету ионный насос, галородопсин, транспортирует хлорид-ионы (СI) в клетку. Система служит для осмотической регуляции в биотопах с очень высоким содержанием солей (до 4М NaCI) у архебактерий.
Рис. 6.66. Фотофосфорилирование у Halobacterium halobium. Благодаря поглощению кванта света бактерио- родопсин пурпурных бактерий превращается из Р560-формы в Р412. Это превращение носит обратимый характер. При этом Н+-ион транспортируется из клетки во внешнюю среду («протонный насос»). Связанная с мембраной АТФ- синтаза может использовать возникающий градиент концентраций ионов водорода для синтеза АТФ