БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
6. ФИЗИОЛОГИЯ ОБМЕНА ВЕЩЕСТВ
6.6. Ассимиляция нитратов
Растения поглощают азот преимущественно в виде нитрата (NO-3) через корневую систему (см. 6.2.3.2). Если в почве есть доступный аммоний (NH4+), он также может поглощаться, преобразуясь в аминокислоты непосредственно в корнях. Аммоний высвобождается в почве в результате разложения органических соединений при отмирании живых организмов либо образуется из атмосферного N2 в результате деятельности азотфиксирующих прокариот (см. 9.2.1). Благодаря деятельности нитрифицирующих микроорганизмов NH4+окисляется сначала до нитрита (NO2-), а затем нитрата (NO3-) (см. 6.9.1). В результате денитрификации («нитратного дыхания») NO3- восстанавливается до N2 по схеме NO-3 —> NO2-—> NO —> N2O —> N2. Последний покидает биосферу. Ежегодно около 80 — 120 • 106 т N2 преобразуются фиксаторами атмосферного азота в NH4+ и почти столько же теряется при денитрификации. В этот круговорот азота (рис. 6.87) человек ежегодно добавляет около 30 • 106 т N2, который преобразуется в аммиак в результате процесса Габер—Боша1 и используется в сельском хозяйстве для производства искусственных удобрений (табл. 6.21).
1 Фамилии немецких химиков, предложивших дешевый способ синтеза аммиака из азота и водорода под давлением на железном катализаторе. Такое название процесса используется только в немецкой литературе — Примеч. ред.
Рис. 6.87. Круговорот азота в природе
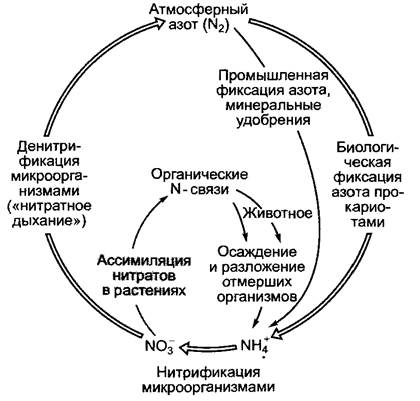
Таблица 6.21. Баланс азота на Земле
Вклад |
Площади, млн га |
Зафиксированный атмосферный азот |
|
кг • га-1 в год |
106 т в год |
||
Биологическая фиксация |
|||
Бобовые |
250 |
55-140 |
14-35 |
Не бобовые |
1015 |
5 |
5 |
Рисовые поля |
135 |
30 |
4 |
Другие почвенные и растительные сообщества |
12000 |
2,5 —3,0 |
30-36 |
Море |
36100 |
0,3-1,0 |
10-36 |
Промышленная фиксация |
30 |
||
Атмосферная фиксация |
7,6 |
||
Вулканическая деятельность |
0,2 |
||
Денитрификация |
|||
Суша |
13 400 |
3 |
40 |
Море |
36 100 |
1 |
36 |
Отложение в осадках |
0,2 |
||
Азот является составной частью многих органических соединений (см. гл. 1, 6.2.2.2; 6.13 — 6.16) исключительно в восстановленной форме (степень окисления — III, азот аммония). Он используется для синтеза органических веществ и в случае необходимости может подвергаться вторичному окислению (пример: нитрогруппа аристолохоновой кислоты появляется в результате окисления одной аминогруппы)2.
2 Более распространенный пример — окисление до N0, который служит вторичным мессенджером при передаче сигнала практически у всех растений — Примеч. ред.
Восстановление нитрата до аммония происходит в результате двухступенчатого процесса с образованием нитрита (NO-2) в качестве промежуточного продукта (степень окисления дана в скобках):
![]()
Оно происходит в зеленых и незеленых частях растения, преимущественно в листьях и корнях. Полученный аммоний используется непосредственно для биосинтеза аминокислот, прежде всего глутамина и глутамата. Животные не могут восстанавливать нитрат, они вынуждены потреблять восстановленные азотистые соединения, которые им предоставляют растения.
6.6.1. Фотосинтетическая ассимиляция нитратов
В фотосинтетически активных клетках (в листе С4-растений исключительно в мезофилле) нитрат восстанавливается до нитрита цитоплазматическим ферментом нитратредуктазой (рис. 6.88) Донором электронов большей частью служит НАДН+ + Н+ (у грибов НАДФН + Н+, у бактерий — восстановленный ферредоксин). Нитрат- редуктаза представляет собой гомодимер. Мономер (молекулярная масса около 100 кДа) состоит из трех доменов, с каждым из которых ковалентно связан отличный от других кофактор, в результате внутри одного молекулярного комплекса возникает цепь переноса электронов (рис. 6.89). От НАДН через ФАД и цитохром b электроны попадают на молибден, который при этом, вероятно, меняет степень окисления с +VI на +IV. Этот взаимодействующий с ионами NO3- молибден каталитического центра является составной частью молибденового кофактора молибдоптерина, который присутствует как в сульфитредуктазе (см. 6.7), так и в ксантиноксидазе и аль- дегидоксидазе.
Рис. 6.88. Фотосинтетическая ассимиляция нитрата и регуляция начальной реакции — нитратредуктазы (Fd — ферредоксин)

Как образование NH3+ из NO2- так и его дальнейшее использование напрямую зависят от света (см. рис. 6.88). Получившийся нитрит восстанавливается в хлоропластах до аммония при периодической подаче 6 электронов, посредством присутствующей в строме высокоактивной нитритредуктазы, без образования свободных промежуточных продуктов. Очень высокое сродство фермента к субстрату гарантирует то, что не происходит накопления химически активного нитрит-иона. Электроны предоставляются восстановленным ферредоксином и переносятся на нитрит с образованием NН4 с помощью Fе4S4-сирогем-кофактора, который представляет собой каталитический центр фермента, существующего в форме мономера (см. рис. 6.89).
Рис. 6.89. Строение и схемы реакций нитрат- и нитритредуктазы (нитратредуктаза: представлен только один мономер фермента, активного в виде димера)
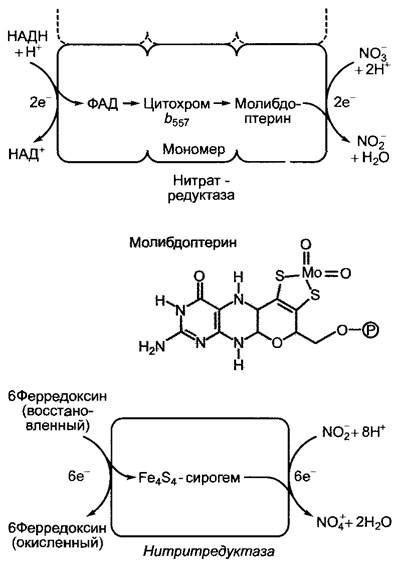
В кофакторе, который также присутствует в очень похожей по строению сульфитредукгазе (см. 6.7), железосерный центр связан с центральным атомом (железом) сирогема при помощи цистеино-серных мостиков. Сирогем (см. рис. 6.112) представляет собой исходный гем, который несет ацетиловые и пропиониловые боковые цепи первого замкнутого кольца тетрапиррола в биосинтезе гема, уропорфирино- гена III (см. рис. 6.113).
NH4+, который является ингибитором фотосинтеза (см. 6.4.9), используется для синтеза глутамата в последовательности необратимых реакций с промежуточным образованием глутамина (см. рис. 6.88) и поэтому не накапливается в концентрациях, способных причинить вред. Ферменты, принимающие участие в синтезе глутамата, глутаминсинтетаза и глутаматсинтаза (также называемая глутамин-2-оксоглута- ратаминотрансфераза, ГОГАТ), катализируют замкнутый процесс, запускаемый АТФ и восстановленным ферредоксином, в котором NH4+ сначала переносится в амидную связь на у- карбоксильную группу глутамата, а оттуда на молекулу 2-оксоглутарата с образованием L-глутамата. В качестве коэнзима глутаматсинтазы, как и у всех трансаминаз, выступает пиридок- сальфосфат, который связывает аминогруппу (пиридоксаминфосфат). L-глутамат покидает хлоропласта в обмен на 2-оксоглутарат, предположительно, в отдельных случаях — на малат. Кроме NH4+, синтезированного в хлоропластах, в глутамат преобразуется также NH4+, полученный в результате фотодыхания (см. рис. 6.88).
NO2- очень активен химически. Поэтому должно быть совершенно точно гарантировано, что нитрит не будет накапливаться в хлоропластах, например, в темноте. Это достигается точной регуляцией нитратредуктазы (см. рис. 6.88). Фермент обладает небольшим биологическим временем полуобмена в несколько часов, поэтому его синтез приведен в соответствие с потребностью при помощи регулируемой экспрессии гена. Как нитрат, так и свет активируют транскрипцию гена нитратредуктазы. Дополнительно свет осуществляет быстрый контроль активности фермента: активированная светом фосфатаза преобразует неактивный в темноте фосфорилированный фермент в активную дефосфорилированную форму. Глутамин репрессирует транскрипцию гена нитратредуктазы. Эти механизмы рефляции гарантируют то, что синтез нитритов будет происходить только тогда, когда в этом есть необходимость, а удаление нитритов из хлоропластов обеспечено. В темноте накопившийся нитрат запасается в вакуолях клеток мезофилла.
6.6.2. Ассимиляция нитратов в фотосинтетически неактивных тканях
В клетках, в которых отсутствуют хлоропласты (например, в корнях, в клетках грибов и у бактерий), нитрат также преобразуется в аммоний через стадию образования нитрита. Реакция нитритредуктазы в корнях протекает в лейкопластах, где фермент использует электроны от НАДН + Н+; НАДН + Н+ поставляется окислительным пентозофосфатным циклом (см. 6.10.3.5). Нефотосинтетическая ассимиляция нитратов протекает в ростках. Она наблюдается также у древесных растений (деревьев, кустарников) и в незначительном объеме у большинства взрослых травянистых растений (исключение: многие бобовые). Растения, у которых происходит преимущественно фотосинтетическая ассимиляция нитратов, запасают значительные количества NO3 в стволе и корневой системе (например, Chenopodium, Xanthium, Beta). Синтезированный в корнях аммонийный азот там же преобразуется в аминокислоты и преимущественно в форме глутамина и аспарагина транспортируется в побег по ксилеме.