ХИРУРГИЯ НОВОРОЖДЕННЫХ - 1976
2. ЧАСТНЫЕ РАЗДЕЛЫ
9. Гнойно-воспалительные заболевания
Гнойно-воспалительные заболевания продолжают оставаться одной из основных причин летальности новорожденных. Число таких больных не имеет тенденции к уменьшению и. по данным отдела хирургии новорожденных нашей клиники, составляет от 40 до 60% от общего числа детей, лечившихся в отделении. Клинические проявления и характер течения гнойно- воспалительных заболеваний у новорожденных существенно отличается от таковых у детей старшего возраста и взрослых. Характер реакций организма новорожденного при гнойно-воспалительных процессах обусловлен анатомическими и функциональными особенностями.
Общие особенности течения гнойно-воспалительных заболеваний новорожденных
Новорожденные дети больше, чем дети других возрастных групп, подвержены гнойно-воспалительным заболеваниям. Этот факт находит объяснение в особенностях взаимоотношения гноеродной микрофлоры с организмом новорожденного ребенка. Новорожденный, будучи в период внутриутробного развития гомобионтом, впервые встречается с микрофлорой (в том число и патогенной) в момент родов, при прохождении через родовые пути матери. В случае развития патологического процесса у новорожденного сущность последнего сводится к взаимодействию двух факторов (патогенного микроорганизма и организма новорожденного), а не трех (микроорганизма, симбионта и макроорганизма), как это отмечается у более старших детей и взрослых (С. Я. Донецкий, 1965). Это в значительной степени определяет специфику течения гнойно-воспалительного процесса у новорожденных (рис. 113). Длительное применение методов лечения, направленных на ликвидацию патогенных микроорганизмов, в таких случаях нецелесообразно, ибо нарушает становление взаимоотношений между симбионтной микрофлорой и организмом больного ребенка.
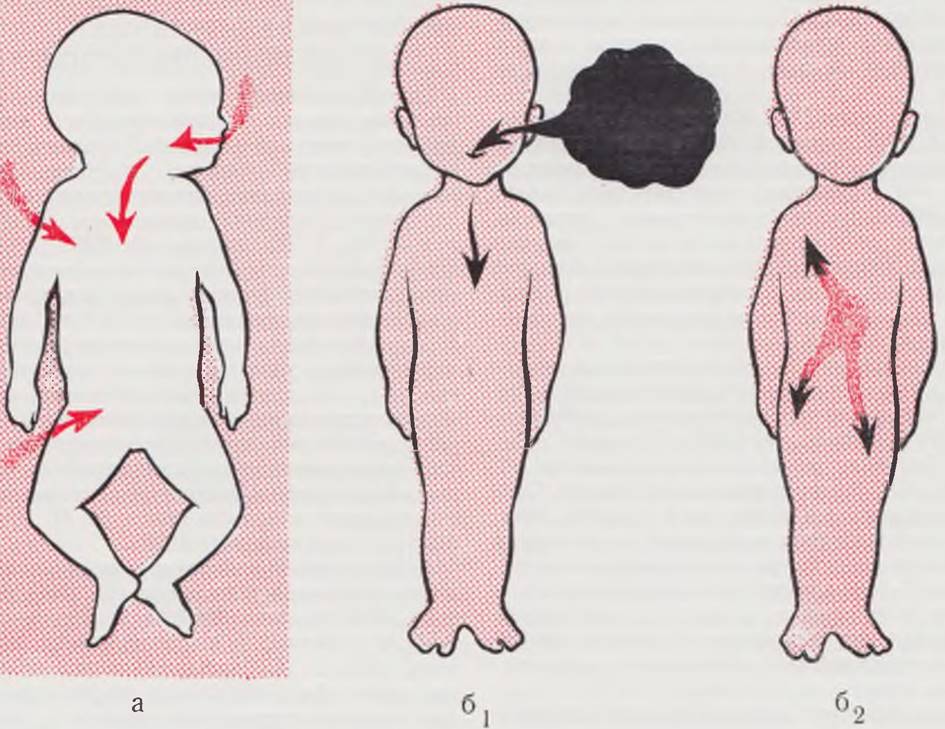
Рис. 113. Схема возникновения гнойно-воспалительных заболеваний.
У новорожденных детей (а) такие болезни возникают иначе, чем у детей более старшего возраста (б1, б2) и взрослых. В первом случае встречаются два фактора — защитные силы организма и микроорганизмы, заселяющие организм новорожденного и одновременно являющиеся источником гнойно-воспалительного процесса. У более старших детей и у взрослых всегда имеют место три фактора: защитные силы, симбионты и гноеродные микробы. При экзогенной инфекции (б1) гноеродные микробы появляются извне, при эндогенной (б2) ими становятся «взбунтовавшиеся») симбионты.
Относительно большая частота гнойно-воспалительных заболеваний у новорожденных объясняется также не сформированными барьерными функциями органов и тканей. Эпителиальный барьер кожи и слизистых оболочек у новорожденных более проницаем для микрофлоры, чем у взрослых. Так, мерцательный эпителий дыхательных путей легко деформируется, клетки эпителия слабо связаны между собой и с подлежащими тканями, легко слущиваются в просвет трахеи (М. А. Скворцов, 1960; Essbach, 1961).
Тонкость и легкая ранимость кожных покровов, частые мацерации и опрелости способствуют проникновению микрофлоры (А. Андронеску, 1970). В возникновении и особенностях течения гнойно-воспалительных заболеваний большое значение имеют особенности строения и кровоснабжения подкожной клетчатки, эпифизов длинных трубчатых костей и др. В частности, преобладание концевого тина кровоснабжения способствует быстрому прогрессированию некротических процессов в подкожной клетчатке (флегмона новорожденного) и эпифизарных концах длинных трубчатых костей (остеомиелит).
Особенности клинического проявления гнойно-воспалительных заболеваний у детей, преобладание в клинической картине общих симптомов над местными обусловлены недостаточной дифференцировкой центральной и периферической нервной системы новорожденного.
Большое значение имеют особенности специфической и неспецифической реактивности организма новорожденного. Известно, что реакция развивающегося организма па различные раздражители, в том числе и на инфекционные агенты, находится в прямой зависимости от степени зрелости его.
У новорожденных и детей первых месяцев жизни имеется выраженная устойчивость к ряду инфекционных, преимущественно вирусного характера, заболеваний. Они почти не болеют корью, скарлатиной, паротитом и др. Принято считать, что дети раннего возраста защищены от этих заболеваний антителами, полученными от матери диаплацентарным путем (Danois е. а., 1961). В настоящее время доказано, что плацента способна не только пропускать антитела, но и синтезировать их. Плацентарный барьер сравнительно легко преодолевают антитела к вирусам; передача антител к токсинам выражена меньше.
Исследованиями Н. Е. Рязанцевой, Е. В. Смирновой, Л. А. Козловской (1959) и др. показано, что от матери передается пассивный иммунитет лишь к тем инфекциям, которыми мать болела или против которых была привита. Антитела, переданные диаплацентарным путем, создают пассивный иммунитет, отличающийся большой продолжительностью и напряженностью. Антитела, с которыми ребенок рождается, сохраняются в организме до 3 — 6 мес.
Работы последних лет показали, что новорожденные дети сами способны вырабатывать антитела, в частности при инфекционных заболеваниях (Л. С. Лозовская, 1969; Еihenwald е. а., 1960). При этом вырабатываются главным образом А- и М-фракции иммуноглобулинов. Синтез G-фракции, способствующей защите организма от воздействия гноеродной, в частности стафилококковой, флоры у новорожденного минимален. G-фракцня начинает синтезироваться не ранее 3 мес жизни. В этом в значительной степени находит объяснение большая частота гнойно-воспалительных заболеваний у новорожденных и тяжесть их течения.
Уровень факторов неспецифического иммунитета в крови новорожденного ребенка мало отличается от такового у детей более старшего возраста.
Для недоношенных характерно быстрое истощение резервных возможностей организма и значительное снижение факторов неспецифпческого иммунитета при заболеваниях инфекционного генеза. Последнее наступает в более ранние сроки по сравнению с доношенным новорожденным ребенком.
Перечисленные выше основные анатомо-физиологические особенности организма новорожденного ребенка, отсутствие симбионтной микрофлоры, недостаточная зрелость центральной и периферической нервной системы, недостаточные барьерные возможности кожи и слизистой оболочки, концевой тип кровоснабжения отдельных органов и тканей, относительная незрелость ретикулоэндотелиальной системы и др. являются основными предпосылками большей подверженности новорожденных гнойно-воспалительным заболеваниям, специфики клинических проявлений гнойно-воспалительных заболеваний у новорожденных. Терапия таких больных может быть эффективной только тогда, когда лечебные мероприятия проводятся с учетом приведенных особенностей.
Сепсис новорожденных. Общие принципы лечения гнойно-воспалительных заболеваний новорожденных
Сепсис — специфическое заболевание инфекционного характера, при котором в организм больного поступают микробы, продукты их жизнедеятельности, токсины, продукты распада клеток из первичного или метастатического очага. Сепсис — понятие клиническое (М. С. Маслов, 1959). Г. Н. Сперанский (1937) указывал, что сепсис является скорее не самостоятельной нозологической формой заболевания, а фазой инфекционного процесса.
Характер клинического течения сепсиса у новорожденных, тяжесть его и неудовлетворительные результаты лечения обусловлены анатомо- физиологическими особенностями, своеобразием реактивности организма новорожденного ребенка, выраженной вирулентностью и устойчивостью гноеродной микрофлоры к широко распространенным антибиотикам (3. Н. Вихирева, 1965; А. Д. Островский, 1970).
В этиологии сепсиса новорожденных ведущее место занимает стафилококк (Г. И. Чистович, 1961; Л. Г. Квасная, 1972; А. Р. Шуринок, 1965; А. Д. Островский, Э. А. Сусленникова; 3. Д. Хозова, 1967; В. Н. Гераськина и др., 1970). Сепсис может быть обусловлен также стрептококком, протеем, синегнойной палочкой, кишечной палочкой и др.
Инфицирование новорожденного может произойти уже во время родов, а затем в родильном доме. Большое значение имеет микрофлора родовых путей матери и бактерионосительство персонала (Э. Г. Исаева, 1965; Е. И. Глоткина, 1970; Раrker, 1966). Источниками инфекции могут быть также предметы ухода за новорожденным ребенком, инструментарий, аппаратура и пр.
Входными воротами сепсиса новорожденных являются пупочная ранка, поврежденная кожа, слизистые оболочки. У большинства новорожденных, заболевших сепсисом, удается обнаружить первичный очаг — омфалит, пиодермию, флегмону новорожденных и др. В ряде случаев первичный очаг выявить не удается.
В зависимости от входных ворот инфекции различают пупочный сепсис, кожный, легочный, кишечный, смешанный и безочаговый сепсис (Э. Г. Исаева, 1965; Л. Г. Квасная, 1972).
В развитии септического процесса Л. Г. Квасная (1972) выделяет три периода — внедрение инфекции, скрытый период заболевания, развитие выраженных симптомов болезни. Последний период наступает через 5 — 10 дней от момента инфицирования.
Большое значение в развитии септического процесса имеет преморбидный фон. В анамнезе заболевших детей, как правило, находят заболевание матери в период беременности, родовую травму и другие осложнения в родах, длительное мокнутие пупка, кровянисто-гнойные выделения из пупочной ранки, воспалительные изменения кожи, заболевания органов дыхания, диспенсические расстройства и др. Более часто встречается и тяжело протекает сепсис недоношенных (Е. Ч. Новикова, 1967, 1967; В. Г. Андреева и др., 1969).
Клиническая картина. Сепсис новорожденных в большинстве случаев не обладает натогномоличной клинической симптоматикой и часто протекает под различными «масками». Выделяют предвестники сепсиса, ранние и выраженные симптомы заболевания.
К предвестникам сепсиса относят позднее отпадение пуповинного остатка, задержку в весе, плохо поддающиеся лечению гнойничковые заболевания, длительную мацерацию кожи и др.
Ранними симптомами считают вялость, срыгивают, плохой аппетит, бледность кожных покровов, воспалительные изменения в области пупочных сосудов, сеть застойных вен передней брюшной стенки, отечность области пупка.
В стадии выраженного заболевания страдают все органы и системы. Различают две формы заболевания — септицемию и септикоциемию. Но клиническому течению выделяют легкий, средней тяжести и тяжелый сепсис (Е. И. Глоткина, 1970). В клинической картине па первый план выступают нейротоксикоз, легочный, кишечный синдромы и др.
У новорожденных преобладает септицемия (Н. В. Орлова, 3. Д. Хозова, 1969). Для последней характерно медленно прогрессирующее ухудшение состояния больного, нарастание явлений токсикоза. Температурная реакция не характерна. Септицемия течет волнообразно, периоды улучшения сменяются ухудшением. Характерны бледность, серость кожных покровов, снижение аппетита, стабилизация или падение веса. Динамика веса ребенка имеет большое диагностическое и прогностическое значение. Прогрессирование заболевания сопровождается нарастанием признаков поражения центральной нервной системы - - ребенок становится вялым, адинамичным, в ряде случаев отмечаются судороги, нистагм, менингеальные симптомы. Возможно нарушение ритма дыхания. Пульс учащен, выявляется приглушенность и даже глухость тонов сердца. Часты поражения желудочно-кишечного тракта, обусловливающие срыгивают, рвоту, дисфункции кишечника.
Печень у большинства больных увеличена в размерах. Отмечается снижение активности холинэстеразы, повышение уровня трансаминаз. В ряде случаев имеет место нарушение обмена билирубина, появляется желтушность склер и кожных покровов. Увеличение селезенки характерно для терминальных стадий заболевания (Е. Ч. Новикова, 1965). В моче таких больных появляются белок, лейкоциты, эритроциты, почечный эпителий, что свидетельствует о явлениях раздражения почек. Нередко наблюдается пиурия.
Наиболее постоянным симптомом сепсиса является анемия. Чем моложе ребенок, тем меньше выражены изменения со стороны красной крови, по мере роста явления анемии прогрессируют. Изменения со стороны белой крови не столь характерны, у одних больных отмечается умеренный лейкоцитоз, а у других — лейкопения. Более отчетливо выражен сдвиг формулы влево. Число тромбоцитов, как правило, снижено, реакция оседания эритроцитов ускорена.
При тяжелых формах сепсиса снижается уровень общего белка. Содержание α1- и α2-глобулинов повышено, что свидетельствует о прогрессировании процесса. Количество у-глобулинов в разгар заболевания уменьшается. Септицемия сопровождается отчетливыми нарушениями водно-минерального обмена. В терминальных стадиях заболевания нередко присоединяются склерема, геморрагические проявления. Исследования последних лет (В. Н. Гераськина, 1970) выявили истощение функции коры надпочечников при сепсисе, что имеет значение для обоснования патогенетической терапии.
Новорожденные с явлениями септицемии, как правило, наблюдаются и лечатся педиатрами. В хирургические отделения они направляются в большинстве случаев при присоединении сентикопиемии. Появление метастатических гнойных очагов сопровождается повышением температуры, резким ухудшением состояния (В. К. Мазурова, 1969; Н. И. Маргулис, 1971). Гнойники могут возникнуть в различных органах, по чаще всего поражаются легкие, в которых клинически вначале отмечаются явления пневмонии. При полисегментарных, крупноочаговых и сливных пневмониях наблюдается деструкция легочной ткани с последующим абсцедированием, прорывом в плевру, развитием пиопневмоторакса. Гнойные очаги развиваются также в области среднего уха, в подкожной клетчатке. Одной из частых форм проявления септикопиемии является остеомиелит. Для недоношенных характерно развитие септического язвенно-некротического энтероколита с последующей перфорацией кишки и перитонитом (Е. Ч. Новикова и др., 1966, 1967, 1971; Л. М. Кондратьева и др., 1968; 15. 15. Гаврюшов и др., 1971). Присоединение явлений сентикониемии резко ухудшает прогноз.
Реактивность организма новорожденного имеет решающее значение в развитии, особенностях течения и исходе септического процесса. Изучению вопросов состояния специфического п неспецифического иммунитета при гнойно-септических заболеваниях посвящены исследования 3. И. Вихиревой (1965), А. Д. Островского (1966, 1970), Т. А. Богомаз (1965, 1967), Ф. Ц. Гохберг (1968) и др. Проведенные исследования показали, что у большинства больных с сепсисом фагоцитоз усиливается. В тяжелых случаях при неблагоприятном прогнозе показатели фагоцитоза снижены. Выявляется определенная зависимость динамики показателя завершенного фагоцитоза от локализации и характера течения септического процесса. Чем тяжелее процесс, тем более высок показатель завершенного фагоцитоза.
Содержание антитоксина при стафилококковом сепсисе у большинства больных снижено. Отмечается снижение содержания лизоцима и комплемента (В. А. Снонкова, Г. Л. Билич, 1966; Л. Б. Балаян, 1969).
Общие принципы лечения. Комплексная терапия гнойно-воспалительных заболеваний и сепсиса новорожденных предусматривает воздействие на возбудителя (микроорганизм), воздействие на микроорганизм (повышение защитных возможностей последнего) и проведение манипуляций по санации гнойных очагов (С. Я. Долецкнй, А. И. Лешошкип, 1965; Л. Г. Билич и др., 1969; Веchamps e. а., 1970; Fardito е. а., 1970, и др.).
Основным методом воздействия па возбудителя при гнойно-воспалительных заболеваниях у новорожденных остается применение антибиотиков. При проведении антибиотин- котерапии учитывают особенности органов и тканей новорожденного. В частности, морфологическая и функциональная незрелость почек обусловливает замедление выведения пенициллина. Энзиматическая незрелость и в связи с этим недостаточность функции печени могут привести к серьезным осложнениям при применении у новорожденных хлорамфеникола (левомицетина). Токсическое действие хлорамфеникола проявляется в виде так называемого серого синдрома: отказа от сосания, напряжения брюшной стенки, расстройства дыхания, вялости и серой окраски кожных покровов. Применение новобиоцина у новорожденных в связи с распространением стафилококковых заболеваний привело к увеличению случаев неонатальной желтухи, что связано с уменьшением способности печени выделять билирубин при приеме этого препарата (Л. Е. Гольдберг, В. И. Бацмщтейн, 1964). При назначении антибиотиков новорожденным следует иметь в виду особую чувствительность детей к прямой фармакологической токсичности препаратов, опасность развития дисбактериоза и суперинфекции.
Особое значение приобретает путь введения антибиотиков. Энтеральный путь введения часто невозможен из-за рвоты, как правило, сопровождающей токсическое состояние. Внутримышечное введение затруднено при общем истощении, склероме, некоторых поражениях кожи. Таким образом, в большинстве случаев методом выбора является внутривенное введение.
Антибиотики делят на несколько групп.
Группа пенициллина. К ней относятся различные препараты бензилпенициллина — натриевая и калиевая соль пенициллина, пепициллины продленного действия (бициллин-3 и бициллин-5), йодистый эфир пенициллина (эфициллин) и пенициллин для приема внутрь (феноксиметилпенициллин), малоаллергенный пенициллин (алмециллин); пенициллины широкого спектра действия (ампициллин, карбенициллин, ценорин, цефалотин).
Биосинтетические пенициллины эффективны в отношении грамположительных микроорганизмов. Полусинтетические пенициллины — метициллин, оксациллин, диклоксациллин — устойчивы к пенициллиназе — ферменту, разрушающему пенициллин. Пенициллины широко применяются для лечения гнойно-воспалительных заболеваний новорожденных. Эффективны комбинации биосинтетических пенициллинов с полусинтетическими, пенициллазоустойчивых пенициллинов с пенициллинами широкого спектра действия.
Из побочных действий препаратов группы пенициллина наиболее опасны аллергические реакции. При высоких дозах возможны нейротоксические реакции.
Группа антибиотиков «резерва». К этой группе относятся препараты, действующие преимущественно на грамполо/кительные бактерии (эритромицин, олеандомицин, линкомицин, ристомицин, новобиоцин).
Линкомицин обладает хорошей способностью проникать в костную ткань и там задерживаться. Его рекомендуют при лечении остеомиелита, септических пневмоний. для профилактики осложнений после операций на сердце и сосудах. Новобиоцин показан при лечении стафилококкового сепсиса, особенно стафилококковых пневмоний. Ристомицин длительно задерживается во внутренних органах, что выгодно отличает его от других антибиотиков. В сочетании с мопомицином ристомицин целесообразно назначать при перитонитах.
Стрептомицины и группа аминогликозидов — стрептомицин, дигидрострептомицин, мономицин, неомицин, канамицин, гарамицин (гентамицин). Эти антибиотки оказывают бактерицидное действие, хорошо проникают в экссудат брюшной и грудной полостей. Антибиотики группы стрептомицина токсичны. Длительное бесконтрольное применение их может привести к изменению кохлеарного и вестибулярного аппаратов; кроме того, они действуют на нервно-мышечные окончания. Препараты группы аминоглюкозидов раздражают паренхиму почки, что проявляется гематурией, альбуминурией, цилиндроурией, они отрицательно действуют на азотистый баланс.
Перечисленные осложнения обусловливают необходимость строгого соблюдения сроков (5 — 7 дней) и доз при лечении.
Дегидрострентомиции у новорожденных применять не рекомендуется из-за выраженного токсического действия его на слух.
Стрептомицин и аминогликозиды назначают в комбинации с антибиотиками других групп — пенициллина, тетрациклина, антибиотиками «резерва».
Антибиотики тетрациклинового ряда — тетрациклин, хлортетрациклин, окситетрациклин, дибиомицин, рондомицин, реверии геомицин, вибрамицин, морфоциклин, гликоциклин. Антибиотики тетрациклинового ряда обладают преимущественно бактериостатическими свойствами. Очень важно, что они депонируются в костной ткани, легких, печени. Препаратам свойственна перекрестная устойчивость. Тетрациклины раздражают слизистую оболочку желудочно- кишечного тракта, нарушают гликогенообразовательную функцию печени. При длительном их приеме поражается микробная флора кишечника, что создает условия для возникновения грибковой суперинфекции или стафилококкового знтероколита. Поотому при назначении тетраинклиновых препаратов одновременно назначают нистатин и витамины.
В связи со значительным побочным действием энтеральный путь введения тетрациклиновых препаратов у новорожденных не имеет клинического применения.
Препараты нитрофуранового ряда. Производные 5-нитрофурана — фурациллин, фурадонин, фуразолидон, фурагин, фурагин К — нашли широкое применение при различных гнойных, воспалительных и септических инфекциях, вызванных стафилококками и кишечными бактериями. Одним из основных условий для назначения нитрофуранов является антибиотико- устойчивость возбудителя.
Нитрофурановые препараты комбинируют с антибиотиками других групп — пенициллина, тетрациклина, антибиотиками «резерва», а также с сульфаниламидами. Из побочных действий нитрофураны наиболее часто вызывают токсические симптомы со стороны желудочно-кишечного тракта (рвоту, потерю аппетита, боли в области желудка, легкие поносы).
Противогрибковые антибиотики — нистатин. леворин, амфотернцин В. Антибиотики этой группы оказывают только противогрибковое действие и не влияют па патогенные микробы. Противогрибковые препараты назначают с профилактической целью при длительной антибиотикотерапии.
Построение рациональной антибиотикотерапии предусматривает: 1) выбор наиболее эффективного препарата; 2) раннее начало лечения; 3) обоснованный выбор комбинации препаратов; 4) определение оптимальных доз, режима и продолжительности терапии. Нецелесообразно применение малых (суббактериоста- тических) доз, поскольку они способствуют формированию устойчивых штаммов микробов. Сроки применения антибиотиков определяют строгими клиническими показаниями, так как длительное применение антибиотиков способствует развитию дисбактериоза.
Антибиотикотерапия строится с учетом индивидуальных особенностей данного больного, характера течения заболевания, сопутствующих патологических процессов.
Особое значение имеет воздействие на макроорганизм новорожденного ребенка. В большинстве случаев реактивность и защитные способности микроорганизма являются решающими факторами, от которых зависит исход острой стадии заболевания, вероятность хронизации процесса и конечный результат. Мероприятия по воздействию на микроорганизм планируют с учетом перечисленных выше особенностей реактивности организма новорожденного. Основное значение придают стимулирующей терапии и повышению в крови новорожденного факторов как специфического, так и неспецифического иммунитета. Учитывая относительную незрелость ретикулоэидотелиальной системы новорожденного ребенка, в частности сниженную способность ее вырабатывать специфические антитела, следует считать целесообразной терапию, направленную па введение в кровь больного готовых факторов иммунитета. Эффективным методом воздействия на организм больного ребенка при гнойно-воспалительном процессе является переливание крови. Его с успехом применяют как в острой стадии, так и в период хронизации процесса и последующей репарации. Наибольшее распространение получила методика переливания консервированной крови небольших сроков хранения в дозе 10 — 15 мл на 1 кг веса тола 1 раз в 2 — 3 дня. Переливание крови чередуют с вливаниями плазмы, назначением гамма-глобулина. Преимущества имеет метод прямого переливания крови, так как в этом случае реципиенту вводится качественно не измененная, абсолютно полноценная кровь.
Лучшим донором для ребенка является одногруппный с ним родитель или близкий родственник (брат, сестра, бабушка, дедушка). При этом значительно сокращается вероятность аллергических реакций за счет уменьшения антигенных различий донора и реципиента.
Прямые трансфузии проводят со строгим соблюденном существующих правил переливания крови. Донора обследуют на пункте переливания крови. Прямое переливание проводят шприцем или пользуются отечественным аппаратом для прямого переливания (модель 210) конструкции НИИЭХАИ. При переливании крови с целью стимуляции достаточно 10 — 15 мл на 1 кг веса. Число переливаний варьирует от 1 — 2 до 10 и более. Интервалы между переливаниями 3 — 4 дня.
Для повышения терапевтической эффективности прямых гемотрансфузий у больных с гнойно-воспалительными заболеваниями стафилококкового характера п пониженными репаративными процессами проводят иммунизацию доноров — родителей или родственников — стафилококковым анатоксином по схеме: троекратная инъекция 0,5 мл стафилококкового анатоксина с интервалом в 5 дней. Одновременно донору вводят 50 мкг-продигиозана. Продигиозан полисахарид, имеющий микробное происхождение. Он стимулирует защитно-приспособительные реакции организма путем воздействия на ретнкудоэндотолиальную и гипофизарно-надпочечниковую системы. Введение его приводит к усилению выхода лейкоцитов в периферическую кровь, увеличению фагоцитарной активности лейкоцитов, повышению лизосомной активности макрофагов (Г. Е. Вайсберг, 1964).
Как показали проведенные исследования, в процессе иммунизации в крови родителей-доноров содержание альфа-антитоксина постепенно повышается. У большинства иммунизируемых накопление альфа- антитоксинов отмечалось уже на 4 — 5-й день после первой инъекции анатоксина. К 14 — 15-му дню от начала иммунизации оно составляло в среднем 1,8 ± 0.3 АЕ/мл, возрастая к 20 — 25-му дню до 10 ± 2,6 АЕ/мл и сохранялось на высоком уровне в течение последующих 10 — 12 дней. Лишь с 30 — 40-го дня отмечалось постепенное снижение уровня специфических антител. После третьей инъекции стафилококкового анатоксина с проднгиозаном у отдельных доноров количество альфа-антитоксина возрастало до 18 — 24 АЕ/мл. Отмечено резкое повышение количества специфических альфа-антитоксических антител в грудном молоке иммунизированных матерей. Если к 15-му дню от начала иммунизации уровень альфа-антитоксических антител составлял 7 ± 0,8 АЕ/мл, то к 20 — 25-му дню он повышался до 20 ± 4 АЕ/мл. Одновременно в молоке увеличивалось ц содержание стафилококковых агглютининов.
Направленная иммунизация вызывает статистически достоверное увеличение антител не только к стафилококку, но и к другим микроорганизмам, по-видимому, за счет общего раздражения ретикулоэндотелиальной системы.
В процессе иммунизации отмечена иммунологическая перестройка организма донора, которая касалась и таких факторов неспецифического иммунитета, как содержание лизоцима и комплемента сыворотки крови. К окончанию иммунизации как лизоцимная, так и комплементарная активность сыворотки крови значительно превышала исходный уровень. Таким образом, иммунизация вызывала значительное повышение защитных способностей организма родителя-донора, и каждая последующая трансфузия крови этого донора оказывала больший терапевтический эффект, чем предыдущая.
Прямые трансфузии крови предварительно иммунизированных доноров приводят к увеличению содержания альфа-антитоксинов крови реципиента (ребенка). Уровень последних уже к 10 — 11-му дню от первой инфузии составил 1 ± 1,5 АЕ, мл и в дальнейшем повышался до 6 0,7 АЕ/мл. Одновременно повышались лизоцимная и комплементарная активность крови реципиента. Характерно, что дети, находившиеся на грудном вскармливании донора — матери, обнаруживали значительно большую лизоцимную активность сыворотки крови, чем дети более старшего воз раста пли дети, которым прямые переливания крови проводили от иммунизированного отца. По-видимому, молоко иммунизированной матери является мощным фактором повышения сопротивляемости организма ребенка.
В отделении хирургии новорожденных кафедры детской хирургии ЦОЛИУ в прямое переливание крови широко применяется с 1970 г. В начале работы показания к прямому переливанию крови ставили в случаях, когда длительное применение обычной терапии, в частности и переливании консервированной крови, не давало отчетливого терапевтического эффекта. По мере накопления опыта и выявления эффективности прямых гемотрансфузий, особенно крови предварительно иммунизированных доноров, показания к прямому переливанию крови были расширены. Прямые переливания проводились, как правило, в комбинации с комплексной антибактериальной, дезинтоксикационной терапией и физиотерапией с одновременной санацией местного очага. В большинстве случаев уже после 1 — 3 прямых гемотрансфузий отмечалось значительное улучшение состояние ребенка, улучшался аппетит, прекращалось падение веса, улучшалось состояние гнойного очага.
Значительный терапевтический эффект удается получить при применении антистафилококковой плазмы (В. А. Таболин и др., 1970; С. В. Скуркович и др., 1971) и антпетафилококкового гамма-глобулина (Т. В. Голосова и др., 1969; Н. С. Захарьевская и др., 1972). Гипериммунную антистафилококковую плазму получают от доноров, иммунизированных стафилококковым анатоксином. Она отличается от обычной плазмы высоким титром специфических антистафилококковых антител. Плазму вводят внутривенно в дозе 6 — 10 мл на 1 кг веса тела ребенка. Курс трансфузий состоит из 3 — 6 переливаний с интервалом 2 — 3 дня. Эффективно чередование переливаний крови, плазмы и гамма-глобулина.
Важной задачей комплексной терапии при гнойно-воспалительных заболеваниях у новорожденных является коррекция показателей гомеостаза в широком значении этого термина: борьба с дыхательной, циркуляторной и тканевой гипоксией, ликвидация гиповолемии и циркуляторных нарушений, поддержание нормальной деятельности сердца, лечение гипертермии, уменьшение протеолиза и патологического воздействия его продуктов, нормализация водно- электролитного баланса и функции почек, коррекция метаболических сдвигов.
Борьбу с гипоксией начинают с оксигенотерапии. Увлажненную смесь кислорода с воздухом (2 : 3) вводят через носовой или назофарингеальный катетер непрерывно в течение суток. Дыхательную недостаточность усугубляет скопление мокроты в дыхательных путях, нередко наблюдающееся у новорожденных. В этих случаях улучшению дыхания способствует санация трахеобронхиального дерева с помощью прямой ларингоскопии и бронхоскопии. Возраст и тяжесть состояния больных не являются противопоказанием к этим процедурам (И. Г. Климкович, 1963; С. Я. Донецкий, В. М. Балаган, Л. А. Гельдт, 1972). Для улучшения тканевого дыхания и окислительных процессов назначают витамины группы В, кокарбоксилазу. Циркуляторные расстройства ликвидируют инфузией крови, плазмы и коллоидных растворов (полиглюкина, поливинола, желатиноля, альбумина, протеина) по 10 — 15 мг на 1 кг веса в сутки. Помимо уменьшения гиповолемии, введение белковых препаратов оказывает прямое антитоксическое действие, ибо их молекулы адсорбируют на себе токсины микробов. Выраженными дезинтоксикационными свойствами обладают низкомолекулярный поливинилпирролидон и его препараты — гемодез, неокомпенсан, перистон. Их молекулы образуют с токсинами комплекс, который выводится с мочой.
Дефицит воды и электролитов, а также энергетические затраты организма, резко возрастающие в условиях воспалительного процесса и гипертермии, восполняют внутривенным введением глюкозо-солевых растворов. Для уменьшения тахикардии, пареза кишечника, мышечной гипотонии, являющихся следствием дефицита калия, последний назначают в виде 7,5% раствора хлористого калия в растворе глюкозы.
Нагрузка солями калия переносится новорожденными и даже недоношенными детьми вполне удовлетворительно. В то же время ионы натрия выводятся медленно и их избыток может вызывать гиперволемию, развитие отеков и способствовать увеличению сердечной недостаточности (Ю. Е. Вельтищев, 1967). В силу указанных обстоятельств приходится быть чрезвычайно осторожным при назначении новорожденным растворов, содержащих поваренную соль. Регидратацию у больных раннего возраста рекомендуют проводить под контролем показателей гематокрита, центрального венозного давления и объема циркулирующей крови.
При явлениях сердечно-сосудистой недостаточности лечебные мероприятия направлены на разгрузку малого круга кровообращения (эуфиллин, лазикс, урегид) и увеличение силы сердечных сокращений (строфантин, коргликон, а в дальнейшем дигоксин).
Протеолитическое действие микробных токсинов и собственных ферментов организма, активизированных инфекционным процессом, а также патологическое влияние продуктов протеолиза нейтрализуют введением ингибиторов протеолиза — трасилола, контрикала и назначением антигистаминных препаратов.
Для борьбы с гипертермией кожу ребенка интенсивно растирают спиртом. На фоне ганглиоблокирующего действия антигистаминных веществ эта манипуляция способствует расширению кожной капиллярной сети и усилению теплоотдачи. Применяют физические методы охлаждения и антипиретики (пирамидон и др.)
Нарастание метаболических сдвигов кислотно-щелочного равновесия крови в сторону ацидоза требует применения буферных растворов (сода, трисамин). Эти препараты используют под контролем показателей кислотно-щелочного равновесия в тех случаях, когда инфузия жидкостей, оксигенотерапия и мероприятия, направленные на снижение температуры тела, не приводят к нормализации pH крови (у новорожденных нормальный pH крови составляет 7,28 — 7,31).
Воздействие на очаг инфекции у новорожденных, как и у детей старших возрастных групп, предусматривает своевременную, максимально полную санацию очага. Характер оперативного вмешательства при этом зависит от локализации и характера процесса. Принципиально важным во всех случаях является стремление к обеспечению оптимальных условий для оттока гноя с минимальным повреждением окружающих тканей (пункция суставов при остеомиелите, метаэпифизарной локализации, множественные мелкие насечки при флегмоне новорожденного и др.).
Избегают широких разрезов и тампонирования ран марлевыми турундами. Преимущества имеют небольшие разрезы с последующим введением топких выпускников из перчаточной резины.
В острой стадии процесса решающее значение имеет фактор времени. Вскрытие очага — неотложное вмешательство. Промедление со вскрытием очага на несколько часов может значительно ухудшить течение заболевания, непосредственные и отдаленные результаты лечения.
Гнойно-воспалительные заболевания кожи и подкожной клетчатки
Флегмона новорожденных — специфическое гнойно-воспалительное заболевание детей первых недель жизни с преимущественным поражением подкожной клетчатки — характеризуется острым началом, быстрым прогрессированием местного процесса с последующим обширным некрозом кожи и подлежащих тканей. В самостоятельную нозологическую единицу флегмона новорожденных впервые выделена С. А. Васильевым в 1939 г.
Входными воротами инфекции в большинство случаев является кожа; нельзя исключить возможность проникновения возбудителя через пупочную ранку, слизистые оболочки и др.
При флегмоне новорожденных первичный воспалительный процесс локализуется в подкожной клетчатке. Возникают очаговые лейкоцитарные инфильтраты вокруг потовых желез с кровоизлияниями в дерме. Макроскопически имеется плотный инфильтрат, кожа гиперемирована, на разрезе она обильно кровоточит, гноя нет. При прогрессировании процесса кожа становится багрово-синюшной, появляются очаги зыбления с отслойкой кожи. Клетчатка на разрезе выглядит тускло-серой, местами имеет желтый цвет вследствие распада жировой ткани, нс кровоточит, вначале отторгается мелкими кусочками, а затем целыми пластами.
Местный процесс при флегмоне новорожденных может локализоваться в различных местах, редко ограничиваясь какой-либо одной анатомической областью. Наиболее часто поражаются грудная клетка, пояснично-крестцовая и ягодичная области (61,8% наблюдений). Третье место по частоте поражения занимает шея. Ладонная поверхность кистей и подошвенная поверхность стон флегмоной новорожденных не поражаются.
Клиническая картина. Заболевание начинается остро с повышения температуры до 38 — 39° С, появления беспокойства, нарушения спа, отказа от груди. Уже в ближайшие часы при осмотре ребенка обнаруживают плотный участок красного цвета, резко болезненный при пальпации. Границы его четкие, кожа гиперемирована, горяча на ощупь, не собирается в складки. Краснота и уплотнение быстро распространяются во все стороны. Первичное изменение кожи напоминает рожистое воспаление. По мере распространения воспалительного процесса состояние больного ухудшается, присоединяется токсикоз, иногда возникают диспенсические расстройства. Кожа над инфильтратом через 36 — 48 ч принимает местами цианотичный оттенок, пальпация болезненна. Постепенно на месте очага инфильтрации образуются участки размягчения, болезнь переходит во второй период — период некроза подкожной клетчатки. С этого времени общее состояние ребенка несколько улучшается, он активнее сосет, меньше беспокоится, температура критически или литически снижается. Над очагом поражения появляются синюшные участки кожи па местах ее отслойки. На 2 —3-и сут заболевания через разрезы или образовавшиеся свищи выделяется жидкий гной с кусочками некротизированной клетчатки. В этот период у большинства больных распространение процесса прекращается, заболевание может закончиться выздоровлением.
У других детей (17%, по нашим наблюдениям) болезнь принимает подострое точение и переходит в следующий период — период некроза кожи и образования раневых дефектов. Участки некроза кожи располагаются в месте начальной локализации процесса, где в первую очередь происходит омертвение подкожной клетчатки. Кожа па этом участке становится цианотичной, холодной, безболезненной и постепенно отторгается. Рана принимает характерный вид: дно покрыто обрывками серой омертвевшей клетчатки, края подрытые, неровные; обнажаются подлежащие ткани — фасции, мышцы, кости. Тенденция к развитию грануляций и эпителизацин, как правило, отсутствует, местные изменения напоминают послеоперационную гангрену. Общее состояние больного в этот период прогрессивно ухудшается, температура остается нормальной или субфебрильной, нарастает интоксикация. Клинические проявления свидетельствуют о развитии сепсиса. Ребенок становится вялым, плохо сосет, кожа теряет свойственную ей эластичность и свежесть, становится бледной с грязно-серым оттенком, снижается тургор тканей. Весовая кривая уплощается, зачастую снижается, характерны множественные нетехиальные высыпания. В отдельных случаях присоединяются септические осложнения, нарастает раневое истощение и больной погибает. Чем больше площадь поражения, тем вероятнее летальный исход. Летальность резко возрастает при поражении 10 — 12%
поверхности тела.
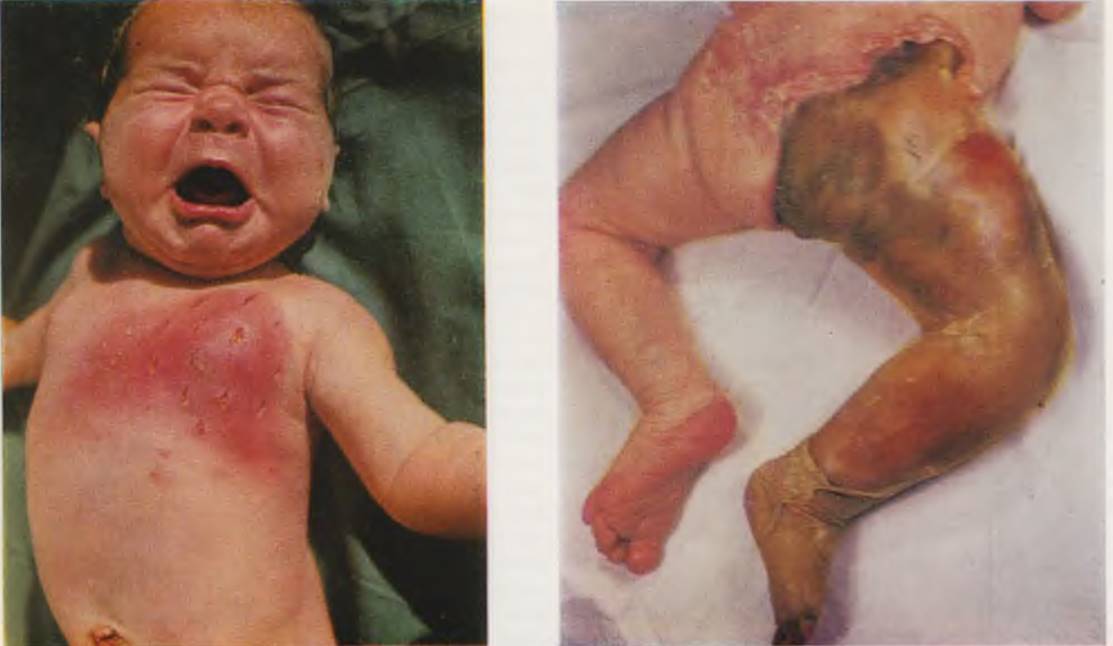
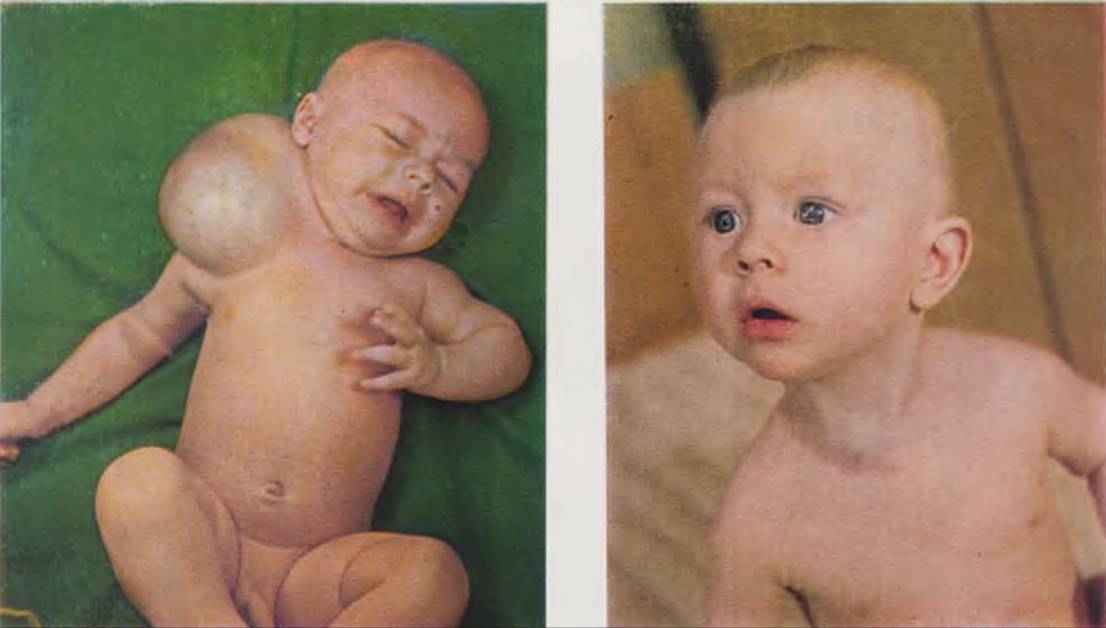
Ребенок с флегмоной новорожденных. Воспалительные изменения через 6 ч распространились за пределы произведенных разрезов (слева). Новорожденный с внутриутробным сепсисом. Гангрена правой нижней конечности, наступившая в результате тромбоза правой пупочной и подвздошной артерий (справа).
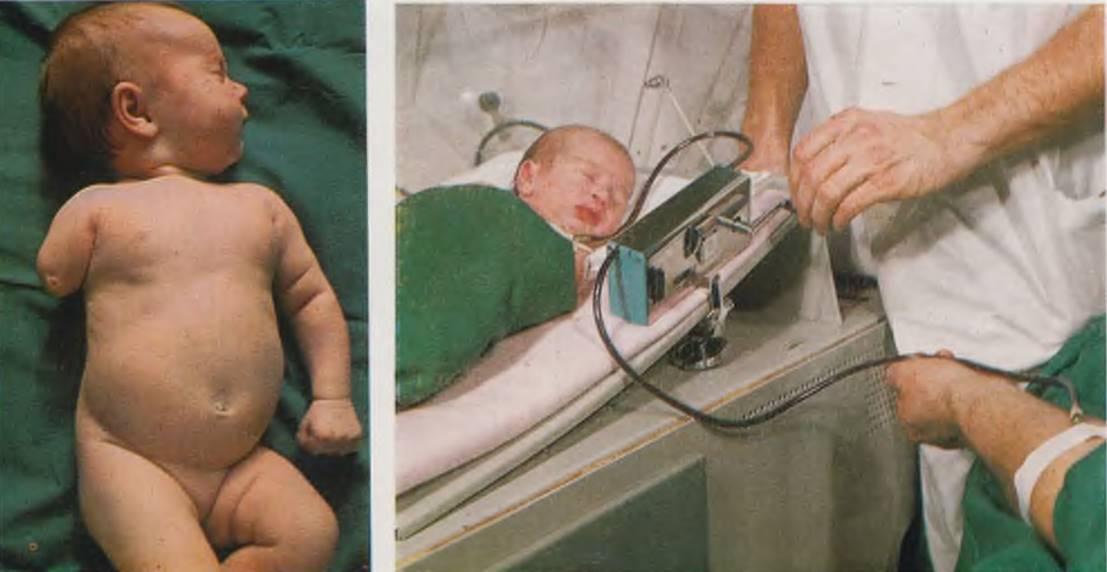
Новорожденный с внутриутробным сепсисом. Ампутация правого плеча как результат перенесенного внутриутробного остеомиелита (слева). Прямое переливание крови новорожденному, осуществляемое при помощи специального аппарата с роликовым насосом (справа).
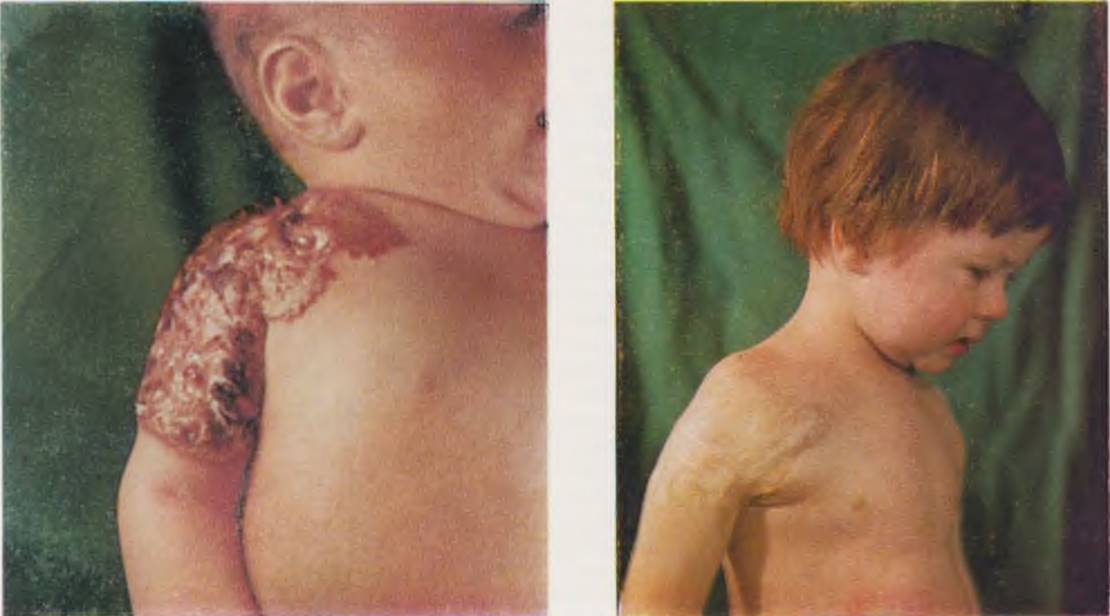
Новорожденная с изъявляющейся кавернозной гемангиомой правого плеча и надплечья (слева). Та же больная через год после курса короткофокусной рентгенотерапии (справа).
Новорожденный с лимфангиомой шеи (слева). Тот же больной через 6 мес после оперативного лечения (справа).
У части детей некроз кожи не достигает угрожающих размеров, по отторжении омертвевшей кожи образуются рапы 2 — 5 см в диаметре. Болезнь переходит в период репарации. Небольшие рапы постепенно выполняются грануляциями, по краям начинается эпителизация, приводящая к закрытию рапы, ребенок выздоравливает.
Обширные раневые дефекты, предоставленные самостоятельному заживлению, эпителизируются длительное время (до 5 мес) и оставляют косметически неблагоприятные и даже уродующие рубцы.
Различают осложнения: а) общие (пневмония, парентеральная диспепсия, отит и др.); б) гематогенные гнойные метастазы (абсцедирующая пневмония, менингит, множественные абсцессы и др.); в) местные, развивающиеся per continuitatem (остеомиелит, гнойный плеврит, гнойный перикардит и др.).
Осложнения первых двух групп возникают при флегмоне новорожденных, как при любом гнойно-воспалительном заболевании, и не зависят от локализации местного процесса. Осложнения местного характера являются следствием прогрессирования местного процесса и зависят от локализации и распространения очага. Наиболее тяжелые осложнения этой группы возникают при локализации процесса в области грудной клетки. При дальнейшем прогрессировании процесса развивается гнойный плеврит, пневмония и, как заключительный этап, гнойный перикардит. Эти осложнения приводят к летальному исходу.
Дифференциальная диагностика. Флегмону новорожденных дифференцируют с рядом заболеваний, которые сходны по клиническим проявлениям. К ним относятся лимфаденит, рожистое воспаление, мастит новорожденных, острый гематогенный остеомиелит, перитонит, подкожно-жировой некроз новорожденных. Наибольшие трудности в постановке диагноза возникают при рожистом воспалении (С. Д. Терновский, 1959), остеомиелите ребра и подкожно-жировом некрозе.
Рожистое воспаление начинается остро с повышения температуры до 38 — 39°. Участок гиперемии кожи быстро увеличивается, границы очага четкие, пальпация болезненна. Рожистое воспаление чаще поражает детей старше месяца, процесс локализуется вокруг входных ворот, которыми могут быть ссадины, пупочная райка, поврежденная кожа, гениталии, особенно при недостаточно квалифицированном уходе за ребенком. При рожистом воспалении гиперемия кожи более яркая, блестящая, лаковая, участок гиперемии располагается в виде языков (так называемая географическая исчерченность границ). Иногда на фоне гиперемии появляются мелкие пузырьки. Отек, краснота и болезненность исчезают от центра к периферии (Г. Фан- кони, А. Вальгрен, 1960). Отек создаст легкое возвышение очага над здоровой кожей, что можно обнаружить при проведении пальца от здоровой кожи к очагу.
В отличие от рожи флегмона новорожденных встречается, как правило, у детей первого месяца жизни. Очаг инфекции характеризуется плотной инфильтрацией. Обратное развитие очага начинается с периферии.
Большие трудности диагностики возникают при остеомиелите ребра. Клиника заболевания напоминает флегмону новорожденных. Даже в стационаре правильный диагноз ставят не сразу. Иногда его удается поставить лишь в процессе наблюдения.
Подкожный жировой некроз — заболевание детей первых дней и недель жизни. Наблюдается оно преимущественно у детей с большим весом (С. Г. Звягинцева и др., 1963). Этиологическим моментом многие авторы считают механическую травму в родах, асфиксию, приемы для оживления новорожденных (Anbari, 1961; Marks, Beasch, 1962, и др.). Местный процесс характеризуется появлением плотных очагов в коже и подкожной жировой клетчатке в первые дни жизни ребенка. Так же как при флегмоне новорожденных, ладони и подошвы не поражаются. Мелкие уплотнения (от 0,2 до 3 — 5 см в диаметре) постепенно сливаются в большие очаги, занимающие иногда всю спину, ягодицы. Кожа гиперемирована, тепла на ощупь, болезненна при пальпации. В редких случаях появляются очаги зыбления (Bernard, 1957). В этот период поражение напоминает флегмону новорожденных. Подкожно-жировой некроз через 3 — 5 мес самостоятельно проходит, специального лечения не требует. Прогноз благоприятный. Общее состояние больного, как правило, не страдает. При учете анамнеза можно установить правильный диагноз. В неясных случаях правильной диагностике помогает наблюдение.
Лечение. Больные с флегмоной новорожденных нуждаются в экстренной хирургической помощи.
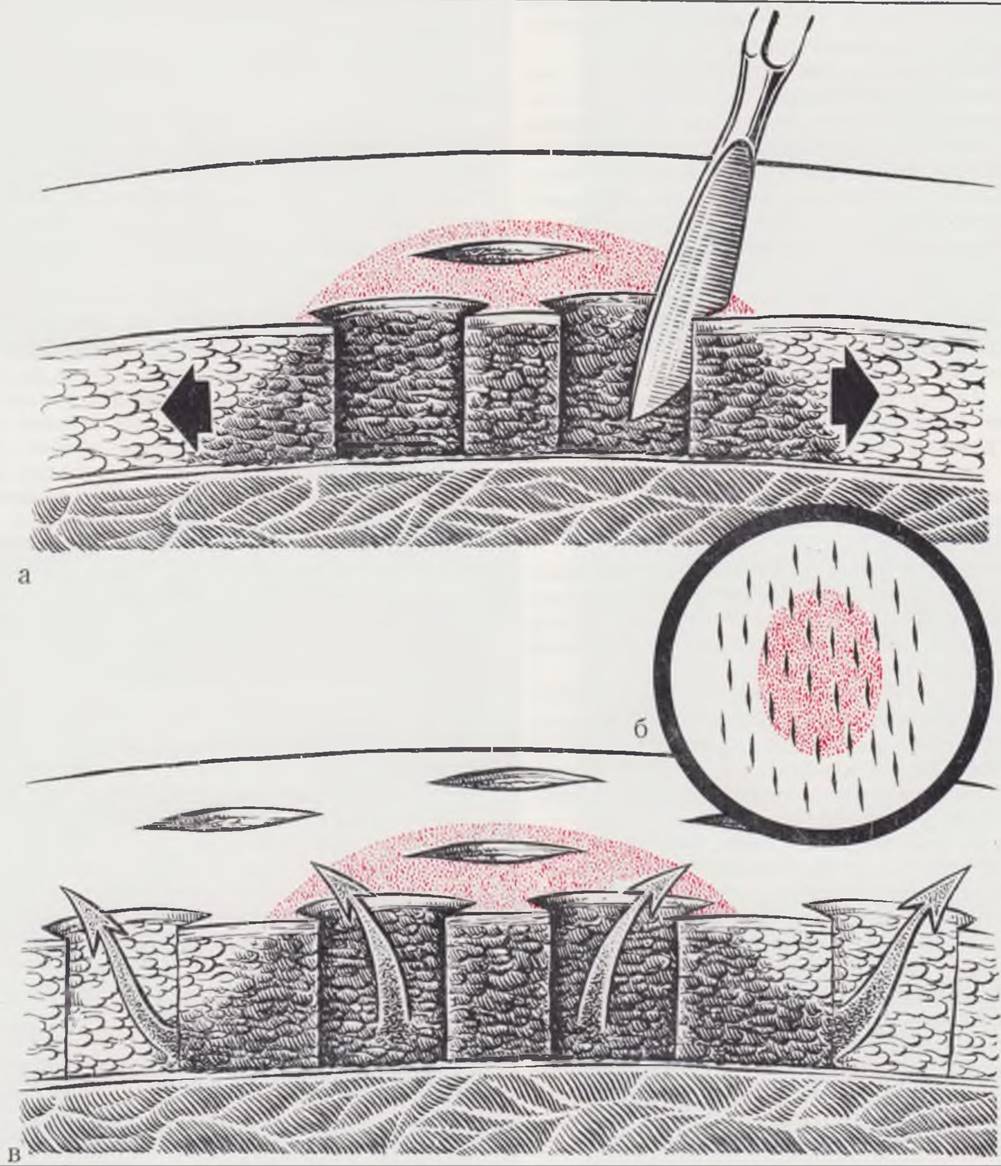
В острой стадии заболевания производят обкалывание воспалительного инфильтрата 0,25% раствором новокаина из нескольких точек по типу короткой новокаиновой блокады по А. В. Вишневскому. Не рекомендуется вводить новокаин под пораженный участок, ибо это увеличивает отслойку кожи. Сразу после новокаиновой блокады производят множественные разрезы кожи в шахматном порядке на всем очаге поражения и на здоровой коже, отступя 0,5 — 1 см от зоны поражения. Длина разреза 1,5 см. Разрезы должны проникать в подкожную клетчатку (рис. 114). Мелкие разрезы снимают напряжение тканей, создают условия для оттока гноя и некротизированной клетчатки. Разрезы на пограничной здоровой коже препятствуют распространению процесса. На всю поверхность флегмоны накладывают повязку с гипертоническим раствором (25% раствор сернокислой магнезии, 10% раствор хлористого натрия). Чтобы своевременно обнаружить распространение очага и нанести дополнительные разрезы, первые 2 — 3 сут перевязки делают каждые 4 — 6 ч.
Рис. 114. Принцип разрезов кожи при флегмоне новорожденных (по С. Я. Долецкому).
Поскольку воспалительный процесс распространяется за пределы видимой на коже зоны, насечки (б) следует производить не только в зоне видимого поражения (а), но и отступя от нее. Активный перифокальный дренаж предупреждает распространение воспаления (в).
Для улучшения оттока гноя во время перевязок разводят края ран, промывают их через микроирригатор раствором фурациллина или изотоническим раствором хлористого натрия с антибиотиками. Со 2— 3-го дня применяют общие ванны, способствующие удалению некротизированных тканей. Физиотерапию применяют в 1 — 2-е сут после поступления больного. Начинают с ультрафиолетовых облучений в эритемной дозе. Одновременно воздействуют па пораженный участок электрическим полем УВЧ с целью вызвать рассасывание инфильтрата (К. Е. Дикая и др., 1972).
Воздействие на местный очаг в подострой стадии заключается в его санации и пластическом закрытии раневых дефектов. Сразу по образовании демаркации производят некротомию. После удаления омертвевшей кожи и клетчатки края образовавшейся раны стягивают лейкопластом или ведут под мазевыми повязками, что приводит к гранулированию и заживлению раны. Добиться заживления обширных ран чрезвычайно трудно. Вызвать гранулирование удается применением биологических стимулирующих повязок (фибринная пленка, аппликации консервированной плаценты, консервированная гомокожа плода). Временное закрытие раны биологическим материалом ускоряет выведение больного из тяжелого состояния и способствует подготовке раневой поверхности к последующей аутопластике. Для полного закрытия раны применяют различные методы пересадки кожи. Фиксацию аутотрансплантатов можно производить фибринной пленкой, гомокожей (Ф. И. Каинов, Г. А. Остромоухова, 1972).
Антибактериальная терапия, дезинтоксикационное и стимулирующее лечение, а также рациональное вскармливание являются непременным условием лечения этих больных.
Весовая кривая является показателем правильности проводимого лечения. Критерием выздоровления считают стойкое улучшение общего состояния ребенка, прибавку в весе, отсутствие воспалительных явлений на участке поражения, нормальную температуру.
Прогноз при флегмоне новорожденных серьезен. Исход зависит от своевременной диагностики и госпитализации, ранней рациональной комплексной терапии.
До применения антибиотиков летальность от флегмоны новорожденных достигала 70% (О. С. Бокастова, 1939), применение антибиотиков позволило снизить летальность до 16,6% (Ф. И. Железнякова, 1950). В последние годы, с введением комплексной терапии этого страдания новорожденных, летальность снизилась до 6 — 7% (Ф. И. Каинов, Г. А. Остромоухова, 1972).
Большинство детей, перенесших флегмону новорожденных, растут и развиваются соответственно возрасту. У некоторых детей отмечены повторные гнойно-воспалительные заболевания. В редких случаях в отдаленные сроки дети отстают в физическом развитии. Косметические результаты оперативного вмешательства в 89% наблюдений хорошие, по в случаях обширного некроза кожи возможны грубые деформирующие рубцы (Н. П. Карпенко, 1960).
Гнойно-воспалительные заболевания органов грудной полости
Абсцедирующие пневмонии у новорожденных вызываются преимущественно патогенным стафилококком или ассоциациями его с разиообразной микрофлорой. Наиболее опасным является сочетание стафилококка с Е. coli, protens и особенно с Вас. pyocioneus. Среди гнойно-воспалительных заболеваний у новорожденных пневмонии занимают одно из первых мест по тяжести течения и частоте летальных исходов, число которых достигает 46 — 64% (Н. Л. Кущ и др., 1970; Bechamps е. а., 1970). Поражение легких может носить первичный характер. Бактериальная инфекция при этом обычно наслаивается на вирусную, с чем связана частота абсцедирующих пневмоний в период вспышек респираторно-вирусной инфекции, пандемий гриппа. В то же время у новорожденных чаще, чем в более старшем возрасте, встречаются вторичные поражения легких, когда пневмония является проявлением сентикопиемии, вызванной пупочным сепсисом, пиодермией, гнойным отитом, флегмоной новорожденных, острым гематогенным остеомиелитом. Развитию стафилококковых пневмоний способствуют недоношенность, родовая травма, гипотрофия, ателектазы новорожденных, диатезы, создающие неблагоприятный преморбидный фон.
По характеру клинического течения различают внутрилегочную и легочно-плевральную формы абсцедирующей пневмонии (В. Ф. Бакланова, 1973). Для первой характерно образование в паренхиме легкого воспалительных инфильтратов и абсцессов, для второй — развитие плевральных осложнений.
Абсцессы легкого
У новорожденных чаще имеют место мелкие, субнилеврально расположенные микроабсцессы, которые могут сливаться в одни гигантский кортикальный абсцесс. Наряду с этим можно встретить больных с крупными, хорошо различимыми на рентгенограмме «макроабсцессами» в толще паренхимы легкого.
Клиническая картина абсцедирующей пневмонии у новорожденных характеризуется выраженными явлениями токсикоза и дыхательной недостаточности. Отмечается сухость кожных покровов, цианоз носогубного треугольника и слизистых оболочек, акроцианоз, выраженная одышка с раздуванием крыльев носа. Появляется влажный кашель, затруднение носового дыхания. Рано присоединяется сердечная недостаточность, проявляющаяся глухостью сердечных тонов, тахикардией, расширением границ сердца, увеличением печени. Пневмония обычно сопровождается дисфункцией пищеварительной системы, парезом кишечника, вздутием живота, рвотой. У части больных возникают судороги в результате гипоксии центральной нервной системы.
В отдельных случаях развивается тяжелый гипертермический синдром. Гипертермия усиливает потерю жидкости, увеличивает расход энергетических ресурсов организма, усугубляет гипоксию и метаболические нарушения. Гипертермический синдром особенно опасен истощением надпочечников и их острой недостаточностью. При возникновения последней нередко наблюдаются внезапные летальные исходы. Наряду с повышением температуры у ряда новорожденных встречаются случаи тяжелой пневмонии с нормальной или субфебрильной температурой. Отсутствие температурной реакции характерно для недоношенных детей и является проявлением ареактивности организма.
Выявление физикальной симптоматики в начальном периоде пневмонии у новорожденных требует навыка. В легком прослушивается ослабленное дыхание, которое может приобретать жесткий, иногда бронхиальный характер. Хрипы, чаще сухие, выслушиваются над всей поверхностью легких, достигая наибольшей интенсивности в прикорневых зонах. Перкуторный звук приобретает коробочный оттенок. При поражении одного легкого отмечается отставание соответствующей половины грудной клетки. Спустя 1 — 2 дня картина меняется. Возникает зона притупления перкуторного звука, над которой дыхание имеет бронхиальный оттенок и сопровождается влажными хрипами, иногда крепитирующими. Позднее появляются симптомы полости: локализованный тимпанит или участок притупления с зоной тимианита над ним. Дыхание в этой области носит бронхиальный или амфорический характер, прослушиваются разнокалиберные влажные хрипы.
Лабораторная диагностика. При исследовании периферической крови у большинства детей отмечается умеренно выраженный лейкоцитоз и относительная лимфонения. Для новорожденных нехарактерны выраженные сдвиги формулы крови. Тем не менее у отдельных детей встречается гиперлейкоцитоз и резкий сдвиг гемограммы в сторону юных форм вплоть до миелоцитов, появляются плазматические клетки и выраженная токсическая зернистость лейкоцитов. При длительном течении заболевания нарастает анемня.
Изменения показателей содержания общего белка сыворотки крови и белковых фракций весьма характерны. У подавляющего большинства больных на фоне мало измененного уровня общего белка определяется значительное понижение содержания альбуминовой фракции, в среднем на 33% по сравнению с нормой. Наряду с выраженной гипоальбуминемией увеличено количество α1- и α2-глобулинов, что свидетельствует об остром воспалительном процессе. Содержание β- и у-глобулинов мало меняется по отношению к нормальным для новорожденных величинам. В результате уменьшения количества альбуминов, обладающих наибольшей гидрофильностью, значительно снижается коллоидно- осмотическое давление крови (в среднем на 22%). Это способствует выходу жидкой части плазмы за пределы кровяного русла и развитию гиповолемии.
Исследование парциального напряжения кислорода (рО2), насыщения крови кислородом (НbО2) и содержания кислорода в артериальной крови (СаO2) показывает выраженную гипоксемию у большинства пациентов. Больше всего страдает парциальное напряжение кислорода и насыщение артериальной крови кислородом (в среднем 62,5 ± 4,3 мм рт. ст. и 82,46 ± 5,4% соответственно). Кислородная емкость крови у ряда больных остается высокой, что расценивают как компенсаторную реакцию организма на состояние гипоксии.
Анализ результатов исследования кислотно- щелочного равновесия крови показывает, что у большинства детей имеет место выраженный ацидоз метаболического или смешанного характера. В последнем случае наряду с уменьшением щелочного резерва крови определяется существенное повышение парциального давления углекислоты, что свидетельствует о снижении дыхательной функции легких и значительных метаболических нарушениях. В более легких случаях определяют сдвиг кислотно-щелочного равновесия в сторону алкалоза. Последний носит дыхательный характер и связан с потерей углекислоты в результате выраженной одышки.
Лабораторная диагностика имеет особое значение у новорожденных, так как позволяет получить объективную информацию о нарушениях внутренней среды организма и проводить направленную их коррекцию.
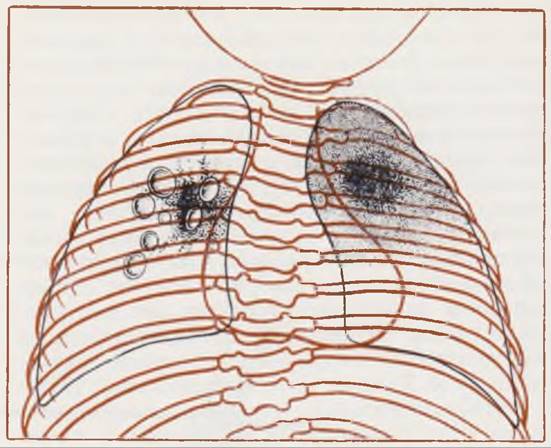
Рентгенологическая картина. Диагностика стафилококковой абсцедирующей пневмонии основана главным образом па данных рентгенологического исследования. К ранним признакам заболевания относят возникновение участков уплотнения, инфильтрации легочной ткани, которые занимают 1 — 2 сегмента и имеют довольно четкие границы. Очаги инфильтрации могут появляться в разных отделах легкого и имеют тенденцию к слиянию в пределах доли. В дальнейшем па фоне уплотнения легочной ткани может появиться участок просветления округлой формы, с четкими контурами и умеренно выраженной перифокальной реакцией (рис. 115, а). Большинство рентгенологов трактуют эти образования как эмфизематозные буллы, которые возникают в результате клапанного вздутия микроабсцессов или участков альве
олярной ткани. Не исключена возможность растяжения их в результате эластической тяги окружающей легочной ткани (С. II. Борисов, 1934; В. Ф. Бакланова, 1967, 1973; Potts, Biker, 1950; Caffey, 1956). Буллезные полости могут быть множественными. Появляются они обычно в период рассасывания инфильтратов. Они нередко остаются сухими на протяжении всего заболевания и почти не влияют на состояние больных.
Рис. 115. Рентгенограмма грудной клетки.
а — ребенок 2 мес, диагноз: двусторонняя абсцедирующая пневмония. В правом легком видны эмфизематозные буллы, возникшие на месте рассасывающегося инфильтрата, в левом — воспалительная инфильтрация легочной ткани; б — тот же ребенок через 3 дня. На месте инфильтрата в левом легком возникла полость с уровнем жидкости («макроабсцесс»), буллы справа слились.
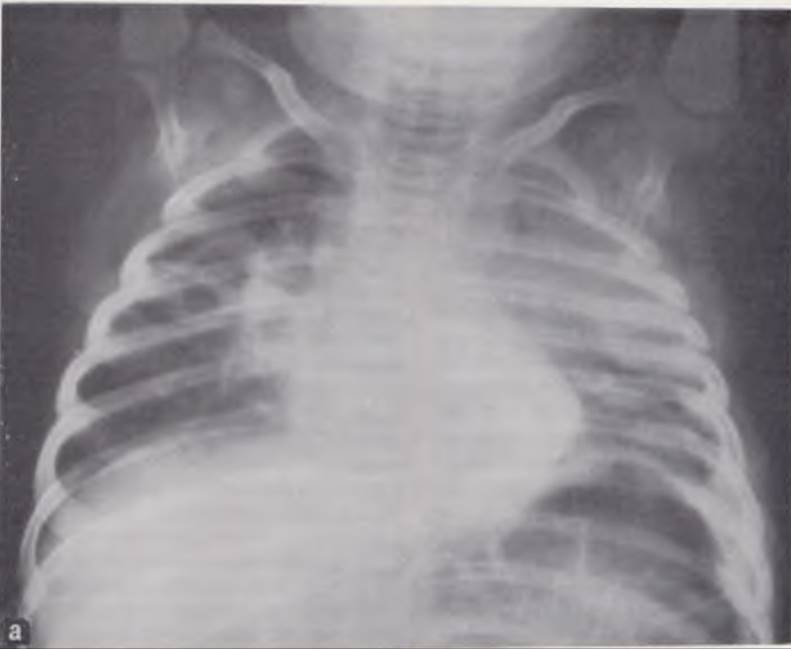
Наряду с буллезными полостями при абсцедирующей пневмонии у новорожденных могут возникать некротические полости, которые имеют при рентгенологическом исследовании более грубые и широкие контуры, окружены зоной перифокального воспаления и содержат жидкость (рис. 115, б). Патогенез их спорен. По мнению В. Ф. Баклановой (1961), С. Я. Долецкого с со- авт. (1969), эти полости являются инфицированными буллами и заполнены гнойным экссудатом. Г. А. Баиров (1969), Э. А. Степанов и В. И. Гераськин (1971, 1972) считают их «макроабсцессами», возникающими вследствие некроза и расплавления легочной ткани. Появление некротических полостей-абсцессов существенно отягощает течение пневмонии и требует интенсивного, направленного лечения.
Лечение. Комплексное лечение абсцедирующей пневмонии включает антибактериальную терапию, коррекцию сдвигов гомеостаза, иммунотерапию п санацию очага инфекции.
Ведущее место в лечении стафилококковой пневмонии у новорожденных занимают полусинтетические пенициллины (оксациллин, метициллин, клоксациллин) в сочетании с препаратами широкого спектра действия — ампициллином (пентриксилом), цепорином. Преимуществом названных антибиотиков является их относительно низкая токсичность и связанная с этим возможность создания высоких концентраций в крови и очаге. Эффективными являются антибиотики тетрацнклинового ряда (глпкоцнклпн, морфоциклин, реверпн) в сочетании с олеандо- мицнном или эритромицином п готовые комбинированные препараты (сигмамицин, тетраолеан, олететрин, олеоморфоциклин). Большинство этих антибиотиков можно вводить внутривенно, что очень важно для создания высоких концентраций в крови. Для длительных прерывистых инфузий у новорожденных детей целесообразно использовать пункционную катетеризацию подключичной вены (О. А. Тимощенко, В. М. Балаган, 1969). Сохраняет свое значение пенициллин. Изменились лишь его дозировки. В последнее время для лечения тяжелых форм пневмонии его назначают в дозе не менее 200 000 — 400 000 ЕД на 1 кг веса в сутки. При сочетании стафилококка с синегнойной палочкой эффективным оказывается гарамицин (гентамицин), который, так же, как и остальные препараты группы аминогликозидов, должен применяться с большой осторожностью в строгом соответствии с возрастными дозировками.
Параллельно антибиотикам используют сульфаниламиды. Хорошо зарекомендовали себя пролонгированные средства: мадрибон, сульфаниридазии, сульфадиметоксин, потесептил. Массивная антибактериальная терапия требует защиты от развития дисбактериоза. С этой целью детям назначают леворин, нистатин, интестинальный эубиотик — мексаформ. Целесообразно применение кислых молочных смесей, кефира, лактобациллина и бифидумбактерина. Парентерально вводят витамины группы В и аскорбиновую кислоту.
Стафилококковые полости — буллы — не требуют, как правило, специального лечения. Появление их не осложняет течения пневмонии, и спустя несколько недель или месяцев они самостоятельно исчезают. Исключение составляют редкие случаи клапанного увеличения буллезных полостей. Возникающая при «том картина внутрилегочного напряжения требует немедленного хирургического вмешательства.
Некротические полости и абсцессы легкого нуждаются в опорожнении. Наиболее простой способ — пункция — может привести к тяжелому осложнению — разрыву стенок полости и развитию нионневмоторакса. Указанные обстоятельства заставляют начинать лечение с попыток дренирования полости через бронхи. Применяют ингаляции антибиотиков и ферментов, постуральное дренирование, бронхоскопию с введением лекарственных препаратов внутрибронхиального. При отсутствии аффекта переходят к пункционному лечению. После аспирации содержимого гнойной полости последнюю промывают антисептическими растворами, ферментами, вводят антибиотики.
При неэффективности консервативного лечения К). Ф. Исаков, Э. А. Степанов и В. И. Гераськин (1969) рекомендуют у новорожденных чаще прибегать к радикальной операции — торакотомии и резекции пораженных отделов легкого.
Гнойный плеврит
Вовлечение в гнойный процесс плевральной полости означает переход заболевания в качественно иную фазу — фазу гнойного плеврита, эмпиемы плевры.
Клиническая картина. У новорожденных чаще встречается тотальное поражение плевральной полости — склонность к осумкованиям для них не характерна. Плевральные осложнения развиваются рано: почти у половины больных — в первые 5 дней от начала заболевания. Ранним признаком плеврита является ухудшение состояния больного, усиление токсикоза, увеличение дыхательной недостаточности. Ребенок становится беспокойным, перестает сосать. Нарастает вздутие живота и парез кишечника. Последнее обстоятельство может послужить причиной диагностической ошибки, когда тяжелую абсцедирующую пневмонию принимают за непроходимость кишечника.
При перкуссии определяется притупление, более выраженное по задней поверхности легкого. По мере накопления жидкости в плевре увеличивается смещение средостения. Последнее у новорожденных фиксировано слабо и смещается уже при накоплении первых 50 — 75 см3 жидкости. Дыхание над пораженным легким ослаблено. Хрипы могут отсутствовать. Классические симптомы плеврита (линия Демуазо, треугольник Раухфуса — Грокко и др.) у новорожденных практически не определяются. Диагноз уточняют после пункции плевральной полости.
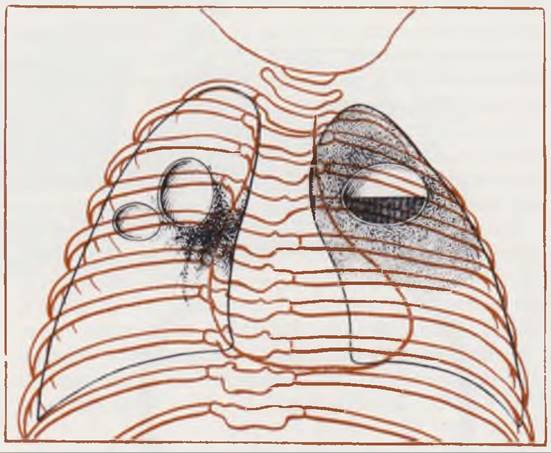
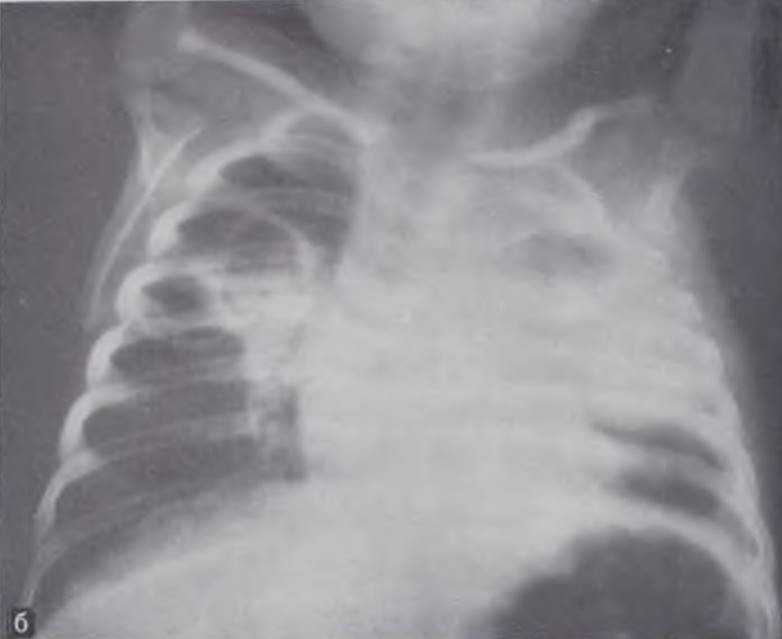
Рентгенологическая картина. Выпот на ранних этапах гнойного плеврита располагается в виде плаща, окутывая легкое тонким слоем. При рентгенографии в этих случаях определяется снижение пневматизации легочного поля па стороне поражения и появление перикостальной полосы затемнения (В. Ф. Бакланова, 1973). Иногда легкое выглядит как бы покрытым вуалью. При прогрессировании плеврита интенсивность затемнения возрастает, оно сливается с тенью грудной стенки и диафрагмы (печени — при правосторонней локализации). Отмечается смещение срединной тени (рис. 116). На пораженной стороне наблюдается расширение межреберий и низкое стояние купола диафрагмы. У отдельных пациентов, наоборот, пораженная половина грудной клетки выглядит уменьшенной из-за рано возникающего искривления позвоночника в больную сторону.
Рис. 116. Рентгенограмма грудной клетки ребенка 22 дней. Диагноз: правосторонний гнойный плеврит.
Лечение. Диагностическая пункция плевральной полости одновременно является и лечебным мероприятием. При серозном выпоте пункционное лечение продолжают, каждый раз аспирируют содержимое, промывают плевральную полость антисептиками и вводят антибиотики.
При нарастании плеврита и при гнойном характере выпота производят дренирование плевральной полости. Лучшие результаты при гнойном плеврите у новорожденных получены при активной аспирации в комбинации с постоянным промыванием плевральной полости.
Пиопневмоторакс
Пиопневмоторакс — самое частое и грозное осложнение абсцедирующей пневмонии — возникает при прорыве в плевральную полость абсцесса или некротической буллы с образованием бронхоплеврального сообщения.
Клиническая картина. Развитие пиопневмоторакса, как правило, сопровождается внезапным резким ухудшением состояния больного. Отмечается нарастание цианоза, выраженная одышка, стонущее, кряхтящее дыхание. Особенно тяжелая картина возникает при клапанном, напряженном пиопневмотораксе. К дыхательной недостаточности присоединяется сердечно-сосудистая недостаточность, связанная с резким смещением средостения и перегибом крупных сосудов. Более тяжелой симптоматикой сопровождается смещение сердца в правую сторону из-за сдавления полых вен н нарушения притока крови к правым отделам сердца (Swan, Aragon, 1954).
При физикальном исследовании отмечается сочетание тимпанита с притуплением в нижних отделах грудной клетки. Границы сердца смещены в противоположную сторону. Дыхание па пораженной стороне почти не проводится. Тоны сердца глухие, частые. Пульс поверхностный, нитевидный.
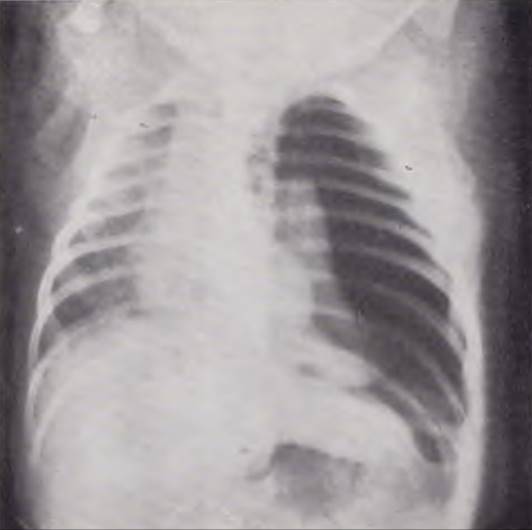
Рентгенологическая картина. Внезапное ухудшение состояния ребенка диктует необходимость срочной рентгенографии грудной клетки. При пиопневмотораксе определяется просветление половины грудной клетки с уровнем жидкости, который может достигать II — III ребра. В большинстве случаев удается четко определить тень коллабированного легкого, прижатого к средостению. Срединная тень смещена в сторону противоположного легкого. Реберные промежутки на больной стороне расширены, купол диафрагмы расположен ниже обычного (рис. 117).
Рис. 117. Рентгенограмма грудной клетки ребенка 15 дней. Диагноз: левосторонний напряженный пневмоторакс.
Лечение. Лечение пиопневмоторакса у новорожденных является сложной проблемой. Наличие бронхоплеврального свища требует экстренного дренирования плевральной полости. При небольших размерах деструкции, когда удается создать разрежение в полости плевры, можно ожидать расправления легкого и закрытия свищей. При широком свище или множественных дефектах легкого дренирование редко приводит к выздоровлению. Нежность тканей новорожденного является причиной быстрого развития зоны некроза вокруг дренажного отверстия, возникновения флегмоны грудной стенки, остеомиелита ребер, прогрессирования септического процесса. В связи с этим у новорожденных чаще приходится прибегать к радикальной операции. Решить вопрос о степени поражения и объеме деструкции помогает плевроскопия, которую производят перед дренированием плевральной полости.
Радикальная операция при пиопневмотораксе у новорожденных сопровождается высокой степенью риска, требует хорошего обезболивания и тщательной оперативной техники. Она состоит из трех этапов: торакотомии и пиевмолиза, декортикации легкого и резекции зоны деструкции. Особенности оперативного вмешательства у новорожденных определяются нежностью тканей и пониженной их сопротивляемостью инфекции, что требует бережного с ними обращения, ограничения сегментарных и атипичных резекций в связи с опасностью рецидива бронхоплеврального свища, повышенной чувствительностью к кровопотере, трудностью манипуляций на легких при узком доступе и ограниченном операционном поле.
Наиболее сложным этапом лечения новорожденных, оперированных на легких, является послеоперационный период. У больных этой возрастной группы отмечается быстрое угнетение дыхания, легко возникают ателектазы, очаги гиповентиляции и пневмонии. Поэтому в первые 6 — 8 дней после операции ребенок требует пристального внимания в условиях послеоперационной палаты или реанимационного отделения.
Отдаленные результаты. Изучение отдаленных результатов лечения абсцедирующих пневмоний у новорожденных в сроки от 6 мес до 11 лет подтверждает высокие репаративные способности легочной ткани (В. Ф. Бакланова, 1970). По данным клиники, хорошие результаты лечения получены у 89,4% больных. Дети хорошо развиваются, не предъявляют жалоб. Патологии в легких при физикальном и рентгенологическом исследовании у них не обнаружено. Удовлетворительные результаты отмечены у 7,1% больных. Эти пациенты жалуются на периодические рецидивы респираторных заболеваний, повторные пневмонии. Во время обострения у них появляются влажный кашель, хрипы, повышается температура. При бронхографии выявляется умеренная деформация бронхов в виде локализованного деформирующего бронхита. Такие больные нуждаются в постоянном диспансерном наблюдении и периодических курсах санации трахеобронхиальной системы.
Неудовлетворительными признаны результаты лечения одного ребенка, перенесшего внутрилегочную форму абсцедирующей пневмонии. При бронхографии у него обнаружены мешотчатые бронхоэктазы и очаговый пневмосклероз, потребовавшие резекции нижней доли легкого в возрасте 2 1/2 лет.
Результаты оперативного лечения гнойных поражений легких у новорожденных благоприятны. Большое значение в увеличении объема и восстановлении нормального строения легочной ткани после частичных резекций легкого у детей этого возраста имеет постнатальное развитие легких в течение первых лет жизни (В. И. Пузик, 1953; Engel, 1947). Оставшаяся легочная ткань увеличивается в размерах за счет нарастания новых генераций бронхов и альвеол; при этом она приобретает нормальную структуру, становится полноценной в функциональном отношении.
Гнойно-воспалительные заболевания органов брюшной полости
Гнойно-воспалительные заболевания органов брюшной полости у новорожденных, как правило, протекают очень тяжело, дают большое число осложнений и неблагоприятных исходов.
Гнойный перитонот
У большинства больных гнойный перитонит развивается вторично, как осложнение сепсиса, вследствие перехода воспалительного процесса с передней брюшной стенки или прилежащих органов, перфорации органов брюшной полости. Возможно внутриутробное развитие перитонита при распространении инфекционного начала через плаценту.
Этиология и патогонез. Полиэтиологичность перитонита новорожденных обусловливает разнообразие микрофлоры, высеваемой из брюшной полости таких больных. По нашим данным, наиболее частыми возбудителями перитонита являются стафилококк и кишечная палочка.
Причины перфорации кишечника у новорожденных многообразны. Они могут быть врожденными и приобретенными. Наиболее часто перфорация кишечной стенки обусловлена пороком развития мышечного слоя ее (И. А. Бобрик. 1965), нарушением трофики стенки кишки при механическом сдавлении у больных с мекониевым илеусом, кишечной атрезией (М. Д. Гращенко, 1963; Birtsch е. а., 1967), язвенно-некротическим процессом в стенке кишки при септическом энтероколите (И. И. Мирончик, 1964; Erick. 1966), нарушением трофики кишечной стенки при сепсисе, генерализованных формах токсоплазмоза, цитомегалин, органических поражениях центральной нервной системы и др. К числу редких причин перфорации кишечника у новорожденных относят обменное переливание крови (Caralps- Riera. Colin, 1970). Первые две группы причин относят к врожденным, последующие — к приобретенным.
Перфорации кишечника, обусловленные причинами врожденного характера, в большинстве случаев возникают внутриутробно или в первые дни и педели жизни ребенка. Патогенез перфорации зависит от характера причины. При недоразвитии мышечного слоя кишки достаточно небольшого повышения внутрибрюшного давления (сдавление туловища во время родов, плач, натуживание). Перфорация кишечной стенки у больных с язвенно-некротическим энтероколитом обусловлена главным образом преобладанием некротического процесса над воспалительным, что является одной из основных особенностей течения гнойно-воспалительных заболеваний у новорожденных и грудных детей. В результате на месте небольшой эрозии быстро разрушается мышечный слой и серозная оболочка — кишка перфорируется.
Клиническая картина. В начальных стадиях заболевания на первый план выступают клинические проявления заболевания, явившегося причиной перитонита (пупочный сепсис, перфорация атрезированной кишки и др.). Состояние ребенка тяжелое, он вял, бледен, обезвожен. Температура у большинства больных повышена. Рано присоединяется рвота. Стул в начале заболевания может быть задержан, в дальнейшем становится жидким, частым. Отмечают нарушения дыхания.
Среди местных симптомов характерным является резкое вздутие живота вследствие пареза кишечника. При явлениях непроходимости нередко видны расширенные, вяло перистальтирующие кишечные петли. Подкожные вены передней брюшной стенки расширены. Пастозность и отечность брюшной стенки — постоянный и наиболее достоверный признак перитонита. При выраженном перитоните отечность распространяется и на половые органы. По мере прогрессирования процесса присоединяется гиперемия кожи передней брюшной стенки. Перистальтика вялая или отсутствует совсем. При перкуссии нередко удается выявить свободную жидкость в латеральных карманах или нижних отделах брюшной полости. При пальпации определяется напряжение мышц брюшной стенки. Пальпация, как правило, болезненна, ребенок становится беспокойным.
Клиническая картина перфорации кишечника, обусловленной причинами врожденного характера, имеет ряд характерных особенностей. Уже через несколько часов после рождения у ребенка отмечается рвота, вздутие живота, задержка стула. Первые порции рвотных масс, как правило, состоят из желудочного содержимого и заглоченных околоплодных вод. Затем появляется примесь желчи и в последнюю очередь — кишечного содержимого. Симптом наличия печеночной тупости нельзя считать абсолютно достоверным. Печень новорожденного относительно велика, и при небольшом количестве газа в брюшной полости печеночная тупость сохраняется. Стул у этих больных пли отсутствует, или очень скуден и состоит из мекониально-слизистых пробок серого цвета, выполняющих дистальные отделы кишечника.
Перфорации приобретенного характера на почве язвенно-некротического энтероколита, как правило, развиваются у недоношенных детей в конце первого — начале второго месяца жизни. Анамнез и история заболевания таких больных в большинстве случаев весьма типичны. Обычно недоношенный ребенок в первые 3 — 4 нед жизни начинает прибавлять в весе, состояние его улучшается. В дальнейшем в связи с присоединением пневмонии, гнойно-воспалительных заболеваний, сепсиса состояние ребенка ухудшается, он перестает прибавлять в весе. Этот период совпадает с развитием сепсиса и образованием изъязвлений слизистой оболочки кишки. В момент перфорации кишечной стенки состояние ребенка резко ухудшается, развивается своеобразный шок. Ребенок становится вялым, цианотичным. Дыхание частое, поверхностное. Прогрессирует вздутие живота. Брюшная стенка растянута, пастозна, отмечается расширение подкожной венозной сети. Присоединяется рвота. Изменения температуры нетипичны — у одних больных она повышена, у других остается нормальной или имеет место понижение температуры. В большинстве случаев отмечается склонность к лейкопении (в связи с общей аре- активностью организма недоношенного, ослабленного ребенка) и сдвигу лейкоцитарной формулы влево.
Если имеет место ограниченная перфорация, клинические проявления заболевания развертываются медленнее и не столь ярки. При большом количестве газа в брюшной полости возможно отсутствие печеночной тупости. Из кала таких больных нередко высевают грамположительные кокки (Dietel, Hartmann, 1967).
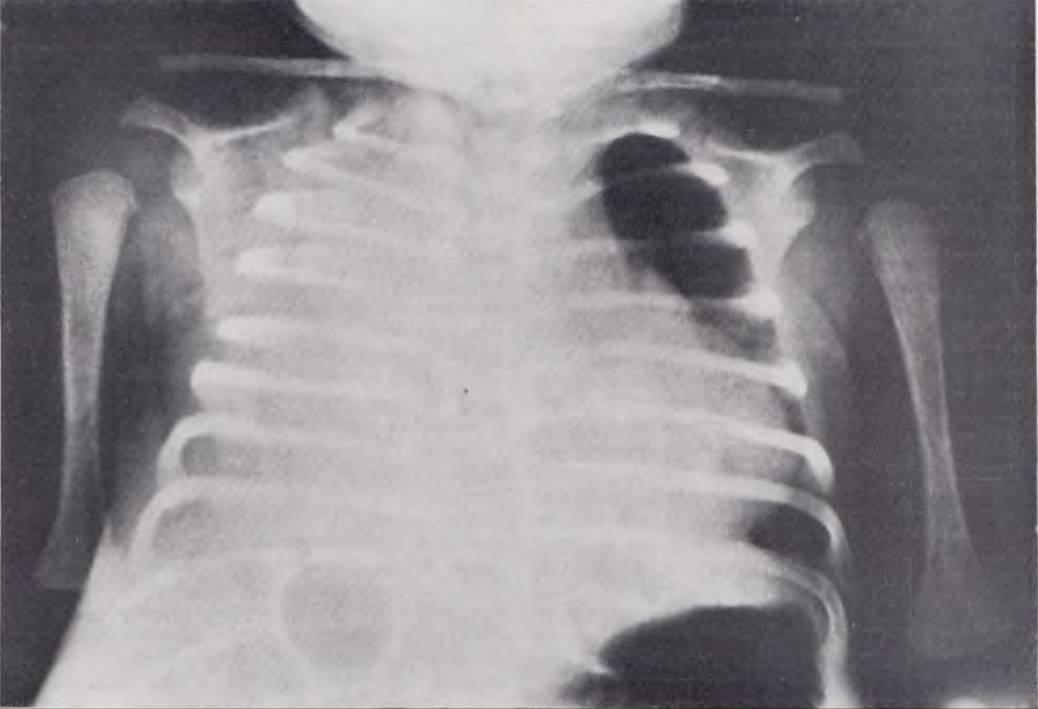
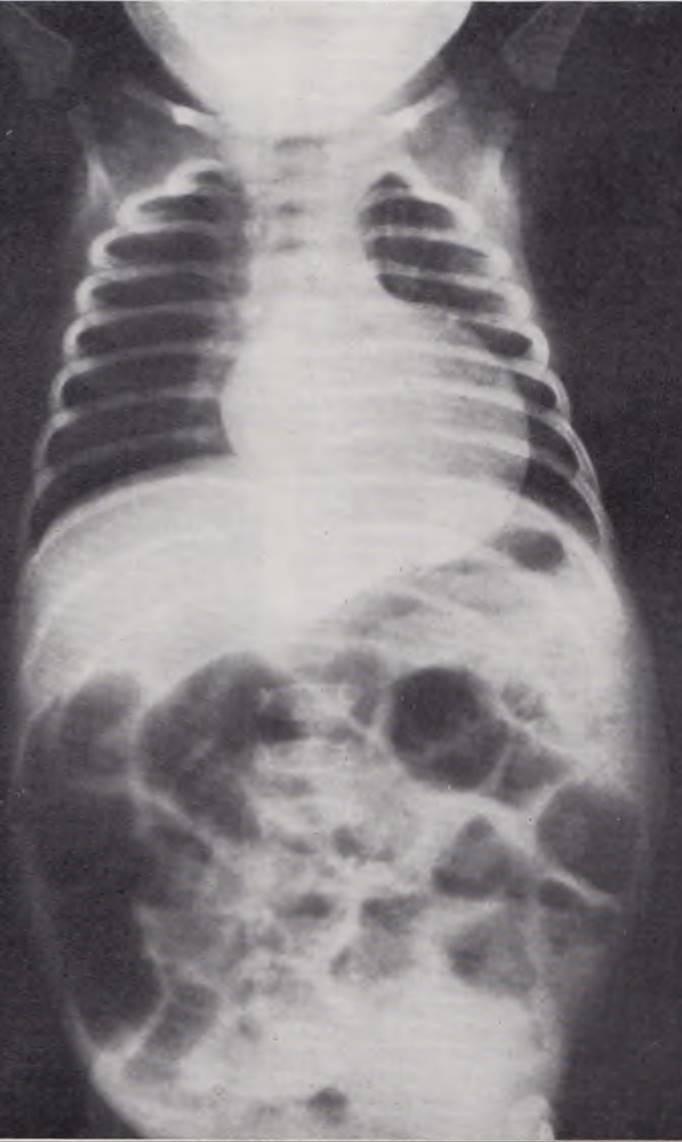
Рентгенологическая картина. Диагноз при перфорации кишки решает обзорная рентгенография в вертикальном положении ребенка, при которой определяется свободный газ в брюшной полости (рис. 118). Однако, как показали наши наблюдения, этот признак имеется не у всех больных, поступивших с клиническими симптомами перфорации кишечника. Нередко в местах, наиболее поражаемых язвенно-некротическим процессом (плео-цекальный угол, печеночный и селезеночный изгибы ободочной кишки), на рентгенограммах отмечается характерная «ячеистость», обусловленная небольшим количеством воздуха, расположенного между петлями кишки, сальником и спайками (рис. 119). Симптом «ячеистости» является патогномоничным для отграниченных, прикрытых перфораций кишечника. Свободного газа в брюшной полости у таких больных не определяется.
Рис. 118. Обзорная рентгенограмма брюшной полости новорожденного. Свободный газ в брюшной полости. Диагноз: септический язвенно-некротический энтероколит.
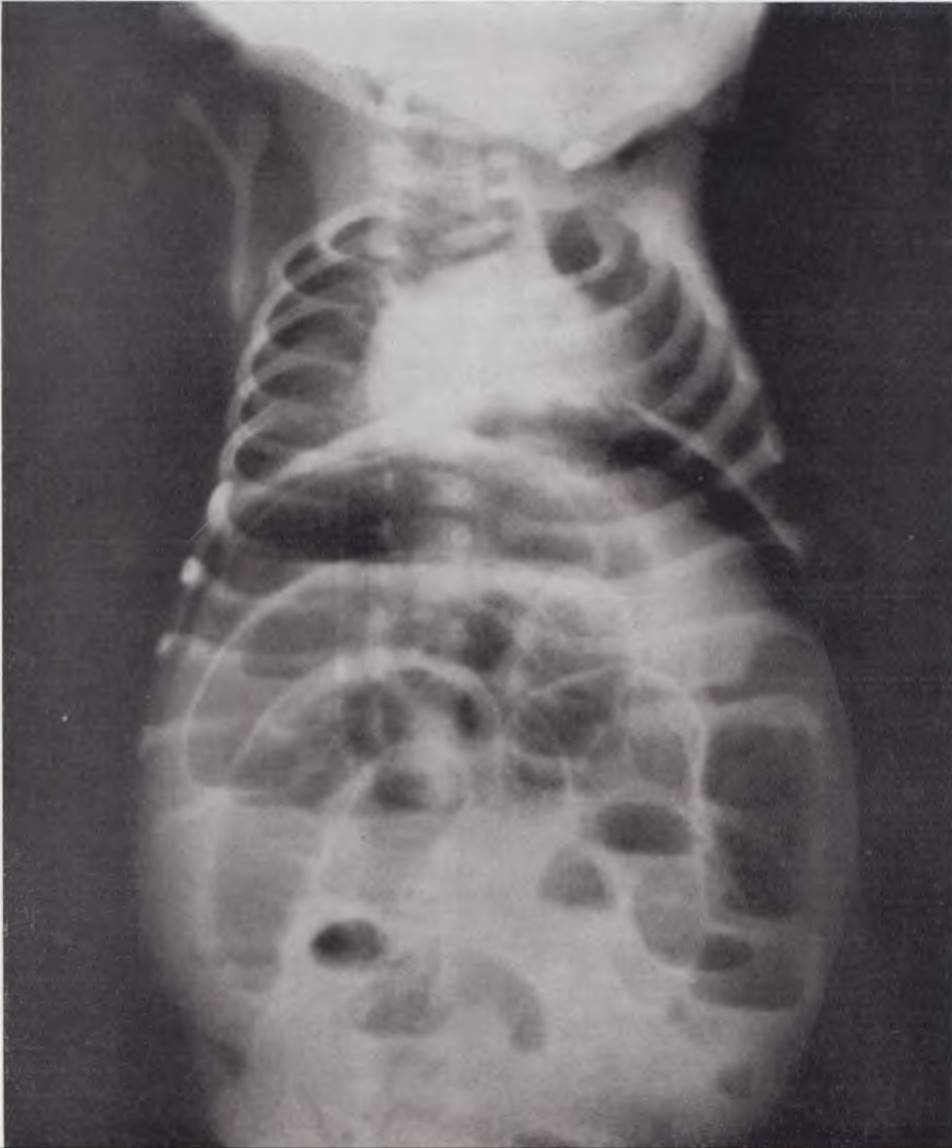
Рис. 119. Обзорная рентгенограмма брюшной, полости новорожденного. В левом верхнем квадранте живота — мелкие воздушные пузыри (пневматоз) на фоне нежного гомогенного затемнения — «симптом ячеистости» — признак прикрытой перфорации кишечника.
Лечение. Диагноз перфоративного перитонита или подозрение па перфорацию является абсолютным показанием к переводу ребенка в хирургический стационар и проведению интенсивной терапии. При выборе показаний к различным методам лечения авторы единодушно отдают предпочтение оперативному методу и считают перфорацию кишечника абсолютным показанием к оперативному вмешательству.
Техника операции. После соответствующей подготовки ребенку производят лапаротомию. С целью предупреждения эвентрации кишечника лапаротомию у таких больных следует, по нашему мнению, проводить только из крестообразного надпупочного доступа с поперечным рассечением кожи и подкожной клетчатки (см. раздел «Особенности оперативной техники»). По вскрытии брюшной полости производят тщательную ревизию кишечника. При этом особое внимание обращают на места наиболее частой локализации перфорации (терминальный отдел подвздошной кишки, илео-цекальный угол, слепая, восходящая, поперечно- ободочная, нисходящая и сигмовидная кишка). Перфорированные язвы, число которых достигает десятка и более, ушивают двухрядным кишечным швом атравматическими иглами. Язвы в стадии преперфорации имеют вид белых точек, просвечивающих сквозь серозную оболочку, и также должны быть тщательно ушиты.
Если перфорация обусловлена аномалией развития отдельных участков мышечного слоя толстой кишки — аномальные участки ушивают серо-серозными швами. При некрозе больших участков кишечной стенки, ушить которые не представляется возможным, операцию заканчивают резекцией пораженного участка с последующей антеростомией по Микуличу или наложением У-образного анастомоза. Больных с атрезией кишки или мекониевым илеусом оперируют по общим правилам. После ликвидации перфорационных отверстий тщательно промывают брюшную полость растворами антибиотиков. Брюшную полость послойно ушивают наглухо с оставлением микроирригатора для по следующего введения антибиотиков. Применение поперечного доступа без пересечения прямых мышц живота позволило свести к минимуму возможность эвентрации кишечника в послеоперационном периоде.
Лечение перфоративных перитонитов — одни из наиболее сложных разделов хирургии новорожденных. Исходы заболевания до настоящего времени остаются неудовлетворительными. Большинство авторов (Г. А. Баиров, 1963; В. М. Державин, 1963; Dietel, Hartmann, 1967, и др.) приводят лишь единичные случаи выздоровления. Только в последние годы удалось несколько улучшить результаты лечения больных с перфоративными перитонитами (Stevenson е. а., 1971). Нам удалось излечить 9 из 55 оперированных по поводу перфоративного перитонита детей. В связи с высокой летальностью в последние годы мы пересмотрели принципы лечения больных с прикрытыми перфорациями кишечника в пользу консервативного метода.
После установления диагноза прикрытой перфорации ребенка помещают в кювез, где за ним устанавливают тщательное наблюдение. Назначают капельное внутривенное вливание растворов глюкозы, электролитов, крови, плазмы в дозах, которые устанавливают в зависимости от веса и состояния больного. Отдают предпочтение внутривенному введению антибиотиков широкого спектра действия. По нашим данным, эффективно применение сигмамнцина (25 мг па 1 кг веса тола ребенка в сутки.) Назначают кислород, по показаниям — сердечные средства и аналептики. При подобной тактике дальнейшее течение заболевания возможно в двух вариантах. В случаях перфорации других язв пли превращении прикрытой перфорации в открытую состояние ребенка резко ухудшается, на контрольной рентгенограмме брюшной полости появляется свободный газ, что служит абсолютным показанием к оперативному вмешательству. В этих условиях проведенная консервативная терапия рассматривается как предоперационная подготовка.
У других больных повторной перфорации не происходит и состояние их под влиянием консервативной терапии постепенно улучшается. У 6 из 14 больных, леченных консервативным методом, на место прикрытой перфорации образовался инфильтрат с последующим абсцедированием в центре. При появлении очага флюктуации производят разрез кожи и вскрытие абсцесса, из полости которого, как правило, выделяется кал и гной. Кишечный свищ в этом месте самопроизвольно закрылся у всех наблюдавшихся нами больных в сроки от 3 нед до 6 мес. У одного из больных выздоровление наступило без образования свища.
Поздними осложнениями язвенно-некротического энтероколита могут быть стенозы кишки, образование кистозных полостей в ее стенке, а также внутренние межкишечные свищи (Lloyd, Cywes, 1973).
Аппендицит
Аппендицит у новорожденных встречается редко. Fornara в мировой литературе до 1970 г. нашел описание только 20 случаев аппендицита у новорожденных. Большинство авторов описывают отдельные наблюдения (А. Г. Богина, 1958; А. А. Першава, 1960; И. Ю. Ибадов, В. П. Ильинов, 1969; Calvani, 1961; Pilotti е. а., 1972). Мы наблюдали и успешно оперировали 2 новорожденных с острым аппендицитом.
Характерны бурное течение местного процесса, быстрый некроз отростка. Некротический процесс за короткое время распространяется через все его слои, что приводит к перфорации и развитию перитонита.
Клиническая карт и па неотчетлива. На первый план выступает ухудшение общего состояния ребенка. Он отказывается от еды, становится беспокойным, сучит ножками. Быстро присоединяются рвота, диспентические явления. Характерно повышение температуры, увеличение числа лейкоцитов в крови. Из местных признаков у большинства больных прежде всего обращают на себя внимание симптомы перитонита. Живот вздут, нередко имеется отечность и гиперемия передней брюшной стенки. При пальпации отмечается резкая болезненность, преимущественно в правой половине живота, напряжение мышц передней брюшной стенки. По мере прогрессирования процесса в клинической картине на первый план выступают явления разлитого перитонита, что у большинства таких больных и является поводом для оперативного вмешательства.
Дифференциальную диагностику проводят с другими заболеваниями органов брюшной полости воспалительного характера. Отсутствие отчетливых местных признаков обусловливает большие трудности в диагностике, в связи с чем дооперационная постановка диагноза острого аппендицита у новорожденного ребенка часто практически невозможна.
Лечение — оперативное. При отчетливой клинической картине брюшную полость вскрывают разрезом по кожной складке в правой подвздошной области. В сомнительных случаях показана лапаротомия параректальным или поперечным доступом. Проводят ревизию органов брюшной полости. Аппендэктомию производят лигатурным способом без предварительного отжатия основания отростка.
Гнойно-воспалительные заболевания органов мочеполовой системы
Гнойно-воспалительные заболевания мочеполовых органов у новорожденных встречаются часто и могут быть причиной тяжелого поражения почек. Воспалительный процесс может локализоваться в области наружных гениталий, распространяться на мочевыводящие пути и почки.
Баланопостит
Под баланопоститом понимают сочетание воспаления крайней плоти и головки полового члена.
Этиология и патогенез. Предрасполагающими моментами к развитию баланопостита у новорожденных являются: физиологический фимоз, длинная крайняя плоть, попытки ретракции препуция, недостаточный уход, обусловливающий склонность кожи промежности к развитию дерматита. Скопление остатков мочи и смегмы в препуциальном мешке с последующим присоединением инфекции приводит к острому воспалению крайней плоти. Поврежденная кожа промежности легко инфицируется пиогенными возбудителями и воспалительный процесс переходит на половой член. Наряду с бактериальной инфекцией возбудителями могут быть и грибы, такие, как Candida albicans. Вирусные инфекции приводят к развитию баланопостита в случаях возникновения herpes simplex в области головки полового члена. В редких случаях рецидивирующий баланопостит у новорожденных приводит к утолщению и рубцовому сужению крайней плоти (приобретенный фимоз).
Клиническая картина. В окружности препуциального кольца наблюдается отек, из-за которого невозможно оттянуть крайнюю плоть за головку. Во время мочеиспускания ребенок беспокоен, при фимозе препуциум раздувается. Из суженной крайней плоти выделяется гной.
Лечение. При легких формах применяют местные теплые ванночки с раствором марганцовокислого калия, компрессы на наружную поверхность полового члена. Новорожденного следует чаще купать, так как скопление мочи в препуциальном мешке поддерживает воспаление. При тяжелых формах заболевания край
нюю плоть промывают раствором антибиотиков и применяют мази с антибиотиками. Процедуры проводятся 2 — 3 раза в день до стихания воспалительного процесса.
Вульвовагинит
Заболевание встречается преимущественно у грудных детей, но может проявиться и в период новорожденности.
Этиология и патогенез. Детская вульва покрыта нежной, легко ранимой кожей, восприимчивой к инфекции. Большое количество малых вестибулярных железок и крипт способствует развитию воспалительного процесса. Влагалище у маленьких детей богато складками и углублениями, выстлано нежной и тонкой (в 2 — 4 слоя) слизистой оболочкой, клетки которой бедны гликогеном. Лактобациллы Дедерлейна отсутствуют. Реакция влагалищного секрета щелочная или амфотерная, иммунные свойства его недостаточны. Половые гормоны, переданные ребенку матерью, защищают слизистую оболочку влагалища от инфекции в первые недели жизни. Тем не менее погрешности в уходе за новорожденной, инфекции матери (трихомониаз, гонорея) могут привести к развитию вульвовагинита. Возбудителями первичного вульвовагинита являются стафилококки, стрептококки, кишечная палочка, грамположительные и грамотрицательные бактерии, диплококки, палочка Фридлендера и др.
Молочница половых органов вызывается дрожжеподобным грибом типа Monilia albicans. Заболевание нередко встречается у беременных женщин (И. И. Богоров, 1966). Девочки заражаются от больных матерей во время родов. Кроме того, грибковые заболевания вульвы и влагалища встречаются у ослабленных дистрофичных детей после длительного лечения антибиотиками.
Иногда в мазках из детского влагалища находят трихомонады, которые могут быть занесены во время родов от матери. Однако физиологические особенности и биохимическая среда детского влагалища, отсутствие длительной эстрогенизации не благоприятствуют развитию в нем трихомонад.
Vulvovaginitis gonorrhoica в последние годы встречается редко. Заражение гонококками возможно сразу после рождения, но чаще отмечается в конце первой — начале второй недели при несоблюдении санитарно-гигиенических правил персоналом родильного дома пли больной гонореей матерью. Вульвовагиниты могут возникать на почве механических, химических и термических повреждений. Комочки крахмала из присыпки, попадая в вагину новорожденной, слишком высокая температура воды (38°) вызывают воспалительную реакцию.
Клиническая картина. Основным симптомом заболевания независимо от этиологического фактора являются слизисто-гнойные или кровянистые выделения из влагалища. Гиперемия вульвы, отек половых губ дополняют картину заболевания. Зуд и боль вызывают беспокойство ребенка. Поражение дистального отрезка уретры сопровождается дизурическими явлениями. Возбудитель заболеваний выявляется при посеве выделений из влагалища и микроскопическом исследовании мазка. Учитывая возможность инфицирования органов мочевой системы восходящим путем, следует контролировать анализы мочи.
Дифференциальный диагноз. Различают неонатальный десквамативный вульвовагинит, который, будучи физиологическим процессом, при неблагоприятных условиях способствует развитию настоящего воспаления. Следствием последнего могут явиться синехии (слипание) половых губ у новорожденных девочек. У некоторых девочек в обычные сроки (до 3 — 4 лет) не происходит замещения эпителия слизистой оболочки внутренней поверхности малых половых губ кожным эпителием. Сопутствующий поверхностный слипчивый воспалительный процесс благоприятствует возникновению склеивания внутренней поверхности половых губ.
Лечение. При бактериальной инфекции показано лечение антибиотиками, которые в зависимости от тяжести процесса применяют местно в виде растворов для промывания гениталий, внутрь или парентерально. Молочницу лечат смазыванием или инстилляцией во влагалище через катетер 3 — 4% водного раствора метиленового синего. Можно вводить во влагалище полоски марли, смоченные 5 — 10% раствором буры в глицерине на 8 — 12 ч ежедневно или через день. При обнаружении в мазках трихомонад специального лечения не проводят, ограничиваются общегигиеническими мероприятиями. При гонорейном вульвовагините хороший эффект достигается парентеральным применением пенициллина. Независимо от характера возбудителя проводят туалет гениталий: ежедневные обмывания кипяченой водой с мылом, ванночки с отваром ромашки и раствором марганцовокислого калия. Для обработки вульвы и вагины применяется 2 — 5% раствор соды, 2 — 4% раствор борной кислоты, 2% раствор азотнокислого серебра. Курс лечения 8 — 15 дней. В упорных случаях возможно кратковременное назначение эстрогенов, повышающих локальную сопротивляемость слизистой оболочки влагалища. Рецидивирующий вульвовагинит требует длительного лечения и после стихания воспалительного процесса.
Пиелонефрит
Исследованиями последних лет установлено, что каждую инфекцию мочевых путей в детском возрасте следует расценивать и лечить как пиелонефрит. Неспецифическое бактериальное воспаление быстро распространяется из почечной лоханки на паренхиму. Возникает очаговый интерстициальный нефрит. Вторично в процесс вовлекаются канальцы, сосуды, гломерулы. Инфекция мочевых путей наиболее часто возникает в период новорожденности и у детей первого года жизни. Заболеваемость пиелонефритом новорожденных обусловлена распространением среди детей этого возраста гнойно-септических заболеваний, возросшей вирулентностью стафилококков, особенностями иммунитета новорожденных. Инфицированную мочу имеют 1 — 2% всех грудных детей (О’Doherty, 1968). Сравнительная оценка возрастных групп свидетельствует о более частой заболеваемости девочек. В период новорожденности половое различие незначительное, что указывает на однородность путей распространения инфекции.
Этиология и патогенез. На развитие пиелонефрита большое влияние оказывают заболевания матери во время беременности. Недоношенность, внутричерепная родовая травма, асфиксия, пороки развития снижают сопротивляемость новорожденного инфекции и обусловливают возникновение заболевания. Урогенитальные заболевания (баланопостит, вульвовагинит, фимоз, синехии) способствуют распространению и развитию инфекции. Основными возбудителями являются кишечная палочка, стафилококк, стрептококк, протей. Нередко в посевах мочи обнаруживают двух и более возбудителей. Гематогенный путь распространения инфекции у новорожденных является ведущим. Особенно это относится к кокковой флоре. Бактерии кишечной группы чаще проникают в почечную лоханку из дистальных мочевых путей восходящим путем. Пути распространения инфекции могут сочетаться. Важную роль в патогенезе заболевания играют пороки развития мочевыводящих путей и очаговая дисплазия почечной паренхимы. Уменьшение нормального тока мочи обусловливает дальнейшее прогрессирование инфекции.
Пиелонефрит, при котором инфекция поражает ранее интактный мочевой аппарат, называется первичным, необструктивным. Напротив, при вторичном, обструктивном пиелонефрите клиника слагается из симптомов предшествующего урологического заболевания и собственно пиелонефрита. Пиелонефрит у детей возникает в 45% случаев при анатомически нормальных ночках, в 25% — при наличии пузырно-мочеточникового рефлюкса и в 30% случаев обусловлен обструкцией различного генеза (Stansfeld, 1966).
Клиническая картина. Пиелонефрит у новорожденных протекает как тяжелый общий инфекционный процесс и характеризуется многообразием клинических проявлений: мочевым синдромом, наличием глубокой интоксикации, нарушениями состояния кислотно-щелочного равновесия, электролитного и белкового обмена, острыми расстройствами функций почек, печени и мочевых путей.
Заболевание у 2/з детей начинается с высокой температуры. У ослабленных гипотрофичных детей оно может протекать без подъема температуры. Отказ от груди, рвота, иногда понос с явлениями тяжелого эксикоза заставляют предположить начало желудочно-кишечного заболевания. Новорожденные часто беспокойны, кричат. Они становятся чувствительны к прикосновению. Проявляются симптомы менингизма. На фоне высокой температуры возможен генерализованный приступ судорог. Локальные симптомы поражения мочевыводящих путей для такого возраста не характерны. Трудности в распознавании пиелонефрита усугубляются при сочетании его с другими заболеваниями — пневмонией, отитом.
Острая фаза пиелонефрита у новорожденных может протекать по-разному. При адекватном лечении все симптомы заболевания ликвидируются через 3 — 4 нед, пиурия и бактериурия исчезают па 5 — 6-й нед. Другая форма характеризуется затяжным и волнообразным течением. Острая фаза затягивается на 8 — 12 нед, а в отдельных случаях — на 5 — 6 мес. В случаях, когда консервативное лечение не дает эффекта, часто удается выявить пороки развития мочевыводящей системы.
Лабораторная диагностика. Лихорадочное состояние новорожденного, изменение поведения, потеря аппетита, бледность, анемия должны служить показаниями к исследованию мочи. Решающими критериями в установлении диагноза пиелонефрита являются лейкоцитурия и бактериурия.
Известные трудности представляет сбор мочи у новорожденного. Гениталии ребенка тщательно обрабатывают, крайнюю плоть у мальчиков по возможности отодвигают. В середине акта мочеиспускания подставляют пробирку. Для сбора мочи у девочек используют пластиковый мешочек, приклеенный в области гениталий, у мальчиков на половой член надевают резиновую трубку. В ряде случаев применяют надлобковую пункцию, которая показана при необходимости срочного установления диагноза пиелонефрита, трудностях в получении не загрязненных порций мочи при поражении кожи промежности воспалительным процессом, вульвовагините, баланопостите.
Техника пункции: иглу вводят над лоном на 1,25 — 2,5 см независимо от времени предшествующего мочеиспускания. Для бактериологического и микроскопического исследования достаточно 1 — 2 мл мочи. Катетеризация у новорожденных опасна возможностью внесения инфекции.
Лейкоцитурию в практике оценивают с помощью исследования осадка мочи. Определяют число клеток в 1 мм3 мочи (А. 3. Нечипоренко, 1965; Stansfeld, Webb, 1953). Нормальным считается наличие не более 10 клеток в 1 мм3. Обнаружение от 10 до 20 лейкоцитов оценивается как пограничное состояние, наличие более 20 клеток считается патологией. Согласно данным А. 3. Нечипоренко, в 1 мл мочп в норме содержится до 2000 лейкоцитов и до 1000 эритроцитов. Бактериологическое исследование мочи проводится с целью определения возбудителя для проведения целенаправленного лечения. Целесообразно количественное определение бактерий. При этом за норму принимают до 1000 клеток в 1 мл мочи. Наличие от 1000 до 10 000 клеток рассматривается как пограничное состояние, нуждающееся в проверке, наличие более 10 000 бактерий в 1 мл считается патологией. Результаты анализов крови, определения остаточного азота, уровня креатинина в плазме дополняют диагностику пиелонефрита, позволяют оценить повреждение почечной паренхимы у новорожденного. Нарушения функции почек значительно усиливают имеющийся в норме легкий метаболический ацидоз. pH крови смещается до 7,15. Канальцевые нарушения и ацидоз вызывают снижение содержания кальция. Уровень его ниже 9 мг % в первые несколько дней жизни также может указывать на поражение почек. Выполнение клиренс-тестов у новорожденных представляет значительные трудности и не является надежным.
Рентгенологическая картина. Патогномоничных рентгенологических признаков острого пиелонефрита не существует. Рентгенологические исследования помогают выявить врожденные аномалии, обструктивные процессы, конкременты и др. Показанием к применению выделительной урографии служат рецидив пиелонефрита, инфицированность мочи после 3-недельного лечения антибиотиками. При трактовке рентгенологической картины оценивают величину и контур почки в пределах пиелонефритического очага, аномалии и нарушение тонуса полостной системы. В редких случаях на рентгенограмме больная сторона слабо контрастирована, отдельные чашечные системы не связаны друг с другом. Цистоуретерография дает сведения об инфравезикалыюм стенозе, аномалиях, нарушениях тонуса мочевого пузыря, везикоуретеральном рефлюксе. Применение радиоизотопных методов исследования показано при отсутствии функции почки (Winter, 1963; Sack, Mitrab, 1966).
Лечение. Главная задача — ликвидация бактериальной инфекции. При острой форме длительность лечения достигает нескольких недель. Необходим тесный контакт между стационаром и врачами поликлиники. Проведение дезинтоксикационной терапии, дозированное питание дополняют антибактериальную терапию. Лучшие результаты у новорожденных получены при использовании ампициллина. Другие антибиотики назначают после установления резистентности возбудителя. Лечение антибиотиками проводят в течение 2 — 3 нед до нормализации анализов мочи. После этого можно перейти к препаратам нитрофуранового ряда (по 5 мг/кг в течение 2 — 3 нед). Суточную дозу дают в 3 приема. Последующее медикаментозное лечение назначают курсами по 10 дней со сменой препаратов (антибиотики, нитрофураны, сульфаниламиды) в течение 3 — 4 мес. Мочу исследуют еженедельно. По окончания лечения проводят контроль за анализами мочи 1 раз в 2 нед на протяжении нескольких месяцев (до года). Длительность лечения острой фазы пиелонефрита составляет в среднем 3 мес. Прогноз заболевания при своевременном и правильно проводимом лечении благоприятный.
Гнойно-воспалительные заболевания костей и суставов
Гематогенный остеомиелит — воспаление костного мозга — у новорожденных в большинстве случаев протекает как паностит (в воспалительный процесс вовлекаются все элементы кости). Остеомиелит является одним из частых гнойновоспалительных заболеваний новорожденных. Преобладает поражение длинных трубчатых костей с метаэпифазарной локализацией процесса (Г. А. Баиров, 1963; С. Я. Долецкий, А. И. Ленюшкин, 1965; В. М. Державин, 1965; Urmalis, 1967). Этому способствуют анатомические особенности костей новорожденного ребенка, для которых характерно грубоволокнистое сетчатое строение. Межуточное вещество состоит из переплетающихся в разных направлениях пучков, между которыми располагаются крупные костные клетки. Губчатое вещество рыхлое, с широкими сосудистыми промежутками. Характерна обильная васкуляризация костей. Артерии многочисленны, имеют широкий диаметр. Эпифизарные концы костей состоят преимущественно из хрящевой ткани и питаются за счет самостоятельной сосудистой системы по концевому типу, что создает условия для замедления тока крови, возможной фиксации патогенной микрофлоры и последующего развития гнойно-воспалительного процесса.
Этиология и патогенез. Гематогенный остеомиелит в большинстве случаев является следствием бактериемии. Из гнойных очагов при пиодермии и фурункулезе возбудитель проникает в кровь через пупочную ранку, нарушенные кожные покровы и слизистую оболочку. Возбудителем гематогенного остеомиелита у новорожденных является преимущественно стафилококк, который высевают из гноя или крови у 80 — 90% больных остеомиелитом. В последние годы увеличился удельный вес смешанной, грамотрицательной флоры.
Распространенные теории патогенеза — эмболическая, инфекционно-аллергическая и рефлекторная — в определенной степени объясняют механизм развития заболевания. Большое значение имеют особенности реактивности организма новорожденного ребенка.
Клиническая картина. Клинические проявления острого гематогенного остеомиелита складываются из общих и местных симптомов. Т. П. Краснобаев выделяет три формы заболевания.
Токсическая, или адинамическая, форма остеомиелита. Характерно быстрое (по часам) прогрессирование заболевания. Преобладают явления токсикоза, сепсиса. Состояние больного крайне тяжелое, температура высокая. Заболевание может закончиться смертью ребенка на 2 — 3-й день. Изменения в костях у таких больных нередко находят только при вскрытии.
Септикопиемическая форма. Заболевание протекает тяжело, со значительным повышением температуры. Часты диспентические явления. Выражены общие и местные симптомы. У большого числа больных образуются метастатические гнойные очаги в костях, внутренних органах и др.
Местноочаговая форма. В клинической картине преобладают местные воспалительные явления. Метастазирование отмечается редко. Общее состояние ребенка страдает значительно меньше.
Гематогенный остеомиелит новорожденных, как правило, начинается остро и бурно прогрессирует. При токсической форме заболевание нередко начинается с потери сознания, судорог, адинамии. Для септикопиемической формы характерно параллельное прогрессирование общих симптомов и местных изменений. Заболевание начинается с ухудшения состояния ребенка (вялость, потеря аппетита), быстро повышается температура, возникают явления токсикоза. Нередко присоединяются рвота, понос. Ребенок имеет вид тяжелого септического больного. Черты лица заостряются, кожа становится сухой, ребенок бледен. Нередки петехиальные высыпания септического характера. Прогрессирует эксикоз. Развивается токсическая одышка, тахикардия. Тоны сердца становятся приглушенными.
Параллельно нарастают местные явления — болезненность в месте локализации очага, ограничение подвижности пораженной конечности, прогрессирование воспалительных проявлений. Постоянным местным симптомом остеомиелита является боль, которая усиливается при движении. Отек быстро нарастает, распространяется на соседние области. Кожа пораженной конечности приобретает стекловидный характер. В первые дни заболевания у большинства больных отмечается повышение температуры до 38 — 40° С, в дальнейшем температура приобретает ремиттирующий характер. У отдельных больных температура может быть повышена незначительно или остается нормальной. Такие случаи трудны в диагностическом отношении. Изменения в крови у большинства новорожденных идентичны таковым при гнойно-воспалительных процессах — отмечается нарастание лейкоцитоза, сдвиг формулы влево. Характерно прогрессирующее нарастание анемии.
При местноочаговой форме состояние больного страдает относительно меньше. Превалирует локальная болезненность, ограничение подвижности, отек пораженной области.
Локализация процесса при остром гематогенном остеомиелите новорожденных характерна. Поражаются преимущественно метаэпифизарные области длинных трубчатых костей — бедра, плеча (до 85%). Поражения других костей, в частности плоских, возможны, но более редки. Диафизарная локализация процесса у новорожденных встречается редко.
Наиболее тяжело протекает остеомиелит проксимального отдела бедренной кости и костей таза. Общее состояние этих больных крайне тяжелое. Конечность па стороне поражения неподвижна, согнута в коленном и тазобедренном суставах. Пассивные движения ограничены, сопровождаются сильной болью и беспокойством ребенка. Отек появляется поздно; нередко при осмотре трудно определить локализацию процесса. В отдельных случаях имеет место резкое расширение сосудистой сети верхней трети бедра и паховой области, что может быть причиной ошибочной диагностики.
Для новорожденных характерно метастазирование процесса и возникновение множественных очагов остеомиелита. Множественный остеомиелит имел место у каждого третьего из наблюдавшихся нами больных. В большинстве случаев очаги возникают последовательно, возможно одновременное поражение нескольких костей. Самым характерным для остеомиелита новорожденных детей является быстрое распространение процесса на сустав с развитием гнойного артрита.
Рентгенологическая картина. Рентгенологическое исследование помогает поставить диагноз остеомиелита у новорожденного уже на 3 — 4-й день заболевания. Самым ранним рентгенологическим симптомом остеомиелита новорожденных, который можно определить уже на 3 — 4-й день заболевания, является расширение суставной щели. Выявление этого симптома возможно только при рентгенографии симметричных суставов в условиях одинаковой укладки. Очаги деструкции кости и периостальная реакция появляются на 6 — 10-й день заболевания в зависимости от локализации процесса (рис. 120). Более четко эти признаки определяются при электрорентгенографии.
Рис. 120. Рентгенограммы суставов новорожденного. Симптом расширения суставной щели правого таго-бедренного сустава (а). Поражение головки правого бедра(б). Очаг деструкции в области проксимального метаэпифиза правого плеча (в). Диагноз: острый остеомиелит.
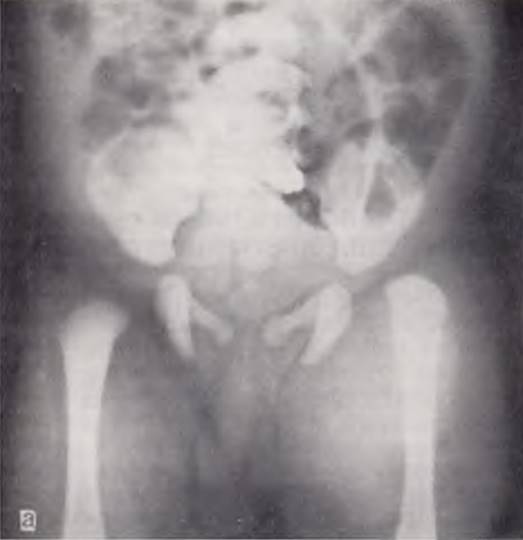
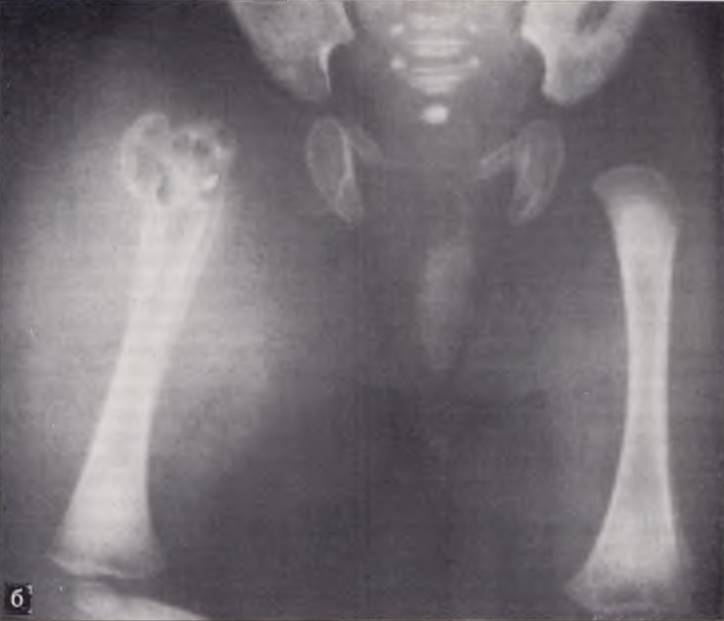
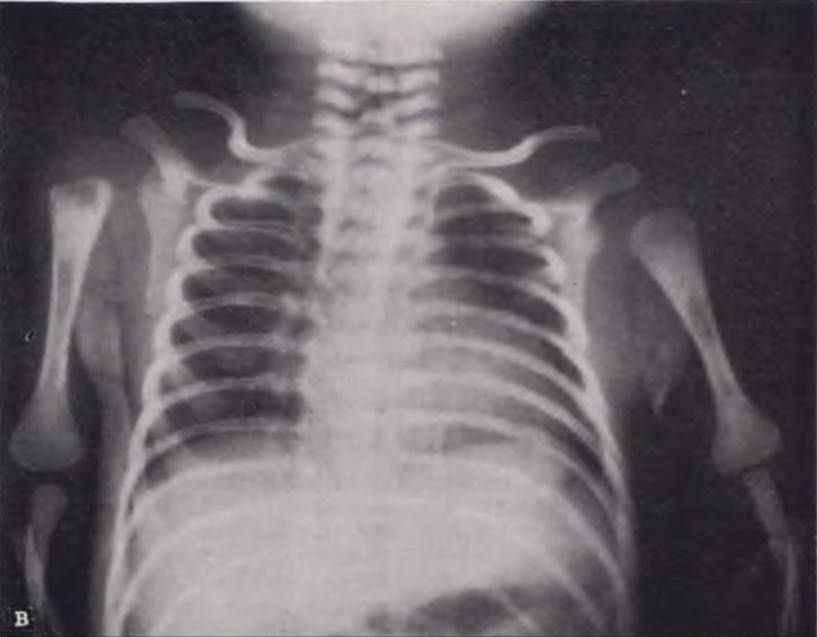
Дифференциальную диагностику проводят с заболеваниями, дающими сходные местные проявления и общую симптоматику. К первым относятся флегмона новорожденных, межмышечная флегмона, лимфаденит, переломы костей, парезы и родовые параличи конечностей, ко вторым — сепсис, пневмония.
При флегмоне новорожденных имеет место резкая воспалительная реакция со вторичной болевой контрактурой и ограничением подвижности конечности. Для флегмоны характерно бурное распространение воспалительного процесса по окружности очага. Пассивные движения конечности в области поражения возможны. Отсутствует симптом расширения суставной щели. Межмышечная флегмона сопровождается резкой болезненностью, болевой контрактурой, отеком конечности. Однако и в этих случаях пассивные движения в конечности возможны, быстрее чем при остеомиелите выявляются очаги размягчения, отсутствует симптом расширения суставной щели. В сомнительных случаях показана пункция очага поражения. При переломе костей общая реакция выражена значительно меньше, нередко наблюдается деформация конечности. Диагноз уточняют методом рентгенографии. Для парезов и параличей характерно отсутствие воспалительного процесса.
Лечение гематогенного остеомиелита проводится по общим правилам лечения гнойно- воспалительных заболеваний у новорожденных.
Хирургические методы воздействия па очаг при остеомиелите у новорожденных имеют свою специфику. Преимущественное поражение метаэпифизарных областей длинных трубчатых костей с быстрым прорывом гнойника в полость прилежащего сустава делает методом выбора пункционное лечение. При этом пунктируют не место поражения, а сустав. При пункции аспирпруют гной, полость сустава промывают растворами антибиотиков. Внутренний диаметр иглы должен быть не менее 1 мм. Это позволяет избежать закупорки иглы густым гноем. Пункцию и санацию полости сустава проводят ежедневно до стихания воспалительного процесса.
Плечевой сустав пунктируют по задней поверхности непосредственно ниже акромиального отростка. Положение иглы контролируют периодическим оттягиванием поршня. При попадании иглы в сустав в шприце появляется гной. Локтевой сустав пунктируют в положении сгибания между наружным надмыщелком и локтевым отростком выше головки лучевой кости. При пункции тазобедренного сустава иглу вкалывают над вершиной большого вертела и продвигают строго во фронтальной плоскости. Возможна пункция сустава спереди. Коленный сустав пунктируют по общим правилам.
К артротомии прибегают крайне редко, при обширных поражениях костей, составляющих сустав, и неэффективности пункционного лечения. При образовании поднадкостичной флегмоны ее вскрывают и дренируют полосками перчаточной резины. Остеоперфорация при лечении остеомиелита новорожденных, как правило, не применяется. Широкие гаверсовы каналы способствуют свободному оттоку гноя.
Обязательна одновременная иммобилизация пораженной конечности. Она обеспечивает покой конечности и предупреждает развитие последующих деформаций, вывихов и подвывихов. Верхнюю конечность фиксируют повязками типа Дезо. При фиксации нижних конечностей в острой стадии гематогенного остеомиелита у новорожденных методом выбора является вытяжение по Шеде. Целесообразно вытяжение за обе ножки, что создает лучший покой и облегчает уход за ребенком. При локализации очага в костях голени конечность фиксируют съемной гипсовой лонгетой. Фиксация продолжается и после стихания острого процесса. Особенно это важно при поражении проксимального отдела бедренной кости, где велика опасность развития патологического вывиха бедра. Таким больным после ликвидации воспалительного процесса назначают шину Виленского или шину ЦИТО на срок не менее 6 — 10 мес.
Непосредственные результаты лечения остеомиелита в последние годы значительно улучшились. Однако отдаленные результаты не всегда удовлетворяют хирургов. При значительном поражении эпифизов нередки нарушения роста конечности в длину. Возможны патологический вывих или варусная деформация бедра. При поражении дистальных эпифизов бедренных костей чаще возникает вальгусная деформация голени, конечность отстает в росте. Анкилоз суставов у новорожденных, как правило, не развивается. Своевременная правильная фиксация конечностей и последующее диспансерное наблюдение у ортопеда в большинстве случаев позволяют предупредить или своевременно корригировать возможные деформации.