Фізіологія людини - Вільям Ф. Ґанонґ 2002
Ендокринна система, метаболізм і репродуктивна функція
Ендокринні функції підшлункової залози й регулювання метаболізму вуглеводів
Структура, біосинтез і секреція інсуліну
Структура та видова специфічність
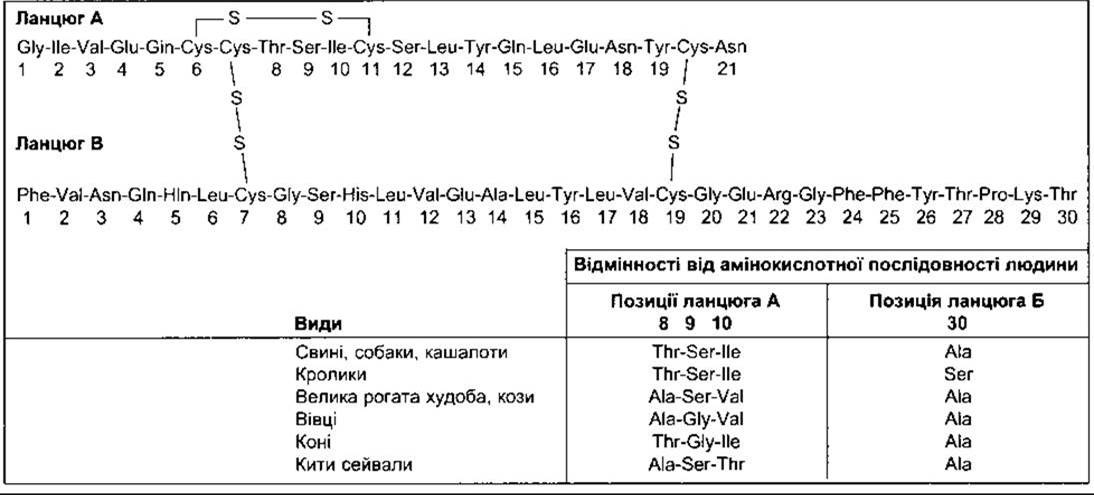
Інсулін - це поліпептид, що містить два ланцюги амінокислот, сполучених дисульфідними мостиками (табл. 19-1). Є незначні відмінності в амінокислотному складі молекул різних видів; однак вони, зазвичай, не настільки суттєві, щоб вплинути на біологічну активність певного інсуліну в гетерологічних видів, та достатні для того, щоб зробити інсулін антигенним. Якщо інсулін одного виду протягом тривалого періоду вводити об’єктам іншого виду, то утворені антиінсулінові антитіла інгібуватимуть його. Майже всі люди, що отримували промисловий бичачий інсулін понад два місяці, мають антитіла проти нього, але їхній титр звичайно низький. Свинячий інсулін відрізняється від людського лише одним амінокислотним залишком і має низьку антигенність. Крім того, тепер для уникнення проблем з утворенням антитіл широко використовують людський інсулін, вироблений бактеріями за допомогою технологій рекомбінантної ДНК.
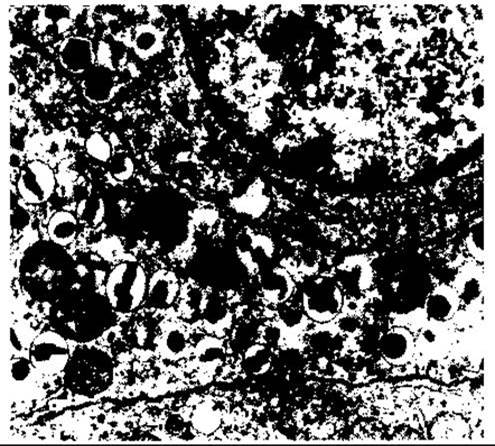
Рис. 19-2. Електронна мікрофотографія двох сусідніх В-клітин підшлункової залози людини. Ґранули типу В - пухирці, обмежені мембраною, що містять кристали, які змінюються у формі від ромбічної до округлої (збільшення у 26 000 разів; з дозволу A Like. Відтворено за дозволом з Fawcett DW: Bloom and Fawcett, A Textbook of Histology, 11th ed. Saunders, 1986).
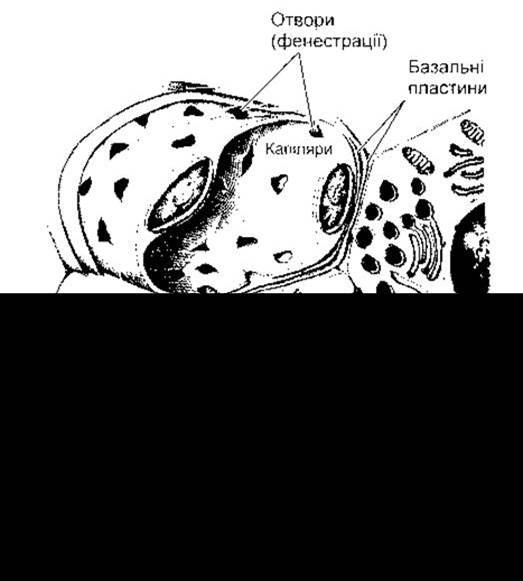
Рис. 19-3. Клітини А та В; показано їхній зв’язок із кровоносними судинами; ҐЕС - ґранулярна ендоплазматична сітка. Інсулін з В-клітини та глюкагон з A-клітини секретовані шляхом екзоцитозу через базальну пластинку клітини та базальну пластинку капілярів, перш ніж потрапити в просвіт фенестрованих гемокапілярів (відтворено за дозволом з Junqueira LC, Carneiro J, Kelley RO: Basic Histology, 9th ed. McGraw-Flill, 1998).
Біосинтез і секреція
Синтезування інсуліну відбувається в гранулярній ендоплазматичній сітці В-клітин (див. рис. 19-3). Після цього гормон надходить в апарат Ґольджі, де упаковується в ґранули, обмежені мембраною. Ці ґранули за допомогою процесу, в якому задіяні мікротрубочки, рухаються до плазматичної мембрани, і їхній вміст вивільняється назовні за допомогою екзоцитозу (див. Розділ 1). Потім, щоб потрапити в кров, інсулін перетинає базальні мембрани В-клітин і сусідніх капілярів та фенестрований ендотелій капілярів. Детально фенестровані гемокапіляри розглянуто в Розділі 30. Як і інші поліпептидні гормони та подібні білки, що потрапляють в ендоплазматичну сітку, інсулін синтезується як частина більшого препрогормону (див. Розділ 1). Ген інсуліну розташований у короткому плечі 11-ї хромосоми людини. Він має два інтрони і три екзони (рис. 19-4). Препроінсулін містить 23-амінокислотний сигнальний пептид (лідерну послідовність), що відщеплюється, потрапивши в ендоплазматичну сітку. Після цього залишок молекули згортається і утворюються дисульфідні зв’язки - формується проінсулін. Пептидний сегмент, що сполучає ланцюги А і В, з’єднувальний пептид (С-пептид - від англ. conecting peptide - С peptide) сприяє згортанню і потім відділяється в гранулах перед секрецією. В обробці проінсуліну задіяні дві протеази. Для нього не виявлено іншої фізіологічної активності. Зазвичай, 90-97% продуктів, що вивільняються з В-клітини, припадають на інсулін разом з еквімолярною кількістю С-пептиду. Решту становить проінсулін. Зазначимо, що С-пептид можна визначити радіоімунологічним дослідженням, а його рівень відображає індекс діяльності В-клітин у пацієнтів, що отримують екзогенний інсулін.
Таблиця 19-1. Структура людського інсуліну (молекулярна маса 5808) та мінливість його структури в інших видів ссавців. У щурів клітини острівців секретують два дещо відмінні інсуліни, а в деяких риб знайдено чотири різні форми