Фізіологія людини - Вільям Ф. Ґанонґ 2002
Ендокринна система, метаболізм і репродуктивна функція
Гормональне регулювання метаболізму кальцію та фізіологія кістки
Фізіологія кістки
Будова
У дорослих і дітей кістки бувають двох типів: компактна, або трубчаста, кістка, що формує зовнішній шар більшості кісток (рис. 21-2) і становить 80% від кісток тіла; та губчаста, або трабекулярна, кістка всередині компактної, що становить решту 20% кісток в організмі людини. В компактній кістці співвідношення площі поверхні до об’єму низьке, а остеоцити - кісткові клітини в цьому типі кістки - малоактивні. Вони лежать у лакунах і отримують поживні речовини через кісткові канальці, розгалужені в компактній кістці (рис. 21-3). Трабекулярна кістка складена зі спікул, або пластинок з великим співвідношенням площі поверхні до об’єму та з великою кількістю клітин, розташованих на поверхні пластин. їй притаманна висока метаболічна активність. У губчастій кістці поживні речовини дифундують з позаклітинної рідини кістки в трабекули, тоді як у компактну їх постачають гаверсові канали (див. рис. 21-3), що містять кровоносні судини. Навколо кожного гаверсового каналу розміщений колаген у вигляді концентричних шарів, які утворюють циліндри, названі остеонами, чи гаверсовою системою.

Рис. 21-2. Будова типової довгої кістки до (ліворуч) та після (праворуч) замикання зони росту епіфіза.
Кістка є спеціальною формою сполучної тканини, побудованою з мікроскопічних кристалів фосфатів кальцію всередині матриксу з колагену. Колаген, відповідно, організований у складну тривимірну систему. З огляду на високий вміст кальцію та фосфату кістка відіграє важливу роль у гомеостазі кальцію. Вона захищає життєво важливі органи, а створена нею міцність уможливлює переміщення та підтримання ваги проти дії сили тяжіння. Стара кістка постійно резорбує, а натомість утворюється нова (див. нижче), що дає змогу таким способом пристосовуватись до прикладених напружень та натягів. Це жива тканина, яка є добре васкуляризованою і має загальний кровоплин 200- 400 мл/хв у дорослих людей.
Білок матриксу кістки - це здебільшого колаген першого типу, який також є головним структурним білком у сухожилках та шкірі. Колаген, що такий же міцний, як і сталь, складається з потрійної спіралі з міцно з’єднаних трьох поліпептидів. Два з них - ідентичні а,-поліпептиди, кодовані одним геном, а третій - а2-поліпептид, кодований іншим геном. Колагени - це родина структурно близьких білків, що забезпечують цілісність багатьох органів. Сьогодні їх визначено 15 типів, кодованих 20 різними генами.
Для підтримки нормальної структури кістки повинні надходити достатні кількості білків та мінеральних речовин. Кісткові кристали мають розмір 20±(3-7) нм і складаються переважно з гідроксіапатитів загальної формули Са10(РО4)6(ОН)2. Натрій та невеликі кількості магнію і карбонатів також наявні в кістці. Окрім того, одним з мінералів
кістки є аморфний фосфат кальцію, який не має зв’язаної структури, здатної до дифракції рентгенівських променів.
Остеобласти та остеокласти
Клітини, що безпосередньо пов’язані з утворенням та резорбцією кістки - це остеобласти та остеокласти. Обидва типи клітин походять із кісткового мозку. Остеобласти є кісткоутворювальними клітинами, що походять від попередників клітин кістковомозкової строми в кістковому мозку. Вони секретують великі кількості колагену першого типу, інших білків кісткового матриксу та лужної фосфатази. Клітини цього типу диференціюють в остеоцити.
Остеокласти є багатоядерними клітинами, що руйнують та резорбують попередньо утворену кістку. Вони формуються з гематопоетичних стовбурових клітин через моноцити (див. Розділ 27). Стовбурові клітини приєднуються до кістки за допомогою інтегринів у видовженні мембрани, названих замикальною зоною. Ця зона створює ізольовану ділянку між кісткою та частиною остеокласта (рис. 21-4). Після цього протонні помпи, що є Н+-залежними АТФ-азами, переміщуються з ендосом у клітинну мембрану, протилежну до ізольованої ділянки, і закиснюють це місце до pH 4. Подібні протонні помпи виявлені в ендосомах та лізосомах усіх еукаріотичних клітин (див. Розділ 1), однак вони лише в кількох інших випадках переміщуються в клітинну мембрану. Зверніть увагу, що замкнутий простір, утворений остеокластами, нагадує велику лізосому. Кисле pH розчиняє гідроксіапатит, а кислі протеази, що їх секрету є клітина, руйнують колаген, утворюючи невелику порожнину в кістці. Продукти дегенерації після цього ендоцитуються і рухаються через остеокласт шляхом трансцитозу (див. Розділ 1) з вивільненням в інтерстиційну рідину. Продукти розпаду колагену містять піридинолінові структури, а піридиноліни можна вимірювати в сечі як показник швидкості резорбції кістки.
Ріст кістки
Кістки черепа утворюються внаслідок скостеніння оболонок (внутрішньомембранне утворення кістки). Довгі кістки спершу формуються як хрящі, а потім перетворюються в кістку шляхом скостеніння, яке розпочинається в діафізі кістки (енхондральне утворення кістки).
Під час росту спеціалізовані ділянки на кінцях кожної довгої кістки (епіфізи) відділені від діафіза кістки пластинкою активно проліферувального хряща - епіфізарною пластинкою (див. рис. 21-2). Кістка видовжується, коли ця пластинка відкладає досередини нову кістку на краях діафіза. Ширина еиіфізарної пластинки пропорційна до швидкості росту. На неї впливає низка гормонів, однак найпомітніше - гормон росту гіпофіза та ІФР-І (див. Розділ 22).
Лінійний ріст кістки може відбуватись доти, доки епіфіз відділений від діафіза кістки, однак припиняється, коли епіфізи з’єднуються з діафізом (замикання зон росту епіфіза). Епіфізи різних кісток замикаються в чіткій часовій послідовності, останні - після настання статевої зрілості. Нормальний вік, за якого відбувається закривання кожного епіфіза, відомий, тому «вік кістки» молодої особи можна визначити шляхом рентгенографії скелета і дослідженням того, які епіфізи відкриті, а які закриті.
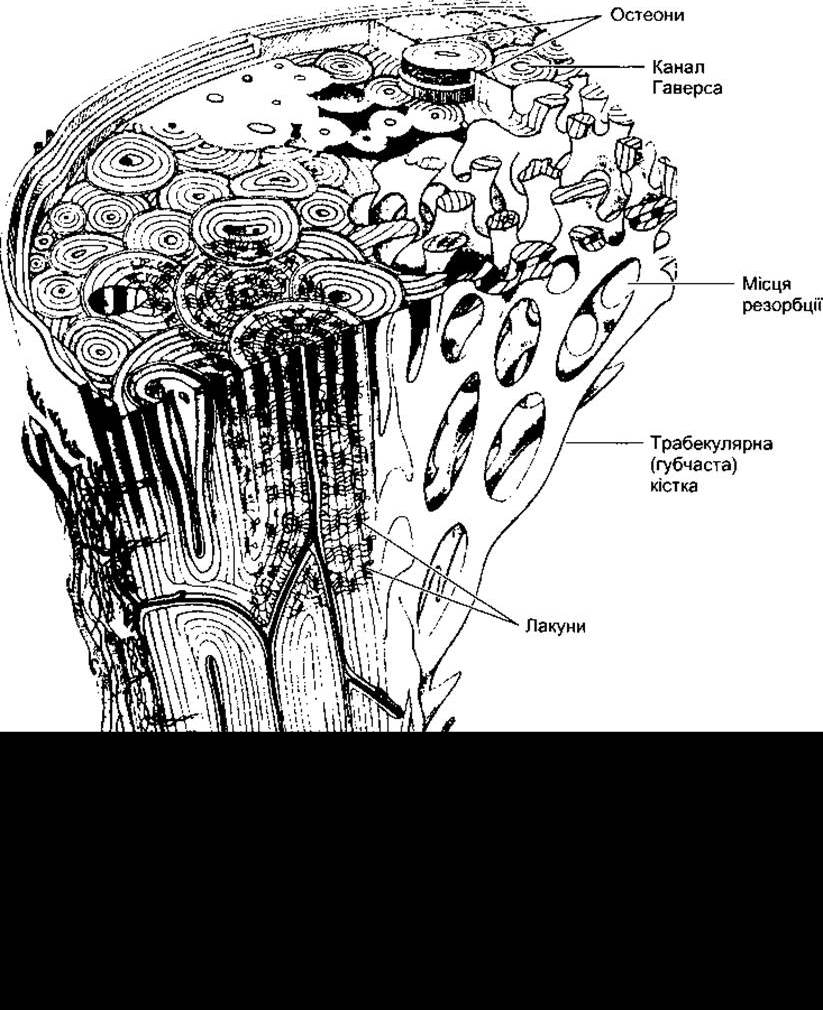
Рис 21-3. Будова компактної та трабекулярної кістки. Компактна кістка показана у горизонтальному (угорі) та вертикальному (ліворуч) перерізі (відтворено за дозволом з Williams PL et al (editors): Gray’s Anatomy, 37th edition, Churchill Livingstone, 1989).
Утворення кістки та резорбція
Протягом життя людини кістки постійно резорбують, а на їхньому місці утворюються нові. Кальцій у кістках оновлюється зі швидкістю 100% за рік у новонароджених та 18% за рік у дорослих. Ремоделювання кістки є переважно місцевим процесом, що відбувається на малих ділянках за допомогою клітин, названих ремоделювальними одиницями кістки. Спершу остеокласта резорбують кістку, а потім остеобласти у цій же ділянці відкладають нову. Цей цикл триває близько 100 днів. Однак ремоделювання дрейфує, у цьому разі форма кістки змінюється, оскільки кістка резорбується в одному місці, а відкладається в іншому. Остеокласта проникають у трубчасту кістку, за ними надходять остеобласти; у трабекулярній кістці ремоделювання відбувається на поверхні. Близько 5% маси кістки дорослої людини щомиті ремодельовані двома мільйонами кістковоремоделювальних одиниць скелета людини. Швидкість оновлення кістки становить близько 4% за рік для трубчастої кістки і 20% - для трабекулярної. Ремоделювання частково пов’язане з тиском і розтягом скелета під дією сили тяжіння та інших чинників і регульоване гормонами, що циркулюють у крові, факторами росту та цитокінами. Попередники остеобластів секретують фактори, що впливають на розвиток остеокластів, і це не дивує, адже воно пояснює підтримання балансу між резорбцією та утворенням кістки. Деякі з факторів, що діють на остеобласти та остеокласта, наведені в табл. 21-2.
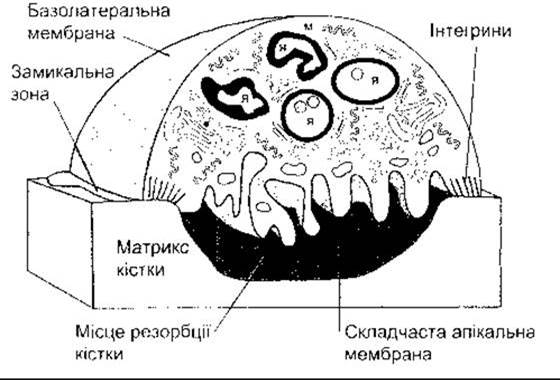
Рис. 21-4. Остеокласт, що резорбує кістку. Краї клітини щільно з’єднані з кісткою, що уможливлює секрецію кислоти зі складчастої апікальної мембрани та наступне руйнування кістки під клітиною. Зверніть увагу на численні ядра (я) та мітохондрії (м) (з дозволу R Baron).
Деталі процесу, відповідального за кальцифікацію новоутвореного кісткового матриксу, незважаючи на інтенсивне вивчення, до кінця не з’ясовані. В цьому процесі задіяні кілька генів, і нокаут одного з них у мишей веде до утворення тварин з хрящовим скелетом без кісток у тілі. Остеобласти секретують лужну фосфатазу, що гідролізує фосфатні естери. Концентрація фосфатів, вивільнених внаслідок гідролізу складних ефірів, збільшується біля остеобластів, а це може спричинювати випадання осаду фосфату кальцію.
Сьогодні виділено та схарактеризовано, окрім колагену, ще кілька білків кістки. Кісткові морфогенні білки (BMPs - від англ. bone morphogenic proteins) стимулюють ріст кістки; тепер також відомо, що вони відіграють провідну роль у розвитку нервової системи та багатьох інших тканин у тілі. Білок Gla матриксу (MGP - від англ. matrix Gla protein) та білок Gla кістки (BGP - від англ. bone Gla protein, остеокальцин) містять у-карбоксильовані залишки глутамінової кислоти (Gla), а у-карбоксилювання каталізоване вітаміном К (див. Розділ 17). Залишки Gla зв’язують Са2+, однак нестача вітаміну К зумовлює скелетні аномалії лише у плоду. Два додаткові білки - остеонектин та остеопонтин - синтезовані остеобластами. Синтез остеокальцину та остеопонтину збільшується з початком кальцифікації. Проте точні функції усіх цих білків у кістці ще треба з’ясувати.
Поглинання інших мінералів
Свинець та деякі інші токсичні елементи кістка поглинає та вивільняє так само, як і кальцій. Швидке кісткове поглинання цих елементів інколи називають механізмом детоксикації, оскільки воно слугує для їхнього вилучення з рідин організму, що зменшує їхній токсичний вплив. Фторид, поглинутий кісткою, зумовлює утворення нової кістки. Він також входить в емаль зубів, а невеликі його кількості підвищують стійкість до карієсу. Проте великий вміст спричинює знебарвлення емалі (мармуровість емалі).
Таблиця 21-2. Чинники, що впливають на остеобласти та остеокласта

Хвороби кісток
Хвороби, спричинені вибірковими аномаліями клітин та процесів, розглянутих нижче, відображають взаємозв’язок між чинниками, що забезпечують нормальні функції кістки.
Різноманітні мутації в генах, які кодують колаген, роблять кістки крихкими, зумовлюючи недосконале кісткоутворення (хворобу крихких кісток), а також спричинюють різноманітні хондродисплазії й принаймні одну форму синдрому Елерса-Данлоса. Можливо, що деякі випадки остеопорозу (див. нижче), остеоартриту та аневризми аорти теж є наслідками мутацій у генах колагену. У випадку остеопетрозу, іншої рідкісної та часто важкої хвороби, остеокласти дефективні і нездатні до резорбції кістки, яку вони виконують за нормальних умов. Це призводить до рівномірного збільшення густини кістки, неврологічних розладів унаслідок звуження отворів, крізь які зазвичай проходять нерви, та гематологічних аномалій унаслідок витіснення порожнин кісткового мозку. У миші, що не мас білка, кодованого негайним раннім геном c-fos, розвиваються ознаки остеопетрозу, який також простежується в мишей, що не мають фактора транскрипції PU.1, та в мишей з дефіцитом остеокальцину. Це наштовхує на думку, що усі три фактори задіяні в процесі нормального розвитку та діяльності остеокластів.
Стан, за якого кількість відкладення кальцію на одиницю кісткового матриксу недостатня, називають рахітом у дітей та остеомаляцією в дорослих. У разі остеопорозу відбувається втрата матриксу та мінералів і зменшення маси кістки (рис. 21 -5) та її міцності, унаслідок чого збільшується частота переломів. Цю хворобу, на противагу остеопетрозу, характеризує сумарне переважання резорбції кістки над її утворенням. Вона має багато причин, однак найпоширенішою формою є інволюційний остеопороз, пов’язаний переважно зі старшим віком та менопаузою. Інволюційний остеопороз - поширена хвороба, він став головною проблемою для охорони здоров’я в Сполучених Штатах та Європі, тому що кількість людей старшого віку збільшилася.
В усіх нормальних людей кістки утворюються в ранньому періоді життя, під час росту. Після стабільного періоду з віком вони починають втрачати масу (рис. 21-6). Якщо ця втрата прискорена або збільшена, як у разі остеопорозу, то це призводить до збільшення частоти переломів, зокрема передпліччя (переломів Колліса), тіл хребців та стегнових кісток. Усі ці ділянки мають високий вміст трабекулярної кістки; оскільки ж вона є метаболічноактивнішою, то й втрачається найшвидше. Переломи хребців зі здавленням спричинюють кіфоз з утворенням типового «горба вдови», що поширений серед старших жінок з остеопорозом. Травми стегна та ушкодження кульшового суглоба у старших осіб пов’язані з рівнем смертності у 12-20% випадків, а половина з тих, хто вижив потребують тривалого дорогого догляду. Дорослі жінки мають меншу масу кісток, ніж дорослі чоловіки, і після менопаузи на початковій стадії втрачають її швидше, ніж чоловіки такого ж віку (див. рис. 21-6), з огляду на це вони більше схильні до розвитку серйозного остеопорозу. Першою причиною втрати маси кісток після менопаузи є нестача естрогену, тому лікування естрогеном дає змогу зупинити прогресування хвороби. Естрогени інгібують секрецію цитокінів, зокрема ІЛ-1, ІЛ-6 та ФНПа, які пришвидшують розвиток остеокластів. Естроген також стимулює утворення ТФР-ß, який, відповідно, збільшує апоптоз остеокластів. На остеобластах є рецептори естрогену і їх можна безпосередньо стимулювати. Великі дози естрогенів збільшують частоту інфарктів міокарда та інсультів, однак малі їхні дози, що ефективні у сповільненні втрати маси кісток, захищають від серцево-судинних хвороб. Естрогени також збільшують частоту ендометріального раку, та здається, цього можна уникнути, якщо естроген вживати з прогестином. З іншого боку, тривале лікування естрогенами може збільшити частоту раку молочної залози. Отже, тактика лікування жінок після менопаузи за допомогою естрогенів залежить від ретельного зважування всіх за і проти.

Рис. 21-5. Нормальна трабекулярна кістка (ліворуч) порівняно з трабекулярною кісткою у разі остеопорозу (праворуч).
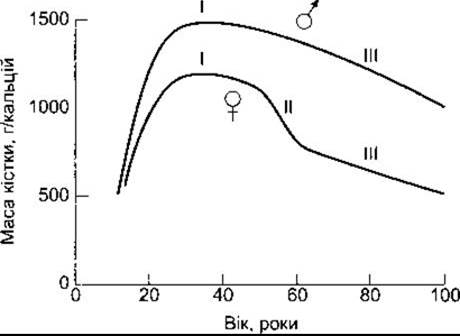
Рис. 21-6. Загальний рівень кальцію в організмі як показник маси кісток у чоловіків та жінок різного віку. Зверніть увагу на швидке збільшення цих рівнів у молодих дорослих людей (фаза І), неухильну втрату маси кістки з віком в обох статей (фаза III) та накладену, спершу прискорену, втрату у жінок після менопаузи (фаза II) (відтворено за дозволом з Riggs BL, Melton LJ III: Involutional osteoporosis. In Evans TG, Williams TF (editors): Oxford Textbook of Geriatic Medicine. Oxford Univ Press, London, 1992).
Збільшене поглинання кальцію, особливо з природних джерел, наприклад, молока, та помірні фізичні навантаження можуть також допомогти запобігти чи сповільнити прогресування остеопорозу, хоча їхній вплив не дуже сильний. Бісфосфонати, такі як етидронат, що інгібує остеокластичну активність, збільшують мінеральний вміст кісток, якщо їх вживати за циклічною схемою, і зменшують частоту нових переломів хребців. Фторид стимулює остеобласти, роблячи кістку щільнішою, однак він не має важливого значення в разі лікування цієї хвороби.
У пацієнтів, що з якоїсь причини іммобілізовані, та у космонавтів (див. Розділ 33) резорбція кісток перевищує її утворення, і розвивається дифузний остеопороз. Рівень кальцію в плазмі не є помітно збільшеним, проте концентрація паратгормону та 1,25-дигідроксихолекальциферолу зменшується, і великі кількості кальцію виходять з сечею. Остеопороз також розвивається у пацієнтів з надлишковою секрецією глюкокортикоїдів (синдром Кушінґа; див Розділ 20).