Фізіологія людини - Вільям Ф. Ґанонґ 2002
Ендокринна система, метаболізм і репродуктивна функція
Гіпофіз
Гормон росту
Біосинтез і хімія
Довге плече 17-ї хромосоми людини містить кластер гормону росту - хоріонічного соматомамотропіну людини (ХСл) з п’яти генів: перший, ГРл-Н (нормальний), кодує найпоширенішу форму гормону росту; другий, ГРл-В (варіантний), - іншу форму гормону росту (див. нижче); два кодують ХСл (див. Розділ 23), а п’ятий, імовірно, ХСл, є псевдогеном.
Нормальний гормон росту людини - це продукт ГРл-Н, він становить 75% усіх молекул ГРл, що циркулюють. Завдяки молекулярній масі - 22 000 він відомий також як 22 К ГРл. На рис. 22-3 показано його структуру, яку порівняно зі структурою ГРл, що також має 191 амінокислотний залишок і відрізняється тільки за 29 залишками. Ген ГРл-В, який первинно виділяється у плаценті, продукує 191-амінокислотний гормон росту, що відрізняється від нормального людського гормону росту 13 амінокислотами, розкиданими по поліпептидному ланцюгу. Помітна кількість гормону простежується в циркуляції лише під час вагітності. Матрична РНК, яку продукує ген ГРл-Н, підлягає альтернативному сплайсингу з утворенням гормону росту, ідентичного до 22 К ГРл, за винятком делегованих амінокислотних залишків 32-46. Менша форма - 20 К ГРл - також є біологічно активною і становить близько 10% гормону росту, що циркулює. Фізіологічне значення наявності двох основних форм - 22 К і 20 К - невідоме. Крім того, в кров’яному руслі виявлені дезаміновані та різні інші форми, що свідчить про множинність типів гормону росту в організмі.
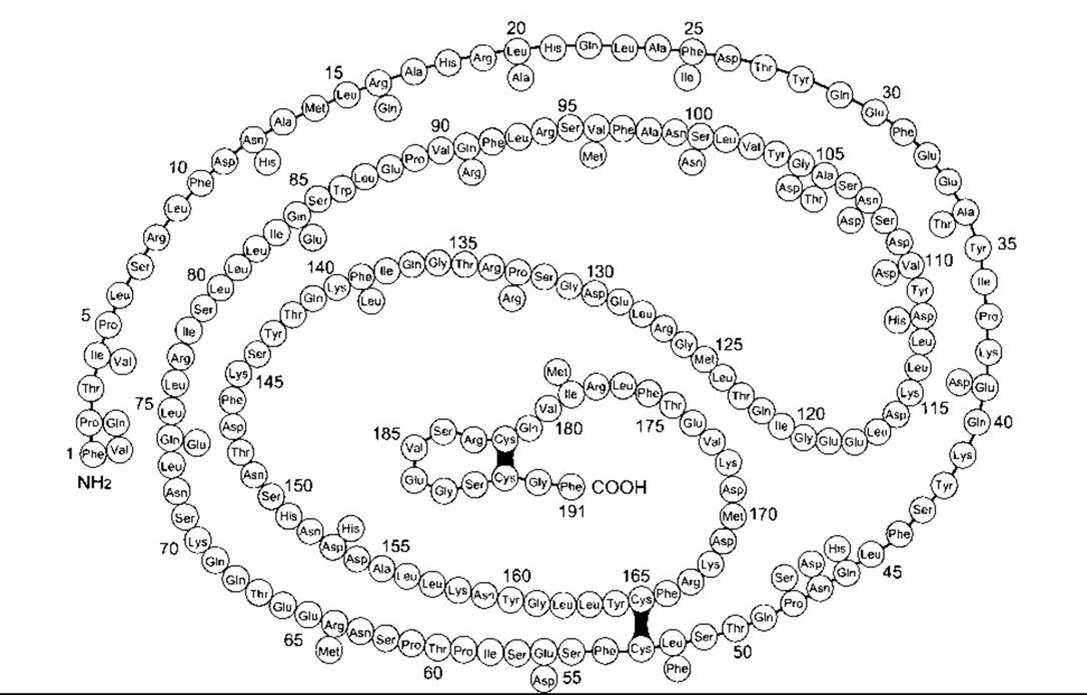
Рис. 22-3. Структура головної форми гормону росту людини (неперервний ланцюг). Темними проміжками позначені дисульфідні мостики; 29 залишків уздовж ланцюга визначають залишки, які відрізняються у хоріонічному соматомамотропіні людини (ХСл; див. Розділ 23). Усі інші залишки у ХСл є такими самими, і ХСл також має 191 амінокислотний залишок.
Видова специфічність
Виявлено значні відмінності у структурі гормону росту між різними видами. Гормон росту, що виділяється у свині і хом’ячка, має короткочасну дію у морської свинки, можливо тому, що він стимулює нщидке утворення антитіл до гормону росту. У мавп і людини гормон росту бика і свині не має навіть значного короткочасного впливу на ріст. Хоча мавп’ячий і людський гормони росту, повністю активні, виявлено як у мавпи, так і в людини. Гормон росту людини має також лактогенну активність.
Концентрації у плазмі, зв’язування і метаболізм
Гормон росту пов’язаний з білком плазми, що є великим фрагментом позаклітинного домену рецептора гормону росту (див. нижче). Він виникає внаслідок розщеплення рецепторів у людини, його концентрація є показником кількості рецепторів гормону росту у тканинах. Близько половини активного гормону росту перебуває у зв’язаній формі, що є джерелом гормону для компенсації широкомасштабних коливань під час його секреції (див. нижче).
Гормон росту швидко розщеплюється, принаймні частково, у печінці. Період півжиття гормону росту, що циркулює, у людини становить 6-20 хв. З’ясовано, що добове виведення гормону росту у дорослих - 0,2-1,0 мг/добу.
У нормі базальний рівень гормону росту в плазмі дорослої людини, визначений радіоімунологічним методом, - менше 3 нг/мл. Він головно представлений 22 К ГРл, оскільки спорідненість 20 К ГРл для більшості антитіл становить близько 30% від спорідненості 22 К ГРл. Білок- зв’язану і вільну форми гормону визначають радіоімунологічним методом, оскільки антитіла, які використовують для цього, мають більшу спорідненість до гормону, ніж до зв’язувальних білків.
Рецептори гормону росту
Рецептором гормону росту є білок, що складається з 620 амінокислот, має велику позаклітинну частину, трансмембранний домен і велику цитоплазматичну частину. Він належить до надродини цитокінових рецепторів, розглянутих у Розділі 27.
Гормон росту має дві ділянки зв’язування з рецептором, і коли він зв’язується з однією субодиницею рецептора, то інша зв’язувальна ділянка притягує іншу субодиницю, утворюючи гомодимер (рис. 22-4). Димеризація є в основі активування рецептора.
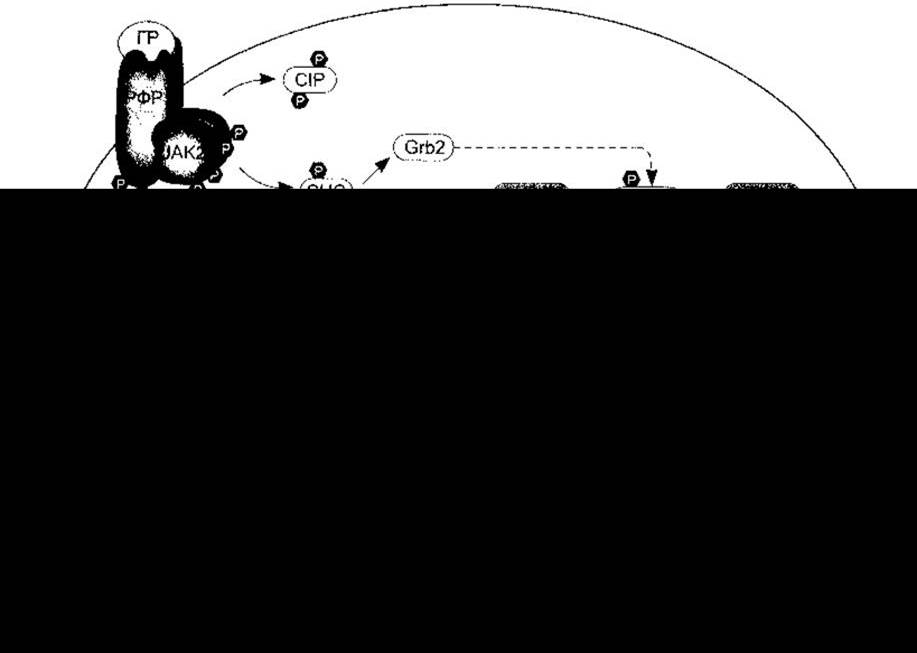
Рис. 22-4. Головні сигнальні шляхи, активовані димеризацією рецептора фактора росту (РФР). Підтверджені реакції впливу гормону росту позначені суцільними стрілками і забарвленими молекулами. Штрихові стрілки і незабарвлені молекули відображають ефекти, зумовлені факторами росту, однак поки що не виявлені для гормону росту. Детальніше шлях від Grb2 до МАР К та ФЛС-шлях розглянуто у Розділі 1; GLE-1, GLE-2 - елементи інтерферон у-активованої відповіді; СІР - субстрат інсулінового рецептора; p90RSK - S6 кіназа; ФЛА2 - фосфоліпаза А2; SIE - Sis-індукований елемент; ЕСВ - елемент сироваткової відповіді; ФСВ - фактор сироваткової відповіді; TCF - фактор четвертинного комплексу. Гени, активовані у випадку C-fos (див. Розділ 1): Р450-ЗА10 - цитохром; Spi 2.1 - інгібітор серинової протеази (модифіковано за дозволом з Argetsinger LS, Carter-Sy С: Mechaism of signalling by growth hormone receptor. Physiol Rev 1996;76.1089).
Гормон росту виконує багато функцій в організмі (див. нижче). Хоча поки що неможливо визначити кореляцію між його внутрішньоклітинним впливом і дією на весь організм, та відомо, що, як і інсулін, він активує різноманітні внутрішньоклітинні ензимні каскади (див. рис. 22- 4). Потрібно зазначити про активування гормоном росту JAK2-Stat шляху. JAK2 є представником родини Janus, до якої належать цитоплазматичні тирозинові кінази. Білки Stat (провідники сигналів і активатори транскрипції) належать до родини цитоплазматичних факторів транскрипції, які після фосфорилювання JAK кіназами мігрують до ядра й активують різні гени. JAK-Stat шлях також опосередковує дію пролактину та різних факторів росту.
Вплив на ріст
У молодих тварин, у яких епіфізи ще не злилися з довгими кістками (див. Розділ 23), ріст пригнічує гіпофізектомія (рис. 22-5), а стимулює гормон росту. Хондрогенез у цьому випадку прискорений, і оскільки хрящові епіфізіальні пластинки розширюються, то вони відкладають більше кісткового матриксу на кінцях довгих кісток (рис. 22-6). Унаслідок цього розміри тіла збільшуються, тому довготривале лікування гормоном росту призводить до гігантизму. Якщо епіфізи закриті, то лінійний ріст стає неможливим, а гормон росту спричинює характерну деформацію кісток і м’яких тканин, відому у людини як акромегалія (рис. 22-7). Розміри більшості внутрішніх органів у цьому разі збільшені. Ендокринні органи можуть також підпадати під вплив гормону росту, який діє синергічно з АКТГ, спричинюючи збільшення розмірів надниркових залоз, та з андрогенами, зумовлюючи збільшення додаткових репродуктивних органів. Вміст білка в організмі за цих умов збільшується, а вміст жиру зменшується.

Рис. 22-5. Вплив гіпофізектомії на ріст незрілої резус мавпи. Два роки тому обидві мавпи мали однаковий зріст і масу, пізніше тварині ліворуч було виконано гіпофізектомію (відтворено за дозволом з Knobil Е in Growth in Living Systems. Zarrow MX [editor]. Basic Books, 1961).
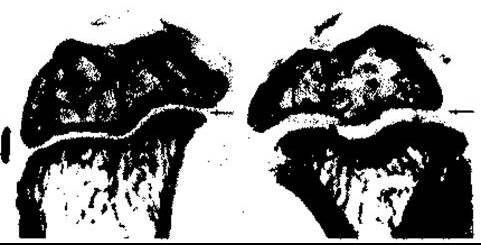
Рис. 22-6. Вплив лікування гормоном росту упродовж чотирьох днів на проксимальні епіфізи гомілкової кістки щурів після епіфізектомії. Простежується збільшення ширини незабарвленої хрящової пластинки великогомілкової кістки у лікованої тварини праворуч (для порівняння ліворуч наведено контроль) (відтворено за дозволом з Evans HM et al Bioassay of pituitary growth hormone. Endocrinology 1943;32:14).
Вплив на метаболізм білків та електролітів
Гормон росту є анаболічним гормоном для білків, він забезпечує позитивний баланс азоту та фосфору, збільшення вмісту фосфору у плазмі і зменшення вмісту сечовинного азоту та амінокислот у крові. У дорослих із його недостатністю створений за рекомбінантною технологією гормон росту людини спричинює збільшення маси тіла і зменшення кількості жиру поряд зі зростанням метаболічної активності і зниженням рівня холестеролу в плазмі крові. Одночасно посилюється всмоктування кальцію у шлунково-кишковому тракті. Екскреція натрію і калію пригнічена незалежно від впливу надниркових залоз, імовірно тому, що ці електроліти переходять з нирок до тканин, що ростуть. Під час росту і в разі акромегалії, а також багатьох інших захворювань посилюється екскреція амінокислоти 4-гідроксипроліну. Більша частина виділеного гідроксипроліну походить з колагену, тому екскреція гідроксипроліну збільшується у випадку захворювань, пов’язаних з активним руйнуванням колагену. Цей процес також посилюється під час активного синтезування розчинного колагену, що його стимулює саме гормон росту.
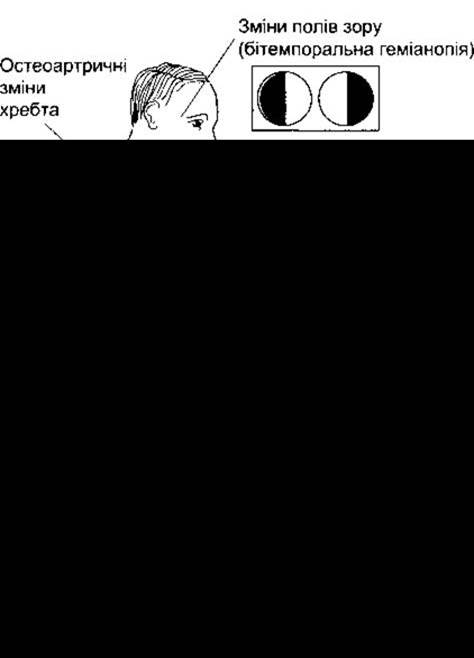
Рис. 22-7. Характерні зміни у разі акромегалії.
Вплив на метаболізм вуглеводів і жирів
Вплив гормону росту на метаболізм вуглеводів розглянуто у Розділі 19. Гормон росту має діабетогенну дію, оскільки підвищує виділення печінкової глюкози і виявляє антиінсуліновий ефект у м’язах. Він також має кетогенну дію, оскільки підвищує рівень вільних жирних кислот (ВЖК), що циркулюють у крові. Збільшення ВЖК, що виникає через декілька годин, є джерелом енергії для тканин під час гіпоглікемії, голодування чи стресу. Гормон росту прямо не стимулює В-клітини підшлункової залози, однак посилює здатність цієї залози реагувати на інсуліногенні подразники, такі як аргінін чи глюкоза. Це додаткове свідчення того, як названий гормон сприяє росту, оскільки інсулін має анаболічний ефект щодо білків (див. Розділ 19).
Соматомедини
Вплив гормону росту на ріст, хрящову тканину та метаболізм білків залежить від взаємодії між цим гормоном і соматомединами, які є поліпептидними факторами росту, що їх виділяє печінка й інші тканини. Перший виділений такий фактор названо фактором сульфатації, оскільки він стимулює проникнення сульфату у хрящову тканину. Однак згодом з’ясували, що він також стимулює утворення колагену, тому назву змінено на соматомедин. Крім того, сьогодні відомо велику різноманітність соматомединів; вони є членами великої родини факторів росту, які впливають на різні тканини й органи.
Головними (а у людини, ймовірно, єдиними) соматомединами, що циркулюють, є інсуліноподібний фактор росту І (ІФР-І, соматомедин С) та інсуліноподібний фактор росту II (ІФР-ІІ). Ці фактори дуже подібні до інсуліну, однак у їхньому складі є С-ланцюги (рис. 22-8) і продовжений А-ланцюг, який ще називають D-доменом. Гормон релаксин (див. Розділ 23) теж член цієї родини. У людини розрізняють дві споріднені форми релаксину; обидві вони подібні до ІФР-ІІ. Варіантна форма ІФР-І, на N-кінці якої нема залишків трьох амінокислот, виявлена у головному мозку людини; є також декілька варіантних форм людського ІФР-ІІ (рис. 22-9). Матричну РНК ІФР-І, ІФР-ІІ знайдено в печінці, хрящовій і багатьох інших тканинах, що свідчить про їхній синтез у цих тканинах.
Властивості ІФР-І, ІФР-ІІ та інсуліну наведено у табл. 22-3. Обидва фактори тісно пов’язані з конкретними білками плазми крові, що продовжує період півжиття фактора у кровообігу. Виявлено шість ІФР-зв’язувальних білків з різним поширенням у тканинах. Вони всі містяться в плазмі, причому ІФР-зв’язувальний білок-3 (ІФРЗБ-З) забезпечує 95% зв’язування ІФР у кровоплині. Внесок ІФР в інсуліноподібну активність у крові розглянуто у Розділі 19. Рецептор ІФР-І дуже подібний до інсулінових рецепторів і, вірогідно, використовує такі самі внутрішньоклітинні механізми дії. Рецептор ІФР-ІІ є рецептором манозо-6- фосфату (див. рис. 19-6), що задіяний у внутрішньоклітинному прикладенні кислої гідролази та інших білків до внутрішньоклітинних органел. Секреція ІФР-І не залежить від гормону росту до народження, однак стимульована ним після народження і має помітну ростостимулювальну активність. Його концентрація в плазмі крові збільшується в дитячому віці, досягає максимального рівня під час статевого дозрівання і спадає до низького рівня у старечому віці. ІФР-ІІ значно менше підпадає під вплив гормону росту і відіграє роль у рості плоду до народження. У людського плоду з надмірною експресією цього фактора непропорційно ростуть органи, зокрема, язик, м’язи, нирки, серце і печінка. У дорослих ген ІФР-ІІ експресується тільки у хоріоїдальному сплетенні і мозкових оболонках.

Рис. 22-8. Будова ІФР-І, ІФР-ІІ та інсуліну людини із вишикуваними в ряд амінокислотними залишками для демонстрації гомологічних, які позначені кольоровими ділянками. Коди з однієї букви використані для амінокислотних залишків. Зазначимо, що в інсуліні С-пептиду нема, тоді як у ІФР-І, ІФР-ІІ А- і В-ланцюги (домени) зв’язані С-пептидом. Крім того, є D-домени (модифіковано і відтворено за дозволом з Sara VR, Hall К: Insulin-like growth factors and their binding proteins Physiol Rev 1990;70:591).
Таблиця 22-3. Порівняння інсуліну та інсуліноподібних факторів росту
Інсулін |
ІФР-І |
ІФР-ІІ |
|
Інші назви |
Соматомедин С |
Активність, що стимулює поділ клітин |
|
Кількість амінокислот |
51 |
70 |
67 |
Джерело |
В-клітини підшлункової залози |
Печінка та інші тканини |
Різні тканини |
Концентрація регульована |
Глюкозою |
Гормоном росту, харчуванням |
Невідомо |
Концентрація у плазмі |
0,3-2,0 нг/мл |
10-700 нг/мл максимальна у період пубертату |
300-800 нг/мл |
Зв’язувальний білок плазми |
Ні |
Так |
Так |
Головна фізіологічна дія |
Регулювання метаболізму |
Ріст кісткової і хрящової тканин |
Ріст під час внутрішньоутробного розвитку |
Безпосередня та опосередкована дія гормону росту
Інтерпретації механізмів впливу гормону росту змінювались, аж доки не отримали нових даних. Початково вважали, що гормон росту зумовлює ріст, безпосередньо діючи на тканини, згодом - винятково через посередництво соматомединів. Проте якщо гормон росту ввести в один із проксимальних великогомілкових епіфізів, то виникає однобічне збільшення ширини хряща, оскільки хрящ, як і інші тканини, виробляє ІФР-І. Недавно запропоновано гіпотезу, що пояснює такі наслідки дії гормону росту на хрящ шляхом перетворення стовбурових клітин у клітини, які відповідають на вплив ІФР-І. Після цього ІФР-І, який виробляється локально і потрапляє в кровообіг, зумовлює ріст хряща.
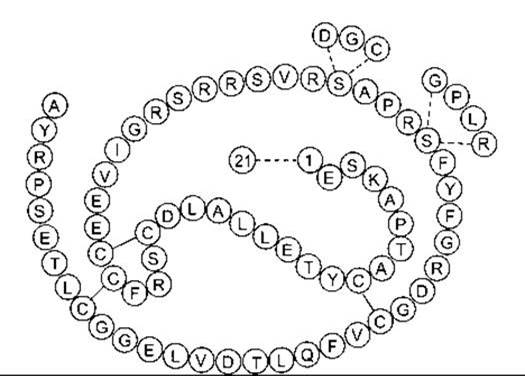
Рис. 22-9. Первинна структура людського ІФР-ІІ і трьох виявлених варіантів; продовження з 21-го залишка амінокислоти на карбоксильному кінці; тетрапептидна заміна Ser-29 і трипептидна заміна Ser-33. Коди з одної букви використані для амінокислотних залишків (відтворено за дозволом з Sara VR, Hall К: Insulin-like growth factors and their binding proteins Physiol Rev 1990;70:591)
Значення ІФР-І, що циркулюють, є важливим, оскільки введення ІФР-І щурам після гіпофізектомії відновлює ріст кісток і тіла.
На рис. 22-10 підсумовано сучасні погляди на дію гормону росту та ІФР-І. Гормон росту, ймовірно, діє спільно з циркулювальними і локально продукованими ІФР-І, зумовлюючи принаймні деякі з названих ефектів.
Гіпоталамічний контроль за виділенням гормону росту
Виділення гормону росту контрольоване гіпоталамусом. Гіпоталамус виділяє соматотропінрилізинг гормон (СТР-РГ) та інгібувальний гормон гормону росту соматостатин у портальну гіпофізальну кров, тому ураження гіпоталамуса чи перерізання гіпофізальної ніжки пригнічує виділення гормону росту. Якщо гормон росту виділяється постійно і тривалий час або тільки у дітей, то важко зрозуміти гіпоталамічний контроль його секреції. Проте велика кількість гормону росту міститься у гіпофізах як дорослих, так і дітей; рівень виділення гормону росту тут значно і швидко спонтанно коливається, а не лише зростає чи спадає у відповідь надію специфічних стимулів. Виділення СТР-РГ є епізодичним і зростає після більшості, однак не всіх, викидів гормону росту. Виділення соматостатину у портальну кров є детермінованішим.
Механізм виділення гормону росту регульований зворотним зв’язком, як і секреція інших гормонів передньої частки гіпофіза. Гормон росту підвищує кількість ІФР-І, що циркулюють у крові, а ІФР-І, відповідно, пригнічує виділення гормону росту гіпофізом та стимулює виділення соматостатину (рис. 22-11).
Чинники, які впливають на виділення гормону росту
Як зазначено, базальна концентрація гормону росту в плазмі крові в нормі у дорослих коливається від 0 до 3 нг/мл. У дітей вона несуттєво вища. Проте показники секреції не можна оцінювати за одним значенням, оскільки протягом дня відбуваються нерегулярні її стрибки (див. нижче). Виділення гормону росту зменшується у старшому віці, тому особливий інтерес становить його введення для противаги процесів старіння (див. Розділ 1). Гормон, як відомо, збільшує «пісну» масу тіла і зменшує жирові відкладення, однак не зумовлює статистично вірогідного підвищення м’язової сили чи розумового розвитку.
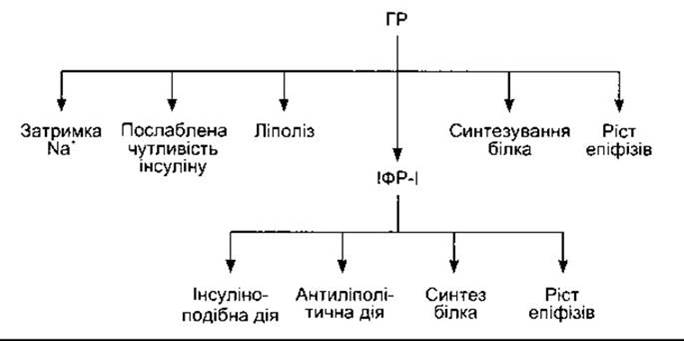
Рис. 22-10. Сучасний погляд на дію, опосередковану гормоном росту, інсуліноподібним фактором росту ІФР-І (з дозволу R Clark і Gesundheit).
Чинники, які посилюють виділення гормону росту, узагальнені в табл. 22-4. Більшість з них належать до складу трьох головних категорій: такі стани, як гіпоглікемія і голодування, за яких простежується справжнє чи загрозливе зменшення кількості субстратів для вироблення енергії у клітинах; стани, у разі яких збільшується кількість певних амінокислот у плазмі; стресові фактори. Підтверджено, що відповідь на глюкагон можна використати як тест механізму виділення гормону росту у пацієнтів з ендокринними захворюваннями. Хоча зміни кількості гормону росту у відповідь на дію інших чинників порівняно однакові, та вони все ж можуть відрізнятися у різних осіб. Максимальний рівень секреції гормону росту виникає із помітною регулярністю під час сну, проте значення взаємовідношень між гормоном росту і сном досі є загадкою. Виділення гормону росту збільшене в осіб, що повільно засинають (див. Розділ 11), і пригнічене під час нормального швидкого сну.
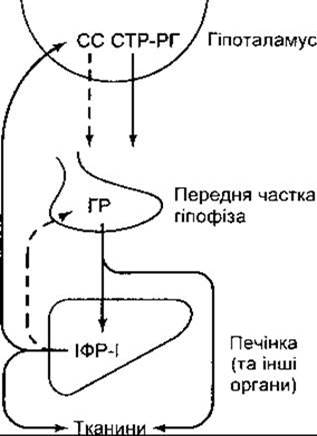
Рис. 22-11. Роль зворотного зв’язку у регулюванні виділення гормону росту. Штрихові стрілки показують інгібіторний, а суцільні - стимулювальний вплив. Зазначимо, що ІФР-І стимулює виділення соматостатину (СС) з гіпоталамуса, безпосередньо впливає на гіпофіз, пригнічує виділення гормону росту (ГР) (порівняйте з рис. 18-13, 20-20, 23-24, 23-38).
Уведення глюкози знижує рівень гормону росту в плазмі і пригнічує відповідь на фізичне навантаження. Підвищення, зумовлене дією 2-дезоксиглюкози, виникає внаслідок внутрішньоклітинної недостатності глюкози, оскільки ця сполука блокує катаболізм глюкозо-6-фосфату. Статеві гормони, зокрема естрогени, посилюють відповідь гормону росту на провокаційні фактори, такі як аргінін та інсулін. Виділення гормону росту пригнічує дія кортизолу, вільних жирних кислот і медроксипрогестерону.
Таблиця 22-4. Чинники, які впливають на виділення гормону росту у людини

Посилює виділення гормону росту дія L-ДОФА, що збільшує вивільнення дофаміну і норадреналіну у головному мозку, та вплив агоніста дофамінового рецептора апоморфіну Стимулювальні впливи норадреналіну і дофаміну визначальні, проте дофамін також має активність конкурентного інгібітора, який діє через D2-рецептори і впливає безпосередньо на соматотропні клітини.