Фізіологія людини - Вільям Ф. Ґанонґ 2002
Ендокринна система, метаболізм і репродуктивна функція
Статева диференціація і розвиток
Вагітність
Запліднення й імплантація
У людини запліднення яйцеклітини сперматозоїдом відбувається, як звичайно, у середній частині маткової труби. Воно охоплює, по-перше, хемоатракцію сперматозоїда до яйцеклітини завдяки речовинам, які утворюються в яйцеклітині; по-друге, злиття з прозорою зоною, мембранною структурою, яка оточує яйцеклітину; по-третє, пенетрацію прозорої зони й акросомальну реакцію; по- четверте, злиття голівки сперматозоїда з клітинною мембраною яйцеклітини і руйнування ділянки з’єднання з виходом ядра сперматозоїда у цитоплазму яйцеклітини (рис. 23-39). У піхві під час статевого акту накопичуються мільйони сперматозоїдів, однак лише 50-100 їх досягає яйцеклітини і багато з них контактують з прозорою зоною. Сперматозоїди зв’язуються зі спермальними рецепторами ZP3 цієї зони, після чого відбувається акросомальна реакція, тобто руйнування акросоми - лізосомоподібної органели на голівці сперматозоїда (див. рис. 23-18). У цьому разі вивільняється багато ензимів, у тому числі трипсиноподібна протеаза акрозин, що сприяє, однак не є необхідною для пенетрації сперматозоїда через прозору зону. Коли один сперматозоїд досягає мембрани яйцеклітини, то злиття з нею опосередковує фертилін - білок, який міститься на поверхні головки сперматозоїда і подібний до вірусних білків, які дають змогу вірусам атакувати клітини. Таке злиття дає сигнал, який ініціює розвиток, і, крім того, сприяє зниженню мембранного потенціалу яйцеклітини, що запобігає поліспермії - заплідненню яйцеклітини більше ніж одним сперматозоїдом. Після цієї тимчасової зміни потенціалу відбувається структурна перебудова прозорої зони, яка забезпечує захист від поліспермії на триваліший час.

Рис. 23-39. Послідовність етапів запліднення у ссавців. Сперматозоїди наближаються до яйцеклітини, зв’язуються із прозорою зоною, виділяють акросомальні ензими, проникають у прозору зону і зливаються з мембраною яйцеклітини, вивільняючи ядро сперматозоїда в її цитоплазму (модифіковано з Vacquier VD: Evolution of gamete recognition proteins. Science 1999;281:1995).
Ембріон, який розвивається (тепер його називають бластоцистою), опускається по трубі до матки. Цей процес триває близько трьох діб, під час яких бластоциста досягає 8- чи 16-клітинної стадії. У разі контакту з ендометрієм бластоцисту оточують зовнішній шар синцитіотрофобласт - багатоядерна маса без видимих клітинних меж, і внутрішній шар цитотрофобласт, який складається з окремих клітин. Синцитіотрофобласт руйнує ендометрій, і бластоциста потрапляє в ямку (імплантація). Як звичайно, місцем імплантації є задня стінка матки. Далі розвивається плацента, а трофобласт і надалі зв’язаний з нею.
Недостатність відторгнення плоду- трансплантата
Зазначимо, що плід і мати є двома генетично відмінними організмами, і в цій ситуації плід відіграє роль трансплантата чужої тканини в організмі жінки. Проте трансплантат толерується, і не виникає реакції відторгнення, яка характерна у разі трансплантації чужих тканин (див. Розділ 27). Покищо до кінця не з’ясовано, як відбувається захист плід- трансплантат. Одним з пояснень може бути те, що плацентарний трофобласт, який відділяє материнську і плодову тканини, не експресує поліморфних генів МНС класу І і класу II, а, натомість, експресує неполіморфний ген HLA-G. Тому не утворюються антитіла до білків плоду. Крім того, на поверхні плаценти виявлено Fas ліганд, який зв’язується із Т-клітинами і призводить до їхнього апоптозу (див. Розділ 1). Фіксують також незначне зниження циркулювальних антитіл в організмі матері. Наприклад, під час вагітності знижується рівень материнських антитиреоїдних антитіл у крові жінки з хворобою Грейвса, і вони часто стають еутиреоїдними до кінця вагітності.
Неплідність
Є клінічна проблема неплідності, яка часто потребує виконання багатьох обстежень, аж доки не буде з’ясовано причину її виникнення. У 30% випадків проблема пов’язана з чоловіком, у 45% - з жінкою, у 20% - з обома партнерами, а у 5% - причина невідома. Допомогою у цих випадках є запліднення in vitro, тобто видалення зрілих яйцеклітин з яєчника, запліднення їх сперматозоїдами та імплантація однієї чи декількох з них у матку на 4-клітинній стадії розвитку. У цьому разі шанс отримання живої дитини становить 5-10%.
Ендокринні зміни
У всіх ссавців під час запліднення жовте тіло в яєчнику не регресує, а навпаки, збільшується під впливом гонадотропних гормонів, що їх виділяє плацента. Плацентарний гонадотропін людини називають хоріонічним гонадотропіном людини (ХГл). Збільшене жовте тіло вагітності виділяє естрогени, прогестерон і релаксин. Релаксин підтримує вагітність, інгібуючи скорочення міометрію. У більшості видів видалення яєчників під час будь-якого періоду вагітності спричинює викидень. У людини плацента виділяє достатню кількість естрогену і прогестерону з материнської та плодової частин, щоб перейняти функцію жовтого тіла після шостого тижня вагітності. Оварієктомія до шостого тижня вагітності призводить до викидня, а її проведення після цього періоду не впливає на вагітність. Функція жовтого тіла починає загасати після восьмого тижня вагітності, однак воно існує протягом усієї вагітності. Виділення ХГл зменшується після раніше згаданого підйому, проте виділення естрогену і прогестерону збільшується аж до пологів (табл. 23-9).
Хоріонічний гонадотропін людини
Гормон ХГл - це глікопротеїн, який містить галактозу і гексозамін. Його виробляє синцитіотрофобласт. Як і глікопротеїнові гормони гіпофіза, він має а- і ß-субодиниці; ХГл-а ідентичний до а-субодиниці ЛГ, ФСГ і ТТГ. Молекулярна маса ХГл-а становить 18 000, а ХГл-ß - 28 000 Да. Гормон ХГл має лютеїнізувальну, лютеотропну та незначну ФСГ активність. Визначають його методом радіоімунного аналізу і виявляють у крові на шостий день після запліднення, а наявність у сечі на ранніх термінах вагітності слугує основою багатьох лабораторних тестів для підтвердження факту вагітності (з’являється в сечі на 14-й день після запліднення); діє на ті самі рецептори, що й ЛГ.
Зазначимо, що ХГл не є абсолютно специфічним для вагітності. Невелику кількість його виділяють деякі пухлини, у тому числі шлунково-кишкового тракту, в осіб обох статей. Тому його визначають в осіб з підозрою на пухлину як пухлинний маркер. Виявлено, що невелику кількість ХГл продукують також у нормі печінка і нирки плоду.
Хоріонічний соматомамотропін людини
Синцитіотрофобласт теж виділяє велику кількість білкових гормонів, які мають лактогенну і незначну ростостимулювальну активність. Цей гормон називають хоріонічний гормон росту - пролактин (ХРП), плацентарний лактоген людини (ПЛл), однак сьогодні використовують назву хоріонічний соматомамотропін людини (hCS). Його структура дуже подібна до структури гормону росту людини (див. рис. 22-4). Виявилося, що ці два гормони і пролактин походять від одного загального гормону-попередника. Велику кількість hCS виявляють у материнській крові, однак дуже мала кількість потрапляє до плоду. Виділення гормону росту гіпофізом матері не збільшується під час вагітності, і може зменшуватися під впливом hCS. Гормон hCS має більшість властивостей гормону росту і, очевидно, діє, як материнський гормон росту вагітності, спричинюючи затримку азоту, калію і кальцію в організмі, ліполіз і зниження утилізації глюкози в цьому стані. Дві останні дії сприяють притоку глюкози до плоду. Кількість виділеного hCS пропорційна до розміру плаценти, маса якої в нормі близько 1/6 маси плоду, а низький рівень hCS є ознакою плацентарної недостатності.
Таблиця 23-9. Концентрації гормонів у материнській крові під час нормальної вагітності
Гормон |
Приблизна максимальна концентрація |
Час максимального виділення |
ХГл Релаксин hCS Естрадіол Естріол Прогестерон Пролактин |
5 мг/мл 1 нг/мл 15 мг/мл 16 нг/мл 14 нг/мл 190 нг/мл 200 нг/мл |
Перший триместр Перший триместр Термінові пологи Термінові пологи Термінові пологи Термінові пологи Термінові пологи |
Інші гормони плаценти
Окрім ХГл, hCS, прогестерону й естрогенів, плацента виділяє інші гормони. Окремі відділи плаценти людини, очевидно, виділяють ПОМК, у культурі тканини - КтРГ, ß-ендорфін, а-МСГ і динорфін А. Усі вони виявилися ідентичними до своїх гіпоталамічних двійників, а також виділяють ГнРГ та інгібін. Оскільки ГнРГ стимулює, а інгібін пригнічує виділення ХГл, то місцеві ГнРГ та інгібін діють у паракринний спосіб, регулюючи виділення ХГл. Клітини трофобласту та амніону виділяють лептин (див. Розділ 14) і зменшують кількість цього гормону ситості у материнському кров’яному руслі. Частина його потрапляє в амніотичну рідину, хоча його функція під час вагітності поки що не відома. Плацента також виділяє пролактин у різних формах.
Плацента секретує а-субодиниці ХГл, тому концентрація вільних а-субодиниць у плазмі збільшується протягом вагітності. Ці а-субодиниці набувають вуглеводних компонентів, що робить їх нездатними до з’єднання з ß-субодиницями. їхня експресія передбачає виконання ними власної функції. Цікавим є те, що секреція пролактину ендометрієм також посилюється впродовж вагітності, тому можливо, що цей процес стимулюють саме а-субодиниці.
Цитотрофобласт людського хоріону містить проренін (див. Розділ 24). Велику кількість прореніну виявляють в амніотичній рідині, однак його функція тут невідома.
Фетоплацентарний зв’язок
Плід і плацента взаємодіють в утворенні стероїдних гормонів. Плацента синтезує прегненолон і прогестерон з холестеролу. Частина прогестерону потрапляє у кровоплин плоду і слугує субстратом для утворення кортизолу і кортикостерону у його надниркових залозах (рис. 23-40). Частина прегненолону переходить до плоду і разом із прегненолоном, синтезованим у його печінці, є субстратом для утворення дигідроепіандростерону сульфату (ДГЕАС) і 16-гідроксидигідроепіандростерону сульфату (16-ГДГЕАС) у його надниркових залозах. Частково 16-гідроксиляція відбувається також у печінці плоду. ДГЕАС і 16-ГДГЕАС потрапляють назад до плаценти, де з ДГЕАС утворюється естрадіол, а з 16-ГДГЕАС - естріол. Головним естрогеном, який утворюється, є естріол, і оскільки фетальний 16- ГДГЕАС - основний субстрат для естрогенів, то виділення естріолу з сечею матері можна вважати показником для моніторингу за станом плоду.
Пологи
Тривалість вагітності у людини в середньому становить 270 днів від запліднення (284 дні від першого дня останньої місячної). В останній місяць вагітності збільшується частота нерегулярних скорочень матки. Різниця між тілом матки і шийкою стає очевидною під час пологів. Шийка, яка є твердою у невагітному стані, під час вагітності ближче до пологів розм’якшується і розширюється, тоді як тіло матки скорочується і виштовхує плід.
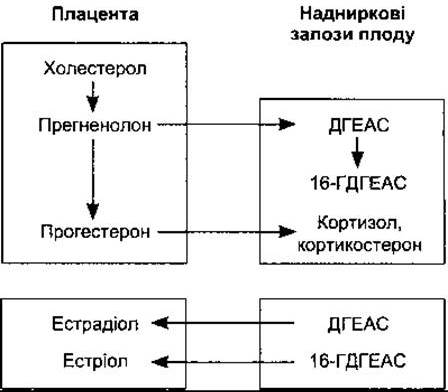
Рис. 23-40. Взаємодія між плацентою і корою надниркових залоз плоду під час продукування стероїдів.
До кінця не з’ясовані механізми, які відповідають за початок пологів. Один із факторів - підвищення рівня естрогенів у крові. Це робить матку чутливішою, збільшує кількість щілинних з’єднань між клітинами міометрія і зумовлює утворення більшої кількості простагландинів, які сприяють її скороченню. Прогестерон заспокійливо впливає на матку. У ссавців-неприматів рівень циркулювального прогестерону перед пологами також знижується. Проте цей спад не виникає у приматів. У людини продукування плацентою КтРГ збільшується в термін пологів, і КтРГ може підвищувати секрецію ДГЕАС шляхом безпосередньої дії на надниркові залози плоду. Збільшення ДГЕАС, відповідно, спричинює зростання рівня естрогенів у крові. Крім того, як плацентарний, так і гіпоталамічний КтРГ плоду збільшують виділення плодом АКТГ, а отже, й кортизолу, посилюючи дисфункцію дихальної системи плоду.
Кількість рецепторів до окситоцину у міометрії і децидуальній оболонці (ендометрій у разі вагітності) збільшується майже у 100 разів під час вагітності і досягає максимального значення на початку пологів. Естрогени збільшують кількість рецепторів до окситоцину; розтягнення матки наприкінці вагітності теж може посилювати їхнє утворення. На початку пологів концентрація окситоцину у плазмі матері не відрізняється від допологового рівня, що становить близько 25 пкг/мл. Можливо, що помітне збільшення рецепторів до окситоцину зумовлює реагування матки на нормальну концентрацію окситоцину у плазмі. Проте принаймні у щурів кількість мРНК окситоцину в матці збільшується, досягаючи максимального рівня під час пологів; це означає, що утворений локально окситоцин також бере участь у процесі. Коли починаються пологи, скорочення матки розширюють шийку, а це, відповідно, передає сигнали аферентними нервами, що збільшує виділення окситоцину (рис. 23-41). Рівень окситоцину у плазмі підвищується, тому більша кількість окситоцину діє на матку. Отже, налагоджується позитивний зворотний зв’язок, що сприяє пологам і закінчується видаленням продуктів запліднення. Окситоцин збільшує маткові скорочення двома шляхами: він безпосередньо впливає на клітини гладкої мускулатури матки, зумовлюючи їхнє скорочення; стимулює утворення простагландинів у децидуальній оболонці. Простагландини посилюють скорочення, зумовлені дією окситоцину.
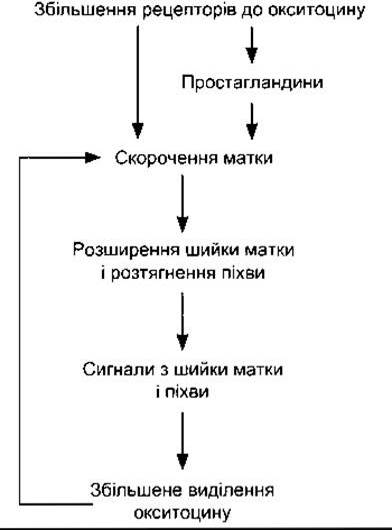
Рис. 23-41. Роль окситоцину під час пологів.
Під час пологів задіяні також спінальні рефлекси і самовільні скорочення м’язів передньої черевної стінки (потуги). Проте пологи можливі і без потуг чи рефлекторного збільшення виділень окситоцину з передньої частки гіпофіза, оскільки жінки із параплегією мали пологи і народжували.