Фізіологія людини - Вільям Ф. Ґанонґ 2002
Ендокринна система, метаболізм і репродуктивна функція
Ендокринна функція нирок, серця та епіфіза
Ренін-ангіотензинова система
Ренін
Відомо, що у разі парентерального введення екстрактів ниркової тканини підвищується артеріальний тиск. Це відбувається завдяки реніну - ензиму з групи кислих протеаз, що його секретують нирки безпосередньо у кров. Ренін діє у комплексі з ангіотензиноперетворювальним ензимом, утворюючи ангіотензин II (рис. 24-1). Ангіотензин II - це глікопротеїн, молекулярна маса якого у людини становить 37 326. Його молекула складається з двох часток, або доменів, у глибокій щілині між якими розміщений активний центр. В активному центрі суміщені два залишки аспарагінової кислоти; один у 104 позиції, інший у 292 (номери залишків амінокислот у препрореніні людини). Вони відіграють важливу роль в активності цього ензиму. Отже, ренін належить до аспартилових протеаз.
Подібно до інших гормонів, ренін синтезується у вигляді великого препрогормону. Препроренін людини містить 406 амінокислотних залишків. Проренін, що утворюється внаслідок від’єднання від препрореніну початкової послідовності з 23 амінокислот, містить 383 амінокислотні залишки. Відповідно, після від’єднання від прореніну так званої пропослідовності амінокислот формується активний ренін, що містить 340 амінокислотних залишків. Біологічної активності проренін практично не має. Деяка його кількість перетворюється в нирках у ренін, а решта - секретується. Проренін секретують також інші органи, зокрема яєчники. Після нефректомії рівень прореніну у крові, що циркулює, знижується незначно і може, фактично, навіть підвищитися, однак рівень активного реніну знижується практично до нуля. Отже, лише дуже незначна кількість прореніну в крові перетворюється у ренін, а активний ренін є продуктом переважно, якщо не винятково, нирок. Проренін секретується в багатьох тканинах організму, тоді як активний ренін утворюється переважно в секреторних гранулах юкстагломерулярних клітин (див. нижче).
Період напівжиття активного реніну в крові, що циркулює, становить до 80 хв. Єдиною відомою сьогодні його функцією є відщеплення ангіотензину І від амінового кінця декапептиду ангіотензиногену (субстрату реніну).
Ангіотензиноген
Ангіотензиноген, що циркулює, виявлено в а2-фракції глобулінів плазми (див. рис. 24-1). Він містить близько 13% вуглеводів і складається з 453 амінокислотних залишків; синтезується в печінці з сигнальною послідовністю із 32 амінокислотних залишків, яка відокремлюється в ендоплазматичній сітці. Глюкокортикоїди, тиреоїдні гормони, естрогени, деякі цитокіни й ангіотензин II підвищують його рівень у крові, що циркулює.
Ангіотензиноперетворювальний ензим і ангіотензин II
Ангіотензиноперетворювальний ензим (АПЕ) - це дипептидилкарбоксипептидаза, яка відщеплює гістидин-лейцин від фізіологічно неактивного ангіотензину І, утворюючи октапептид ангіотензин II (рис. 24-2). Той самий ензим інактивує брадикінін (див. Розділ 31). Більша частина перетворювального ензиму, що утворює ангіотензин II у крові, міститься в ендотеліальних клітинах. Перетворення відбувається головно під час проходження крові через легені, однак також і в багатьох інших ділянках організму.
АПЕ - це ектоензим, у якому наявні дві форми - соматична, що є по всьому організму, і термінальна, що міститься лише в постмейотичних сперматогенних тканинах і сперматозоїдах (див. Розділ 23). Обидві форми АПЕ мають єдиний трансмембранний домен і короткий цитоплазматичний «хвіст». Однак соматичний АПЕ є білком з молекулярною масою 170 кДа і двома гомологічними позаклітинними доменами, кожен з яких містить активний центр (рис. 24-3). Термінальний АПЕ має молекулярну масу 90 кДа, лише один позаклітинний домен і один активний центр. Обидва ензими утворюються з одного гена. Однак цей ген має два різні промоутери, які утворюють дві різні мРНК. У мишей чоловічої статі з вилученим геном АПЕ артеріальний тиск нижчий від нормального, а в таких же мишей жіночої статі він нормальний. Крім того, у мишей чоловічої статі в цьому разі знижується плідність, чого не простежується у мишей жіночої статі.
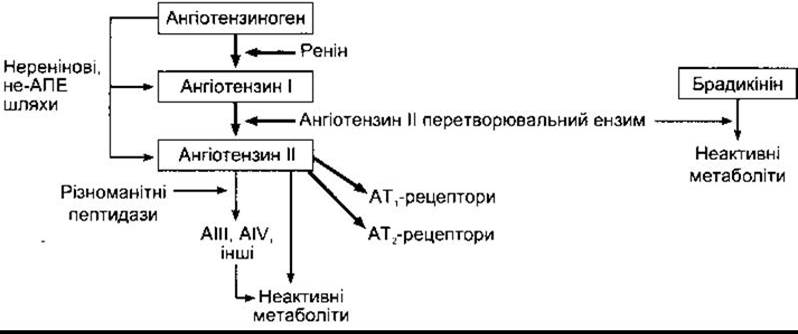
Рис. 24-1. Утворення і метаболізм ангіотензинів, що циркулюють у крові.
Метаболізм ангіотензину II
Ангіотензин II метаболізує швидко, період його напівжиття в крові людини становить 1-2 хв. Його розщеплюють різноманітні пептидази. Амінопептидаза відщеплює залишок аспарагіну від амінового кінця пептиду. Гептапептид, що утворюється внаслідок цього, має фізіологічну активність; деколи його називають ангіотензином III (див. нижче). Відщеплення другої кінцевої амінокислоти від ангіотензину III приводить до утворення гексапептиду - ангіотензину IV, якому, ймовірно, також притаманна деяка активність. Більшість інших пептидних фрагментів неактивна. Крім того, амінопептидаза може впливати на ангіотензин І, унаслідок чого утворюється (des-Asp1)-aнгioтензин І, здатний перетворюватись безпосередньо в ангіотензин III під впливом АПЕ. Здатність метаболізувати ангіотензин мають еритроцити та інші тканини організму. Вилучення ангіотензину II з кровообігу відбувається, ймовірно, за допомогою деякого механізму захоплення, який діє в капілярних ложах різних тканин (за винятком легень).
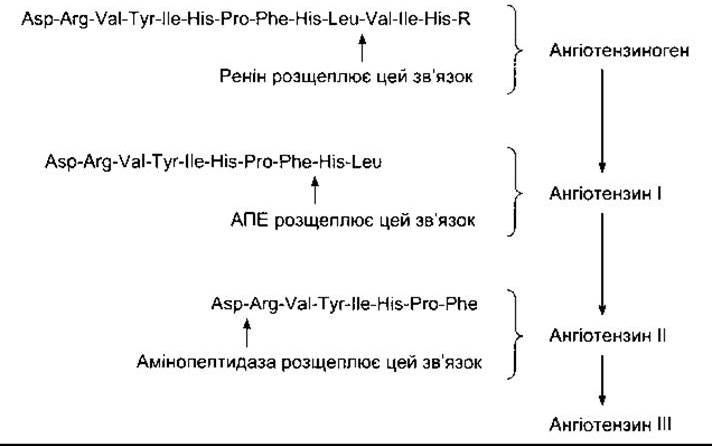
Рис. 24-2. Структура амінного кінця ангіотензиногену й ангіотензинів I, II та III у людини; R - залишок білка. Після відщеплення лідерної послідовності з 24 амінокислот ангіотензиноген містить 453 амінокислотні залишки. Структура ангіотензину II у собак, щурів та багатьох інших ссавців ідентична до структури у людини. Ангіотензин II у корів і овець у 5-й позиції замість ізолейцину містить валін.
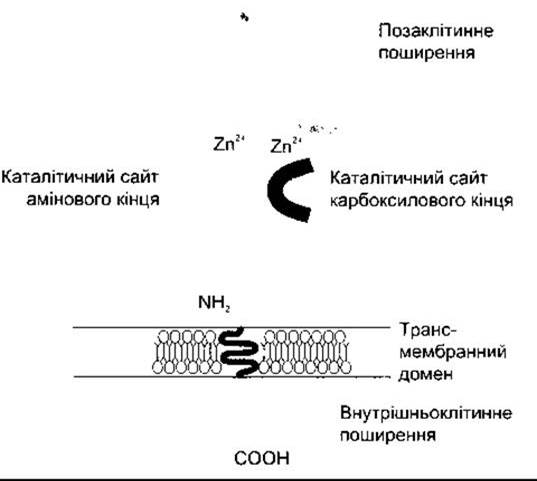
Рис. 24-3. Схематичне зображення структури соматичної форми ангіотензиноперетворювального ензиму. Зверніть увагу на короткий ендоплазматичний «хвіст» молекули та два позаклітинні каталітичні сайти, кожен з яких зв’язується з йоном цинку (Zn2+) (Відтворено за дозволом з Johnston СІ: Tissue angiotensin-converting enzyme in cardiac and vascular hypertrophy, repair and remodeling. Hypertension 1994;23 258)
Рівень реніну, як звичайно, вимірюють шляхом інкубації зразка, який піддають аналізу, і визначенням за допомогою імунохімічного аналізу кількості утвореного ангіотензину І. Таким способом визначають ренінову активність плазми (РАП) зразка. РАП може знижуватись не лише зі зменшенням кількості реніну, а й у разі дефіциту ангіотензиногену, що може призвести до неправильної інтерпретації результатів дослідження. Щоб уникнути цього, до зразка часто додають екзогенний ангіотензиноген; у цьому випадку визначають концентрацію реніну в плазмі (КРП), а не РАП. В осіб, що одержують з їжею нормальну кількість натрію, нормальне значення РАП у горизонтальному положенні становить близько 1 нг ангіотензину І на 1 мл зразка за 1 год. Концентрація ангіотензину II в плазмі крові у таких людей становить близько 25 пг/мл (близько 25 пмоль/л).
Дія ангіотензинів
Ангіотензин І діє винятково як попередник ангіотензину II і не має жодної іншої відомої сьогодні функції. Ангіотензин II, який попередньо називали гіпертензином, або ангіотоніном, зумовлює звуження артеріальних судин і підвищення систолічного і діастолічного тиску крові. Це один з найпотужніших відомих вазоконстрикторів, який у нормальних осіб виявляє у 4-8 разів більшу активність, ніж норадреналін. Однак його пресорна активність послаблюється в осіб з вираженою нестачею натрію і в хворих на цироз печінки та деякі інші захворювання. За цих станів рівень ангіотензину II в крові, що циркулює, підвищується, і за механізмом негативного зворотного зв’язку відбувається пригнічення ангіотензинових рецепторів у гладкій мускулатурі судинної стінки. Цим же пояснюють той факт, що ангіотензин II, уведений ззовні, зумовлює менш виражений ефект, ніж ендогенний.
Ангіотензин II діє безпосередньо на кору надниркових залоз, збільшуючи секрецію альдостерону. Отже, головною регулювальною ланкою секреції альдостерону є ренін- ангіотензинова система (див. Розділ 20). До додаткових ефектів ангіотензину II належать полегшене вивільнення норадреналіну шляхом прямої дії на постгангліонарні симпатичні нейрони, скорочення мезангіальних клітин, яке супроводжується значним зменшенням швидкості клубочкової фільтрації (див. Розділ 38), а також безпосередня дія на систему ниркових канальців, що спричинює збільшення реабсорбції натрію.
Крім того, ангіотензин II впливає на мозок, знижуючи поріг чутливості барорефлексу (див. Розділ 31), а це потенціює пресорний ефект ангіотензину II. Він також діє на мозок, посилюючи відчуття спраги (див. Розділ 14) і збільшуючи секрецію вазопресину і АКТГ. Ангіотензин II не проникає через гематоенцефалічний бар’єр, однак впливає, діючи на навколошлуночкові органи - чотири невеликого розміру структури, що містяться поза гематоенцефалічним бар’єром (див. Розділ 32). Одна з цих структур, так звана area postrema, відповідає передусім за потенціацію пресорного впливу, тоді як дві інші (субфорнікальний орган (СФО) і судинний орган кінцевої пластинки (СОКП)) - за збільшене відчуття спраги (дипсогенний ефект). Проте сьогодні не визначено, які з навколошлуночкових органів відповідають за підвищення секреції вазопресину й АКТГ.
Ангіотензин III [(des-Asp 1)-aнгіoтензин II] має лише близько 40% пресорної активності ангіотензину II, проте 100% його альдостероностимулювальної дії. Різні дослідники припускали, що ангіотензин III є природним альдостероностимулювальним пептидом, тоді як ангіотензин II регулює артеріальний тиск. Однак насправді ангіотензин III - це просто продукт розпаду з притаманною йому деякою біологічною активністю. Це ж стосується й ангіотензину IV, хоча деякі дослідники вважають, що він має деякий унікальний вплив на мозок.
Тканинні ренін-ангіотензинові системи
Крім системи, яка продукує ангіотензин II у крові, що циркулює, багато інших тканин містять незалежні ренін- ангіотензинові системи, які генерують ангіотензин II, напевно, для місцевої дії. Компоненти ренін-ангіотензинової системи містяться у стінці кровоносних судин, матці, плаценті та оболонках плоду. Високу концентрацію прореніну зафіксовано в амніотичній рідині. Крім того, ренін-ангіотензинова система або принаймні деякі її компоненти є в очних яблуках, екзокринній частині підшлункової залози, серці, жировій тканині, корі надниркових залоз, яєчках, яєчниках, передній та середній частках гіпофіза, епіфізі та мозку. Функції цих тканинних ренін-ангіотензинових систем ще не з’ясовані, хоча з’являється щораз більше доказів того, що ангіотензин II - це один з вирішальних факторів росту серцевої тканини і кровоносних судин. Тканинний ренін потрапляє у кровообіг лише у мізерних кількостях, тому після двобічного видалення нирок активність реніну плазми знижується до рівня, який сучасними методами не виявляють.
Рецептори ангіотензину II
Є принаймні два класи рецепторів ангіотензину II (див. рис. 24-1). Рецептори AT1 - це ангіотензинові рецептори плазунів, які за допомогою G-білка (білок Gq) з’єднуються з фосфоліпазою С, після чого ангіотензин II підвищує рівень вільного Са24 в цитозолі. Він також активує численні ензими групи тирозинових кіназ. У гладких м’язах судинної стінки АТ1-рецептори з’єднуються з ямками на поверхні клітини (див. Розділ 1); у цьому разі ангіотензин II збільшує утворення кавеоліну 1 - однієї з трьох ізоформ білка, який є специфічним для клітинних ямок. У гризунів є два відмінні, однак тісно пов’язані підтипи АТ1-АТ1А І AT1В, кодовані двома окремими генами. Підтип AT1А виявляють у стінках кровоносних судин, мозку і багатьох інших органах. Він є трансмітером більшої частини відомих ефектів ангіотензину II. Рецептор АТ1В виявляють у передній частці гіпофіза і в корі надниркових залоз. У людини ген AT1-рецептора є в 3-й хромосомі. Відомі докази наявності й другого типу AT1 -рецепторів, однак ще не вирішено, чи у людини справді є такі ж окремі підтипи ангіотензинових рецепторів, як AT1А і AT1В.
Наявні також АТ2-рецептори, які у людини кодовані геном, що розташований в Х-хромосомі. Як і AT1 -рецептори, вони мають сім трансмембранних доменів, однак виконують цілком інші функції: діють через G-білок, активуючи різноманітні фосфатази, які, відповідно, діють як антагоністи факторів росту і відкривають IC-канали. Крім цього, активування АТ2-рецепторів збільшує утворення NО і, отже, підвищує внутрішньоклітинний вміст цГМФ. Загальні фізіологічні наслідки цих вторинних месенджерних ефектів сьогодні ще нез’ясовані. У плоду і новонародженого є значно більше АТ2-рецепторів, проте їх виявлено й у дорослих - у мозку та в деяких інших органах.
Регулювання AT1 -рецепторів в артеріолах і AT1 -рецепторів у корі надниркових залоз відбувається протилежним способом: надлишок ангіотензину II впливає на судинні рецептори за механізмом негативного зворотного зв’язку, однак на рецептори в корі надниркових залоз - за механізмом позитивного зворотного зв’язку, що робить цю залозу чутливішою до альдостероностимулювальних ефектів цього пептиду.
Юкстагломерулярний апарат
Ренін, що міститься в екстрактах нирки і судинному руслі, продукують юкстагломерулярні клітини (ЮГ-клітини). Ці епітеліальні клітини розташовані між аферентних артеріол у місці їхнього входження в клубочок (рис. 24-4). Вони містять секреторні пухирці, які є резервуаром реніну. Ренін також виявляють в аґранулярних клітинах, які заповнюють ділянку з’єднання між аферентними та еферентними артеріолами, однак його функція в цьому місці невідома.
У проміжку, де аферентна артеріола входить у клубочок, а еферентна покидає його, канадець нефрону дотикається до артеріол клубочка, з якого походить. У цьому місці, яке позначає початок дистального покрученого канальця, є ділянка зміненого канальцевого епітелію, яку називають щільною плямою (див. рис. 24-4). Щільна пляма розміщена в безпосередній близькості до ЮГ-клітин. Мезангіальні, ЮГ-клітини, і щільна пляма утворюють юкстагломерулярний апарат.
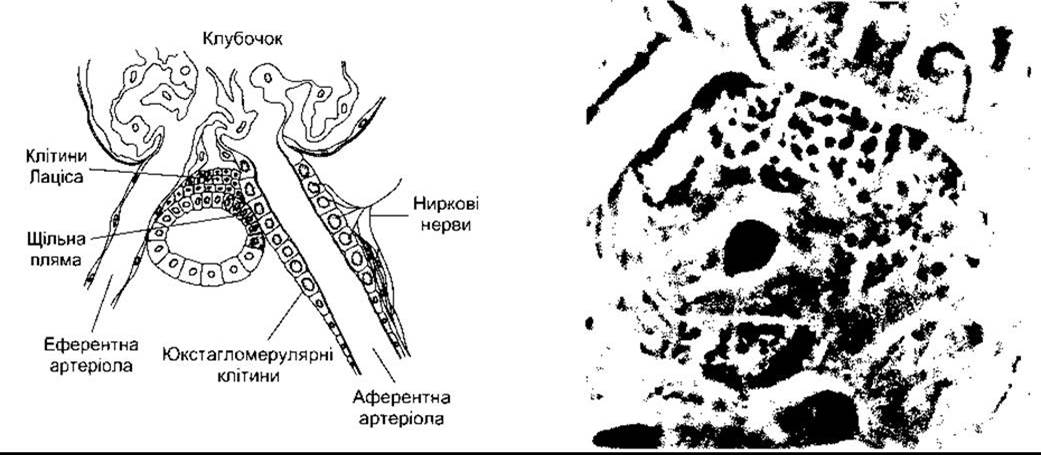
Рис. 24-4. Ліворуч: схематичне зображення клубочка з юкстагломерулярним апаратом. Праворуч: фазова контрастна мікроскопія аферентної артеріоли у незабарвленому замороженому препараті нирки миші. Зверніть увагу на еритроцит у просвіті артеріоли і ґранульовані юкстагломерулярні клітини в стінці судини (з дозволу С Peil).
Регулювання секреції реніну
На секрецію реніну впливають багато різноманітних чинників (табл. 24-1), у будь-який момент часу вона залежить від сумарної активності цих чинників. Одним з важливих чинників є внутрішньонирковий барорецепторний механізм, що зменшує секрецію реніну у випадку, коли тиск в артеріолах на рівні ЮГ-клітин підвищується, і збільшує її, коли він знижується. Іншим сенсорним механізмом регулювання секреції реніну є щільна пляма: рівень секреції реніну обернено пропорційний до швидкості транспортування Na+ і Сl через цю ділянку канальця. Швидкість транспортування залежить не лише від активності щільної плями, а й від кількості електролітів, що досягають її. Отже, зменшене надходження Na+ і Сl- до дистальних канальців пов’язане зі збільшенням секреції реніну. Простагландини, особливо простациклін (див. Розділ 17), стимулюють секрецію реніну, очевидно, безпосередньо впливаючи на ЮГ-клітини. Є деякі докази того, що трансмітер, через який клітини щільної плями впливають на секрецію реніну, - це NO (див. Розділ 31). Рівень секреції реніну зворотно залежить від концентрації К+ в плазмі крові, однак вплив К+, ймовірно, опосередкований змінами надходження Na+ і Сl до клітин щільної плями.
Ангіотензин II за механізмом зворотного зв’язку пригнічує секрецію реніну шляхом прямої дії на ЮГ-клітини. Вазопресин також пригнічує секрецію реніну in vitro і in vivo, хоча досі нез’ясовано, є його ефект in vivo прямим чи опосередкованим.
Нарешті, посилення активності симпатичної нервової системи також підвищує секрецію реніну. Цей ефект пов’язаний зі збільшенням концентрації катехоламінів у крові і впливом норадреналіну, секретованого постгангліонарними симпатичними нервами нирки. Катехоламіни діють найбільше на ß1-адренергічні рецептори ЮГ-клітин. Зростання внутрішньоклітинної концентрації збільшує секрецію реніну.
Головні стани, що супроводжуються збільшенням секреції реніну у людини, наведені в табл. 24-2. У більшості випадків центральний венозний тиск знижується і це призводить до збільшення симпатичної активності, що потенційно може призвести до зниження тиску в ниркових артеріолах. Звуження ниркової артерії й аорти в ділянці прокси- мальніше до ниркових артерій призводить до зниження тиску в ниркових артеріолах. Психологічні подразники збільшують активність ниркових нервів.
Таблиця 24-1. Чинники, що впливають на секрецію реніну

Фармакологічний вплив на ренін- ангіотензинову систему
Сьогодні вплив реніну можна пригнічувати багатьма різними способами. Інгібітори синтезу простагландинів, такі як індометацин і ß-адреноблокатори (пропранолол), можуть знижувати секрецію реніну.
Пептид пепстатин і нещодавно розроблені інгібітори реніну, наприклад, препарат еналкірен, перешкоджають реніну утворювати ангіотензин І. Інгібітори ангіотензиноперетворювального ензиму, такі як каптоприл і еналаприл, попереджають перетворення ангіотензину І в ангіотензин II. Саралазин і деякі інші аналоги ангіотензину II є конкурувальними інгібіторами дії ангіотензину II як на АТ1-, так і на АТ2 -рецептори. Лозартан (DuP-753) селективно блокує AT1 -рецептори, a PD-123177 та деякі інші медикаментозні середники селективно блокують АТ2-рецептори.
Роль реніну в розвитку артеріальної гіпертензії
Звуження однієї ниркової артерії зумовлює раптове збільшення секреції реніну і розвиток стабільної гіпертензії (ниркова гіпертензія, або гіпертензія Ґольдблатта). Видалення ішемізованої нирки або усунення артеріальної обструкції усуває гіпертензію, якщо вона не була тривалою. Загалом гіпертензія, спричинена обструкцією однієї ниркової артерії в разі інтактної іншої нирки (див. табл. 33-5), супроводжується збільшенням концентрації реніну в крові, що циркулює. Клінічним відповідником цього стану є ниркова гіпертензія внаслідок атеросклеротичного ураження ниркової артерії та інші аномалії ниркового кровообігу. Однак активність реніну плазми за однобічної оклюзії, як звичайно, є в межах норми.
Причини гіпертензії за цих обставин невідомі. У багатьох пацієнтів, що страждають на гіпертонічну хворобу, інгібітори АПЕ і лозартан дають добрий гіпотензивний ефект навіть тоді, коли нирковий кровоплин нормальний, а активність реніну плазми нормальна або навіть знижена.
Роль реніну в механізмі зворотного зв’язку, що допомагає підтримувати сталість об’єму позаклітинної рідини шляхом регулювання секреції альдостерону, описана в Розділі 20. Високий рівень секреції реніну відповідає за посилення секреції альдостерону (вторинний гіперальдостеронізм), що простежується у деяких нормотензивних пацієнтів з цирозом печінки і нефрозом.
Таблиця 24-2. Стани, у яких збільшується секреція реніну
