Фізіологія людини - Вільям Ф. Ґанонґ 2002
Кровообіг
Нагнітальна функція серця
Хвилинний об'єм крові
Методи вимірювання
В експериментах з тваринами хвилинний об’єм крові можна виміряти за допомогою накладання електромагнітного давача на висхідну частину аорти. У людей для вимірювання хвилинного об’єму, крім комбінації доплерографії з ехокардіографією, можна застосувати прямий метод Фіка і метод розведення.
Таблиця 29-2. Шуми серця
Клапан |
Порушення |
Час появи шуму |
Аортальний або легеневий |
Стеноз АВ-отвору |
Систолічний |
Недостатність |
Діастолічний |
|
Митральний або тристулковий |
Стеноз АВ-отвору |
Діастолічний |
Недостатність |
Систолічний |
Згідно із принципом Фіка, кількість речовини, яку поглинає орган (або весь організм) за одиницю часу, дорівнює різниці між артеріальним і венозним рівнем (А-В різниці), помноженій на плин крові. Звичайно, цей принцип можна застосувати лише у випадках, коли артеріальна кров - єдине джерело поглинальної речовини. Його також доцільно використовувати для визначення хвилинного об’єму шляхом вимірювання кількості О2, яку споживає організм за заданий проміжок часу, поділеної на A-В різницю в легенях. Оскільки системна артеріальна кров має однаковий рівень О2 у всіх ділянках тіла, то артеріальний вміст О2 можна виміряти у крові із будь-якої доступної артерії. Венозну кров із легеневої артерії отримують за допомогою серцевого катетера. Раніше з цією метою використовували кров із правого передсердя. Проте у цьому разі недостатнє змішування крові може давати похибку, і взятий взірець не буде показовим для всього організму. Наведемо приклад розрахунку хвилинного об’єму з використанням середніх показників:

Сьогодні звичною стала процедура введення довгого катетера через вену передпліччя в серце за допомогою флюороскопа. Цей метод розробив Фореман, який вводив катетер особисто собі. Однак після того, як Форсман спробував отримати дозвіл на випробування цього методу в інших людей з діагностичною метою, його звільнили з роботи. Тепер з’ясовано, що ця процедура безпечна. Катетери можна вводити не тільки в праве передсердя, а й через передсердя і правий шлуночок у малі (дрібні) гілки легеневої артерії, а також через периферійні артерії в ретроградному напрямі в серце та коронарні й інші артерії. Метод розведення полягає в тому, що відому кількість речовини, наприклад, барвника або частіше радіоактивного ізотопу, вводять у плечову вену, після чого визначають концентрацію речовини у серії зразків артеріальної крові. Хвилинний об’єм дорівнює кількості введеного індикатора, поділеній на середню концентрацію в артеріальній крові після одного проходження через серце (рис. 29-4). Звичайно, що індикатором повинна бути речовина, яка протягом дослідження перебуває в крові і не спричинює небажаних гемодинамічних ефектів. На практиці будують графік залежності логарифма концентрації індикатора в серії зразків артеріальної крові від часу. Концентрація збільшується, зменшується і знову збільшується внаслідок рециркуляції індикатора. Початкове зниження концентрації, лінійне на напівлогарифмічному графіку, екстраполюють на вісь абсцис, отримуючи час першого проходження індикатора через кровообіг. Розраховують серцевий викид за цей проміжок часу (див. рис. 29-4), а потім на його підставі обчислюють серцевий викид за хвилину (хвилинний об’єм).
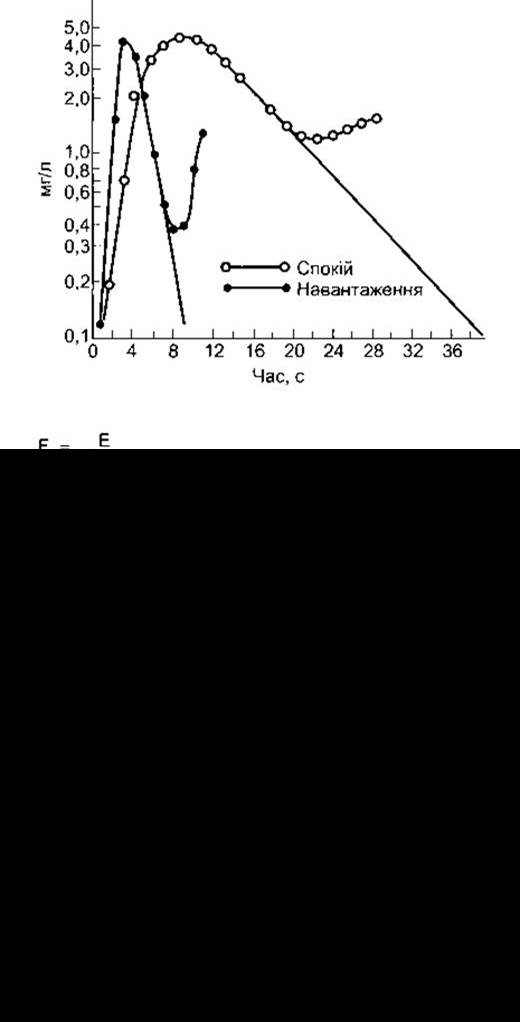
Рис. 29-4. Визначення хвилинного об’єму методом розведення індикатора (барвника).
Поширеним методом розведення є метод термодилюції, під час якого як індикатор застосовують охолоджений ізотонічний розчин. Цей розчин вводять у праве передсердя через один кінець катетера з двома просвітами. Одночасно записують зміни температури крові у легеневій артерії за допомогою термістора на другому, довшому боці катетера. Зміна температури є обернено пропорційною до кількості крові, що проходить через легеневу артерію, тобто рівня розведення охолодженого ізотонічного розчину кров’ю. Цей метод має дві важливі переваги: по-перше, ізотонічний розчин зовсім нешкідливий; по-друге, холод поширюється в тканинах і тому не виникає проблем, пов’язаних з рециркуляцією, отже, вимірювання можна повторювати.
Хвилинний об’єм можна також вимірювати за допомогою комбінації метода Доплера й ехокардіографії (див. вище).
Хвилинний об’єм залежно від різних умов
Кількість крові, яку викидає кожен шлуночок за одне скорочення, називають ударним об’ємом. Ударний об’єм становить приблизно 70 мл у людини із середньою масою тіла, що лежить у стані спокою (70 мл з лівого шлуночка і 70 мл з правого). Об’єм крові, що його викидає серце за одиницю часу, називають хвилинним об’ємом (серцевим викидом). У стані спокою в лежачому положенні він становить приблизно 5,0 л/хв (70 мл х 72 уд/хв). Є залежність між серцевим викидом і площею поверхні тіла. Хвилинний об’єм на квадратний метр площі тіла (серцевий індекс) становить приблизно 3,2 л. Вплив різноманітних факторів на серцевий викид схарактеризовано в табл. 29-3.
Фактори, що контролюють хвилинний об’єм
Зміни хвилинного об’єму можуть бути зумовлені змінами частоти серцевих скорочень або ударного об’єму (рис. 29-5). Частота серцевих скорочень контрольована передусім нервовою системою. Стимулювання симпатичного відділу збільшує частоту серцевих скорочень, а парасимпатичного - зменшує (див. Розділ 28). Ударний об’єм теж частково залежить від впливу нервової системи. Симпатичне стимулювання змушує м’язові волокна скорочуватися з більшою силою за будь-якої довжини. Парасимпатичне стимулювання спричинює протилежний ефект. Якщо сила скорочення збільшується без збільшення довжини волокон, то більше крові викидається зі шлуночків; тобто збільшується фракція викидання і зменшується кінцевосистолічний об’єм. Вплив катехоламінів, що їх виділяють симпатичні нерви, на частоту серцевих скорочень називають хронотропною дією, а їхній вплив на силу серцевого скорочення - інотропною дією. Фактори, які збільшують силу серцевого скорочення, характеризують як позитивні інотропні, а фактори, що її зменшують, - як негативні інотропні.
Таблиця 29-3. Вплив різноманітних факторів на хвилинний об’єм
Умова або фактор1 |
|
Без змін |
Сон Помірні зміни температури довкілля |
Збільшення |
Тривога і збудження (50-100%) Приймання їжі (30%) Фізичні вправи ( до 700%) Висока температура довкілля Вагітність Адреналін |
Зменшення |
Перехід від лежання до сидіння або стояння (20-30%) Тахіаритмії Захворювання серця |
1 У дужках наведено наближений відсоток зміни.
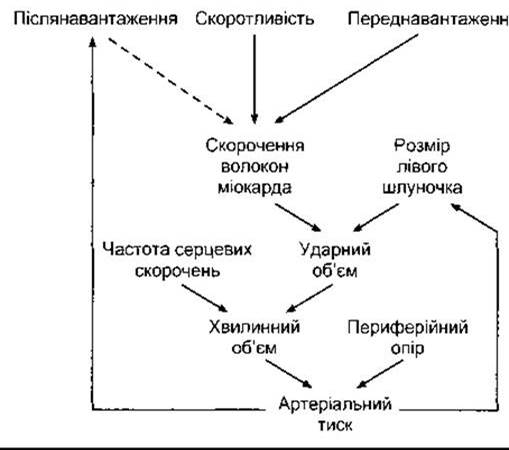
Рис. 29-5. Взаємодія факторів, які регулюють хвилинний об’єм крові й артеріальний тиск. Суцільна лінія означає збільшення, штрихова - зменшення.
Сила скорочення серцевого м’яза залежить від перед- і післянавантаження. Дія цих факторів показана на рис. 29- 6, де стрічку м’яза розтягують за допомогою вантажу (переднавантаження), який лежить на площині. Початкова фаза скорочення є ізоволюметричною; еластичний компонент і скоротливий елемент розтягуються, і напруженість збільшується до моменту, доки вона не буде достатньою, щоб підняти вантаж.
Напруженість, за якої вантаж піднімається, є післянавантаженням. Потім м’яз скорочується ізотонічно без підвищення напруженості. В умовах in vivo переднавантаження - це ступінь розтягування міокарда перед скороченням, післянавантаження - це опір, який потрібно подолати в разі викидання крові.
Залежність напруги від довжини волокон серцевого м’яза
Залежність між довжиною і напруженням м’язових волокон серця (див. рис. 3-16) подібна до залежності у скелетних м’язах (див. рис. 3-10). Зі скороченням м’яза напруженість збільшується, досягаючи максимального значення, однак у разі дуже сильного розтягування вона зменшується. Сгарлінґ звернув на це увагу, коли виявив, що енергія скорочення прямо пропорційна до початкової довжини м’язового волокна. Це положення відоме як закон Старлінґа, або закон Франка-Старлінґа.
У серці довжина м’язових волокон (тобто рівень переднавантаження) прямо пропорційна до кінцеводіастолічного об’єму. Залежність між ударним об’ємом шлуночків і кінцеводіастолічним об’ємом відображає крива Франка-Старлінґа.
Регулювання хвилинного об’єму завдяки зміні довжини м’язових волокон серця деколи називають гетерометричним регулюванням, а регулювання внаслідок зміни скоротливості незалежно від довжини волокон - гомометричним.
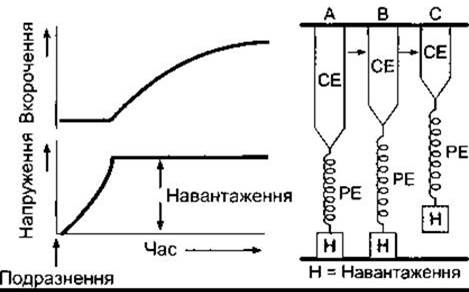
Рис. 29-6. Модель скорочення м’яза на фоні післянавантаження: А: спокій; В: часткове скорочення скоротливого елемента м’яза (СЕ) із розтягненням еластичного елемента (РЕ) без скорочення; С: повне скорочення зі скороченням (відтворено за дозволом з Sonnenblick EH in: The Myocardial Cell: Structyre, Function and Modification. Briller SA, Conn HL [editors]. Univ Pennsylvania Press, 1966).
Серцево-легеневий препарат
Те, до чого призводять зміни периферійного опору, можна продемонструвати на серцево-легеневому препараті. Анестезованій тварині, частіше собаці, вводять канюлі в аорту і порожнисту вену так, що кров з аорти через систему трубок і резервуар надходить у праве передсердя, а потім через серце тварини і легені - знову в аорту. Інші тканини організму тварини позбавлені кровопостачання, тому серце виявляється функційно денервованим, і частота серцевих скорочень практично не змінюється. Змінюючи калібр трубки, по якій відтікає кров, можна підвищувати опір (периферійний опір), який потрібно подолати серцю, штовхаючи кров. Якщо периферійний опір підвищується, то серце викидає менше крові, ніж у нього надійшло, протягом декількох ударів. Кров накопичується в шлуночках, і розмір серця збільшується. Розтягнуте серце скорочується з більшою силою, внаслідок чого хвилинний об’єм набуває початкового рівня.
На серцево-легеневому препараті можна простежити також вплив зміни венозного повернення. Коли резервуар, з якого кров надходить у праве передсердя, збільшують, то венозний тиск і венозне повернення підвищуються. М’язові волокна розтягуються, і це зумовлює збільшення хвилинного об’єму.
Фактори, які впливають на кінцеводіастолічний об’єм
Зміни систоли і діастоли по-різному впливають на функцію серця. Коли систолічне скорочення послаблюється, то відбувається зменшення хвилинного об’єму. Зміни діастоли теж впливають на ударний об’єм, однак іншим способом. Фактори, які в нормі регулюють кінцеводіастолічний об’єм, наведені в табл. 29-4. Підвищення внутрішньоперикардіального тиску обмежує ступінь наповнення шлуночків. Так само впливає зменшення еластичності міокарда внаслідок інфаркту міокарда, інфільтративних процесів та інших розладів. Скорочення передсердь сприяє наповненню шлуночків. Інші фактори впливають на кількість крові, що надходить до серця, а отже, опосередковано через діастолу діють на наповнення шлуночків. Збільшення об’єму крові, що циркулює, збільшує венозне повернення. Звуження вен спричинює зменшення венозної ємності, знижує депонування венозної крові і збільшує венозне повернення. Підвищення нормального негативного внутрішньо грудного тиску збільшує градієнт тиску, за яким кров надходить до серця, а зниження зменшує венозне повернення. У положенні стоячи кількість крові, що надходить до серця, зменшується, а м’язова активність, навпаки, збільшує венозне повернення завдяки нагнітальній дії скелетних м’язів.
Нарис. 29-7 зображено вплив систолічної і діастолічної дисфункції на співвідношення тиск-об’єм у лівому шлуночку.
Таблиця 29-4. Фактори, які в нормі збільшують або зменшують довжину м’язових волокон шлуночків

Скоротливість міокарда
Скоротливість міокарда суттєво впливає на ударний об’єм. У випадку стимулювання симпатичних нервів серця крива довжина-напруга зміщується догори і ліворуч (рис. 29-8). Позитивну інотропну дію норадреналіну, що його виділяють нервові закінчення, посилює норадреналін, що циркулює. Подібний ефект зумовлює й адреналін. Стимулювання блукаючих нервів спричинює негативний інотропний вплив на м’язи передсердя і незначний негативний інотропний ефект у м’язах шлуночків.
Зміни частоти серцевих скорочень і ритму також впливають на скоротливість міокарда (залежність сила-частота, див. рис. 29-8). У разі шлуночкових екстрасистол у міокарді кожне наступне скорочення є сильнішим, ніж попереднє нормальне. Постекстрасистолічне потенціювання не залежить від наповнення шлуночків, оскільки воно виникає в ізольованому серцевому м’язі і зумовлене підвищенням внутрішньоклітинної концентрації Са2+. Постійне зростання скоротливості можна спричинити, якщо подавати на серце подвійні електричні стимули так, що другий стимул надходить відразу після рефрактерного періоду, зумовленого першим імпульсом. Було з’ясовано також, що скоротливість міокарда збільшується з посиленням частоти серцевих скорочень, хоча цей ефект порівняно незначний. Катехоламіни спричинюють інотропний ефект, впливаючи на серцеві β1-адренорецептори та Gs з подальшим активуванням аденілатциклази і збільшенням внутрішньоклітинної концентрації цАМФ. Ксантини, такі як кофеїн і теофілін, пригнічують розпад цАМФ і зумовлюють позитивний інотропний ефект. Глюкагон, який посилює утворення цАМФ, рекомендують застосовувати у разі деяких захворювань серця. Позитивний інотропний ефект наперстянки і подібних речовин (див. рис. 29-8) зумовлений їхньою здатністю пригнічувати Na+-K+-ATФ-aзy міокарда. Інгібування ензиму спричинює збільшення внутрішньо- клітинної концентрації Na+, що, відповідно, призводить до збільшення концентрації Са2+ всередині клітини. Ключову роль Ca2+ у скороченні скелетного і серцевого м’яза описано в Розділі 3. Гіперкапнія, гіпоксія, ацидоз та ліки, такі як хінідин, новокаїнамід (прокаїнамід), барбітурати, послаблюють скоротливість міокарда. Скоротливість міокарда зменшується також у разі серцевої недостатності (внутрішнє пригнічення). Механізм цього пригнічення остаточно не з’ясований.
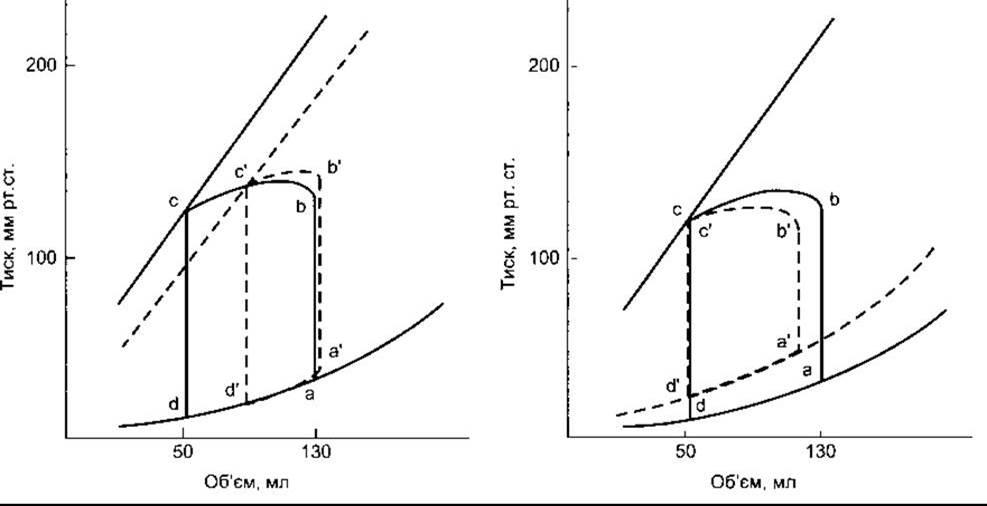
Рис. 29-7. Вплив систолічної і діастолічної дисфункції на петлю тиск-об’єм лівого шлуночка. Ліворуч: систолічна дисфункція спричинює зміщення кривої ізометричний тиск-об’єм (див. рис. 29-2) до правого боку, зменшуючи ударний об’єм з b-с до b'- с' Праворуч: діастолічна дисфункція зумовлює збільшення кінцеводіастолічного об’єму і зміщує криву діастолічний тиск- об’єм угору і до лівого боку. Це спричинює зменшення ударного об’єму з b-с до b'- с' (відтворено за дозволом з McPhee SJ et al [editors]: Pathophysiology of Disease, 3rd ed. McGraw-Hill, 2000).
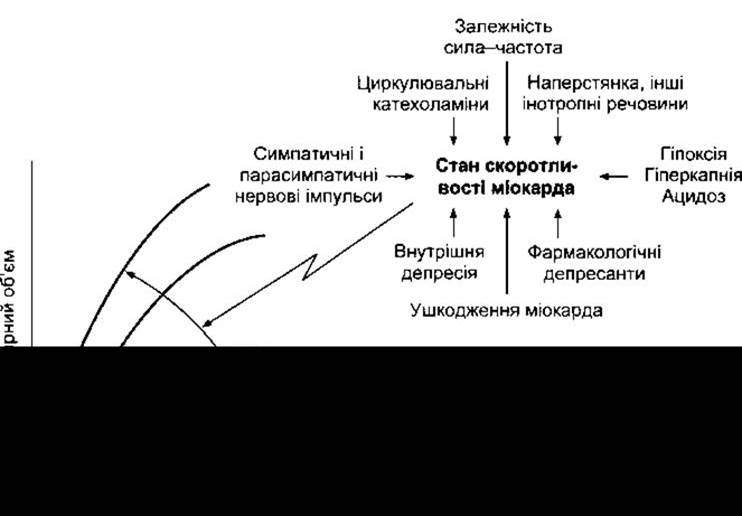
Рис. 29-8. Вплив скоротливості міокарда на криву Франка-Старлінґа. Крива зміщується вниз і праворуч зі зменшенням скоротливості. Головні фактори, що впливають на скоротливість, наведені праворуч. Штриховими лініями позначені ділянки кривої функції шлуночка, які відповідають перевищенню максимальної скоротливості міокарда, тобто це низхідні ділянки кривої Франка-Старлінґа; КДО - кінцеводіастолічний об’єм (відтворено за дозволом з Braunwald Е, Ross J, Sonnenblick EH: Mechanisms of contraction of the normal and failing heart. N Engl J Med 1967;277:794).
Інтегративне регулювання хвилинного об’єму
В інтактних тварин і людей описані вище механізми беруть участь в інтегративному регулюванні підтримки хвилинного об’єму. Під час роботи скелетних м’язів посилюється симпатична імпульсація, внаслідок чого скоротливість міокарда і частота серцевих скорочень збільшуються. Збільшення частоти серцевих скорочень особливо яскраво виражене у здорових людей, у цьому випадку простежується лише незначне збільшення ударного об’єму (табл. 29-5). Однак у хворих з трансплантованим серцем хвилинний об’єм за фізичного навантаження може збільшуватися без іннервації серця за допомогою механізму Франка-Старлінга (рис. 29-9). Цьому сприяють також катехоламіни, що циркулюють у крові. Збільшення хвилинного об’єму в таких хворих відбувається не так швидко, і максимальний ефект є слабшим, ніж у здорових людей, однак він суттєвий. Якщо венозне повернення збільшується, а тонус симпатичної нервової системи не змінюється, то венозний тиск підвищується, діастолічний приплив крові збільшується, шлуночковий кінцеводіастолічний тиск підвищується, і серцевий м’яз скорочується з більшою силою. За фізичного навантаження венозне повернення збільшується завдяки нагнітальній дії м’язів і посиленню дихання (див. Розділ 33). Крім того, внаслідок розширення судин у разі скорочення м’язів зменшується периферійний опір, а отже, і післянавантаження. В кінцевому підсумку і в здоровому, і у трансплантованому серці простежується швидке і виражене збільшення хвилинного об’єму. У нормі серце ніколи не розтягується так, щоб досягти «низхідної частини» кривої Франка-Старлінга (див. рис. 29-8), тобто стану, коли подальше розтягування призводить не до збільшення, а до зменшення ударного об’єму. Якщо це трапляється, то виникає зачароване коло, в якому подальше збільшення наповнень шлуночків зумовлює зменшення серцевого викиду, а це, відповідно, спричинює ще більше наповнення шлуночків.
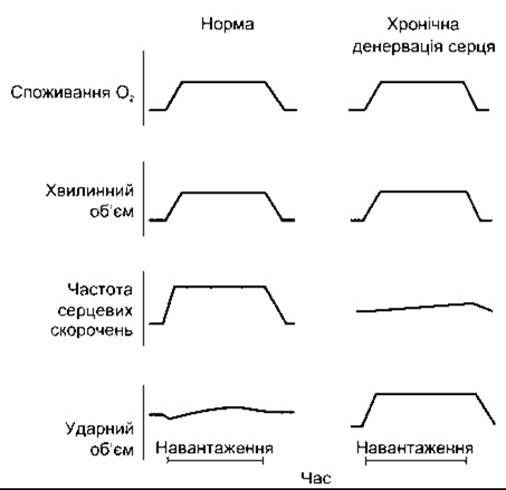
Рис. 29-9. Зміни функції серця у випадку помірного фізичного навантаження в лежачому стані у здорових людей і хворих з трансплантованим і, отже, денервованим серцем (відтворено за дозволом з Kent KM, Cooper Т: The denervated heart. N Engl J Med 1974;291*1071)
Одна з відмінностей між нетренованими людьми і спортсменами полягає в тому, що у спортсменів менша частота серцевих скорочень, більший кінцевосистолічний об’єм шлуночків і більший ударний об’єм у стані спокою. Тому, на відміну від нетренованих людей, спортсмени можуть досягти збільшення хвилинного об’єму завдяки збільшенню ударного об’єму без зростання частоти серцевих скорочень.
Споживання кисню серцем
Базальне споживання міокардом О2, яке можна визначити, зупинивши серце і підтримуючи коронарний кровообіг, становить приблизно 2 мл/100 г/хв. Це значення перевищує відповідний показник для скелетних м’язів у стані відпочинку. Споживання О2 серцем, яке скорочується, становить приблизно 9 мл/100 г/хв у стані відпочинку. Цей показник збільшується під час фізичного навантаження і в разі деяких станів. Напруженість О2 у венозній крові серця низька, і мало додаткового кисню може поглинатися з крові у вінцевих судинах. Тому для посиленого споживання О2 необхідно стимулювати вінцевий кровообіг. Регулювання вінцевого кровообігу описане у Розділі 32.
Таблиця 29-5. Зміни функції серця у разі фізичного навантаження. Зверніть увагу, що ударний об’єм досягає максимуму, однак потім за дуже високої' частоти скорочень дещо зменшується (внаслідок зменшення діастоли)1
Навантаження, кгм/хв |
Споживання О2, мл/хв |
Частота пульсу, ударів/хв |
Хвилинний об’єм, л/хв |
Ударний об’єм, мл |
Різниця A-В О2, мл/дп |
Спокій |
267 |
64 |
6,4 |
100 |
4,3 |
288 |
910 |
104 |
13,1 |
126 |
7,0 |
540 |
1430 |
122 |
15,2 |
125 |
9,4 |
900 |
2143 |
161 |
17,8 |
110 |
12,3 |
1260 |
3007 |
173 |
20,9 |
120 |
14,5 |
1 Відтворено за дозволом з Asmussen Е, Nielsen М: The cardiac output in rest and work determined by the acetylene and the dye injection methods. Acta Physiol Scand 1952;27:217
Споживання О2 міокардом передусім залежить від внутрішньоміокардіальної напруженості, скоротливості міокарда і частоти серцевих скорочень. Робота шлуночків за один удар корелює зі споживанням О2. Робота дорівнює добутку ударного об’єму і середнього артеріального тиску в легеневому стовбурі (для правого шлуночка) або аорті (для лівого шлуночка). Оскільки тиск в аорті у сім разів вищий, ніж у легеневому стовбурі, то робота лівого шлуночка приблизно в сім разів більша, ніж робота правого шлуночка. Теоретично збільшення ударного об’єму на 25% без змін артеріального тиску повинно спричиняти збільшене споживання О2 - таке, яке простежується в разі підвищення артеріального тиску на 25% без змін ударного об’єму. Однак з незрозумілих причин робота в разі підвищення тиску спричинює більше зростання споживання О2, ніж робота у випадку підвищення об’єму. Іншими словами, збільшення післянавантаження спричинює більше підвищення споживання О2 міокардом, ніж зростання переднавантаження. Цим пояснюють той факт, що стенокардія внаслідок недостатнього надходження О2 до міокарда частіше розвивається у випадку стенозу аорти, ніж за недостатності аортального клапана. У разі стенозу аорти внутрішньошлуночковий тиск повинен підвищуватися для проштовхування крові через звужений аортальний отвір, тоді як у разі аортальної недостатності регургітація крові зумовлює збільшення ударного об’єму без суттєвих змін опору.
Зазначимо, що зростання споживання О2, зумовлене збільшенням ударного об’єму, коли м’язові волокна розтягуються, є прикладом дії закону Лапласа. Згідно з цим законом, детально описаним у Розділі 30, напруженість, яка розвивається в стінці судин, прямо пропорційна до радіуса судини, і радіус розслабленого серця збільшується. Споживання О2 за одиницю часу збільшується в разі стимулювання симпатичної нервової системи, оскільки збільшується кількість ударів, а також швидкість і сила скорочення. Однак цьому протидіє зменшення кінцевосистолічного об’єму, а отже, і радіуса серця.