Фізіологія людини - Вільям Ф. Ґанонґ 2002
Вступ
Загальні засади та клітинні основи фізіології людини
Структура та функції ДНК і РНК
Геном
ДНК є в бактеріях, ядрах еукаріотичних клітин та мітохондріях. Вона складається з двох надзвичайно довгих нуклеотидних ланцюгів, що містять основи аденін (А), гуани (G), гимін (Т) га цитозин (С) (рис. 1-14). Хімічна структура цих пуринових та піримідинових основ описана в Розділі 17. Ланцюги зв’язані між собою водневим зв’язком між основами, причому аденін - з тиміном, а гуанін - з цитозином. Кінцева структура молекули у вигляді подвійної спіралі зображена на рис. 1-15. Доказом складності цієї молекули є те, що в гаплоїдному геномі людини (повний генетичний текст) ДНК налічує 3x109) пар основ.
ДНК є компонентом хромосом, у якому міститься генетична інформація про всі спадкові характеристики клітини та її попередників. Кожна хромосома містить сегмент подвійної спіралі ДНК. Генетична інформація закодована послідовністю пуринових та піримідинових основ у нуклеотидних ланцюгах. Зчитування генетичної інформації забезпечуване порядком, у якому амінокислоти розміщені в білках, створених клітиною. Інформація передається за допомогою РНК до рибосом, ділянок синтезу білків у цитоплазмі. РНК відрізняється від ДНК тим, що має одно- ниткову структуру, урацил замість тиміну, а її вуглеводним залишком є рибоза, а не 2'-дезоксиробоза (див. Розділ 17). Білки, утворені з матриці ДНК, містять усі ензими, які відповідно, контролюють метаболізм клітини. Ген визначають як обсяг інформації, необхідний для утворення однієї молекули білка. Однак білок, кодований одним геном, може пізніше розділитися на кілька білків з різною фізіологічною активністю. Гени також містять промотори, послідовності ДНК, що сприяють утворенню РНК. Мутації трапляються, коли послідовність основ у складі молекули ДНК змінюється під впливом рентгенівських чи космічних променів або інших мутагенних чинників. З’ясовано, що геном людини складений з 50 000-100 000 генів або з трьох мільярдів пар основ.
Поліморфізм ДНК
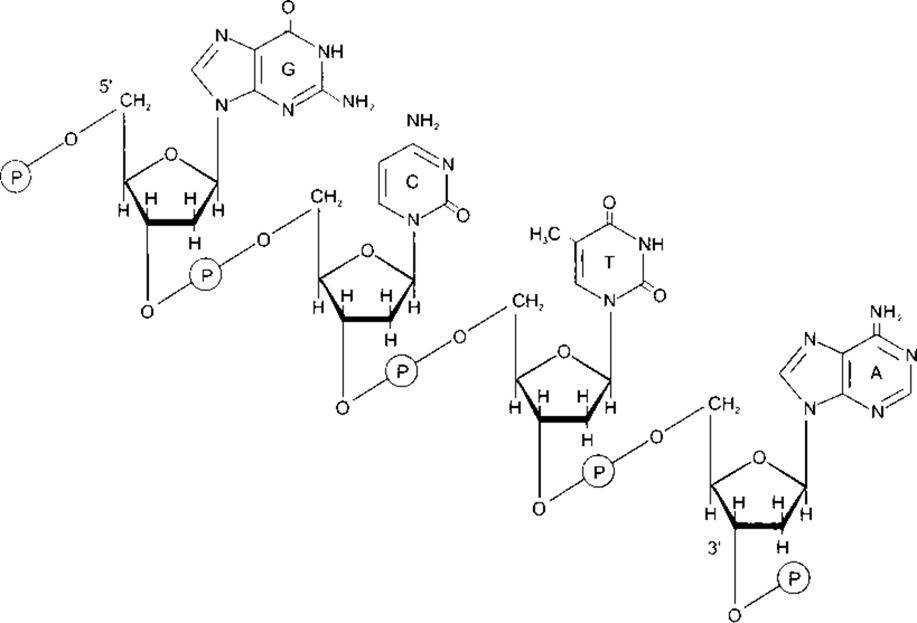
Рис. 1-14. Сегмент структури молекули ДНК, у якому пуринові та піримідинові основи аденін (А), тимін (Т), цитозин (С) та гуанін (G) зв’язані скелетом, утвореним фосфодіестерними мостиками між молекулами 2’-дезоксирибози, які прикріплені до нуклеотидних основ N-глікозидними зв’язками. Зверніть увагу на те, що скелет має полярність (5’ та 3’ напрями) (відтворено за дозволом з Murray RK et al Harper’s Biochemistry, 25th ed McGraw-Hill, 2000)
Білок-кодувальні гени (екзони) становлять лише 3% геному людини; решта 97% - це інтрони (див. нижче) та інші види ДНК, що мають невизначену чи невідому функції. Інколи ці 97% називають непотрібною ДНК. Характерна ознака ДНК людини - це її структурна різноманітність у різних людей. Більшість варіацій виникають у некодувальних ділянках, однак можуть траплятися і в кодувальних; вони бувають приховані або ж виражені як зміни у білку, які можна їдентифікувати. Переважно варіації виявляються як змінні повторювання пар основ (тандемних повторювань) від одного до сотень разів. Ця варіація змінює довжину ланцюга ДНК між точками, де його розщеплюють різні рестрикційні ензими. Отже, у фрагментах ДНК різних людей простежується поліморфізм довжин рестрикційних фрагментів (ПДРФ). Аналіз ПДРФ серед населення дає зразки, що є, по суті, характерною картою або фінґернринтом ДНК. Важливість визначення фінґерпринту ДНК було доведено за допомогою додаткових спеціалізованих методів. Імовірність отримання ідентичних зразків ДНК за умови використання цих методів у індивідів, що не є монозиготними близнюками, змінюється відповідно до кількості застосовуваних ензимів, родинних зв’язків осіб, а також інших факторів. З огляду на це, питання щодо того, які саме статистичні дані найбільше придатні для аналізу, гостро дебатували. Все ж імовірність збігу ПДРФ оцінювали в межах від 1 на 1 000 000 до 1 на 100 000. ПДРФ можна аналізував за зразками сперми, крові чи іншої тканини. Численні ж копії зразків ДНК отримують, використовуючи полімеразно-ланцюгову реакцію (ПЛР) - винахідливий метод копіювання ДНК. Фінгерпринтування ДНК має над звичайно важливе значення для розкриття злочинів та з’ясування батьківства, хоча для цього необхідно використовувати надійні і перевірені методи, а отримані результати тлумачити обережно. Аналіз ПДРФ також є цінним у випадку вивчення еволюції тварин та людини й ідентифікації хромосомного розміщення генів, що спричиняють спадкові хвороби.
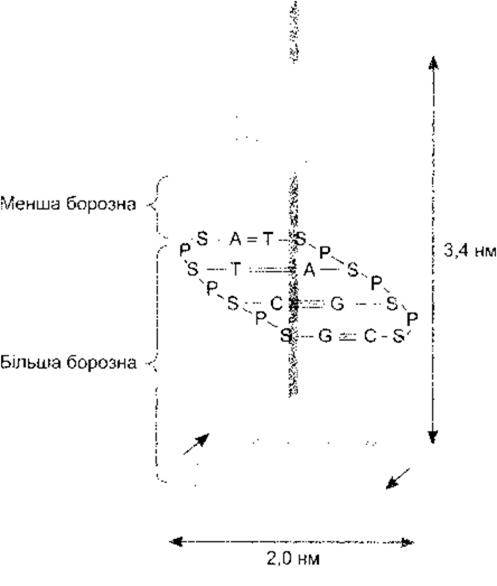
Рис. 1-15. Двоспіральна структура ДНК, де аденін (А) зв’язується з тиміном (Т), а цитозин (С) - з гуаніном (G) (відтворено за дозволом з Murray RK et al: Harper’s Biochemistry, 25th ed. McGraw-Hill, 2000).
Мітоз
Під час кожного соматичного поділу клітини (мітозу) два ланцюги ДНК роз’єднуються і кожен слугує матрицею для синтезу нового комплементарного ланцюга. Цю реакцію каталізує ДНК-полімераза. Перша з утворених подвійних спіралей потрапляє до однієї дочірньої клітини, а друга - до іншої, тому загальна кількість ДНК у кожній дочірній клітині є такою ж, як і в батьківській.
Теломерази
У процесі реплікації клітини задіяна не лише ДНК-полімераза, а також спеціальна зворотна транскриптаза, яка синтезує короткі повторення ДНК, що характеризують кінці хромосом (теломери). Клітини, у яких бракує транскриптази, яку ще називають теломеразою, поступово втрачає ДНК на геломерах, а це може призводити до припинення клітинного поділу з а їхнього старіння. З іншого боку, клітини, у тому числі більшість ракових, у яких теломераза виявляє високу активність, продовжують ділитися. Не дивує велика зацікавленість до механізму дії теломерази стосовно старіння та появи раку. Тепер уже зрозуміло, що механізм реплікації хромосомних кінців є комплексним, і потрібно провести додаткові дослідження для цілковитого з’ясування можливостей терапевтичного застосування.
Мейоз
У статевих клітин редукційний поділ (мейоз) відбувається впродовж їхнього дозрівання. Унаслідок цього одна з кожної пари хромосом опиняється в кожній статевій клітині; тому кожна зріла статева клітина містить половину від кількості хромосомного матеріалу, що міститься в соматичних клітинах. Відповідно, коли сперматозоїд зливається з яйцеклітиною, новоутворена зигота має повний набір ДНК, по половині від батьківської та материнської клітини. Те, що відбувається з хромосомами в процесі запліднення, детально описано в Розділі 23. Термін «плоїдність» інколи використовують, маючи на увазі кількість хромосом у клітині. Нормальні диплоїдні клітини в стані спокою є еуплоїдними, і стають тетраплоїдними саме перед поділом. Анеуплоїдія - це стан, у якому клітина містить збільшену чи зменшену кількість хромосом, не кратну гаплоїдному набору, такий стан типовий для ракових клітин.
Клітинний цикл
Очевидно, що мітоз та нормальний поділ ініційовані відповідно до послідовності подій, які прийнято називати клітинним циклом. Діаграму цих подій зображено на рис. 1-16. До біохімічних механізмів, що спричиняють мітоз, виявляють значний інтерес з огляду на зв’язок мітозу з раковими захворюваннями. Мітоз у клітинах ініціюють білки цикліни і циклінозалежпа протеїнкіназа, яка фосфорилює інші білки. Однак зазначимо, що регулювання клітинного циклу є складним процесом, ми його детально не аналізуватимемо.
Транскрипція та трансляція
Ланцюги подвійної спіралі ДНК не тільки реплікуються, а й завдяки вибудовуванню комплементарних основ слугують матрицею для утворення в ядрі матричної РНК (мРНК), транспортної РНК (тРНК), рибосомної РНК (рРНК) та ін. Утворення мРНК називають транскрипцією (рис. 1-17), його каталізують різноманітні РНК полімерази. Зазвичай, після посттранскрипційного процесингу (див. нижче) мРНК сприяє утворенню поліпептидного ланцюга - білка (трансляція). Цей процес відбувається в рибосомах: гРНК прикріплює амінокислоти до мРНК. Молекули мРНК менші, ніж молекули ДНК, і кожна є транскриптом маленького сегмента ланцюга ДНК. Молекула гРНК містить лише 70-80 азотистих основ (порівняйте з сотнями в мРНК та 3 мільярдами в ДНК).
Зазначимо, що ДНК відповідає за підтримання видів; вона передається від покоління в покоління в статевих клітинах. Натомість РНК відповідає за відтворення індивідуума; вона транскрибує інформацію, закодовану в ДНК, та формує смертну людину. Цей процес назвали «брунькування зародкової лінії від накопичених гаплоїдних клітин».
Гени
Обсяг інформації про структуру генів та їхнє регулювання накопичується зі значною швидкістю. Структура типового еукаріотичного гена зображена на рис. 1-18. Цей ген складається з ланцюга ДНК, що містить кодувальні та некодувальні ділянки. В еукаріот, на відміну від прокаріот, порції генів, що відповідають за утворення білків, як звичайно, розділені на кілька сегментів (екзонів) та відокремлені від сегментів, які не транслюються (інтрони). Пре-мРНК утворюється від ДНК, згодом у ядрі внаслідок посттранскрипційного процесингу відбувається елімінація інтронів та певної кількості екзонів. Отже, зріла мРНК, яка потрапляє до цитоплазми, складається з екзонів (рис. 1-19). Інтрони елімінують, а екзони внаслідок кількох різноманітних процесів з’єднуються. Елімінація інтронів деяких генів відбувається за допомогою сплайсингосом - утворень, що складаються з невеликих РНК та білків. Інші інтрони елімінують унаслідок самосплайсингу РНК, що спричинений двома різними механізмами. РНК може також каталізувати інші реакції, тому сьогодні каталітична активність РНК становить значний інтерес.
Завдяки наявності інтронів та сплайсингу з одного й того самого гена може утворюватися більше ніж одна мРНК. Відмінність між цими мРНК полягає у включенні різних екзонів. Інших фізіологічних функцій інтронів усе ще не виявлено, однак є ймовірність, що вони сприяють змінам у генетичній інформації і, відповідно, еволюції.
Біля сайту початку транскрипції міститься промотер, сайт на якому сполучається РНК-полімераза з власними кофакторами. Він часто включає ТАТА послідовність (ТАТА ділянка), яка забезпечує початок транскрипції в належному місці. Далі, на 5'-кінці розташовані регуляторні елементи, які охоплюють послідовності енхансерів та сайленсерів. З’ясовано, що в середньому на один ген припадає п’ять регуляторних сайтів. Регуляторні послідовності інколи бувають на 3'-кінці. Є докази, що послідовності в цьому кінці можуть також впливати на функції інших генів.
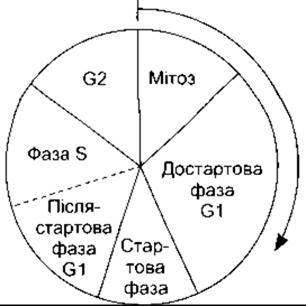
Рис. 1-16. Послідовність подій під час клітинного циклу.
Регулювання генної експресії
Кожна соматична клітина тіла містить повну генетичну інформацію, проте серед різноманітних видів дорослих клітин с значна диференціація та спеціалізація функцій і тільки траскрибування незначної частини інформації відбувається нормально. Отже, генетична інформація, як звичайно, перебуває в репресивному стані. Однак гени контрольовані як у просторі, так і у часі. Що ж задіює гени саме цієї клітини, а не інших? Що задіює гени в клітині саме на цій стадії розвитку, а не на інших невідповідних стадіях? Що підтримує впорядкований ріст кількості клітин і запобігає неконтрольованому росту, який називають раком? Звичайно ж послідовності ДНК, такі як ТАТА ділянка, сприяють правильному транскрибуванню гена, частиною якого вони є (цис-регулювання). Та все ж головний ключ селективної експресії гена - білки, які прикріплюються до регуляторних ділянок гена, посилюючи чи послаблюючи його активність. Ці фактори транскрипції є продуктами інших генів і тому діють як посередники у разі транс-регулювання. Вони надзвичайно численні й охоплюють активовані стероїдні гормональні рецептори та багато інших факторів. Стимулятори, такі як нейротрансмітери, що прикріплюються до клітинної мембрани, зазвичай, ініціюють хімічні дії, що активують гени негайного типу. Вони, відповідно, створюють фактори транскрипції, що діють в інших генах. Найліпше описані гени негайного типу c-fos і c-jun. Білки, створені цими генами - c-Fos, c-Jun і декілька споріднених - формують гомо- та гетеродимери, які прикріплюються до регуляторної послідовності ДНК, відомої як сайт АР-1 (рис. 1 -20). Одні димери посилюють транскрипцію, інші її послаблюють. Наявність c-Fos, c-Jun та деяких суміжних білків є загальною ознакою активації клітини, й імуноцитохімічні методи для них чи для вимірювання їхніх мРНК дають змогу визначити, які клітини в нервовій чи будь-якій іншій системі активовані певними стимуляторами.
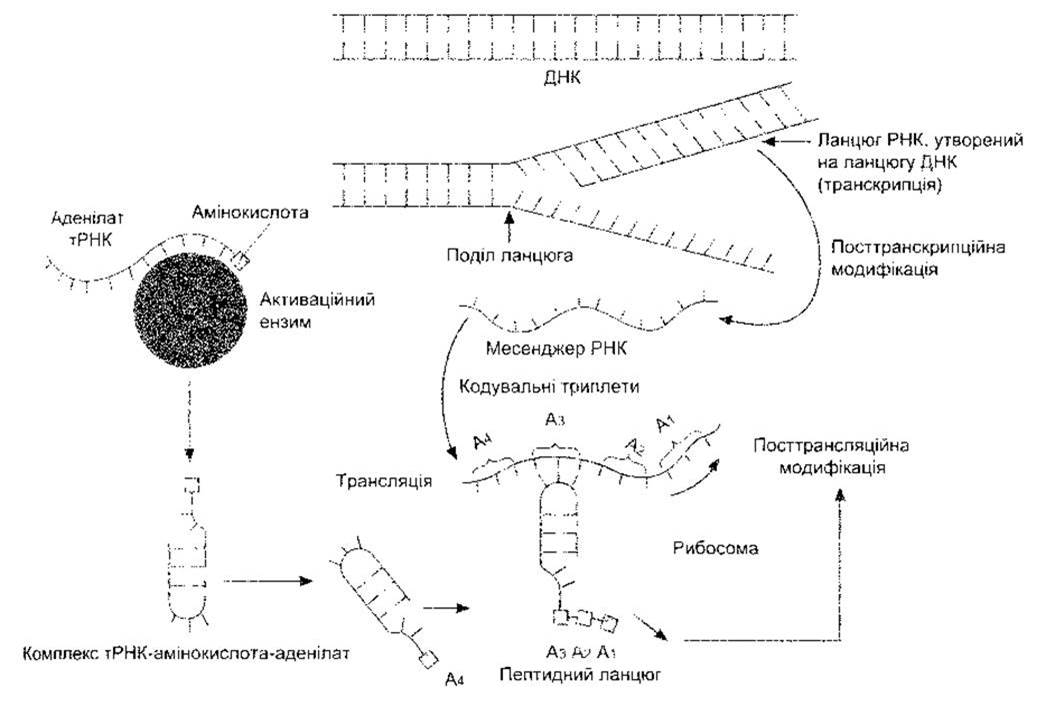
Рис. 1-17. Схематичне зображення синтезу білка Нуклеїнові кислоти показані у формі ліній з численними короткими виступами - окремими основами.
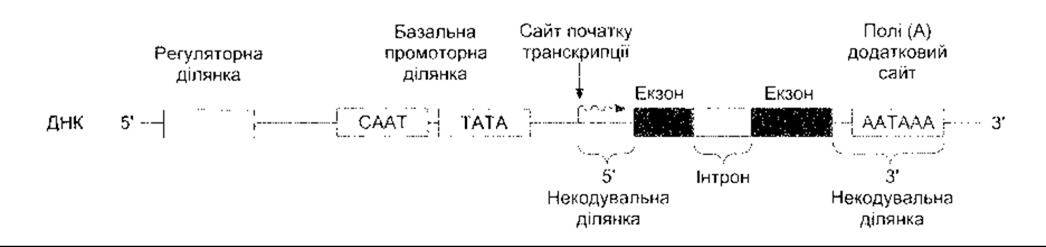
Рис. 1-18. Схематичне зображення компонентів типового еукаріотичного гена Кодувальна ділянка складається з інтронів та екзонів, по боках межує з некодувальними ділянками. Бокова 5’-ділянка містить фрагменти ДНК, що взаємодіють з білками, сприяючи або інгібуючи транскрипцію, а 3’ - полі(А) додатковий сайт (відтворено за дозволом з Murray RK et al Harper’s Biochemistry, 25th ed. McGraw-Hill, 2000).
Понад 80% відомих факторів транскрипції мають один з чотирьох ДНК-зв’язувальних факторів. Найпоширеніший - цинкозв’язані пальці, у якому комплекси характерної форми утворюються шляхом зв’язування Zn2+ з двома залишками цистеїну і гістидину чи з чотирма залишками цистеїну. Різні фактори транскрипції містять 2-37 таких цинкових пальців, які є посередниками прикріплення до ДНК. Інший фактор - лейцинова защіпка (з англ. lencine zipper), у якій а-спіральні ділянки димерів мають регулярно розміщені залишки лейцину, що взаємодіють один з одним, утворюючи скручений клубок. Розгалуження димеру поза межами з’єднаної ділянки багаті на аргінін та лізин, які прив’язуються до ДНК. Крім того, до ДНК прив’язуються структури спіраль-вигин-спіраль, спіраль-петля-спіраль.
Сьогодні за допомогою методів молекулярної біології можна підсилювати функції певних генів, переносити гени людей тваринам, порушувати функцію окремих генів (генний нокаут). Метод генного нокауту використовують у багатьох експериментах.
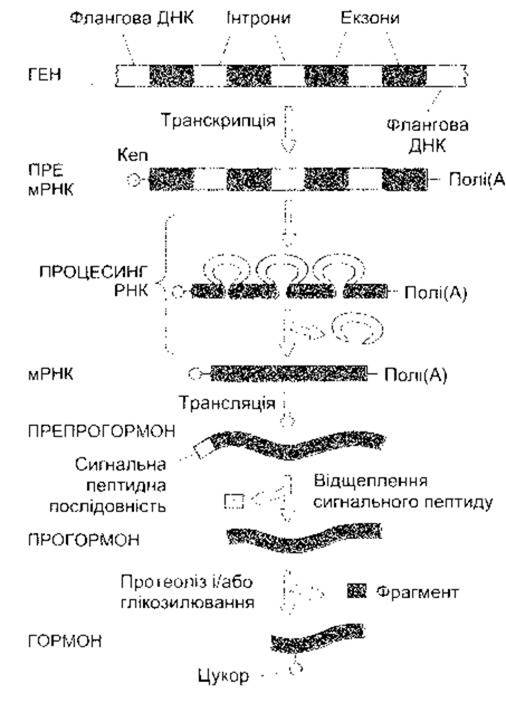
Рис. 1-19. Транскрипція, посттранскрипційна модифікація мРНК, трансляція в рибосомах та посттрансляційний процес у разі утворення гормонів та інших білків Кеп - кеп-сайт (модифіковано та відтворено за дозволом з Baxter JD. Principles of endocriniligy. In Cecil Textbook of Medicine, 16th ed. Wyngaarden JB, Smith LH Jr [editors] Saunders, 1982).
Синтез білка
Процес синтезу білка є складним і водночас викликає захоплення. Як зазначено, він має чотири етапи: транскрипцію, посттранскрипційну модифікацію, трансляцію та посттрансляційну модифікацію. Ці етапи зображено і коротко схарактеризовано на рис. 1-19. Коли активація достатня, транскрипція ієна розпочинається на так званому кеп-сайті (див. рис. 1 -19), а закінчується приблизно за 20 основ від послідовності ААТААА. Транскрипт РНК кепується в ядрі шляхом додавання 7- метилгуанозинтрифосфату до 5'-кінця; цей кеп необхідний для правильного приєднання до рибосоми (див. нижче). Полі(А) хвіст, що складається з понад 100 основ, прикріплюється до нетрансльованого сегмента на 3 '-кінці. Призначення полі(А) хвоста нез’ясоване, однак, можливо, він допомагає підтримувати стабільність мРНК. Під час процесингу пре-мРНК, утворена внаслідок кепування і додаванням полі(А) хвоста, проходить стадію елімінації інтронів (див. рис. 1-19), і коли ця посттранскрипційна модифікація завершується, то зріла мРНК переміщується до цитоплазми. Посттранскрипційна модифікація пре-мРНК є регульованим процесом, і, як зазначено вище, внаслідок диференційного сплайсингу з однієї пре-мРНК може утворитися більше ніж одна мРНК.
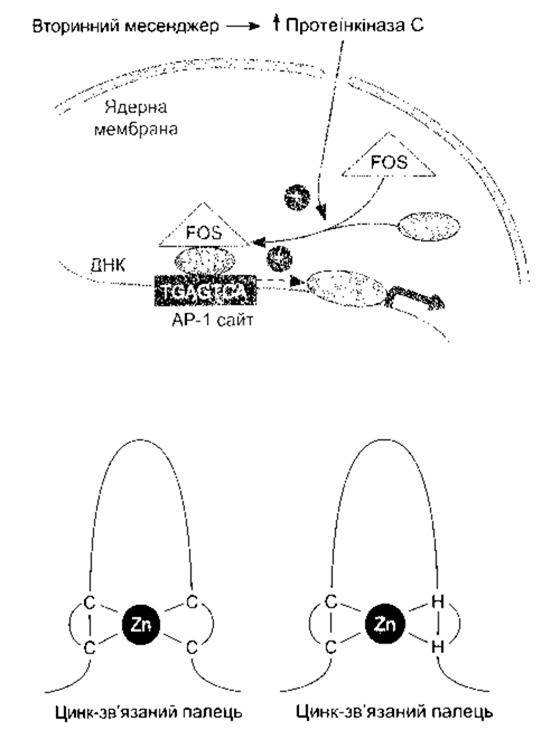
Рис. 1-20. Угорі: активація генів вторинними месенджерами. Вплив генів негайного типу збільшує кількість протеїнкінази С, що призводить до утворення c-Fos та c-Jun. Гетеродимер c-Fos-c-Jun зв’язується з Ар-1 сайтом, активуючи транскрипцію інших генів Унизу: цинк-зв’язані пальці Кривими лініями зображено поліпептидні ланцюги, що зв’язуються з ДНК, а прямі лінії показують зв’язування цинку з цистеїнами (С) або цистеїнами та гістидинами (G) (відтворено за дозволом з Murray RK et al Harper’s Biochemistry, 25th ed. McGraw-Hill, 2000).
Коли зріла мРНК досягає рибосоми в цитоплазмі, то вона спричинює утворення поліпептидного ланцюга. Активування амінокислоти у цитоплазмі відбувається шляхом поєднання з ензимом та аденозинмонофосфатом (аденилатом) і тоді кожна активована амінокислота сполучається зі специфічною молекулою тРНК. На кожну із 20 немодифікованих амінокислот, що містяться в значних кількостях у білках тіла тварин, припадає щонайменше одна тРНК (див. Розділ 17), а на деякі амінокислоти - більше ніж одна тРНК. Комплекс тРНК-амінокислота-аденілат прикріплюється до матриці мРНК. Цей процес відбувається в рибосомах; у вигляді діаграми він зображений на рис. 1-17. Молекула тРНК «розпізнає» відповідне місце прикріплення на матриці мРНК, оскільки на активному кінці має набір з трьох основ, які є комплементарними до набору трьох основ у певному місці ланцюга мРНК. Генетичний код складається з відповідних триплетів або кодонів, послідовності трьох пуринових чи/і піримідинових основ; причому кожен триплет відповідає за певну амінокислоту.
Трансляція починається в рибосомах з AUG (транскрибовані з ATG у гені), що кодує метіонін. Потім до них долучається амінний залишок амінокислоти, і ланцюг стає довшим на одну амінокислоту. Матрична РНК прикріплюється до субодиниці 40S рибосоми під час синтезу білка; утворений поліпептидний ланцюг приєднується до субодиниці 60S, а тРНК - як до однієї, так і до іншої. Оскільки додавання амінокислот відбувається в порядку, визначеному триплетним кодом, то рибосома рухається вздовж молекули мРНК як намистина по нитці. Процес трансляції припиняється на одному з трьох стоп або нонсенс кодонів - UGA, UAA чи UAG, і поліпептидний ланцюг вивільняється. Молекули тРНК будуть використані повторно, а молекули мРНК - ще приблизно десять разів, після чого відбувається їхня заміна.
Як звичайно, на кожному ланцюгу мРНК міститься більше ніж одна рибосома. Ланцюг мРНК та набір рибосом можна побачити через електронний мікроскоп як сукупність рибосом, яку називають полірибосомами (полісомами).
Принаймні теоретично, синтез деяких білків можна припинити за допомогою десенсибілізувальних олігонуклеотидів - коротких синтетичних фрагментів основ, комплементарних до сегментів основ мРНК білка. Ці фрагменти зв’язуються з мРНК, блокуючи трансляцію. Перші результати застосування цієї методики виявились невдалими. Причиною цього стали неспецифічне зв’язування та імунна реакція, однак дослідження тривають і є надія, що будуть отримані продукти, які допоможуть лікувати різноманітні захворювання, в тому числі й рак.
Посттрансляційна модифікація
Модифікування утвореного поліпептидного ланцюга в кінцевий білок відбувається за допомогою комбінації реакцій, зокрема гідроксилювання, карбоксилювання, глікозилювання чи фосфорилювання амінокислотних залишків; розщеплення пептидних зв’язків, унаслідок чого великий поліпептид перетворюється на меншу форму; а також утворюється та упаковується білок і набуває кінцевої, часто комплексної конфігурації. Припускали, що типова еукаріотична клітина за період існування синтезує близько 10 000 різних білків. Як же ці білки потрапляють на своє місце в клітині? Синтез розпочинається у вільних рибосомах. Як зазначено, більшість білків, що будуть секретовані або зібрані в органелах, а також усі трансмембранні білки мають на кінцевій аміногрупі сигнальний пептид (лідерну послідовність), що спрямовує їх до ендоплазматичної сітки. Цей пептид складається з 15-30 переважно гідрофобних амінокислотних залишків. Синтезований сигнальний пептид зв’язується з сигнальною розпізнавальною частиною (СРЧ) - складною молекулою, у якій є шість поліпептидів та 7S РНК, одна з малих РНК. СРЧ припиняє трансляцію до того часу, доки не зв’яжеться з транслоконом - заглибленням в ендоплазматичній сітці, яка є гетеротримерною структурою, що складається з Sec 61 білків. Рибосома також зв’язується, а сигнальний пептид спрямовує пептидний ланцюг, що зростає, у порожнину ендоплазматичної сітки (рис. 1-21). Далі сигнальний пептид відщеплюється від решти пептиду за допомогою сигнальної пептидази, тоді як синтез іншої частини пептидного ланцюга триває далі.
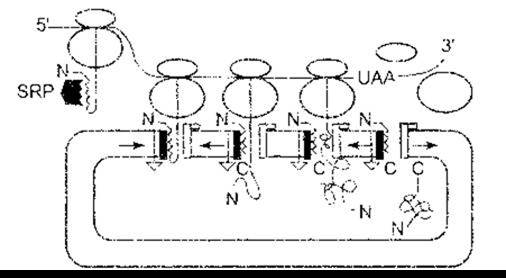
Рис.-1-21. Трансляція білка в ендоплазматичну сітку відповідно до сигнальної гіпотези. Рибосоми, що синтезують білок, рухаються вздовж мРНК з 5'- до 3'-кінця. Коли сигнальний пептид білка, призначеного для секреції клітинної мембрани чи лізосом, з’являється з великої одиниці рибосоми, він зв’язується з частинкою розпізнавання сигналу (англ, signal recognition particle - SRP), і це припиняє подальшу трансляцію, аж доки він не зв’яжеться з транслоконом на ендоплазматичній сітці. Це вивільняє SRP, яка рециклюється в цитоплазмі. Також відбувається зв’язування з рецептором рибосоми, і тунель відкривається, забезпечуючи входження зростаючого білкового ланцюга в ендоплазматичну сітку. Сигнальний пептид виводить сигнальна пептидаза. У разі завершення синтезу білка дві субодиниці рибосоми дисоціюють, а кінцева карбоксильна група потрапляє до ендоплазматичної сітки; N - амінокінець білка; С - карбоксильний кінець білка (відтворено за дозволом з Регага Е, Lingappa VR: Transport of proteins into and across the endoplasmic reticulum membrane. In. Protein Transfer and Organeiie Biogenesis. Das RC, Robbins PW [editors]. Academic Press, 1988)
Сигнали, що спрямовують нові білки у відповідні частини клітини, формуються в апараті Ґольджі (див. нижче) і спричиняють специфічні модифікації вуглеводневих залишків у глікопротеїнів.
Секретовані білки
Більшість білків, що їх секретують клітини, синтезуються як великі білки, і поліпептидні послідовності відщеплюються від них у період дозрівання. У випадку з гормонами ці більші форми називають прегормонами та прогормонами (див. рис. 1-19, 1-22). Прикладом тут є паратиреоїдний гормон (див. Розділ 21). Він синтезується як молекула, що містить 115 амінокислотних залишків (препропаратгормон). Лідерна послідовність-25 амінокислотних залишків на кінцевій аміногрупі - швидко виводиться і, таким способом утворюється пропаратиреоїдний гормон. Перед секрецією з кінцевої аміногрупи виводяться шість додаткових амінокислот, утворюючи секретовану молекулу. Призначення ензиму з шести амінокислот невідоме.
Хоча більшість поліпептидів та білків, які виділяються, мають лідерну послідовність, що спрямовує їх до ендоплазматичної сітки, і секретуються в разі екзоцитозу (див. нижче), однак зростає перелік таких білків, які не мають такої послідовності. В організмі людини це стосується цитокінезу інтерлейкіну-la (ІЛ-Іа) іа ІЛ-lß, трьох факторів росту та різноманітних факторів, що задіяні під час гемостазу. Секреція, очевидно, відбувається через АТФ-залежні мембранні транспортери. Є велика група цих АТФ-касетозв’язувальних (АКЗ) транспортних білків, які переносять йони та інші речовини, а також білки між органелами та через клітинну мембрану. Як звичайно, вони складаються з двох цитоплазматичних АТФ-зв’язувальних доменів та двох мембранних доменів, кожен з яких прикріплює мембрану і містить шість довгих а-спіральних послідовностей (рис. 1-23). Муковісцидозний трансмембранний провідний регулятор (МТР) є одним з АКЗ транспортних білків, який частково регульований цАМФ. Він транспортує СІ та є аномальним в осіб з муковісцидозом (див. Розділ 37).
Укладання білка
Укладання білка є додатковою посттрансляційною модифікацією. Цей складний процес зумовлений головно послідовністю амінокислот у поліпептидному ланцюгу. Однак в окремих випадках новосформовані білки з’єднуються з іншими білками, які називають шаперонами, або білками-опікунами. Вони запобігають невідповідним контактам з іншими білками і гарантують досягнення остаточної правильної конформації білка. Неправильно укладені білки та інші білки, «помічені» для деградації, кон’югують убіквітином і розпадаються в органелах, які називають 26S протеосомами (див. Розділ 17).
Апоптоз
Під генетичним контролем перебувають не тільки полід та ріст клітини, а й її загибель та поглинання. Цей процес називають запрограмованою загибеллю клітини (ЗЗК), або апоптозом. Слово апоптоз у грецькій мові означає листки, що падають з дерева. Такий процес можна також назвати «самогубством клітини», оскільки за її загибель значно відповідають її власні гени. Його треба відрізняти від некрозу (змертвіння клітини), за якого руйнування здорових клітин відбувається внаслідок зовнішніх процесів, наприклад запалення. Апоптоз є звичним процесом на стадії розвитку та зрілості. Зокрема, в центральній нервовій системі формується значна кількість нейронів, які зрештою гинуть під час ремоделювання, що трапляється протягом розвитку га утворення синапсу (див. Розділ 4). В імунній системі за допомогою апоптозу вилучаються невідповідні клони імуноцитів (див. Розділ 27); він відповідає за літичні впливи глюкокортикоїдів на лімфоцити (див. Розділ 20). Апоптоз також є важливим чинником у таких процесах, як видалення в плода перетинок між пальцями та регресія проточних систем плода в період статевого розвитку (див. Розділ 23). У дорослих апоптоз спричинює циклічний розрив ендометрію, що призводить до місячних (див. Розділ 23), та відповідає за відмирання ентероцитів, які злущилися з кінчиків кишкових ворсинок (див. Розділ 26). Аномальний апоптоз, імовірно, виникає в разі автоімунного захворювання, нейродеґенеративних хвороб та ракових захворювань.
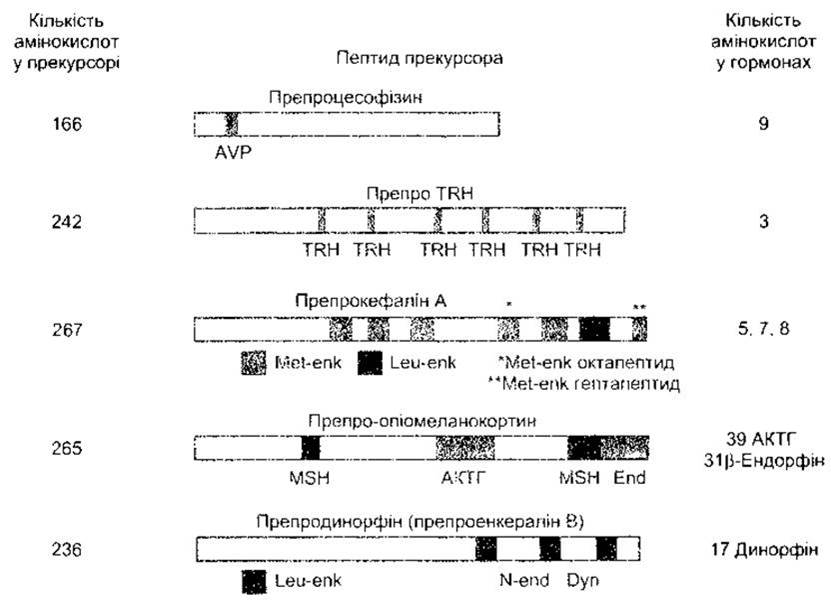
Рис. 1-22. Приклади великих прекурсорів (препрогормонів) для малих пептидних гормонів Див також рис. 14-12 TRH - тиреотропінвивільнювальний гормон, AVP - аргінін вазопресин; Met-enk - met-енкефалін; Leu-enk - Іеu-енкефалін, MSH - меланоцитстимулювальний гормон; АКТГ - адренокортикотропний гормон; End - ß-ендорфін; Dyn - динорфін; N-end - неоендорфін.
Різноманітні позаклітинні ліганди можуть активувати рецептори, що запускають апоптоз. Один з них - Fas, між- мембранний білок, що випинається з лімфоцитів - клітин природних вбивців (NK - від англ. natural killer), і Т-лімфоцитів (див. Розділ 27), що перебувають у різних формах і циркулюють у крові. Апоптоз зручно характеризувати в категоріях активації, внутрішньоклітинного передавання сигналів і їхнього виконання. Два головні позаклітинні фактори, що активують процес, - це Fas та TNF. Коли Fas приєднується до свого рецептора, відбувається активація каскаду внутрішньоклітинних ензимних реакцій, що призводить до руйнування клітини. Апоптозопродукувальний каскад ініціюється активацією каспаз - представників великої родини цистеїнових протеаз. Сьогодні вже ідентифіковано і схарактеризовано тринадцять каспаз у ссавців.
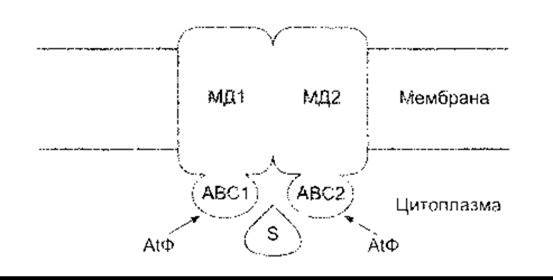
Рис. 1-23. Загальна будова еукаріотичних ABC транспортних білків, що переміщають йони, інші речовини та білки через мембрани АВС1 та АВС2 - АТФ-зв’язуювальні домени; МД1 та МД2 - мембранні домени; S - субстрат (модифіковано з Kuchler К, Thorner J Secretion of peptides and proteins lacking hydrophobic signal sequences. The role of adenosine triphosphate-driven membrane translocators. Endocr Rev 1992; 13:499).
Фактор некрозу пухлин також може імітувати апоптоз. Унаслідок цього починається дія активованих апоптичних генів, що спричинюють у клітині фрагментацію ДНК, конденсацію цитоплазми та хроматину, а також у кінцевому підсумку утворення мембранного пухиря, розпад клітини та видалення залишків за допомогою фагоцитозу.
Одним з головних механізмів, за допомогою якого продукт гена супресора пухлин Р53 (див. нижче) виконує свою антиракову функцію, є активація апоптозу.
Молекулярна медицина
Фундаментальні дослідження молекулярних аспектів генетики, регулювання генної експресії та білкового синтезу щораз більше потрібні в клінічній медицині.
Серед перших досягнень у цій галузі було розуміння механізмів впливу антибіотиків (табл. 1-5). Багато з них діють шляхом пригнічення синтезу білків на одному з описаних вище рівнів. Антивірусні препарати впливають подібним чином, наприклад, ацикловір і гансикловір пригнічують ДНК полімерази. Деякі з цих ліків передусім впливають на бактерії, інші ж пригнічують синтез білків у клітинах тварин, у тому числі ссавців. Цей факт свідчить про важливість антибіотиків для досліджень, як і для лікування інфекцій.
Таблиця 1-5. Механізми інгібування синтезу білка антибіотиками та іншими сполуками
Агент |
Ефект |
Хлорамфенікол (левоміцетин) |
Запобігає нормальному сполученню мРНК з рибосомами |
Стрептоміцин, неоміцин, канаміцин |
Спичиняють неправильне зчитування генетичного коду |
Цикпогексимід, тетрациклін |
Інгібують перенесення комплексу тРНК-амінокислота до поліпептиду |
Пуроміцин |
Комплекс пуроміцин-амінокислота заміщує комплекс тРНК-амінокислота і запобігає додаванню амінокислот до поліпептиду |
Мітраміцин, мітоміцин С, дактиноміцин (актиноміцин D) |
Зв’язуються з ДНК, запобігають полімеризації РНК на ДНК |
Хлорохін, колхіцин, новобіоцин |
Інгібують ДНК полімеразу |
Азотисті іприти, наприклад, мехлоретамін (мустарген) |
Зв’язуються з гуаніном у парах основ |
Токсин дифтерії |
Запобігає руху рибосоми на мРНК |
Сьогодні ідентифіковано одиничні генетичні аномалії, що спричиняють понад 600 людських хвороб. Багато з цих хвороб рідкісні, однак є значна група відомих, а деякі навіть призводять до серйозних, інколи й летальних наслідків. Приклади таких аномалій: дефективно регульований Сl - канал у разі кістозного фіброзу (муковісцедозу див. вище, а також Розділ 34); нестабільні тринуклеотидні повтори в різних частинах геному, що спричиняють хворобу Гантінґтона; синдром крихкої Х-хромосоми та кілька інших неврологічних захворювань (див. Розділ 12). Аномалії в мітохондріальній ДНК також можуть зумовлювати різні хвороби людини, зокрема спадкову оптичну нейропатію Лебера та деякі форми кардіоміопатії. Не дивно, що найбільше уваги приділяють генетичним аспектам раку. Деякі ракові захворювання спричинені онкогенами, генами, перенесення яких відбувається в геномах ракових клітин, і які відповідають за їхні злоякісні характеристики. Онкогени виникають унаслідок соматичних мутацій від близьких протоонкогенів. Уже описано понад 100 онкогенів.
Інша група генів продукує білки, що пригнічують пухлини, таких генів - супресорів пухлин - описано понад 10. З них найліпше вивченими є ген Р53 людської хромосоми 17. Білок Р53, вироблений цим геном, спричиняє апоптоз. Він також є фактором транскрипції ядра, що збільшує продукування 21 кДа білка, який блокує ензими двох клітинних циклів, сповільнюючи цикл та даючи змогу виправляти мутації й інші дефекти ДНК. Ген Р53 піддається мутації майже в 50% пацієнтів, хворих на рак, що впливає на продукування Р53 білків, які послаблюють сповільнення клітинного циклу та не допускають появи інших мутацій у ДНК. Акумульовані мутації зрештою призводять до раку.
Генна терапія все ще перебуває на початкових стадіях розвитку, та незважаючи на це розробляють різноманітні винахідливі підходи для отримання генів з клітини Один з них уже клінічно випробовують для лікування деяких хвороб. Він полягає у виділенні клітин з хворого пацієнта, трансфекції цих клітин нормальними генами in vitro та їхній реін’єкції у вигляді автотрансплантатів. Інший метод передбачає вставляння відповідного гена у порівняно безпечні віруси, які після цього вводять пацієнтам з метою донесення генів до клітин, які вони уражують.
Апарат Ґольджі та везикулярне транспортування у клітинах
Апарат Ґольджі - це набір оточених мембраною мішечків (цистерн), що розташовані подібно до тарілок на обідньому столі (див. рис. 1-4). Таких мішечків здебільшого близько шести, однак інколи може бути більше. Один чи більше апаратів Ґольджі розташовані в усіх еукарютичних клітинах, як звичайно, біля ядра. Апарат Ґольджі є поляризованою структурою з цис-і транс-боками (рис. 1- 24). Мембранні пухирці, що містять щойно синтезовані білки, відбруньковуються від гранулярної ендоплазматичної сітки та зливаються з цистерною на цис-боці апарату. Потім через пухирці білки потрапляють до серединних цистери і нарешті до цистерни на транс-боці, звідки пухирці розгалужуються в цитоплазму. З транс-боку пухирці переходять у лізосоми та поза межі клітини конститутивним і неконститутивним шляхом, причому обидва способи спричиняють екзоцитоз (див. нижче). У протилежному напрямі пухирці витискаються із клітинної мембрани ендоцитозом (див. нижче), потрапляють в ендосоми і зрештою у лізосоми. З лізосом деякі білки переходять назад у транс-боки апарату Гольджі. Остаточне глікозилювання білків відбувається в разі приєднання раніше сформованих олігосахаридів в ендоплазматичній сітці, однак ці олігосахариди перетворюються на велику кількість різноманітних вуглеводневих складових в апараті Ґольджі.
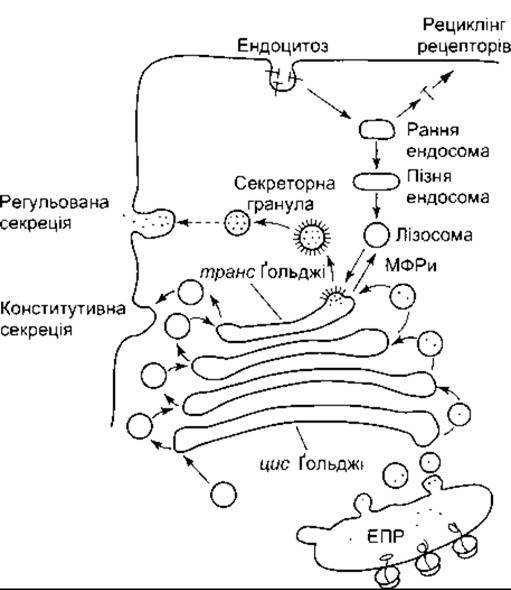
Рис. 1-24. Шляхи, задіяні в процесингу білків в апараті Ґольджі, секреція в разі екзоцитози та реґенерація мембрани у разі ендоцитози ЕПР - ендоплазматична сітка з прикріпленими рибосомами. Зверніть увагу на різноманітні шляхи для регульованої (неконститутивної) та конститутивної секреції у разі екзоцитози, МФРи - маноло-6-фосфат рецептори.
Перевірка якості
Процеси, які відбуваються під час синтезу білка, його укладання на міграції до інших частин клітини, відображають складний комплекс різноманітних перевірок для того, щоб уникнути появи помилок та аномалій. Відповідний механізм «перевірки якості» є на кожному рівні. Пошкоджена ДНК виявляється і піддається репарації. Різні РНК також перевіряються під час процесу трансляції. Кінцево, коли білкові ланцюги перебувають в ендоплазматичній сітці або в апараті Ґольджі, дефектні структури розкриваються і аномальні білки деградують у лізосомах і протеосомах. Остаточним результатом є точне перевіряння продукції білків, що необхідне для нормальної діяльності організму.