Основы биоинформатики - Огурцов А.Н. 2013
Основания биоинформатики
Геномы и протеомы
Структура белков и информация
Функциональные свойства белков определяются их третичной структурой - особенностями пространственной укладки полипептидной цепи белковой молекулы. При переходе от одномерных аминокислотных последовательностей к пространственным трёхмерным молекулярным структурам должны быть адекватные изменения и в биологической информации, описывающей такие структуры.
Белки играют целый ряд ролей в процессах жизнедеятельности: есть структурные белки (например, белки оболочек вирусов, белки ороговевшего внешнего слоя кожи человека и животных, белки цитоскелета); белки, катализирующие химические реакции (ферменты); транспортные (гемоглобин) и информационные белки; регуляторные белки, включая гормоны и рецепторные белки; белки, контролирующие генетическую транскрипцию; белки, участвующие в узнавании, включая клеточную адгезию, антитела и другие белки иммунной системы.
Белки - достаточно крупные молекулы. В большинстве случаев лишь малая часть их структуры - функциональный центр - явно выполняет специфическую функцию. Остальная часть белковой глобулы играет роль некой инфраструктуры, с достаточно произвольной и, в некоторых случаях, даже рыхлой, разупорядоченной структурой, служащей только для того, чтобы точно сформировать каталитические и сорбционные участки - точно расположить в пространстве компоненты этих участков.
Белки эволюционируют благодаря изменениям, вызванным мутациями в генах, которые их кодируют, что приводит к изменениям в аминокислотной последовательности. Первый принцип эволюции состоит в том, что изменения в ДНК изменяют и структуру, и функции белков, что сказывается на репродуктивной способности индивидуума, в результате чего и становится возможным естественный отбор.
На данный момент в PDB записано более 86 000 структур белков (рисунок 1). Большая часть этой информации была получена с помощью методов рентгеновской кристаллографии и ядерного магнитного резонанса (ЯМP, NMR). Знание пространственных особенностей укладки аминокислотной цепи позволило определить специфические функции индивидуальных белков, например, объяснить химическую каталитическую активность ферментов.
Первичной структурой белка называется последовательность расположения аминокислотных остатков в полипептидной цепи.
Полипептидная цепь определяет повороты в пространстве; направление цепи, определяющее модель изгиба.
Вторичной структурой белка называется упорядоченное строение полипептидных цепей, обусловленное внутрибелковыми водородными связями между группами С=0 и N-H разных аминокислот. Наиболее устойчивыми вторичными структурами, обеспечивающими максимальное число внутрибелковых водородных связей, являются а-спирали и ß-структуры (рисунок 44).
Выделяют надвторичные (супервторичные) структуры (элементарные комплексы) - термодинамически или кинетически стабильные комплексы а-спиралей и ß-структур.
Третичной структурой называют пространственную организацию всех а-спиралей и ß-структур белка, распределение в пространстве всех атомов белковой молекулы.
Четвертичной структурой белка называется агрегация двух или большего числа полипептидных цепей, имеющих третичную структуру, в олигомерную функционально значимую композицию.
В некоторых случаях, субъединицы могут эволюционно объединяться в единую аминокислотную цепь. В этом случае четвертичная структура переходит в третичную. Например, пять различных ферментов в бактерии Е. coli, которые катализируют соответствующие шаги в процессе биосинтеза ароматических аминокислот, соответствуют пяти областям одного белка гриба Aspergillus nidulans.

Рисунок 44 - Схематическое изображение вторичных структур: а - а-спирали, б - ß-структуры
Иногда гомологичные мономеры формируют олигомерную четвертичную структуру белка различными способами; например, глобины формируют тетрамеры в гемоглобине млекопитающих, в то время как в моллюске Scapharca inaeguivalvis эти же глобины образуют димеры.
Помимо четырёх основных уровней структурной организации, приведенных выше, выделяют следующие дополнительные уровни.
✵ Супервторичные структуры. В белках нередко повторяются взаимодействия между ß-структурами и а-спиралями; супервторичные структуры включают шпильки а-спиралей, ß-шпильки, ß-a-ß-мотивы.
✵ Домены. Многие белки включают несколько компактных единиц в одной цепи, которые могут существовать независимо стабильно. Они называются доменами. В иерархии структур домены располагаются между супервторичными структурами и третичными структурами.
✵ Модульные белки. Модульные белки являются многодоменными белками, которые часто содержат много копий близкородственных доменов. Эти домены появляются в различных структурных контекстах, так что различные модульные белки представляют из себя мозаику таких доменов.
Например, фибронектин, линейная последовательность которого имеет вид (F1)6(F2)2(F3)15(F1)3 - это большой внеклеточный белок, участвующий в адгезии и миграции, и содержащий 29 доменов, включающих в себя множественные тандемные повторы из трёх типов доменов, называемых F1, F2, F3. Фибронектиновые домены появляются также в других модульных белках. Модульным белкам посвящен сайт (рисунок 45)
http://www.bork.embl-heidelberg.de/Modules/.
Там же приведены схемы модульных белков и их номенклатура.
Рисунок 45 - Веб-сайт модульных белков
Наиболее общая классификация семейств белковых структур основана на вторичной и третичной структуре белка.
В этих достаточно широких категориях белки имеют большое разнообразие способов укладки (таблица 6).
Среди белков со сходной укладкой представлены семейства, имеющие достаточно большое количество деталей структур, последовательностей и функций, обусловленное эволюционными взаимоотношениями. Однако и неродственные белки зачастую имеют похожие способы укладки.
Классификация белковых структур занимает одно из центральных мест в биоинформатике, по крайней мере, как мост между последовательностью и функцией.
Таблица 6 - Классы белков
|
Класс |
Характеристика |
|
а-спираль |
вторичная структура почти исключительно содержит а-спирали |
|
ß-структура |
вторичная структура почти исключительно содержит ß- листы |
|
а + ß |
a-спирали и ß-листы находятся в разных частях молекулы; отсутствуют ß-a-ß-супервторичные структуры |
|
a/ß |
спирали и листы собраны из ß-a-ß структурных единиц |
|
a/ß линейный |
линия, проходящая через центры тяжей (strands) листов, - почти прямая |
|
Бесструктурный |
мало или нет элементов вторичной структуры |
Аминокислотная последовательность (первичная структура) белка определяет его пространственную структуру. Если поместить денатурированный белок в подходящие условия, например, такие, которые существуют в цитозоле клетки, то он восстанавливает свое нативное активное состояние - происходит самопроизвольный фолдинг белка. Некоторые белки для правильного сворачивания нуждаются в помощи специальных белков - шаперонов. Но это просто ускоряет процесс, а не направляет его (см. [9], п. 4.5).
Если аминокислотная последовательность содержит достаточно информации для определения её собственной пространственной структуры, то должна существовать возможность создать алгоритм предсказания пространственной структуры по последовательности. Однако это очень трудно. Поэтому для решения фундаментальной проблемы - предсказания структуры белка по его последовательности - исследователи ставят более простые задачи:
✵ Предсказание вторичной структуры. Какие сегменты последовательности образуют а-спирали или тяжи ß-листов?
✵ Распознавание фолда. Дана библиотека известных структур и их аминокислотных последовательностей и последовательностей с неизвестной структурой. Можем ли мы найти в библиотеке структуру, которая с наибольшей вероятностью имеет способ укладки, сходный с укладкой неизвестного белка?
✵ Моделирование по гомологии. Допустим, дан белок с известной последовательностью и неизвестной структурой. И пусть есть гомологи этого белка с известной структурой. В этом случае мы предполагаем, что целевой белок будет иметь сходство с известным белком, и это может послужить в качестве основы для модели соответствующей структуры. Полнота и качество результата зависят, прежде всего, от схожести последовательностей. Считается, что, если последовательности двух родственных белков имеют 50% или более идентичных остатков в выравнивании, то они, вероятно, обладают аналогичной конформацией пространственной структуры с вероятностью не менее чем 90% (см. также п. 8.5).
На рисунке 46 приведено наложение трёхмерных структур двух родственных белков: лизоцим из белка куриного яйца LYSC_CHIK и а-лактальбумин павиана LALBA PAPCY.
Выравнивание последовательностей этих двух белков с помощью программы ClustalW2 показало, что их последовательности достаточно близкие (37% идентичных остатков в этих двух последовательностях), и, следовательно, их трёхмерные структуры очень похожи. Каждый белок мог бы послужить в качестве хорошей модели для другого настолько значительно, насколько схожи пространственные трассировки их главных (пептидных) цепей.
До появления генной инженерии молекулярные биологи были схожи с астрономами — они могли наблюдать исследуемые молекулярные объекты, но не могли модифицировать их. Теперь это не так. В лаборатории стало возможно модифицировать нуклеиновые кислоты и белки по желанию. Мы можем изучать их, создавая мутации и наблюдая изменения функций. Мы можем старым белкам придать новые функции, как, например, при разработке каталитических антител (абзимов) (см. [9], п. 12.3). Мы можем даже пытаться создавать новые белки.

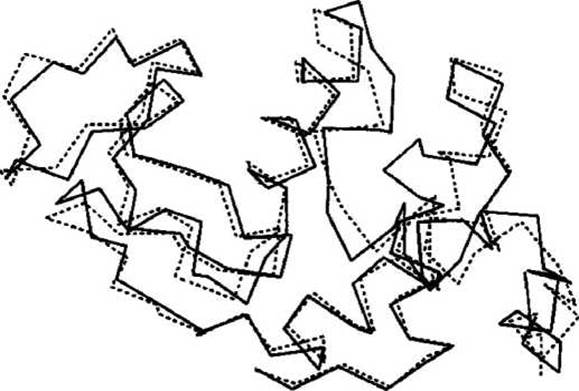
Рисунок 46 - Трассировка полипептидного остова лизоцима (из белка куриного яйца) и а-лактальбумина (павиана)
Большинство правил о белковой структуре было выведено благодаря наблюдениям за природными, нативными белками. Эти правила не обязательно относятся к синтетическим белкам. У природных белков характеристики подчиняются основным принципами физической химии и механизмам белковой эволюции. Синтетические белки должны подчиниться законам физической химии, но они не являются результатом эволюции. Поэтому белковая инженерия сегодня обособляется в новое научное направление.