БІОТЕХНОЛОГІЯ - Іншина Н.М. - 2009
РОЗДІЛ 4. МЕДИЧНА БІОТЕХНОЛОГІЯ
Генна терапія
Із загальної кількості відомих захворювань людини 40% становлять генетичні хвороби. Спадковими є понад 5000 захворювань людини. Більшість із них зустрічається рідко (10-5), деякі відносно часто (10-4).
Деякі спадкові захворювання обумовлені мутаціями в одному гені. Для лікування моногенних захворювань застосовують генну терапію — уведення нормальних генів пацієнтам для корекції дефектних генів. Усі дослідження з генної терапії спрямовані на корекцію генетичних дефектів соматичних, а не статевих клітин. Експерименти в галузі генної терапії клітин зародкової лінії людини заборонені.
Генна терапія орієнтована насамперед на отримання генів і векторів, що забезпечують перенесення цих генів у клітини організму.
Для лікування спадкових захворювань на молекулярному рівні використовують 2 основних підходи: генна терапія ex vivo і генна терапія in vivo. Генна терапія ex vivo грунтується на трансплантації генетично модифікованих клітин, що продукують терапевтичний білок.
Генна терапія ex vivo складається з таких етапів (рис. 4. і):
1) одержання клітин хворого;
2) корекція генетичного дефекту за допомогою введення потрібного гена в ізольовані клітини;
3) відбір і культивування генетично «виправлених» клітин;
4) інфузія або трансплантація цих клітин пацієнту.
Використання власних клітин пацієнта (аутологічних клітин) гарантує, що після інфузії чи трансплантації не буде розвиватися імунна відповідь. Використання аутологічних клітин попереджає їх відторгнення, але обмежує сферу застосування генної терапії ex vivo. Так, число клітин тканини-мішені може бути недостатнім для їх виділення і культивування invitro, деякі соматичні клітини неефективно поглинають ДНК, а експресія клонованого гена виявляється короткочасною. Тому розроблено системи, що захищають неаутологічні клітини від імунної відповіді. Альтернативний спосіб генної терапії ex vivo використовує генно-інженерну модифікацію неаутологічних клітин, оточених мембраною, що запобігає реакції відторгнення і не перешкоджає вивільненню «терапевтичного» генного продукту.
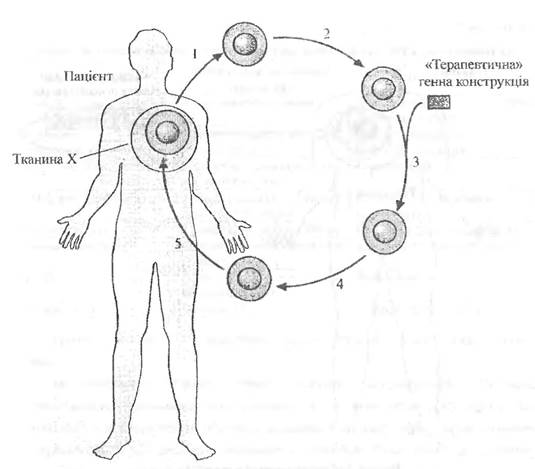
Рис. 4.1. Схема генної терапії ex vivo
Під час генної терапії in vivo «терапевтичний» ген уводять безпосередньо у клітини тканини-мішені хворого (рис. 4.2).
Розроблено різні системи доставки генів: вірусні (ретровірусні, аденовірусні, вектори на основі вірусу простого герпесу) і невірусні (ін’єкція ДНК, бомбардування тканини-мішені частинками, кон’югованими з ДНК, уведення ДНК у складі ліпосом). Оптимальна векторна система повинна забезпечувати високу ефективність поглинання «терапевтичного» гена клітинами-мішенями, мінімальність його внутрішньоклітинного руйнування під час транспорту в ядро і підтримку достатнього рівня експресії. Уважають, що оптимальним терапевтичним вектором є штучна хромосома людини.
Вивчається терапевтичний ефект різних олігонуклеотидів: модифікованих за допомогою генної інженерії рибозимів, що розщеплюють специфічні мРНК; аптамерів, що зв’язуються зі специфічними білками і блокують їх функції; олігонуклеотидів, за допомогою яких можна здійснюват и корекцію заміни однієї нуклеотидної пари і мутації.
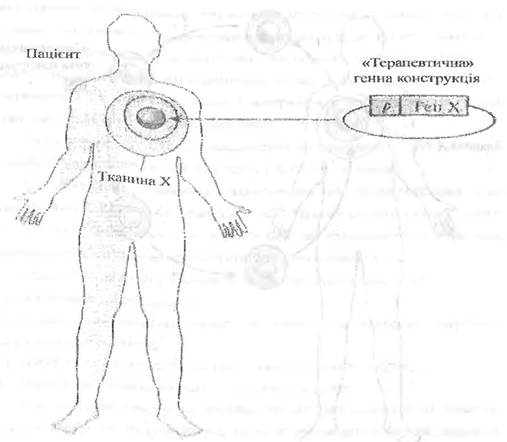
Рис. 4.2. Схема генної терапії in vivo
Уперше генна терапія була застосована у 1990 р. для лікування спадкового імунодефіциту. Група вчених СІЛА під керівництвом В. Андерсона розпочала лікування 4-річної дівчинки Ашанти Де Сільви з важкою формою імунодефіциту. Молекулярною причиною захворювання є пошкодження гена білка аденозиндезамінази (АДА). Якщо немає АДА, лейкоцити гинуть, організм стає беззахисним перед вірусами і бактеріями. Для лікування Ашанти застосували генну терапію ex vivo: з організму виділили клітини імунної системи, піддали їх генетичній модифікації і ввели дівчинці. Копії нормального гена були введені у клітини крові Ашанти за допомогою вірусного вектора. У клітинах розпочався синтез АДА, через 6 місяців вміст лейкоцитів в організмі дівчинки досягнув нормального рівня.
З 90-х років XX ст. сотні лабораторій світу проводять дослідження щодо використання генної інженерії для лікування захворювань (табл. 4.4).
Таблиця 4.4
Деякі захворювання, генна терапія яких проходить дослідження
Захворювання |
Генотерапевтичний препарат |
Клітини-мішені |
Важкий комбінований імунодефіцит |
АденозиндезамІназа |
Лімфоцити, клітини кісткового мозку |
Меланома |
Фактор некрозу пухлин |
Клітини пухлини |
Меланома, рак нирки |
Інтерлейкін-2 |
Клітини пухлини |
Гіперхолестеролем ія |
Рецептор ліпопротеїнів низької густини |
Гепатоцити |
СНІД, рак яєчників |
Тимідинкіназа вірусу простого герпесу |
Клітини пухлини, Т- лімфоцити |
Муковісцидоз |
Трансмембранний білок |
Епітелій дихальних шляхів |
Анемія Фанконі |
Фактор анемії Фанконі групи С |
Клітини головного мозку |
Артит |
Антагоніст рецептора інтерлейкіна-1 |
Фібробласти |
Гемофілія В |
Фактор IX |
Фібробласти шкіри |
Триває більше 500 клінічних випробовувань різних видів генної терапії.
За допомогою генної терапії лікують міодистрофію Дюшена. Молекулярною причиною захворювання є мутація гена дистрофіну, що необхідний для скорочення м’язових волокон. Ген дистрофіну локалізований у Х-хромосомі, тому хворіють переважно чоловіки. Якщо немає дистрофіну, м’язи втрачають здатність до скорочення, настає смерть. Для моделювання захворювання в експериментальних тварин (мишей) видалили ген дистрофіну. Під час уведення нормального гена експериментальним тваринам спостерігалося відновлення функції м’язових волокон (до 25%). Установлено, що під час генної терапії міодистрофії людини необхідна модифікація більшості (до 50%) м’язових волокон.
У 2000 р. у США для лікування гемофілії була запропонована процедура введення гена одного з факторів згортання крові. Встановлено, що введення цього гена хворим на гемофілію перешкоджає виникненню крововиливів у пацієнтів. Після такого лікування пацієнти з гемофілією більше року не відчувають необхідності у додаткових ін’єкціях фактора згортання крові.
Серед неспадкових захворювань людини вчені приділяють значну увагу раку. Впроваджується кілька напрямів боротьби з хворобою:
— генетична модифікація клітин імунної системи для посилення їх протипухлинної активності і пригнічення роботи онкогенів;
- підвищення чутливості пухлинних клітин до хіміотерапевтичних препаратів.
З метою підвищення чутливості злоякісних клітин до хіміотерапії використовують ген, що кодує фермент тимідинкіназу вірусу простого герпесу. Клітини, в яких синтезується вірусна тимідинкіназа, перетворюють хімічний препарат ганцикловір у токсичний продукт, у результаті чого вони гинуть, ріст пухлини зупиняється.
Є певні успіхи генної терапії в боротьбі зі СНІДом. Учені ідентифікували ген CCR5, який забезпечує резистентність до ВІЛ. Ген CCR5 перешкоджає утворенню на поверхні Т-лімфоцитів рецепторів, з якими зв’язується ВІЛ. Також ідентифікований ген Rantes, який визначає, чи стане людина носієм ВІЛ, чи захворіє на СНІД. Незначні відмінності в гені Rantes, який відповідає за формування імунної системи, можуть підвищувати схильність до ВІЛ.
Відомо, що геном ВІЛ містить послідовність TAR, яку розпізнає вірусний регуляторний білок. Тільки після взаємодії цього білка з TAR-елементом вірус починає розмножуватися. Щоб зупинити процес розмноження ВІЛ, було запропоновано вводити штучно синтезовану TAR-послідовність в інфіковані клітини. Вбудована у клітини послідовність ДНК відіграє роль пастки: в інфікованій клітині на ній синтезуються РНК, регуляторний білок вірусу зв’язується переважно з ними, а не з РНК вірусу, у результаті чого вірус припиняє розмножуватися.
Незважаючи на значні досягнення генної терапії у лікуванні багатьох захворювань, вона не має широкого застосування в медичній практиці. Причини цього полягають у наступному:
- відторгнення чужорідних генів, спричинене імунною реакцією організму;
- перенесені гени існують у клітинах протягом короткого часу, іноді навіть не встигають напрацювати необхідну кількість лікувального продукту, у зв’язку з цим спостерігається тимчасове виліковування і тільки у частини клітин;
- невисока ефективність сучасних методів перенесення генів у клітини хворих;
- вбудовування нового генетичного матеріалу в певні ділянки ДНК людини може викликати рак. Відомі випадки, коли пацієнти з імунною недостатністю після застосування генної терапії захворіли на лейкемію.
Корекція генетичних дефектів не призведе до погіршення генофонду людської популяції. За даними популяційної генетики для суттєвого підвищення частоти шкідливого гена в результаті ефективного лікування необхідні тисячі років. Наприклад, якщо генетичне захворювання зустрічається в одного із 100 000 новонароджених, то пройдуть 2000 років після початку застосування ефективної генної терапії, перш ніж частота захворювання подвоїться. Отже, генна терапія людини вважається безпечною медичною процедурою, хоча не зовсім ефективною.