Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
Оптимизация экспрессии генов, клонированных в прокариотических системах
Экспрессия генов при участии сильных регулируемых промоторов
Основная цель экспериментов по клонированию генов, которые предполагается использовать в биотехнологии, — подбор условий для эффективной экспрессии в нужном организме-хозяине. К сожалению, сам факт встраивания того или иного гена в клонирующий вектор еще не означает, что этот ген будет экспрессирован. В то же время, чтобы получение коммерческого продукта было экономически оправданным, уровень его синтеза должен быть достаточно высоким. Для достижения эффективной экспрессии уже сконструировано много специфических векторов; для этого проводились манипуляции с целым рядом генетических элементов, контролирующих процессы транскрипции и трансляции, стабильность белков, секрецию продуктов из хозяйской клетки и т. д. Среди молекулярно-биологических свойств систем экспрессии наиболее важны следующие: 1) тип промотора и терминатора транскрипции; 2) прочность связывания мРНК с рибосомой; 3) число копий клонированного гена и его локализация (в плазмиде или в хромосоме хозяйской клетки); 4) конечная локализация синтезируемого продукта; 5) эффективность трансляции в организме хозяина; 6) стабильность продукта в хозяйской клетке.
Никакой универсальной стратегии оптимизации экспрессии клонированных генов не существует. Большинство таких генов имеют уникальные молекулярные свойства, и оптимальные системы экспрессии для каждого из них приходится подбирать всякий раз заново. Эффективность экспрессии любого чужеродного гена зависит также от его родства с организмом-хозяином. Несмотря на то что многие представители как про- так эукариотических организмов способны к экспрессии чужеродных генов, для получения важных в коммерческом отношении продуктов с помощью технологии рекомбинантных ДНК используют в основном Escherichia coli. Это связано прежде всего с тем, что генетические, молекулярно-биологические, биохимические и физиологические свойства этого микроорганизма детально изучены. Кроме того, это наиболее дешевый и быстрый способ получения многих белков. Но для экспрессии некоторых клонированных генов используются и другие организмы-хозяева: В. subtilis, дрожжи, животные, растения и т. д., хотя стратегии, разработанные для Е. соli-систем, в принципе применимы и в этих случаях.
Для эффективной экспрессии любого гена совершенно необходимо наличие сильного регулируемого промотора, расположенного перед данным геном. Такой промотор имеет высокое сродство к РНК-полимеразе, поэтому прилегающие к нему последовательности эффективно (с высокой частотой) транскрибируются. Регулируемость промотора позволяет клетке (и исследователю) осуществлять строгий контроль транскрипции. Для экспрессии клонированных генов широко используется промотор хорошо изученного lac (лактозного)-оперона Е. coli. Однако есть и другие промоторы, обладающие полезными для контроля экспрессии свойствами. Для их идентификации перед так называемым геном-репортером, кодирующим легко регистрируемый продукт, но лишенным промотора, встраивают случайные фрагменты ДНК (рис. 6.1). Если в результате такой вставки ген-репортер эффективно экспрессируется, то делают вывод, что клонированный фрагмент содержит функциональный промотор. Большинство генов-репортеров кодируют либо продукты, обусловливающие устойчивость к антибиотикам, либо фермент, который идентифицируется с помощью достаточно простого колориметрического теста.
Может показаться, что наиболее подходящим способом оптимизации экспрессии клонированного гена является встраивание его в плазмиду так, чтобы он находился под контролем постоянно функционирующего сильного промотора. Однако непрерывная экспрессия чужеродного гена может оказаться гибельной для клетки-хозяина, поскольку приводит к истощению ее энергетических ресурсов и нарушению метаболизма. Кроме того, плазмиды, несущие постоянно (конститутивно) экспрессирующийся ген, нередко утрачиваются после нескольких клеточных циклов, поскольку не содержащие их клетки растут быстрее и со временем становятся в культуре преобладающими. Нестабильность плазмид — это основная проблема, мешающая получению продукта гена, локализованного в плазмиде, в промышленных масштабах. Для ее решения нужно научиться контролировать экспрессию таким образом, чтобы клонированный ген экспрессировался только в определенной фазе клеточного цикла и только в течение определенного времени, а для этого нужно использовать сильные регулируемые промоторы. Плазмиды, сконструированные для этих целей, называются экспрессирующими векторами.
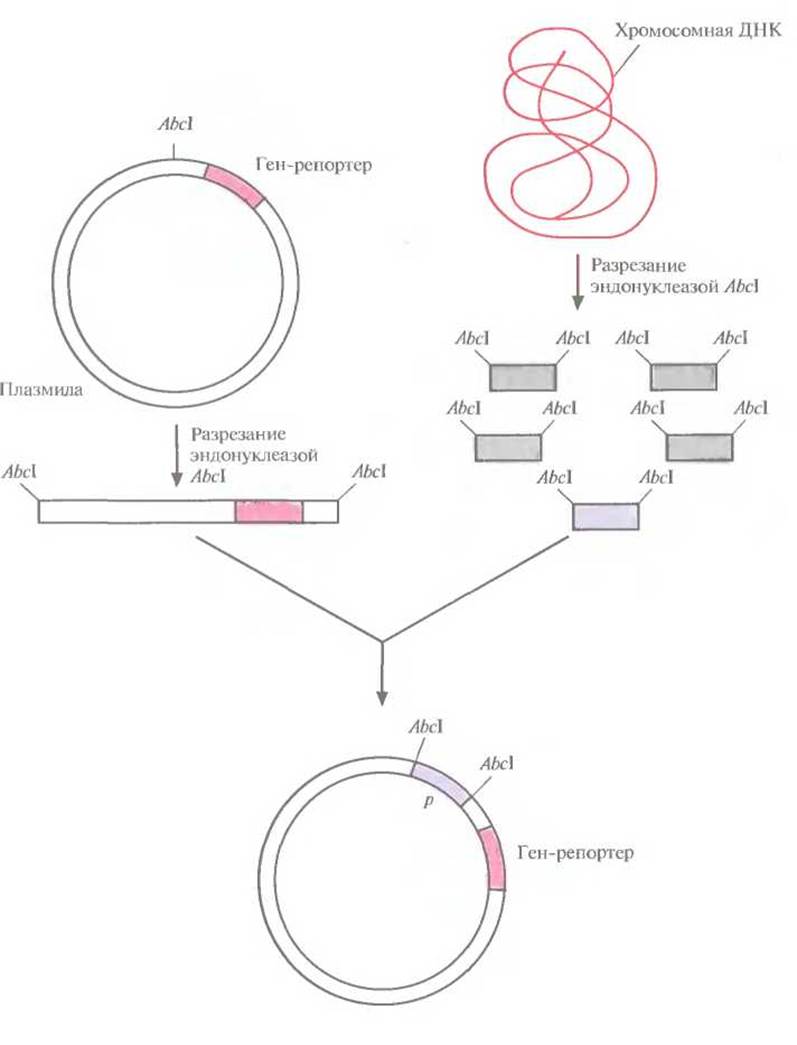
Рис. 6.1. Идентификация сильных регулируемых промоторов. В плазмиду встраивают ген-репортер без промотора. Хромосомную ДНК разрезают рестрицирующей эндонуклеазой Abcl и встраивают фрагменты в плазмиду. Если ген-репортер эффективно экспрессируется, значит, клонированный фрагмент содержит функциональный промотор.
Регулируемые промоторы
Наиболее широко используются следующие сильные регулируемые промоторы: промоторы lac- и trp-р-оперопов Е. coli, специально сконструированный tac-промотор, включающий —10-область lас-промотора и -35-область trp-промотора (участки, находящиеся на расстоянии 10 и 35 п. н. до сайта инициации транскрипции); левый, или pL, промотор бактериофага А; промотор гена 10 бактериофага Т7. С каждым из них связываются соответствующие репрессоры, которые опосредуют включение и выключение транскрипции специфических генов. Кроме того, каждый из этих промоторов узнается холоферментом РНК-полимеразой Е. coli, в который входит основной сигма-фактор, присутствующий в клетке в значительно больших количествах, чем другие, минорные сигма-факторы. Благодаря этому транскрипция не останавливается по причине недостатка свободных сигма- факторов.
В отсутствие лактозы в среде lac-промотор Е. coli находится в репрессированном состоянии, т. е. он выключен белком-репрессором, блокирующим транскрипцию laс-оперона. Индукция, или включение laс-оперона происходит при добавлении в среду лактозы или изопропил - ß- D-тиогалактопиранозида (ИПТГ). Оба этих соединения предотвращают связывание репрессора с laс-оператором, и транскрипция возобновляется.
Транскрипция, контролируемая lac-промотором, регулируется также с помощью белка — активатора катаболизма (САР) (рис. 6.2). При связывании САР с промотором повышается сродство последнего к РНК-полимеразе и усиливается транскрипция примыкающих к нему генов. В свою очередь сродство САР к промотору повышается при его связывании с циклическим АМР (сАМР), уровень которого повышается при снижении концентрации глюкозы в среде. Таким образом, если репрессор не связан с оператором, то в присутствии индуктора при повышении внутриклеточной концентрации сАМР может произойти усиление транскрипции генов, регулируемых lас-промотором.
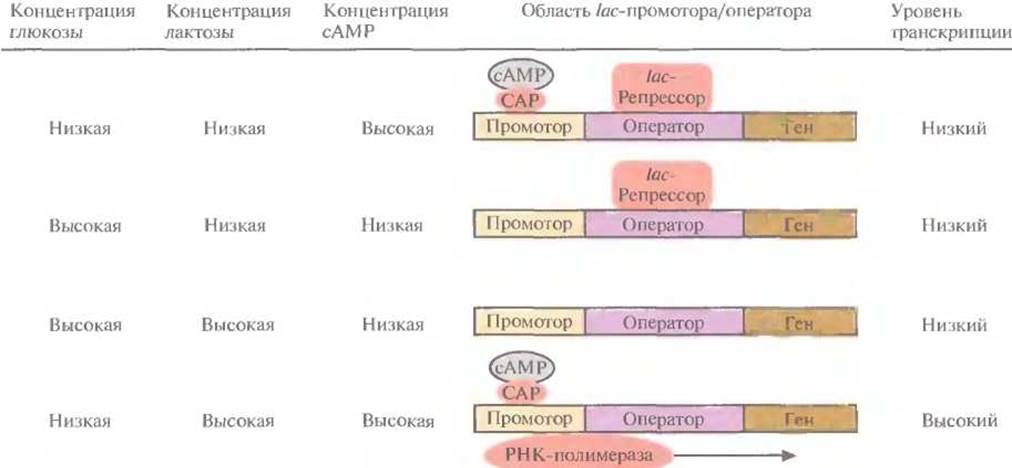
Рис. 6.2. Влияние глюкозы, лактозы и сАМР на транскрипцию, регулируемую lac-промотором Е. coli. Стрелка указывает направление транскрипции. (По данным работы Abeles et al., 1992, Biochemistry, p. 383, Jones and Barlett Publishers, Boston, Mass.)
На самом деле в плазмидных экспрессирующих векторах используется один из вариантов lac-промотора — lacUV5 с измененной -10-последовательностью, более сильный, чем lас-промотор дикого типа. Транскрипция с промотора tac также подавляется lac-репрессором и возобновляется при добавлении в среду лактозы или ИПТГ.
Промотор trp выключается под действием комплекса триптофан—trp-репрессор, который связывается с trp-оператором и предотвращает транскрипцию trp-оперона. Активация (включение) trp-промотора происходит либо при удалении из среды триптофана, либо при добавлении 3-индолилакриловой кислоты.
Работа промотора pL регулируется репрессорным белком сl бактериофага λ. На самом деле для регуляции транскрипции с рL-промотора обычно используется термочувствительная мутантная форма репрессора сI — белок cI857. Клетки, синтезирующие этот репрессор, сначала выращивают при температуре 28—30 °С; в этих условиях репрессор блокирует транскрипцию с pL-промотора. Когда культура достигает нужной фазы (как правило, середины log-фазы), температуру повышают до 42 °С. при которой cIg57-peпрессор инактивируется и начинается транскрипция.
Для транскрипции с промотора бактериофага Т7 нужна соответствующая РНК-полимераза. Чтобы можно было использовать этот промотор, ген РНК-полимеразы фага Т7 встраивают в хромосому Е. coli в составе профага λ, поместив его под контроль lас-промотора. Затем клетки трансформируют плазмидой, содержащей генмишень под контролем Т7-промотора, и добавляют в среду ИПТГ. В этих условиях происходит индукция гена РНК-полимеразы Т7, синтезируется РНК-полимераза и происходят транскрипция и трансляция клонированного гена. Часто между временем индукции гена РНК-полимеразы Т7 и началом транскрипции генамишени проходит более часа. Для транскрипции с сильного Т7 промотора создана целая серия плазмид, получивших название рЕТ-векторов.
Эффективность инактивации белка-репрессора и соответственно активации транскрипции зависит от соотношения между числом молекул репрессора и числом копий промотора. Если концентрация репрессора слишком велика, то транскрипция не инициируется, и наоборот, если молекул репрессора очень мало (даже при том, что их больше, чем копий промотора), то транскрипция может идти и в отсутствие индукции. Про такие промоторы говорят, что они «текут». Чтобы осуществлять строгий контроль таких регулируемых систем, разработаны разные стратегии. Например, ген репрессора и соответствующий промотор помещают в две разные плазмиды, присутствующие в клетке в разном числе копий; это позволяет поддерживать нужное соотношение между числом молекул репрессора и числом копий промотора. Обычно ген репрессора находится в малокопийной плазмиде, число ее копий в клетке не превышает 8, а промотор — в мультикопийной плазмиде с 30—100 копиями на клетку. Ген репрессора может быть локализован и в хромосомной ДНК, находясь в ней в единственном числе, что позволяет поддерживать низкую концентрацию репрессора. В системах, использующих lас-промотор, можно получить lас-репрессор в значительно большем количестве, если заменить lacI-ген его мутантной формой lacIq, что приводит к уменьшению «протекания» промотора, т. е. к снижению уровня транскрипции клонированного гена без индуктора.
Получение больших количеств белковых продуктов
Для получения больших количеств чужеродных белков с помощью рекомбинантных штаммов Е. coli была сконструирована плазмида pPLc2833. Она содержит сильный промотор, селективный маркерный ген и короткий участок с несколькими уникальными сайтами для рестрицирующих ферментов (полилинкер), следующий непосредственно за промотором. Эффективность этого экспрессирующего вектора в осуществлении синтеза чужеродных белков в Е. coli можно еще больше повысить, заменив сайт инициации репликации плазмиды pPLc2833 аналогичным сайтом плазмиды pKN402. Это приводит к увеличению числа копий модифицированной плазмиды в 5—10 раз при температуре 42 °С (табл. 6.1). Полученная таким образом плазмида рСР3 содержит pL -промотор и ген ß-лактамазы (ген устойчивости к ампициллину) из pPLc2833, а сайт инициации репликации — из pKN402 (рис. 6.3). Несущие ее клетки сначала выращивают при температуре 28 °С, а затем — при 42 °С. При пониженной температуре ген d-penpeccopa, интегрированный в ДНК Е. coli, экспрессируется, pL-промотор не функционирует и образуется обычное число копий плазмиды (табл. 6.1). При повышении температуры d-peпpecop инактивируется, pL-промотор переходит в активное состояние, и число копий плазмиды увеличивается. Все это и делает плазмиду рСР3 эффективным экспрессирующим вектором. Когда ген ДНК-лигазы Т4 был встроен в полилинкер рСРЗ, то выход его продукта составил примерно 20% от общего количества белка, синтезируемого Е. coli при 42 °С. При этом на долю собственных, наиболее активно синтезируемых белков Е. coli, например фактора элонгации EF-Тu, приходится примерно 2%.
Таблица 6.1. Зависимость числа копий трех плазмидных экспрессирующих векторов от температуры 1)
|
Плазмида |
Число копий |
на клетку |
Промотор pL |
|
28 °С |
24 С |
||
|
pKN402 |
82 |
521 |
Нет |
|
pPLc2833 |
38 |
42 |
Да |
|
рСРЗ |
60 |
713 |
Да |
1) Поданным работы Rcmaut et ah, 1983, Genell: 103—1 ІЗ.
Крупномасштабные системы
При культивировании в небольших объемах (от 1 до 5 л) индукцию экспрессии осуществляют либо изменением температуры, либо добавлением химического индуктора. Однако в опытных установках (20—100 л) и в промышленных биореакторах (>200 л) температуру нельзя изменить мгновенно, для этого требуется время от 30 до 60 мин; кроме того, на подъем температуры нужна энергия. И время, и энергия стоят дорого. Столь же дорого обходится и применение химического индуктора, например ИПТГ. Все это может сделать процесс неэкономичным. Для преодоления некоторых проблем, связанных с использованием pL-промотора для крупномасштабного производства белковых продуктов, была разработана двухплазмидная система. Ген репрессора сI поместили под контроль trp-промотора и включили в малокопийную плазмиду (рис. 6.4), что обеспечило невысокий уровень синтеза репрессора. Вторая плазмида содержала клонированный ген, находящийся под контролем pL-промотора. Как видно из рис. 6.4, А, в отсутствие триптофана включается trp-промотор и синтезируется репрессор cl, выключающий pL-промотор. И наоборот, как видно из рис. 6.4, Б, при наличии триптофана tpr-опромотор выключается, репрессор не синтезируется, а pL-промотор активно работает.
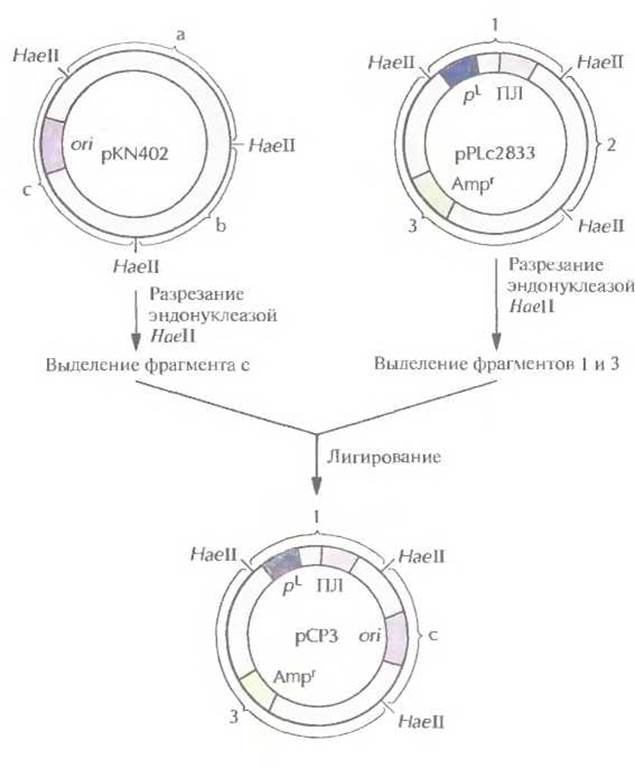
Рис. 6.3. Создание плазмиды рСРЗ. Из плазмиды pKN402 с помощью рестрицирующей эндонуклеазы НаеІІ вырезают фрагмент с, содержащий температурочувствительный сайт инициации репликации (ori), и сшивают его с НаеІІ-фрагментами 1 и 3 плазмиды pPLc2833 Фрагмент I содержит pL-промотор и полилинкер (ПЛ), а фрагмент 3 — селективный маркерный ген устойчивости к ампициллину (Ampr).
Культуры с такими двухплазмидными системами можно выращивать на недорогих средах на основе гидролизатов мелассы или казеина, содержащих незначительное количество свободного триптофана, и индуцировать экспрессию клонированного гена добавлением в среду триптона. Последний содержит свободный триптофан в количестве, достаточном для эффективной индукции транскрипции. Пробные испытания этой системы показали, что на долю продуктов клонированных генов ß-лактамазн и цитратсинтазы после индукции транскрипции добавлением триптона приходится соответственно 21 и 24% от общего количества синтезируемого белка. Таким образом, двухплазмидные системы позволяют получать белковые продукты с помощью рекомбинантных микроорганизмов в промышленных масштабах и относительно недорого.
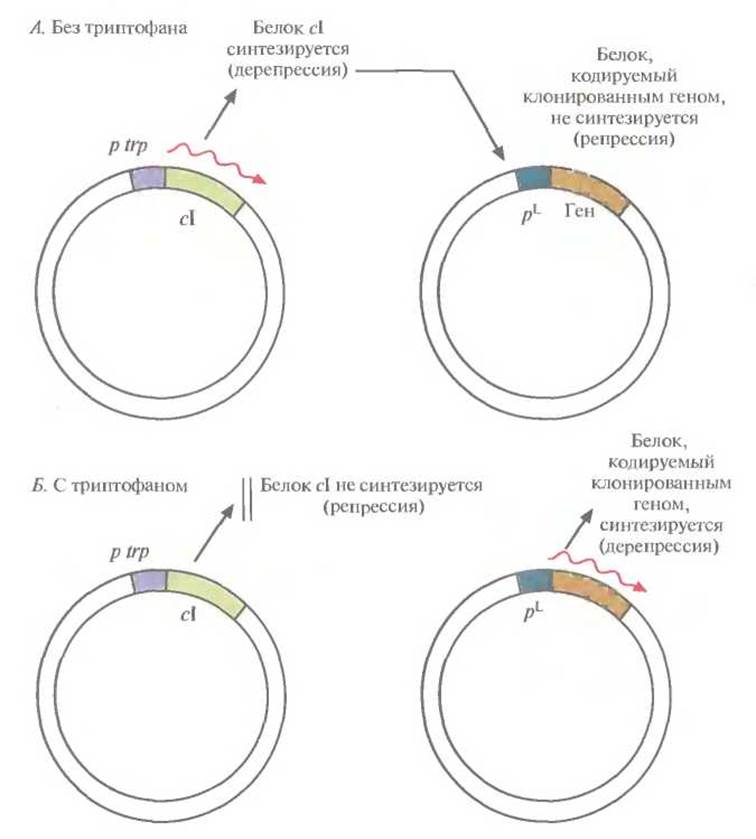
Рис. 6.4. Двухплазмидная система, позволяющая контролировать работу pL-промотора фага λ путем регуляции синтеза cI-peпрессора с помощью триптофана. Ген репрессора d вместе с триптофановым промотором (р trp) находятся в одной плазмиде, a pL-промотор и клонированный ген — в другой. Стрелками указано направление транскрипции. А. В отсутствие триптофана в среде ген d транскрибируется и транслируется, репрессор cI связывается с pL-промотором и блокирует транскрипцию клонированного гена. Б. В присутствии триптофана ген cI репрессируется, его продукт не синтезируется, поэтому клонированный ген транскрибируется и транслируется.
Использование для экспрессии других микроорганизмов
Е. coli — не единственный микроорганизм, который используется для синтеза чужеродных белков. К сожалению, генетические и молекулярно-биологические свойства большинства других микроорганизмов изучены не так хорошо. Кроме того, нет ни одного вектора или даже промоторно-репрессорной системы, которая обеспечивала бы оптимальный уровень экспрессии в клетках всех или хотя бы только грамотрицательных бактерий. К счастью, многие стратегии, разработанные для Е. coli, пригодны и для множества других микроорганизмов, что позволило проверить различные промоторы на их способность обеспечивать транскрипцию в других грамотрицательных бактериях. Так, в одном из исследований был сконструирован набор плазмидных экспрессирующих векторов, содержащих промоторы lac, tac, Nm (гена устойчивости к неомицину) и S1 (гена рибосомного белка Sl Rhisobium meliloti), и определен уровень экспрессии гена ß-лактамазы под контролем каждого из них (табл. 6.2). Обнаружилось, что: 1) указанные промоторы проявляют ту или иную активность во всех использованных бактериальных системах; 2) промотор tac наиболее активен в Е. coli и гораздо менее — в других бактериях; 3) Nm — второй по активности промотор в Е. coli и самый активный в других бактериях. Промоторные участки у всех грамотрицательных бактерий имеют сходную нуклеотидную последовательность, однако это не означает, что самым эффективным промотором для того или иного организма будет тот, который наиболее эффективен в Е. coli. Тем не менее Е. соli-промоторы могут оказаться вполне приемлемыми для регуляции экспрессии клонированных генов и в других грамотрицательных бактериях.
Попытки создания «универсального» экспрессирующего вектора для грамотрицательных бактерий были весьма многочисленными. В конце концов была выбрана следующая стратегия. Фрагмент ДНК размером 70 и. н., происходящий от одного из концевых инвертированных повторов в транспозоне 5 (Тn5), встроили вместе с соответствующим промотором в полилинкер малокопийной плазмиды pRK290 с широким спектром хозяев и получили плазмиду pAV10 (рис. 6.5). Клонированный сегмент ДНК из Тn5 содержал два независимых, но перекрывающихся промотора, каждый из которых необходим для транскрипции одного из ключевых Тn5-генов. Поскольку Тn5 эффективно экспрессируется в разных бактериях, его промоторы можно использовать для транскрипции различных генов. Чтобы проверить это, в полилинкер сразу за клонированными промоторами Тn5 встроили гены хлорамфеникол-ацетил-трансферазы и ß-галактозидазы. Их эффективная экспрессия происходила в клетках Alcaligenes sp., Е. coli, Enterobacter cloacae, Klebsiella pneumoniae, Pseudomonas stutzeri, Pseudomonas fluorescens и Serratia marcescens. Таким образом, есть реальная возможность использовать Тn5-промоторы для инициации транскрипции чужеродных генов в клетках различных бактерий.
Таблица 6.2. Активность ß-галактозидазы в грамотрицательных бактериях, несущих плазмидный вектор с геном lacZ E.coli и гетерологичным промотором1)
|
Промотор |
Активность ß-галактозидазы, ЕД |
|||
|
Escherichia coli |
Rhizobium meliloti |
Rhizobium leguminosarum |
Pseudomonas putida |
|
|
Отсутствует |
16 |
110 |
130 |
150 |
|
Nm |
1400 |
21 800 |
13 900 |
16 300 |
|
lac |
2000 |
9050 |
6250 |
9800 |
|
tac |
11300 |
2850 |
1150 |
2950 |
|
SI |
40 |
3300 |
1200 |
3350 |
1) По данным Labes et al., 1990, Gene 89: 37—46.
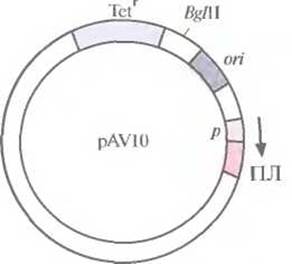
Рис. 6.5. Клонирующий вектор pAV10 (без соблюдения масштаба). Показано положение гена устойчивости к тетрациклину (Tetr), сайта рестрикции для эндонуклеазы BglII, сайта инициации репликации (оri), промотора (р) и полилинкера (ПЛ). Встраивание клонированного гена в полилинкер ставит его под контроль промотора Тn5 (p). Стрелка указывает направление транскрипции.