Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
Оптимизация экспрессии генов, клонированных в прокариотических системах
Интеграция чужеродной ДНК в хромосому хозяина
При наличии в клетке плазмиды часть энергетических ресурсов расходуется на ее репликацию, транскрипцию и синтез белков, которые она кодирует. При этом, как правило, многокопийные плазмиды требуют больше энергии, чем малокопийные, и в результате часть клеток в процессе роста популяции утрачивает плазмиды. Клетки, лишившиеся своих плазмид, обычно растут быстрее тех, в которых они сохранились, и в конечном счете оказываются в культуре преобладающими. По прошествии нескольких генераций это отражается на количестве синтезируемого продукта клонированного гена. Разработано по крайней мере два подхода к решению этой проблемы. В лабораторных условиях для сохранения плазмид клетки выращивают в присутствии антибиотиков или метаболитов, обеспечивающих рост только тех клеток, в которых есть плазмида. Однако добавление антибиотиков и каких-то других веществ в культуры, выращиваемые в больших объемах, или в промышленные ферментеры приводит к значительному удорожанию конечного продукта. Особенно важно, чтобы клонированные гены сохранялись, не утрачиваясь и не передаваясь другим микроорганизмам, в том случае, когда сконструированный микроорганизм предназначен для использования вне стен лаборатории. Он должен не только оставаться эффективным, но и быть экологически безопасным. Включение клонированной ДНК в хромосомную ДНК хозяйского организма позволяет обойтись без плазмид и избежать утраты плазмидных генов. При встраивании нужного гена в хромосомную ДНК хозяина нужно позаботиться о том, чтобы сайт интеграции не находился внутри гена, кодирующего важную клеточную функцию. Для этого чужеродный ген включают в заведомо несущественный сайт. Кроме того, для обеспечения эффективной экспрессии его помещают под контроль регулируемого промотора. Для интеграции в нужный сайт вводимый ген должен содержать нуклеотидную последовательность длиной не менее 50 нуклеотидов, сходную с таковой в хромосомной ДНК, в пределах которых и должен произойти физический обмен (рекомбинация) между двумя молекулами ДНК. Вкратце процесс интеграции состоит в следующем.
1. Идентификация подходящего сайта интеграции, т. е. сегмента хозяйской ДНК, последовательность которого может быть прервана без ущерба для функционирования клетки.
2. Выделение и клонирование всего хромосомного сайта интеграции или его части.
3. Встраивание нужного гена вместе с регулируемым промотором в клонированный сайт интеграции (рис. 6.15, А) или вблизи него (рис. 6.15, Б).
4. Перенос полученной генетической конструкции «хромосомный сайт интеграции/клонированный ген» в хозяйскую клетку в составе плазмиды, не способной к автономной репликации в клетках этого хозяина.
5. Отбор и сохранение тех хозяйских клеток, которые экспрессируют клонированный ген. Наследование клонированного гена возможно только в случае его интеграции в хромосому клеток хозяина.
Если клетка трансформирована нереплицируюшейся плазмидой, несущей клонированный ген в середине клонированного фрагмента с хромосомным сайтом интеграции, то может произойти спаривание между гомологичными нуклеотидными последовательностями плазмиды и хозяйской ДНК (рис. 6.15, А) и далее интеграция в результате двойного кроссинговера, осуществляемого ферментами клетки-хозяина. Альтернативный вариант — интеграция всей плазмидной ДНК в хромосому хозяина в результате одиночного кроссинговера (на рисунке не показано). Интеграция всей плазмиды может произойти и в том случае, если клонированный ген встроен вблизи клонированного хромосомного сайта интеграции.
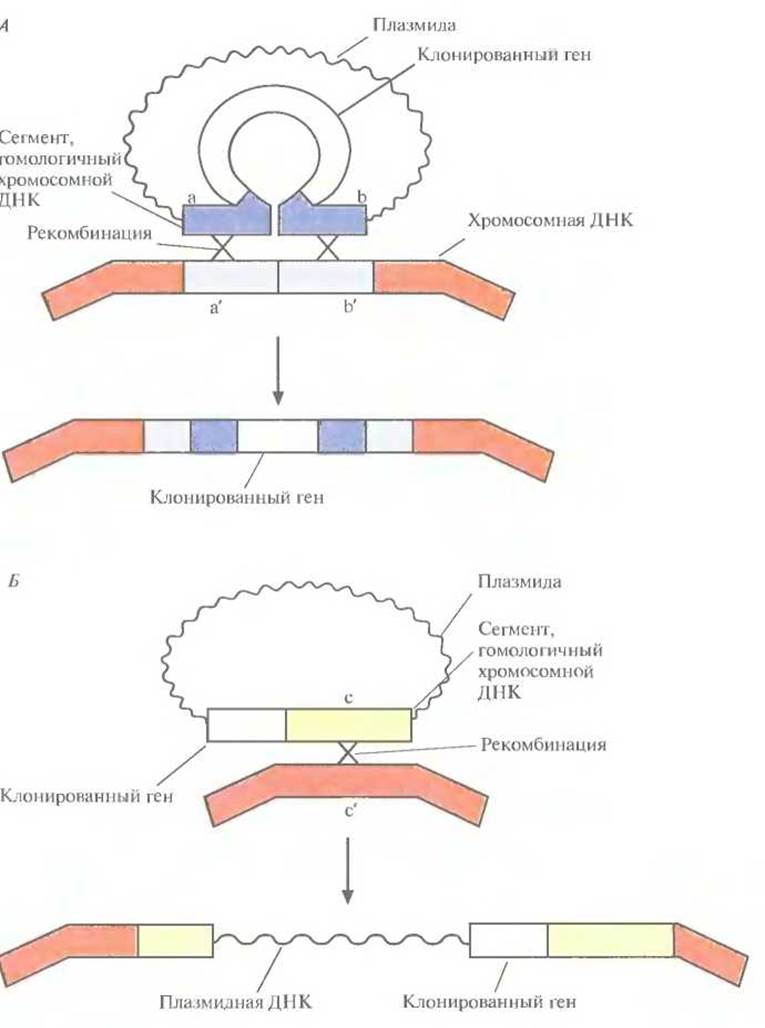
Рис. 6.15. Два способа интеграции клонированного в плазмиде гена в хромосому. А. Ген встроен в середину клонированного в плазмиде сегмента ab, гомологичного сегменту a' b' в хромосомной ДНК. В результате двойного кроссинговера (Х-Х) клонированный ген оказывается в составе хромосомы. Б. Ген встроен вблизи клонированного в плазмиде сегмента с, гомологичного сегменту с' в хромосомной ДНК. В результате одиночного кроссинговера (X) происходит интеграция в хромосому всей плазмиды вместе с включенным в нее геном.
Для проверки эффективности интеграции клонированного гена использовали В. subtilis. Была сконструирована плазмида Е. coli, содержащая ген а-амилазы (фермента, участвующего в гидролизе крахмала) Bacillus amyloliquefaciens, встроенный в середину фрагмента ДНК из В. subtilis. Она была неспособна реплицироваться в этом микроорганизме, но ею можно было трансформировать клетки В. subtilis. Обнаруженные трансформанты синтезировали а-амилазу, что свидетельствует об интеграции гена, кодирующего данный фермент, в хромосому В. subtilis, и о его функционировании. Отобранные рекомбинанты были устойчивы к ампициллину и хлорамфениколу. Поскольку оба гена устойчивости находились в плазмиде, было очевидно, что произошла одиночная рекомбинация, в результате которой вся плазмида включилась в хромосомную ДНК В. subtilis.
Чтобы увеличить число копий гена а-амилазы, локализованных в хромосоме В. subtilis, исходные трансформанты выращивали в присутствии хлорамфеникола в высокой концентрации. В таких условиях выживали только те клетки, в которых происходила спонтанная дупликация интегрированной плазмиды. Клетки, отобранные по признаку устойчивости к хлорамфениколу, проверяли на активность а-амилазы (табл. 6.5). После такой процедуры были получены клетки, содержащие до 9 копий гена а-амилазы. Уровень ферментативной активности в клетках, содержащих а-амилазные гены в составе хромосомы, была гораздо выше, чем в том случае, когда эти гены находились в многокопийной плазмиде (от 20 до 40 копий на клетку) В. subtilis. В одном из исследований несколько копий чужеродного гена было встроено в разные заранее выбранные сайты в хромосоме В. subtilis, при этом для каждой из копий использовалась двухэтапная процедура (рис. 6.16). На первом этапе выбирали селективный маркерный ген (например, ген устойчивости к какому-либо антибиотику) и встраивали его в середину вполне определенного, но несущественного фрагмента хромосомной ДНК В. subtilis в составе плазмидного вектора, не способного к репликации в этом микроорганизме. Отбирали клетки, экспрессирующие маркерный ген, т. е. клетки, у которых этот ген включился в хромосомную ДНК. На втором этапе ген-мишень с соответствующими сигналами инициации транскрипции и трансляции, введенный в середину такого же, как и выше, несущественного фрагмента хромосомной ДНК В. subtilis в составе плазмиды, включали в хромосомную ДНК с помощью рекомбинации, заменив им маркерный ген. Отбирали клетки, которые уже не экспрессировали маркерный ген, т. е. несли вместо него ген-мишень, интегрированный в хромосомную ДНК. Для интеграции других копий гена-мишени в хромосомную ДНК хозяйской клетки повторяли эту процедуру, используя другие несущественные области ДНК.
Таблица 6.5. Связь между числом копий гена а-амилазы и уровнем ее активности в клетках В. subtilis1)
|
Число копий на геном |
Активность, ЕД на 1 мл культуры, находящейся в середине экспоненциальной фазы |
|
2 |
500 |
|
5 |
2300 |
|
7 |
3100 |
|
8 |
3400 |
|
9 |
4400 |
|
Многокопийная плазмида |
700 |
1) По данным работы Kallio et аl. 1987. Appl. Microbiol. Biotechnol. 27: 64-71.
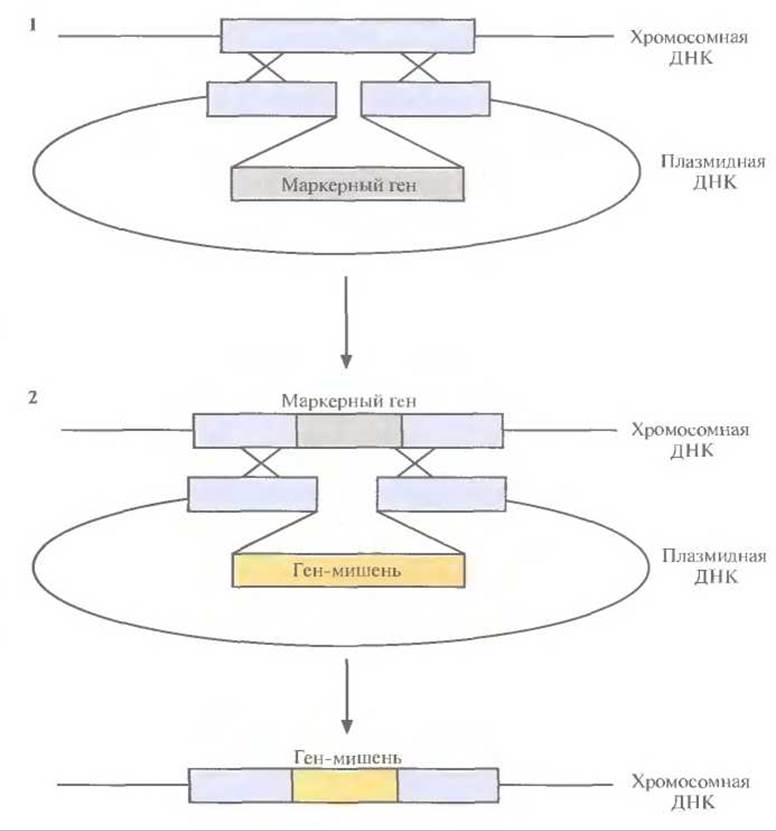
Рис. 6.16. Встраивание чужеродного гена в заранее выбранный сайт в хромосоме В. subtilis. На этапе 1 в хромосомную ДНК хозяйской клетки с помощью гомологичной рекомбинации встраивают маркерный ген. На этапе 2 маркерный ген замещают геном-мишенью. Аналогичную операцию повторяют для других сайтов.