Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Биодеградация токсичных соединений и утилизация биомассы
Метаболические пути биодеградации ксенобиотиков, созданные методами генной инженерии
Некоторые микроорганизмы обладают природной способностью к деградации различных ксенобиотиков, однако следует иметь в виду, что:
1) ни один из них не может разрушать все органические соединения; 2) некоторые органические соединения в высокой концентрации подавляют функционирование или рост деградирующих их микроорганизмов; 3) большинство очагов загрязнения содержит смесь химикатов, и микроорганизм, способный разрушать один или несколько ее компонентов, может инактивироваться другими компонентами; 4) многие неполярные соединения адсорбируются частицами почвы и становятся менее доступными; 5) биодеградация органических соединений часто происходит довольно медленно. Часть этих проблем можно решить, осуществив конъюгационный перенос плазмид, которые кодируют ферменты разных катаболических путей, в один реципиентный штамм (рис. 13.5). Если две плазмиды содержат гомологичные участки, то между ними может произойти рекомбинация с образованием гибридной плазмиды, которая имеет больший размер и обладает свойствами исходных плазмид. Если же две плазмиды не содержат гомологичных участков и относятся к разным группам несовместимости, то они могут сосуществовать в одной бактерии.
Перенос плазмид
В 1970-х гг. Чакрабарти и его коллегами был создан первый бактериальный штамм, обладающий более широкими катаболическими возможностями. Он расщеплял большинство углеводородов нефти и был назван «супербациллой». Для его получения использовали плазмиды, каждая из которых кодировала фермент, расщепляющий определенный класс углеводородов: плазмида САМ детерминировала деградацию камфары, ОСТ — октана, NAH — нафталина, XYL — ксилола (рис. 13.5). Сначала путем конъюгации перенесли плазмиду САМ в штамм, несущий плазмиду ОСТ. Эти две плазмиды несовместимы (не могут существовать в одной клетке в виде отдельных плазмид), но в результате происходящей между ними рекомбинации образуется одна плазмида, объединяющая их функции. Затем аналогичным путем плазмиду NAH перенесли в штамм, несущий плазмиду XYL. Эти плазмиды совместимы и могут сосуществовать в одной клетке-хозяине. И наконец, гибридную плазмиду перенесли в штамм, несущий плазмиды NAH и XYL. В результате всех этих манипуляций получили штамм, который растет на неочищенной нефти лучше исходных штаммов, взятых по отдельности или вместе.
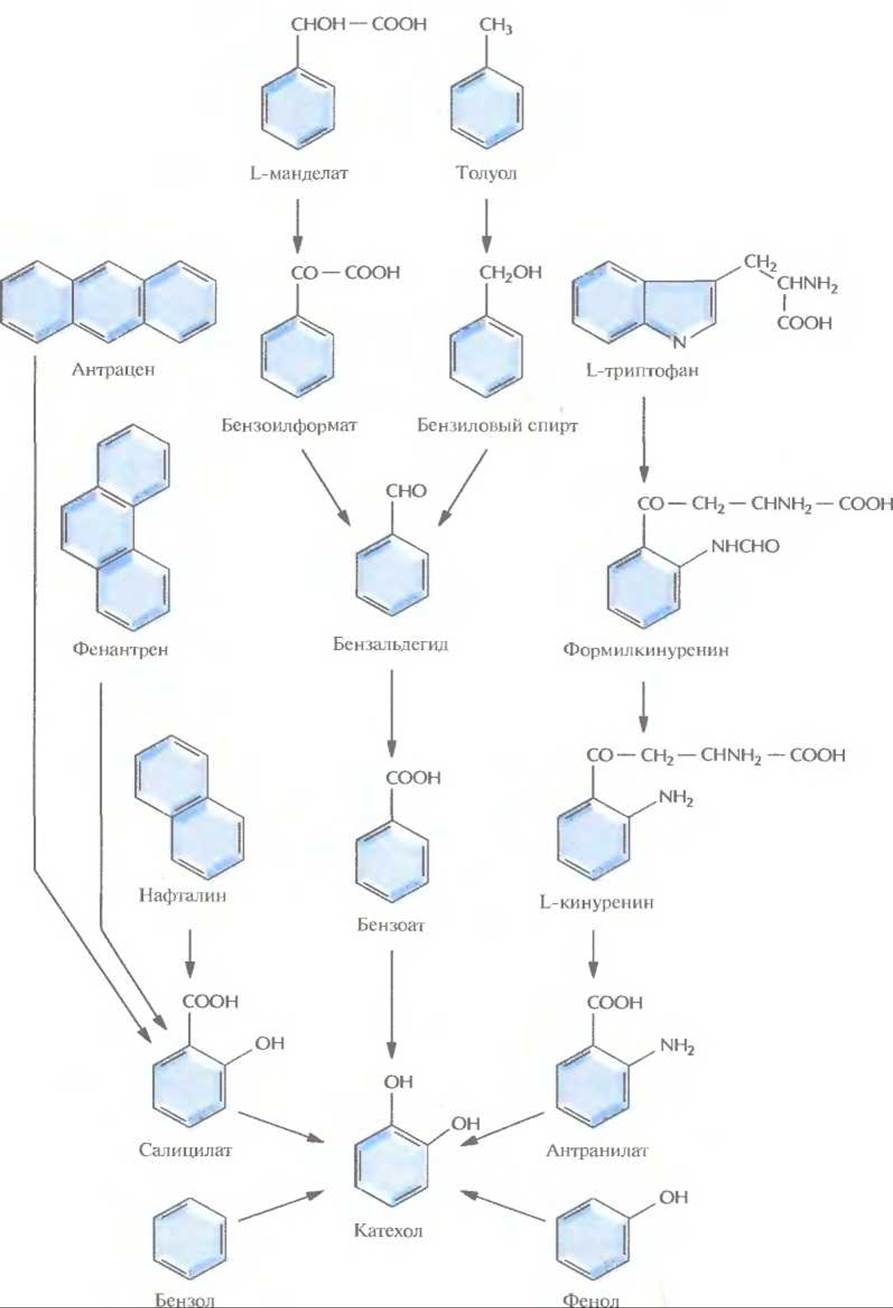
Рис. 13.1. Пути ферментативного превращения ароматических соединений в катехол бактериями, разрушающими ксенобиотики.
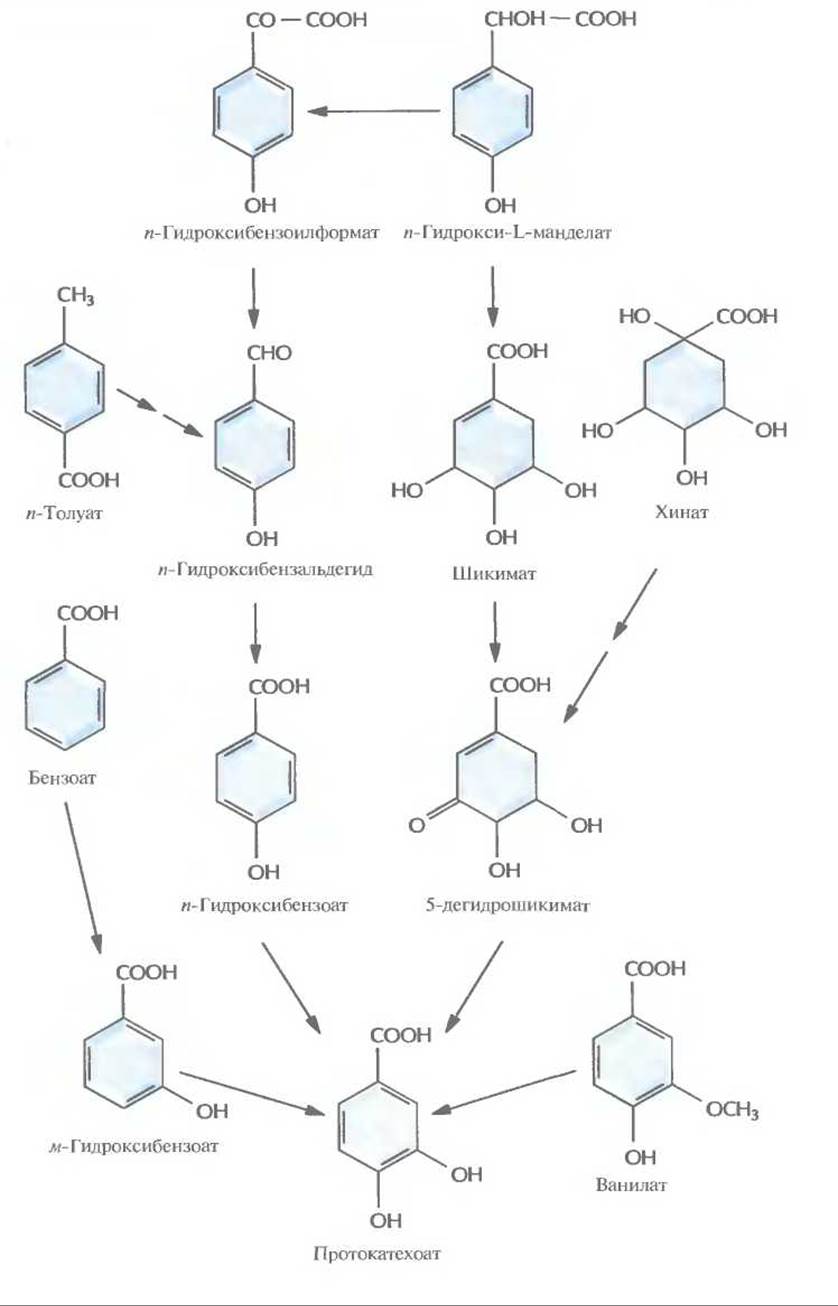
Рис. 13.2. Пути ферментативного превращения ароматических соединений в протокатехоат бактериями, разрушающими ксенобиотики.
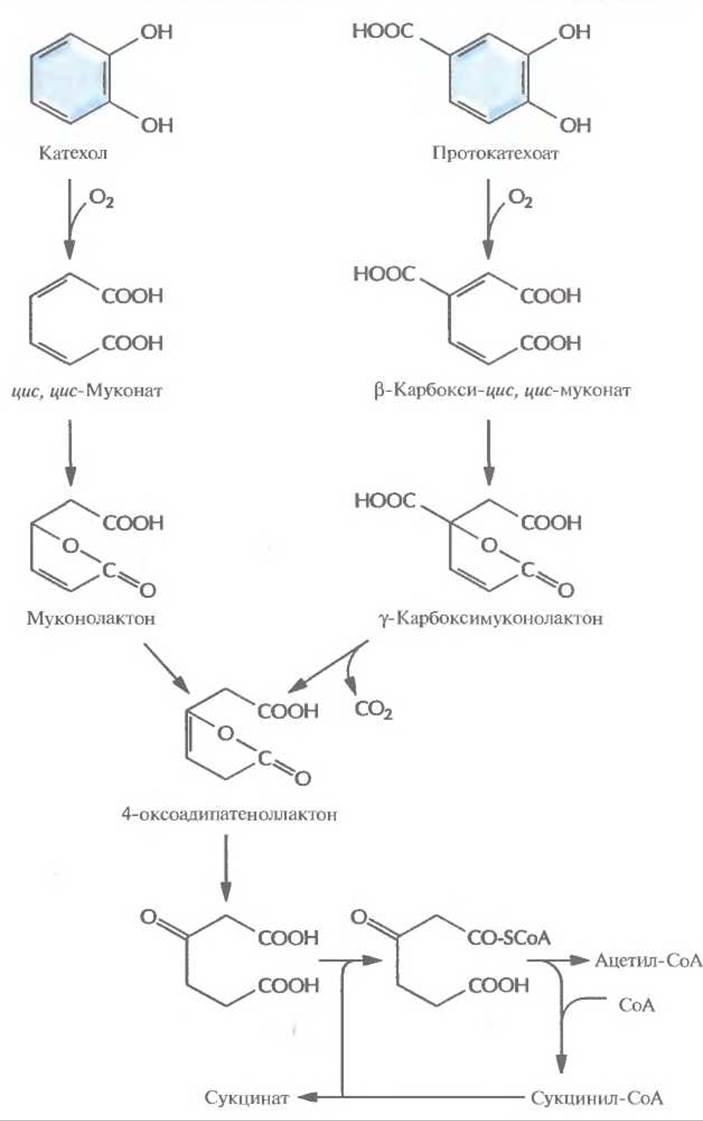
Рис. 13.3. Путь opmo-расщепления при ферментативном превращении катехола и протокатехоата в ацетил-CoA и сукцинат.
Хотя сам этот штамм не использовали для ликвидации нефтяных загрязнений, он сыграл важную роль в становлении биотехнологической промышленности. Изобретатель «супербациллы» получил патент США, описывающий структуру данного штамма и возможности его применения. Это был первый патент, выданный за создание генетически модифицированного микроорганизма и подтвержденный Верховным судом США, который проиллюстрировал, что биотехнологические компании могут защищать свои изобретения точно так же, как химические и фармацевтические.
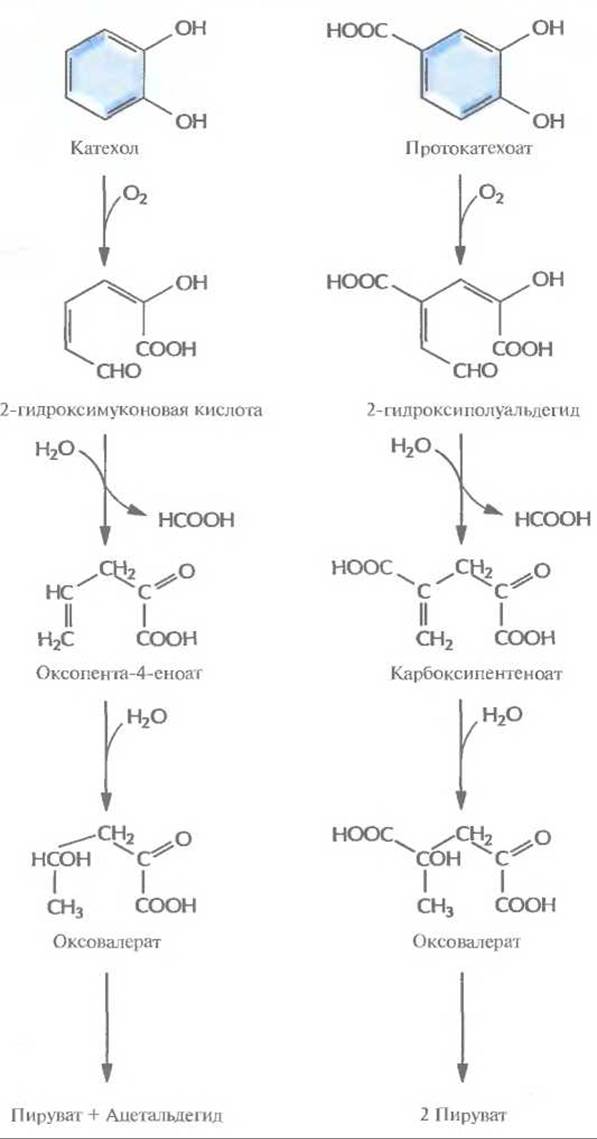
Рис. 13.4. Путь мета-расщепления при ферментативном превращении катехола и протокатехоата в пируват и ацетальдегид.
Большинство разрушающих ксенобиотики бактерий, модифицированных путем переноса плазмид, являются мезофильными микроорганизмами (хорошо растут при 20—40 °С), а температура воды в загрязненных реках, озерах и океанах обычно лежит в диапазоне от 0 до 20 °С.
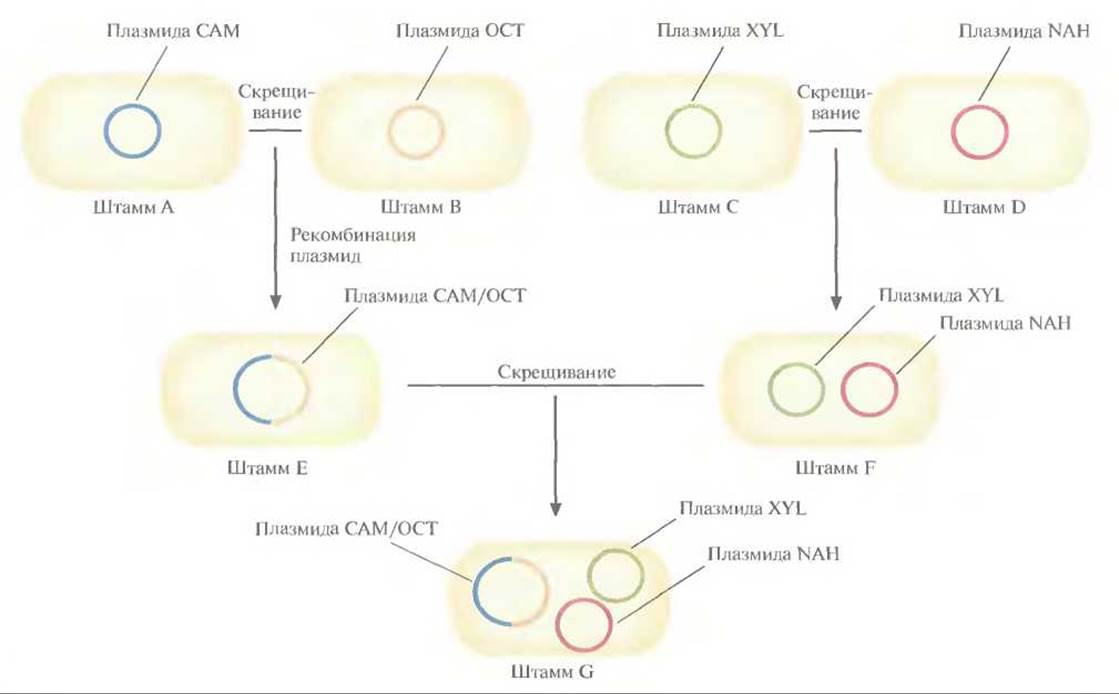
Рис. 13.5. Создание бактериального штамма, способного разрушать камфару, октан, ксилол и нафталин. Штамм А, несущий плазмиду САМ (она детерминирует разрушение камфары), скрещивают со штаммом В, несущим плазмиду ОСТ (разрушение октана). При этом образуется штамм Е, который содержит гибридную плазмиду, образовавшуюся в результате гомологичной рекомбинации между исходными плазмидами и обладающую функциями каждой из них. Штамм С, содержащий плазмиду XYL (разрушение ксилола), скрещивают со штаммом D, содержащим плазмиду NAH (разрушение нафталина), и получают штамм F, который несет обе эти плазмиды. Наконец, скрещивают штаммы Е и F, в результате чего образуется штамм G, содержащий плазмиды САМ/ОСT, XYL и NAH.
Чтобы проверить, можно ли создать бактерию, обладающую более широкими катаболическими возможностями и в то же время способную расти и развиваться при низких температурах, плазмиду ТОL (детерминирует разрушение толуола) мезофильного штамма Pseudomonas putida перенесли с помощью конъюгации в психрофильный (с низким температурным оптимумом) штамм, утилизирующий салицилат при температуре, близкой к О °С. Трансформированный штамм содержал введенную в него плазмиду TOL и собственную плазмиду SAL, детерминирующую разрушение салицилата, и был способен утилизировать как салицилат, так и толуол в качестве единственного источника углерода при 0°С (табл. 13.2). Психрофильный штамм дикого типа (нетрансформированный) не мог расти при любой температуре, если единственным источником углерода был толуол (толуат). Эта работа показала принципиальную возможность создания психрофильных штаммов бактерий, эффективно разрушающих ксенобиотики в природных условиях, но для их реального получения необходимо провести дополнительные исследования.
Изменение генов
Объединение разных метаболических путей в одном микроорганизме с помощью конъюгации — это лишь один из способов создания бактерий с новыми свойствами. Расширить их катаболические возможности можно и другим путем, модифицируя гены, кодирующие ферменты того или иного метаболического пути. Осуществимость этого подхода проверяли на примере плазмиды pWWO, 12 генов которой кодируют мета-расщепление толуола и ксилола. Обладающие этой плазмидой псевдомонады могут использовать в качестве источника углерода алкилбензоаты (рис. 13.6). Указанные гены входят в состав одного хуl-оперона, находящегося под контролем Pm-промотора. Транскрипционная активность последнего находится под позитивным контролем продукта гена xylS, активируемого почти всеми субстратами данного метаболического пути (например, бензоатом и 3-метилбензоатом) (рис. 13.6). Детальный биохимический и генетический анализ показал, что несущие pWWO-плазмиду бактерии могут расщеплять 4-этил-бензоат только до 4-этилкатехола, который инактивирует один из основных ферментов данного метаболического пути, катехол-2,3-диоксигеназу, являющуюся продуктом гена xylE, и поэтому не разрушается и накапливается в среде. Кроме того, 4-этилбензоат, в отличие от остальных алкилбензоатов, не активирует XylS-белок; поэтому, если он является единственным субстратом, хуl-оперон не транскрибируется. Для усовершенствования природной системы мета-расщепления алкилбензоатов необходимо решить две основные задачи: 1) предотвратить инактивацию катехол-2,3-диоксигеназы 4-этил-бензоатом; 2) индуцировать транскрипцию генов хуl-оперона в том случае, если единственным субстратом является 4-этилбензоат.
Таблица 13.2. Время генерации дикого и трансформированного психрофильных штаммов Р. putida, использующих в качестве единственного источника углерода салицилат или толуат, при разных температурах1)
|
Температура, °С |
Время генерации, ч |
||
|
штамм дикого типа, салицилат2) |
трансформированный штамм, салицилат |
трансформированный штамм, толуат |
|
|
37 |
Не растет |
Не растет |
Не растет |
|
30 |
2,2 |
2,5 |
2,0 |
|
25 |
2,1 |
3,2 |
1,3 |
|
20 |
2,6 |
3,8 |
1,9 |
|
15 |
3,2 |
4,2 |
2,9 |
|
10 |
6,3 |
5,6 |
3,3 |
|
5 |
13,9 |
12,9 |
12,2 |
|
0 |
18,6 |
18,1 |
24,4 |
1) Из работы Koletic et al, Appi Environ. Microbiol. 54: 638-641, 1988 с изменениями.
2) Штамм дикого типа не может утилизировать толуат ни при какой температуре, поскольку у него отсутствуют необходимые для этого ферменты.
Для решения второй задачи был проведен поиск мутантной плазмиды. Для этого в плазмиду, несущую ген устойчивости к ампициллину, встроили ген устойчивости к тетрациклину, находящийся под контролем Pm-промотора. В другую плазмиду, несущую ген устойчивости к канамицину, встроили ген xylS. Полученными конструкциями трансформировали Е. coli, отобрали клетки, содержащие обе плазмиды, по признаку устойчивости к ампициллину и канамицину (рис. 13.7, А), обработали их мутагеном этилметансульфонатом и вырастили на среде, содержащей тетрациклин и 4-этилбензоат. Растущие на этой среде клетки содержат мутантный ген xylS и продуцируют измененный XylS-белок (S*), который способен взаимодействовать с 4-этилбензоатом и активировать транскрипцию гена устойчивости к тетрациклину. Чтобы решить проблему инактивации катехол-2,3-диоксигеназы, мутантный ген xylS встроили в плазмиду с широким кругом хозяев, несущую ген устойчивости к канамицину, и ввели ее в клетки Р. putida, содержащие плазмиду pWWO (рис. 13.7, Б). Трансформированные клетки высеяли с высокой плотностью на чашки с минимальной средой, содержащей 4-этилбензоат в качестве единственного источника углерода, канамицин для отбора клеток с плазмидой и этилметансульфонат. Клетки, растущие на этой среде, вырабатывают измененную катехол-2,3- диоксигеназу, которая не ингибируется 4-этил-катехолом. Дополнительный анализ подтвердил, что в гене катехол-2,3-диоксигеназы pWWO действительно произошла мутация и что два мутантных гена (xylS и ген катехол-2,3-диоксигеназы) обеспечивают расщепление 4-этил-бензоата.
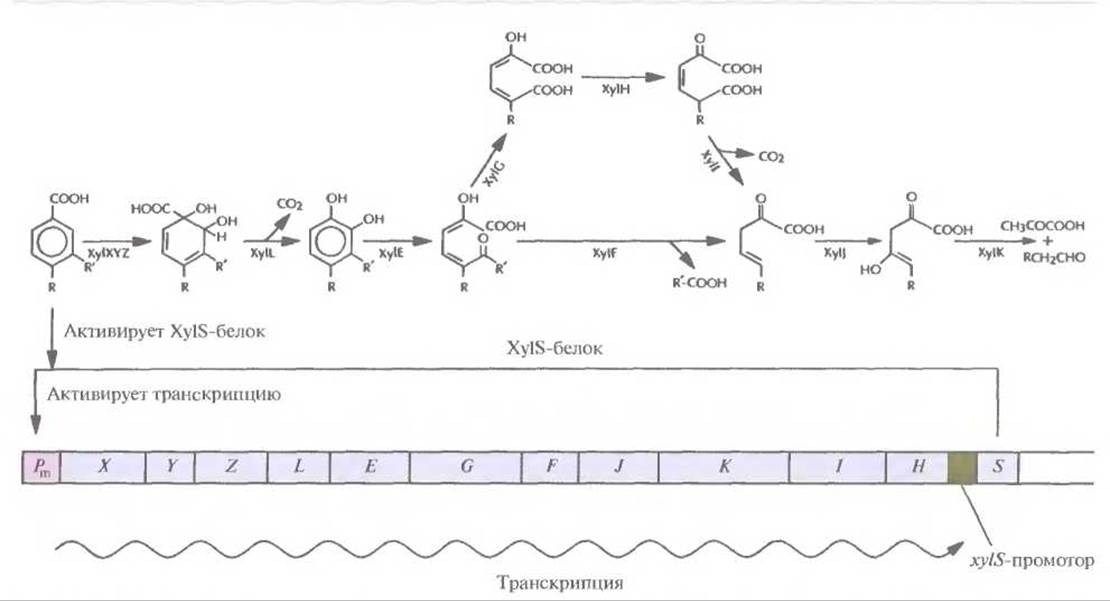
Рис. 13.6. Путь мета-расщепления толуола и ксилола и хуl-оперон плазмиды pWWO. хуl-Оперон находится под контролем Рm-промотора, который регулируется с помощью продукта гена xylS, в свою очередь активируемого одним из исходных субстратов. Гены хуlX—хуlH находятся под контролем Pm-промотора. Ген xylS нe входит в состав оперона и экспрессируется конститутивно. Исходным субстратом может быть бензоат (R и R' — это Н), 3-метил-бензоат (R — это Н, R' — это СН3), 3-этилбензоат (R — это H, R' — это СН2СН3) и 4-метилбензоат (R — это СН3, R' — это Н) Гены xylXYZ кодируют толуолдиоксигеназу, xylL — дигидроксициклогексадиенкарбоксилатдегидрогеназу, xylE — катехол-2,3-диоксигеназу, xylF— гидролазу полуальдегида гидроксимуконовой кислоты, xylG — дигидрогеназу полуальдегида гидроксимуконовой кислоты, хуlH — 4-оксалокротонат-таутомеразу, xyll — 4-оксалокротонатдекарбоксилазу, xylJ — 2-оксопента-4-еноатгидратазу, xylK — 2-оксо-4-гидроксипентонатальдолазу.
Оба модифицированных гена участвуют в процессе деградации всех субстратов данного метаболического пути. Поэтому стратегия, использованная для повышения эффективности расщепления 4-этилбензоата, применима и в случае других соединений: мутация, приводящая к гиперпродукции XylS-белка, может усиливать активацию Рm- промотора и повышать скорость разрушения субстрата; кроме того, можно избирательно модифицировать Pm-промотор, чтобы он стал более сильным, сохранив способность взаимодействовать с XylS-белком. Таким образом, проведенная работа показывает, что вполне реально усовершенствование того или иного катаболического пути с помощью технологии рекомбинантных ДНК, традиционного мутагенеза и соответствующих методов отбора.
Одним из наиболее распространенных веществ, загрязняющих почву и воду, является трихлорэтилен, широко использующийся в качестве растворителя и обезжиривающего средства. Он длительное время остается в окружающей среде и считается канцерогеном. Кроме того, анаэробные почвенные бактерии могут дегалогенировать его, превращая в еще более токсичное соединение винилхлорид. Было показано, что некоторые штаммы Р. putida, разрушающие ароматические соединения, такие как толуол, разрушают и трихлорэтилен. С помощью проведенных генетических исследований удалось установить, что для полной детоксикации трихлорэтилена не нужны все ферменты мета-расщепления ксилола и толуола, достаточно лишь толуолдиоксигеназы, которая в норме катализирует реакцию окисления толуола до цис-толуолдигидродиола.
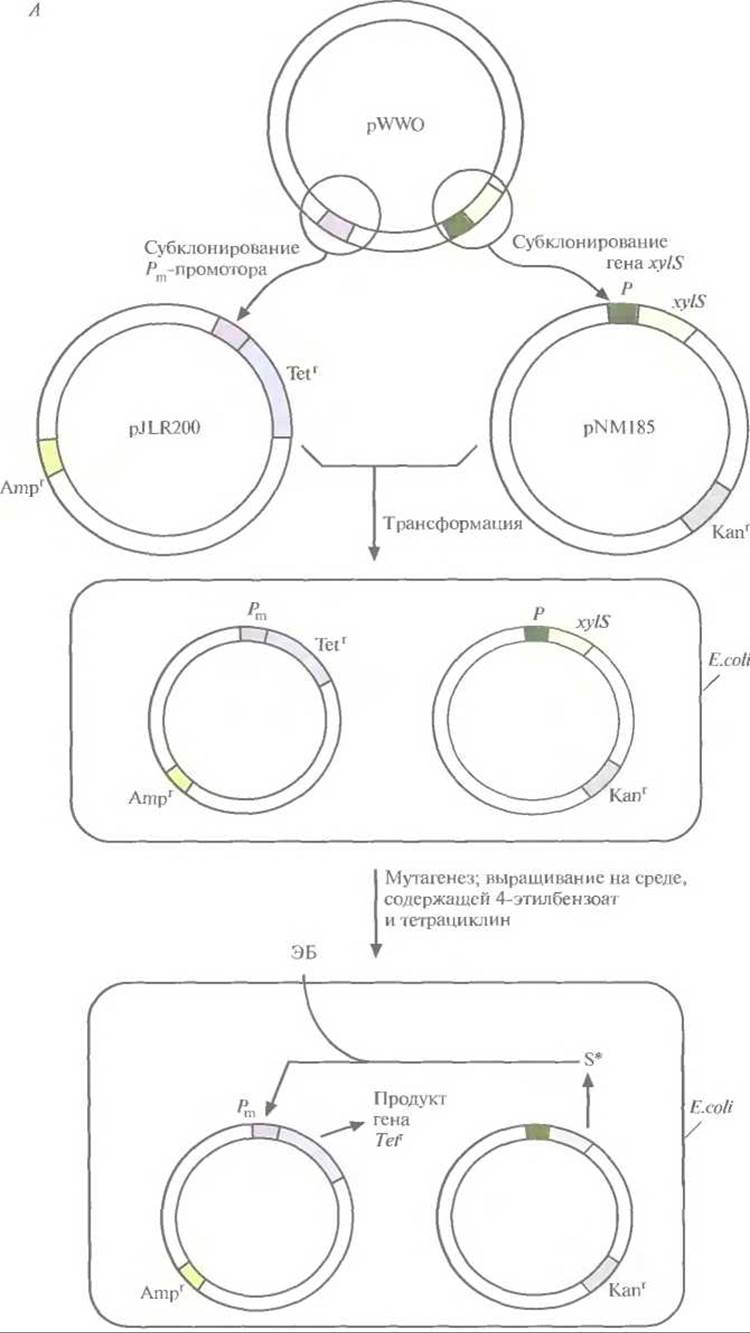
Рис. 13.7. А. Создание системы синтеза XylS-белка, активируемого 4-этилбензоатом. Сначала заменяют промотор гена устойчивости к тетрациклину в плазмиде pßR322 Pm-промотором и получают плазмиду pJLR200. Затем ген xylS с собственным промотором встраивают в плазмиду с широким кругом хозяев, несущую ген устойчивости к канамицину. Полученными плазмидами трансформируют Е. coli. Отбирают трансформированные клетки по признаку устойчивости к ампициллину и канамицину и подвергают мутагенному действию этилметансульфоната. В клетках, несущих мутантный ген xylS (S*), XylS-белок активируется 4-этилбензоатом (ЭБ), активируя в свою очередь Рm-промотор, поэтому они могут расти на среде, содержащей 4-этилбензоат и тетрациклин.
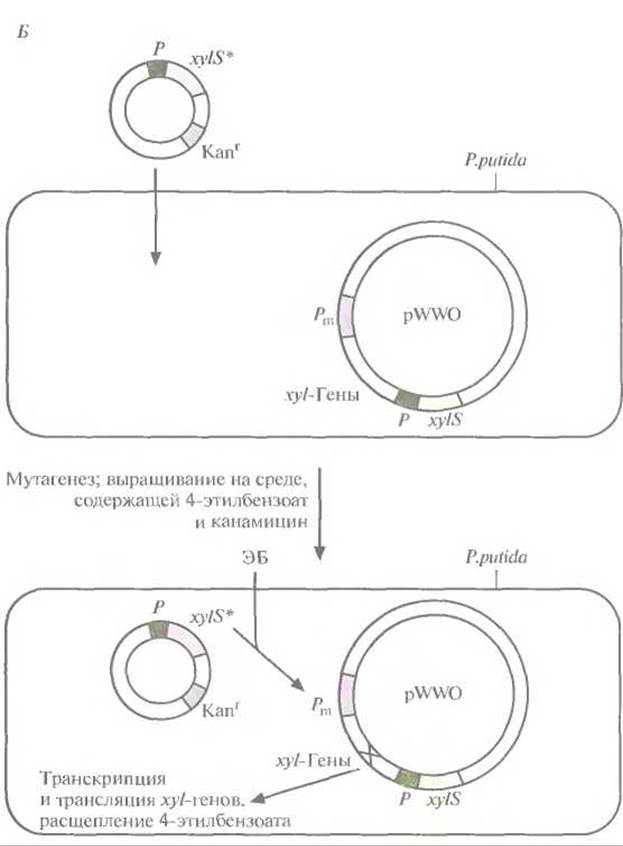
Рис. 13.7. (Продолжение) Б. Создание системы синтеза модифицированной катехол-2,3-диоксигеназы, которая не ингибируется 4-этилкатехолом. Штамм Р. putida, несущий плазмиду pWWO, трансформируют плазмидой с широким кругом хозяев, содержащей мутантный ген xylS*. продукт которого активирует Рm-промотор. Проводят химический мутагенез трансформированных клеток и выращивают их на минимальной среде, содержащей 4-этилбензоат и канамицин. Клетки, растущие на этой среде, содержат мутантный ген катехол-2,3-диоксигеназы (мутация X в середине хуl-оперона).
Образование функциональной толуолдиоксигеназы кодируется четырьмя генами (рис. 13.8, А). Их выделили и экспрессировали в Е. coli под контролем сильного индуцибельного tас-промотора, который активируется изопропил-β-D-тиогалактопиранозидом (ИПТГ), в результате чего трихлорэтилен разлагается до безвредных соединений. Исходная скорость деградации трихлорэтилена в Е. coli ниже, чем в Р. putida, но она сохраняется в Е. coli дольше. С этим различием может быть связана меньшая, чем у Р. putida, чувствительность Е. coli к повреждающему действию трихлорэтилена. В одном из вариантов этого эксперимента был создан рекомбинантный штамм Pseudomonas, в котором были объединены элементы двух разных катаболических путей. Бактериальные штаммы, способные разрушать бифенил, содержат бифенилдиоксигеназу. В состав этого ферментного комплекса входят состоящая из двух субъединиц терминальная диоксигеназа, ферредоксин и ферредоксин редуктаза. По своим структуре и функции бифенилдиоксигеназа сходна с толуолдиоксигеназой, однако утилизирующие бифенил псевдомонады не могут расти на толуоле, а штаммы, утилизирующие толуол, не растут на бифениле. После того как в штамме KF715 Р. putida ген bphAl, кодирующий большую субъединицу бифенилдиоксигеназы, был заменен с помощью гомологичной рекомбинации на кодирующий большую субъединицу толуолдиоксигеназы ген todCI из штамма F1 Р. putida, получили штамм, способный эффективно разрушать трихлорэтилен (табл. 13.3). Кроме того, этот штамм растет на многих ароматических соединениях, а следовательно, есть возможность создания микроорганизмов, способных разрушать сразу несколько разных соединений.
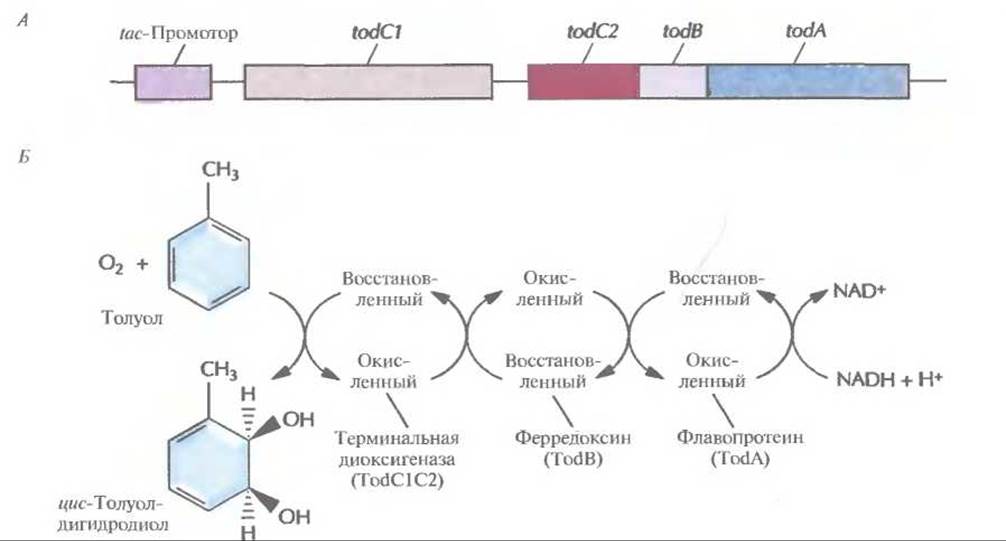
Рис. 13.8. А. Клонированный оперон толуолдиоксигеназы, находящийся под контролем tac-промотора Е. coli. Образование толуолдиоксигеназы обеспечивают четыре гена (todA, todB, todC1 и todC2). Ген todA кодирует флавопротеин, который акцептирует электроны с восстановленного никотинамидадениндинуклеотида (NADH) и переносит их на ферредоксин. Последний кодируется геном todB и восстанавливает терминальную диоксигеназу, кодируемую генами todC1 и todC2. Эти гены эквивалентны генам xylXYZна рис. 13.6, Б. Превращение толуола в цис-толуолдигидродиол в результате совместного действия Tod-белков.