Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Биодеградация токсичных соединений и утилизация биомассы
Утилизация целлюлозы
Структурный каркас почти всех наземных растений состоит из полимеров: лигнина, гемицеллюлозы и целлюлозы. Объединяясь в разных пропорциях, они образуют лигноцеллюлозный материал (табл. 13.8), на долю которого приходится основная часть биомассы, остающейся в огромном количестве в виде отходов сельского хозяйства, деревообрабатывающей промышленности и других отраслей хозяйственной деятельности человека. Эти отходы необходимо переработать или использовать в качестве промышленного сырья. С этой точки зрения лигноцеллюлозные материалы можно разделить на три класса.
✵ Сами растения, специально выращиваемые для получения целлюлозы, строительных материалов или корма для скота (хлопок, древесина, сено).
✵ Растительные отходы, остающиеся после сбора и переработки урожая и после обработки древесины (солома, рисовая шелуха, багасса сахарного тростника, древесная щепа, опилки и т. д.).
✵ Бытовые отходы (использованные бумага, картон и т. д.).
Таблица 13.8. Состав разных лигноцеллюлозных материалов1)
|
Сырье |
Содержание, % |
||
|
лигнин |
целлюлоза |
гемицеллюлоза |
|
|
Сосновая древесина |
27,8 |
44,0 |
26,0 |
|
Березовая древесина |
19,5 |
40,0 |
39,0 |
|
Багасса сахарного тростника |
18,9 |
33,4 |
30,0 |
|
Рисовая солома |
12,5 |
32,1 |
24,0 |
|
Хлопок |
Не содержит 80—95 |
5-20 |
|
1) Из работы Brown, Philos. Trans. R. Soc. Lond. Б. 300: 305—322, 1983.
Компоненты лигноцеллюлозы
Лигнин — глобулярный нерегулярный нерастворимый полимер (мол. масса >10 000), состоящий из остатков фенилпропана (рис. 13.13). Молекулы этого ароматического вещества при образовании лигнина соединяются друг с другом случайным образом с помощью разных химических связей, не поддающихся ферментативному гидролизу или химическому расщеплению. У растений лигнин образует комплекс с гемицеллюлозой, в который заключены проводящие пучки. Лигнин обусловливает ригидность растений, а также их устойчивость к механическим повреждениям и действию микробов.
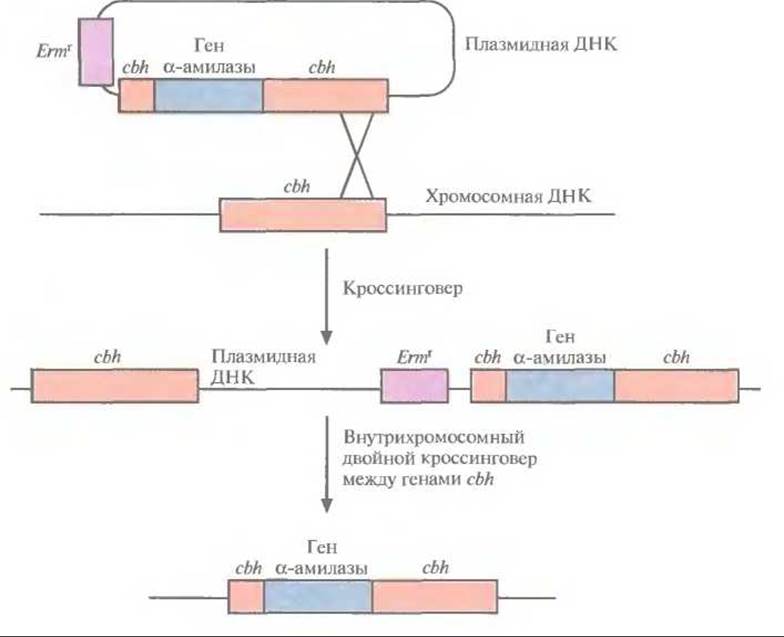
Рис. 13.12. Введение гена a-амилазы в хромосому L. plantarum. Ген а-амилазы встраивают в ген cbh челночной плазмиды Е. coli—L. plantarum, которой затем трансформируют клетки L. plantarum. В результате кроссинговера между сbh-локусами плазмидной и хромосомной ДНК образуются клоны L. plantarum, устойчивые к эритромицину и обладающие а-амилазной активностью. При выращивании трансформированных клеток в течение достаточно длительного времени (не менее 30 генераций) в неселективных условиях может произойти внутрихромосомный двойной кроссинговер, приводящий к элиминации гена устойчивости к эритромицину Еrmr, хромосомного гена cbh и плазмидной ДНК.
Гемицеллюлозы — это короткоцепочечные гетерогенные полимеры, состоящие из гексозных (шестиуглеродные сахара, такие как глюкоза, манноза и галактоза) и пентозных (пятиуглеродные сахара, такие как ксилоза и арабиноза) единиц. Все гемицеллюлозы можно разделить на три основных типа: ксиланы, остов которых состоит из молекул поли-ß-1,4-ксилана с присоединенными к ним арабинозой, глюкуроновой и арабиноглюкуроновой кислотами; маннаны, состоящие из глюкоманнанов и галактоманнанов; арабиногалактаны. Тип гемицеллюлозы обычно зависит от ее происхождения; так, ксиланы обычно содержатся в твердых сортах древесины, а глюкоманнаны — в мягких.
Целлюлоза, наиболее простой компонент дигноцеллюлозы, является самым распространенным природным полимером. Его длинные цепи состоят из остатков D-глюкозы, соединенных ß-1,4-связями (рис. 13.14). При гидролизе из целлюлозы, как и из крахмала, образуется глюкоза, но сами эти исходные вещества имеют разное строение. Крахмал — запасающая энергию молекула, остатки глюкозы в которой соединены так, что полимерные цепи не могут располагаться упорядоченно и образуют сетчатую структуру, легко пропускающую воду; поэтому он растворяется в воде и легко гидролизуется амилазами и глюкоамилазами. В целлюлозе полимерные цепи упакованы так, что образуется кристаллоподобная структура, непроницаемая для воды; поэтому целлюлоза не растворяется в воде и устойчива к гидролизу. Целлюлоза - очень ценный материал, из которого можно получать множество продуктов (например, этанол). Но сначала необходимо высвободить ее из комплекса с лигнином и гемицеллюлозой. Для этого можно обработать лигноцеллюлозный материал сильной кислотой или сильной щелочью либо подвергнуть его действию высоких температуры и давления. В любом случае необходимые для этого энергетические затраты существенно повысят стоимость конечного продукта.
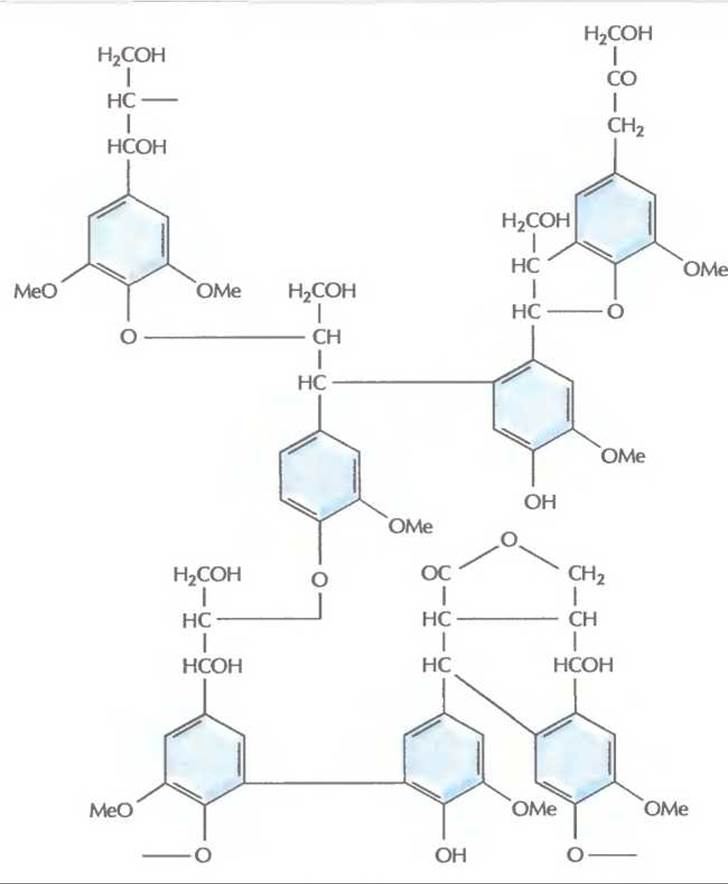
Рис. 13.13. Структура лигнина. Представлены лишь некоторые из возможных способов соединения остатков фенилпропана (шестиуглеродного ароматического соединения, содержащего алкильную группу).
Годовое производство лигноцеллюлозы огромно, поэтому ведется непрерывный поиск более эффективных способов ферментативного расщепления целлюлозы (и, в меньшей степени, гемицеллюлозы). Кроме того, разрабатываются методы избирательного химического и ферментативного растепления лигнина.
Выделение прокариотических целлюлозных генов
Многие бактерии и грибы способны расщеплять целлюлозу благодаря совместному действию нескольких ферментов, называемых целлюлазами.
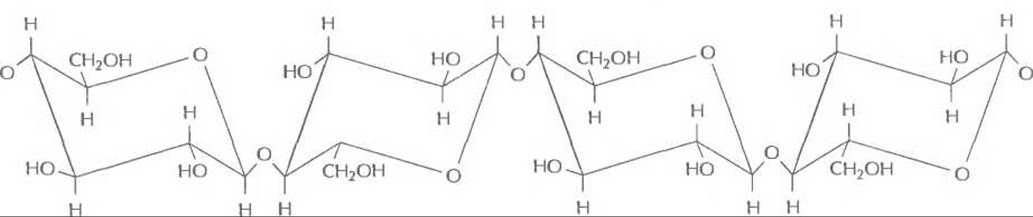
Рис. 13.14. Сегмент полимерной цепи целлюлозы. Остатки глюкозы соединены ß-1,4-связями «голова к хвосту».
У некоторых микроорганизмов они входят в состав целлюлосомы — белкового комплекса, находящегося на клеточной поверхности. Эти ферменты следующие:
✵ эндоглюканаза, которая гидролизует ß-1,4- связи между соседними остатками глюкозы в неплотно упакованных областях целлюлозы, образуя разрывы в середине цепи (рис. 13.15)
✵ экзоглюканаза, которая расщепляет разорванные целлюлозные цепи с нередуцирующих концов с образованием глюкозы, целлобиозы (два остатка глюкозы) и целлотриозы (три остатка глюкозы)
✵ целлобиогидролаза, которая часто присутствует в целлюлолитических грибах и является разновидностью экзо глюканазы, отщепляющей фрагменты из 10 и большего числа остатков глюкозы с не редуцирующих концов молекул целлюлозы
✵ ß-глюкозидаза, или целлобиаза, которая катализирует превращение целлобиозы и целлотриозы в глюкозу (рис. 13.15).
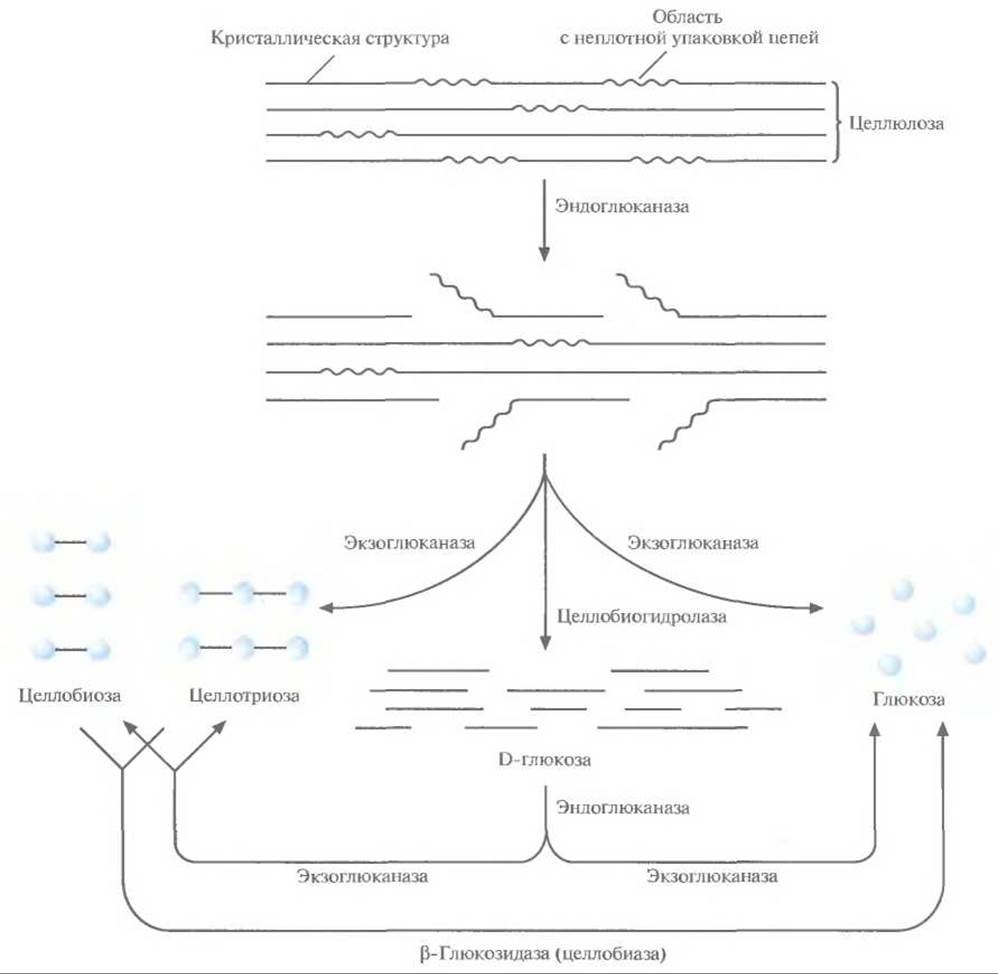
Рис. 13.15. Биодеградация целлюлозы. Гидролиз цепей начинается с расщепления эндоглюканазой ß 1.4-связей в неплотно упакованных областях. Затем экзоглюканаза(ы) и целлобиогидролаза(ы) отщепляют олигосахариды с нередуцируюшего конца частично гидролизованных цепей. Далее ß-глюкозидаза катализирует превращение целлобиозы и целлотриозы в глюкозу.
Расщепление целлюлозы с помощью целлюлолитических микроорганизмов происходит медленно и часто не до конца. Поэтому были предприняты попытки создать с помощью генной инженерии микроорганизмы, обладающие более высокой целлюлазной активностью. Для этого выделили про- и эукариотические гены, кодирующие отдельные ферменты целлюлазного комплекса.
Прокариотические эндоглюканазные гены клонировали и идентифицировали с помощью следующего простого, но эффективного подхода.
1. Клонированием в Е. coli создали банк ДНК- клонов целлюлолитического прокариотического организма и выращивали рекомбинантные клетки в течение 12 ч на твердой среде, содержащей селективный антибиотик.
2. Образовавшиеся колонии покрыли слоем агара, содержащего карбоксиметилцеллюлозу (КМК), растворимое производное целлюлозы, и инкубировали при 37 °С еще несколько часов. За это время произошло частичное расщепление молекул КМК, находящихся вблизи колоний, которые синтезируют и секретируют эндоглюканазу. Трансформированные клетки, синтезирующие, но не секретирующие эндоглюканазу, не способны расщеплять данный субстрат, молекулы которого из-за большого размера не проникают в клетку.
3. Те области, где произошел гидролиз КМК, выявляли с помощью не токсичного для бактерий красителя конго красного и раствора хлорида натрия. Конго красный избирательно связывается с целлюлозой, окрашивая ее в красный цвет, и слабо связывается с низкомолекулярными сахаридами, окрашивая их в желтоватый цвет. Обработка хлоридом натрия стабилизирует цвет. Колонии, продуцирующие секретируемую эндоглюканазу, были окружены желтым гало, а фон, создаваемый нерасщепленной КМК, имел красный цвет.
С помощью этого подхода были выделены гены эндоглюканазы из Streptomyces, Clostridium, Thermoanaerobacter, Thermomonospora, Erwinia, Pseudomonas, Cellvibrio, Ruminococcus, Cellulomonas, Fibrobacter и Bacillus.
Для выявления рекомбинантных клонов, синтезирующих экзоглюканазу, использовали иммунный скрининг, позволяющий идентифицировать белок-мишень с помощью специфичных к нему антител; секреция белка при этом необязательна. Рекомбинантные клетки лизировали in situ (парами хлороформа), перенесли цитоплазматические белки на найлоновый или нитроцеллюлозный фильтр и провели иммунологический тест. Использованный при этом метод реплик позволил сохранить жизнеспособные клетки для дальнейших исследований.
Прокариотические ß-глюкозидазные гены выделяли с помощью трансформации Е. coli банком ДНК-клонов, полученным из продуцирующего данный фермент микроорганизма, и отбора трансформантов, способных расти на минимальной среде с целлобиозой в качестве единственного источника углерода. Клоны, проявляющие ß-глюкозидазную активность, можно также выявлять с помощью среды, содержащей хромогенный субстрат (например, 5- бром-4-хлор-3-индол-β-0-глюкопиранозид), или целлобиозного агара Мак-Конки; в этих условиях колонии окрашиваются в красный цвет.
Выделение эукариотических целлюлозных генов
Скрининг кДНК-или геномных библиотек с помощью гибридизации с гетерологичным зондом не очень эффективен при идентификации целлюлазных генов, поскольку их нуклеотидные последовательности довольно сильно различаются у разных организмов. Поэтому нужны новые подходы для выделения мРНК целлюлолитических ферментов из грибов или растений. К сожалению, эти мРНК составляют лишь небольшую часть суммарной мРНК, поэтому приходится обогащать библиотеки этими мРНК или кДНК и элиминировать кДНК-клоны, не несущие последовательности-мишени. Для выделения некоторых генов эукариотических целлюлаз использовали метод «дифференциальной гибридизации», суть которого состоит в следующем (рис. 13. 16).
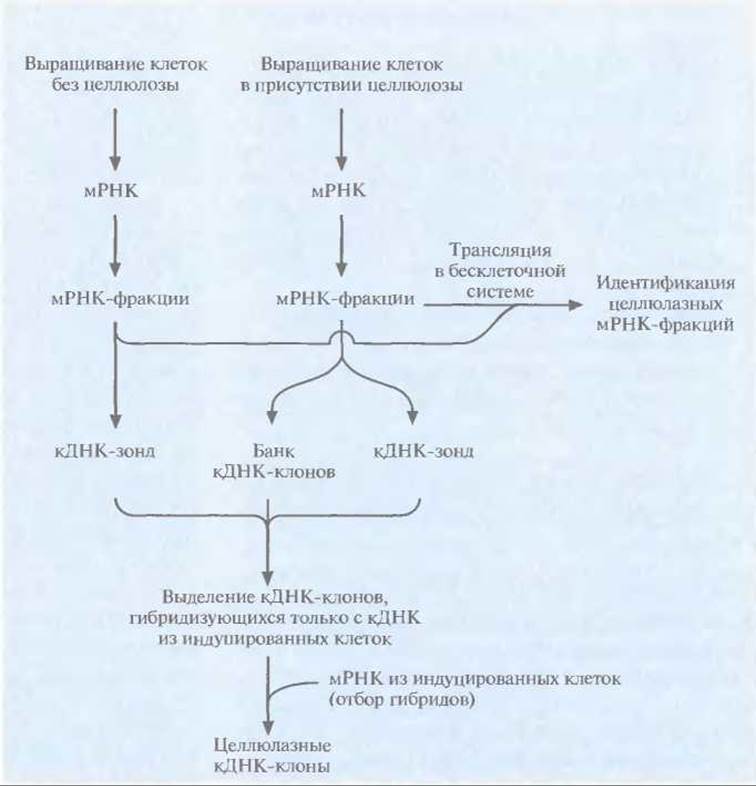
Рис. 13.16. Идентификация кДНК-клонов, кодирующих эукариотические целлюлазы, с помощью дифференциальной гибридизации.
1. Выделяют мРНК из клеток, выращенных на среде без целлюлозы (неиндуцированных клеток), и клеток, которые для увеличения продукции целлюлаз были выращены в присутствии целлюлозы или ее производных (индуцированных клеток).
2. Каждую популяцию мРНК фракционируют в градиенте плотности сахарозы. Проводят трансляцию мРНК каждой фракции в бесклеточной системе на основе ретикулоцитов кролика или зародышей пшеницы. Определяют мол. массу соответствующих белков и проводят иммунологический тест, с тем чтобы идентифицировать фракцию (или фракции), содержащую мРНК целлюлазы. Разделяют продукты трансляции в полиакриламидном геле и выявляют полосы, происходящие от индуцированных клеток и отсутствующие для неиндуцированных; материал этих полос и представляет собой белки, синтез которых был индуцирован целлюлозой.
3. мРНК-фракции индуцированных клеток, детерминирующие синтез целлюлаз, и их «партнеры» в градиенте плотности сахарозы мРНК неиндуцированных клеток по отдельности используют в качестве матриц для синтеза кДНК.
4. кДНК индуцированных клеток клонируют в плазмидном или фаговом векторе, вводят в Е. coli, высевают на чашки, делают реплики и проводят скрининг, используя в качестве гибридизационных зондов радиоактивно меченную кДНК фракций из индуцированных и неиндуцированных клеток. Клоны, гибридизующиеся с кДНК индуцированных и не гибридизующиеся с кДНК неиндуцированных клеток, могут содержать целлюлазные гены, поэтому проводят их дальнейшее изучение.
5. Чтобы доказать, что позитивные кДНК-клоны действительно кодируют целлюлазы, их ДНК гибридизуют с суммарной мРНК индуцированных клеток, проводят трансляцию гибридизовавшейся мРНК in vitro в бесклеточной системе и идентифицируют полученные продукты с помощью антител, специфичных к ферментам целлюлазного комплекса.
6. Определяют нуклеотидную последовательность каждого позитивного кДНК-клона и устанавливают, какие клоны кодируют одинаковые, а какие — разные белки целлюлазного комплекса.
Эту схему можно использовать для выделения любых индуцибельных эукариотических генов.
Манипуляции с целлюлозными генами Клонированные целлюлазные гены можно использовать в разных целях: для облегчения очистки рекомбинантных белков с помощью связывающего целлюлозу домена; для получения коммерческих продуктов (например, этанола) из целлюлозных отходов с помощью микроорганизмов, в которые встроены целлюлазные гены.
Молекула целлюлазы обычно состоит из трех доменов: каталитического, шарнирного, часто обогащенного остатками пролина, серина и треонина, и связывающего целлюлозу. Каталитический и связывающий домены функционируют независимо друг от друга. Такое разделение функций можно использовать, включив нуклеотидную последовательность связывающего целлюлозу домена в состав химерного гена, другая часть которого кодирует представляющий коммерческий интерес белок. Чтобы очистить полученный белок, его экстракт пропускают через колонку, набитую целлюлозой. С целлюлозой связывается только гибридный белок; его элюируют и удаляют «целлюлозный» домен протеолизом. Эта система сходна с иммуноаффинной хроматографией, но обходится дешевле.
Большинство целлюлазных генов исходно клонировали и экспрессировали в Е. coli, но их можно ввести в другие микроорганизмы и получить новые штаммы с полезными свойствами. Так, S. cerevisiae и Z. mobilis, эффективно преобразующие в этанол простые сахара (например, глюкозу) после введения им целлюлазных генов, могли бы превращать целлюлозу непосредственно в этанол. Для проверки этой гипотезы провели ряд исследований.
В одной из серий экспериментов гены эндо- и экзоглюканазы бактерии Cellulomonas fimi. каждый из которых находился под контролем промотора и сигнальной последовательности S. cerevisiae, субклонировали в плазмидном векторе и ввели в S. cerevisiae. Некоторые трансформанты секретировали оба фермента в культуральную среду с эффективностью примерно 70% и частично расщепляли целлюлозу, входящую в состав фильтровальной бумаги и предварительно обработанных древесных стружек. Скорость и степень гидролиза этих субстратов возрастала при добавлении в смесь ß-глюкозидазы, расщепляющей целлобиозу до глюкозы, но полного гидролиза целлюлозы не происходило. Это связано с существованием двух регуляторных механизмов, действующих по принципу обратной связи: накапливающаяся целлобиоза ингибирует гидролиз целлюлозы, а глюкоза ингибирует расщепление целлобиозы. Ген ß-глюкозидазы выделили из грибов Tńchoderma reesei, клонировали в мультикопийной плазмиде и вновь ввели в Т. reesei. Трансформированный штамм продуцировал ß-глюкозидазу в 5,5-кратном избытке и расщеплял производное целлюлозы авицел (Avicel) на 33% быстрее, чем нетрансформированный штамм. Это подтверждает данные о том, что ß-глюкозидаза облегчает ферментативное расщепление целлюлозы, и позволяет предположить, что для создания более эффективных целлюлолитических микроорганизмов нужно встроить в уже существующие штаммы гены ß-глюкозидазы.
Эндоглюканазные гены можно использовать не только для получения из целлюлозных отходов полезных веществ, но и для других целей. Если ввести ген эндоглюканазы, находящийся под контролем конститутивного промотора актинового гена дрожжей, в винные дрожжи, можно усилить аромат получаемого вина. Это связано с повышением содержания в нем как минимум 12 летучих соединений, в том числе этилпропионата, 2-бутанола, изоамилацетата, изоамилонового спирта и изомасляной кислоты. С помощью такой генетической модификации можно стабилизировать процесс ферментации и создать такие штаммы дрожжей, которые будут производить вина с определенными свойствами.
Исследовалась также возможность использования целлюлаз при промышленной биопереработке бумажных отходов в этанол. Для этого отходы частично расщепляли целлюлазами при 45 °С, а затем, не удаляя целлюлаз, проводили ферментацию высвободившейся глюкозы с помощью S. cerevisiae при 37 °С. Основываясь на полученных результатах, рассчитали, что этот подход позволит получить 400 л этанола из 1 т бумажных отходов. Если все 100 млн. т бумажных отходов, ежегодно образующихся в Северной Америке, превратить в этанол и использовать его в качестве топлива, можно сэкономить примерно 16% бензина.