Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Введение в биологию клетки
Макромолекулы: структура, форма и информационные функции
Процессы молекулярного узнавания
Макромолекулы клетки отличаются от ее малых молекул не только более крупными размерами. Белки, нуклеиновые кислоты и полисахариды обладают уникальными и поистине поразительными свойствами, мало похожими на те, которые присущи их составляющим малым молекулам. Биологические макромолекулы построены из тысяч, иногда миллионов, атомов, собранных в точно детерминированную пространственную структуру. Каждая из этих макромолекул несет специфическую информацию, заключенную в их структуре. Ее можно рассматривать как серию биологических посланий, которые могут быть «прочитаны» при их взаимодействии с другими молекулами, что позволяет осуществить определенную функцию, необходимую для клетки.
В этой главе мы проанализируем структуру макромолекул, главным образом белков и нуклеиновых кислот, и попытаемся объяснить, как они в процессе эволюции приспособились к выполнению своих функций. Мы рассмотрим принципы, по которым эти молекулы катализируют химические превращения, строят сложные макромолекулярные структуры, осуществляют движение и (самое важное) хранят и передают наследственную информацию.
Макромолекулы обычно имеют молекулярные массы от 10000 до 1 млн., т. е. по размеру такие молекулы занимают промежуточное положение между описанными в гл. 2 органическими молекулами и надмолекулярными структурами и органеллами, которые будут обсуждаться в последующих главах (рис. 3-1). Одна малая молекула, вода, составляет 75% общей массы клетки; почти всю остальную массу клетки составляют макромолекулы (табл. 3-1).
Как описано в гл. 2, макромолекулы собираются из низкомолекулярных субъединиц, которые, присоединяясь одна за другой, образуют длинную полимерную цепь (см. рис. 2-33). Обычно в построении каждой цепи участвуют лишь субъединицы одного семейства. Так, аминокислоты, связываясь с другими аминокислотами, образуют белки; нуклеотиды, связываясь с другими нуклеотидами, образуют нуклеиновые кислоты, а сахара, соединяясь с другими сахарами, формируют полисахариды. Поскольку для нормального функционирования макромолекулы решающее значение имеет точная последовательность субъединиц (мономеров), при биосинтезе макромолекул должны действовать механизмы, точно определяющие положение каждого мономера в цепи полимера.
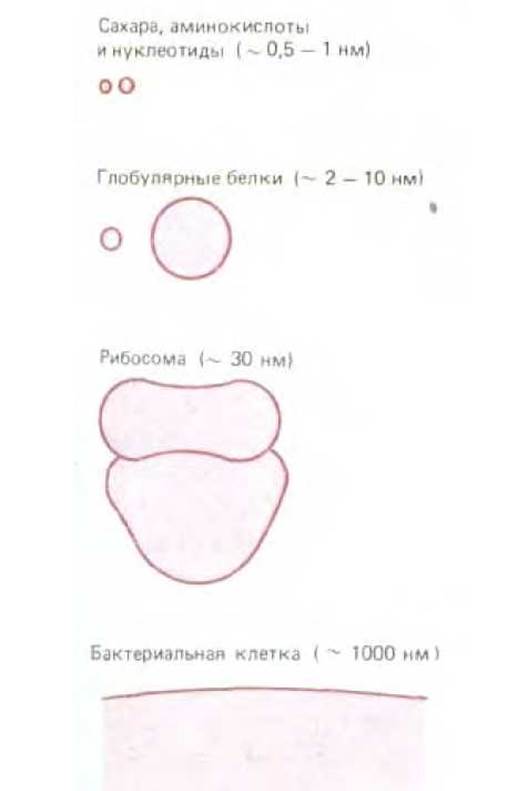
Рис. 3-1. Сопоставление размеров белков с размерами других компонентов клетки. Рибосома представляет собой макромолекулярный комплекс, состоящий из примерно 60 белков и молекул РНК.
Таблица 3-1. Примерный химический состав типичной бактерии и типичной клетки млекопитающего
Доля от общей массы клетки, %
|
Компонент 1) |
бактерия Е. coli |
клетка млекопитающего |
|
Н2О |
70 |
70 |
|
Неорганические ионы (Na+, K+, Mg2+, Са2+, Cl- и т. п.) |
1 |
1 |
|
Разнообразные низкомолекулярные метаболиты |
3 |
3 |
|
Белки |
15 |
18 |
|
РНК |
6 |
1,1 |
|
ДНК |
1 |
0,25 |
|
Фосфолипиды |
2 |
3 |
|
Другие липиды |
— |
2 |
|
Полисахариды |
2 |
2 |
|
Общий объем клетки |
2- 10-12 см3 |
4-10-9 см3 |
|
Относительный объем клетки |
1 |
2000 |
1) Белки, полисахариды, ДНК и РНК - это макромолекулы. Липиды обычно не считают макромолекулами, хотя они и обладают некоторыми свойствами последних; например, большинство липидов синтезируется в виде линейных полимеров из молекул меньшего размера (ацетильной группы ацетилкофермента А) и путем самосборки образует более крупные структуры (мембраны).
3.1.1. Специфические взаимодействия макромолекулы зависят от слабых нековалентных связей [2]
Макромолекулярные цепи образуются с помощью ковалентных связей, которые достаточно прочны, чтобы поддерживать последовательность субъединиц макромолекулы в течение длительного времени. Но заключенная в этой последовательности информация выражается с помощью значительно более слабых нековалентных связей. Такие слабые связи возникают между разными частями одной и той же макромолекулы и между разными макромолекулами. В совокупности эти связи определяют и пространственную структуру макромолекулярных цепей, и то, как эти структуры взаимодействуют друг с другом.
Нековалентные связи в биологических молекулах обычно подразделяют на три типа: ионные взаимодействия, водородные связи и вандерваальсовы взаимодействия. Еще одно важное слабое взаимодействие создается пространственной структурой воды, которая стремится свести вместе гидрофобные группы и тем самым ослабить их разрушительное действие на сеть водородных связей молекул воды (схема 2-1). Такое выталкивание из водного раствора иногда считают четвертым типом слабой нековалентной связи. Все эти четыре типа слабых связей представлены на схеме 3-1.
В водном растворе каждая нековалентная связь в 30-300 раз слабее, чем типичные ковалентные связи, удерживающие вместе биологические молекулы (табл. 3-2) и лишь ненамного превышает среднюю энергию столкновения молекул, обусловленную тепловым движением при 37 °С. Одна нековалентная связь в отличие от одной ковалентной слишком слаба, чтобы противостоять тепловому движению, стремящемуся раздвинуть молекулы в разные стороны, поэтому, чтобы скрепить поверхности двух молекул требуется большое количество нековалентных связей. Большое число нековалентных связей может образоваться между двумя поверхностями только тогда, когда большое число атомов поверхностей точно соответствуют друг другу (рис. 3-2). Именно этим объясняется специфичность биологического узнавания, которое происходит, например, между ферментом и его субстратами.
Слабые нековалентные связи определяют, как различные участки одной молекулы располагаются друг относительно друга, кроме того, они определяют, как такая макромолекула взаимодействует с другими молекулами. Однако, как можно видеть в верхней части схемы 3-1, атомы ведут себя как твердые шары определенного радиуса («вандерваальсов радиус»). Невозможность взаимного перекрывания двух атомов ограничивает число пространственных расположений атомов (или конформаций), которые возможны для каждой полипептидной цепи. В принципе длинная подвижная цепь, такая, как молекула белка, может складываться огромным числом способов, при которых каждая кон-формация будет иметь разный набор слабых взаимодействий между цепями. Однако на деле большинство клеточных белков стабильно складывается только одним способом; в ходе эволюции была отобрана такая последовательность аминокислотных субъединиц, одна конформация которой способна образовывать значительно более благоприятные взаимодействия между цепями, чем любая другая.
3.1.2. Спираль является общим структурным элементом биологических молекул, построенных из повторяющихся субъединиц [3]
Биологические структуры часто образованы путем соединения похожих друг на друга субъединиц, таких как аминокислоты или нуклеотиды, в длинную повторяющуюся цепь (разд. 2.4.5). Если все субъединицы одинаковы, то соседние субъединицы в цепи будут соединены друг с другом только одним способом: их взаимное расположение будет таково, что энергия контакта между ними окажется минимальной. Каждая субъединица при этом расположена точно так же, как соседние, так что субъединица 3 будет входить в субъединицу 2, а субъединица 2 - в субъединицу 1 и т. д. Поскольку сборка субъединиц в виде прямой линии явление очень редкое, то обычно образуется спираль - регулярная структура, напоминающая винтовую лестницу, как показано на рис. 3-3. В зависимости от направления закручивания различают спирали правые и левые (рис. 3-4). Направление спирали не изменится, если спираль перевернуть, но изменится при зеркальном отражении.
Спирали весьма распространены среди биологических структур. Спирализации подвержены и молекулы, состоящие из субъединиц, соединенных ковалентными связями (ДНК), и большие белковые молекулы с нековалентными связями (актиновые нити). Это неудивительно: спираль возникает при простом накладывании друг на друга многих субъединиц, каждая из которых строго повторяет положение предыдущей.
3.1.3. Диффузия - первая стадия молекулярного узнавания [4]
Прежде чем связаться друг с другом, две молекулы должны прийти в соприкосновение. Это достигается путем теплового движения, вызывающего случайные перемещения, или диффузию молекул. Поскольку, находясь в жидкости, молекулы быстро сталкиваются и отскакивают друг от друга, индивидуальная молекула движется сначала. В одну сторону, затем в другую, описывая «беспорядочную траекторию» (рис. 3-5). Среднее расстояние, пройденное такой молекулой, пропорционально квадратному корню времени. Иными словами, если перемещение некой молекулы на 1 мкм занимает в среднем 1 с, то перемещение на 2 мкм в среднем займет 4 с, а на 10 мкм - 100 с и т.д. Таким образом, диффузия - это эффективный способ перемещения молекул на ограниченные расстояния, но неэффективный для перемещения на большие расстояния.
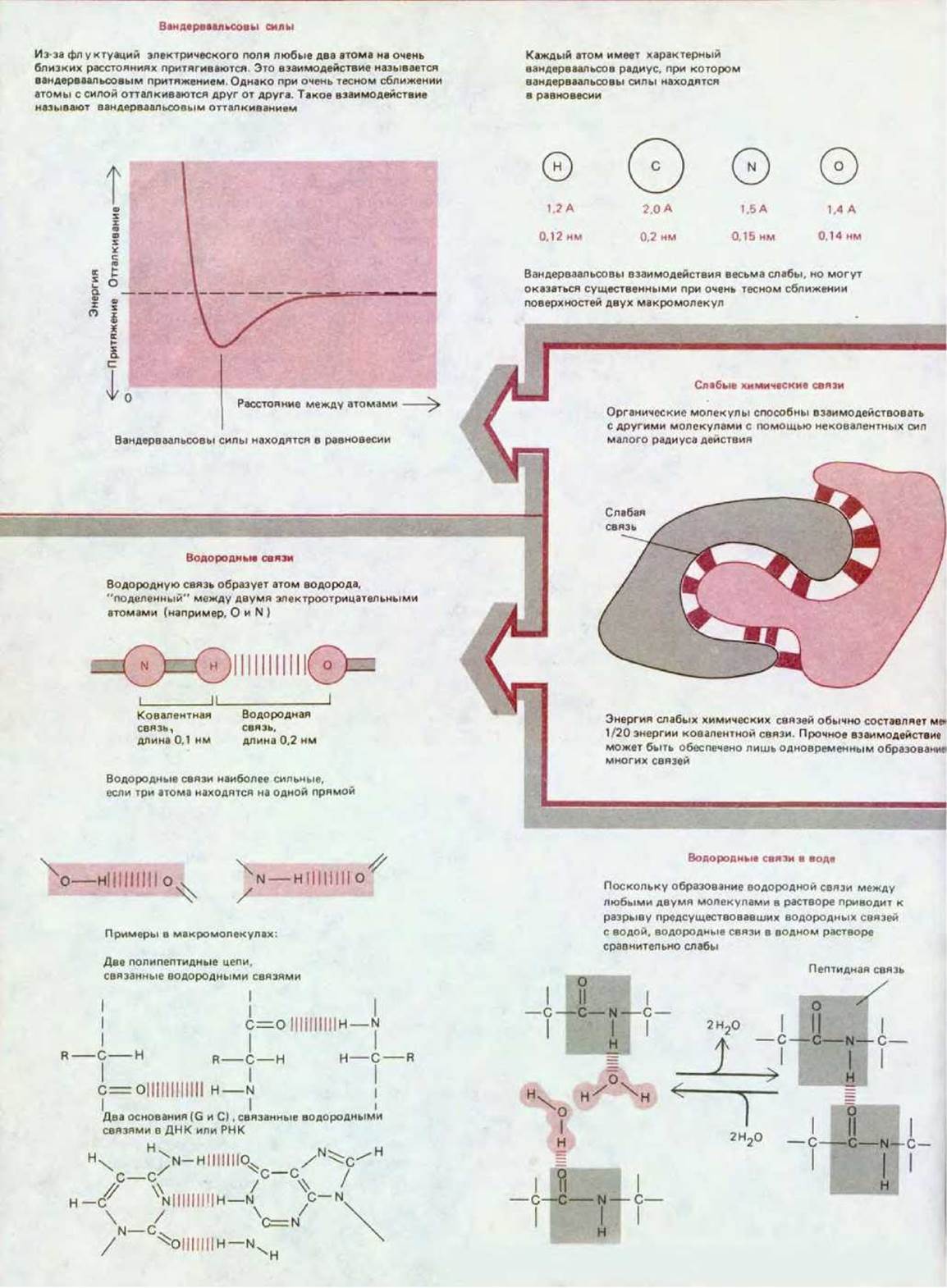
Схема 3-1. Основные типы слабых нековалентных связей, участвующих во взаимодействии макромолекул.
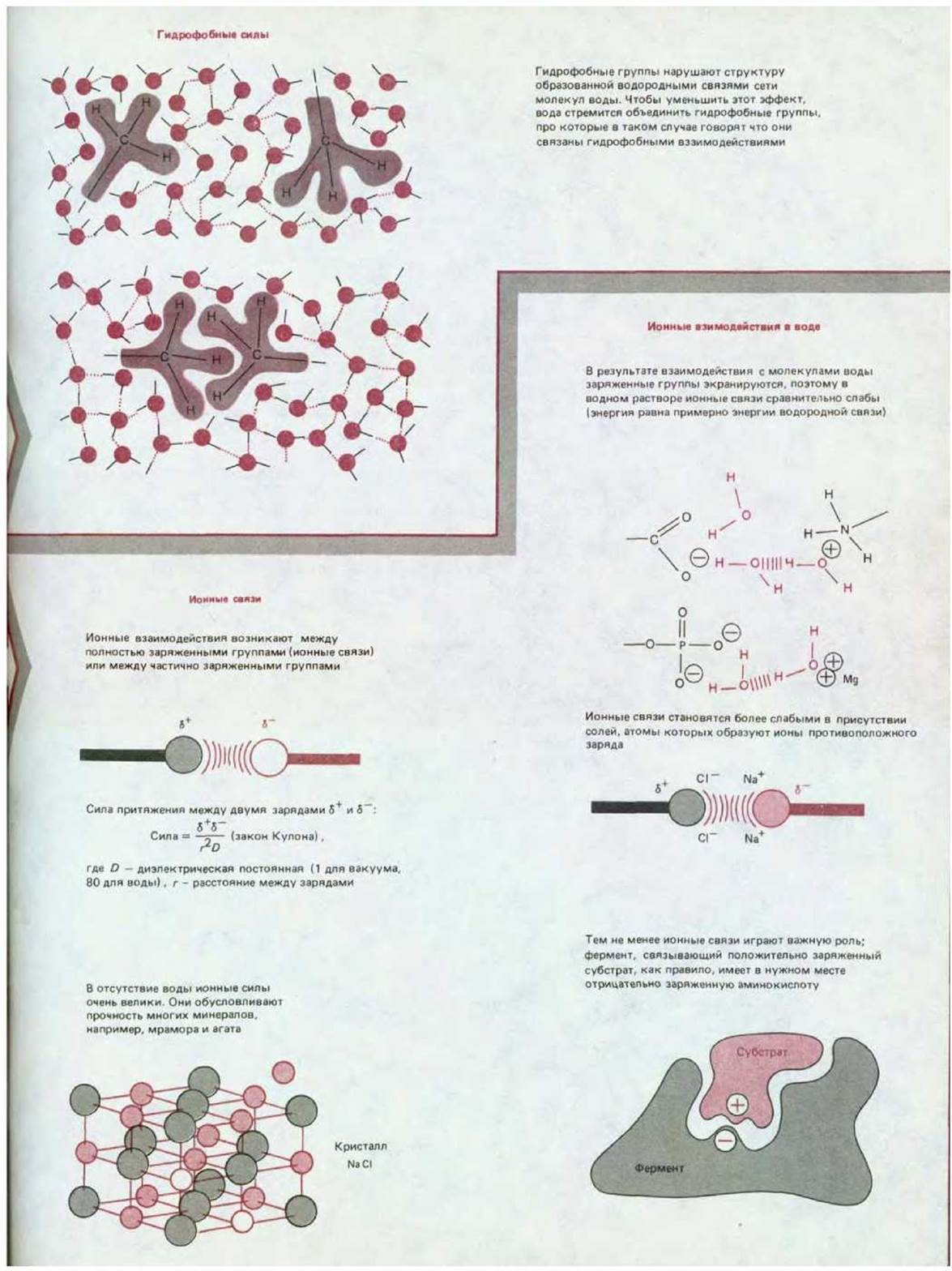
Таблица 3-2. Ковалентные и нековалентные химические связи
Энергия связи, ккал/моль 1)
|
Тип связи |
Длина, нм |
в вакууме |
в воде |
|
Ковалентная |
0,15 |
90 |
90 |
|
Ионная |
0,25 |
80 |
1 |
|
Водородная |
0,30 |
4 |
1 |
|
Вандерваальсова |
0,20 |
0,1 |
0,1 |
1) Энергию связи можно представить как энергию, необходимую для ее разрыва. Здесь она дана в килокалориях на моль (ккал/моль). Одна килокалория - это количество энергии, необходимое для повышения температуры 1000 г воды на 1°С. Широко используется и другая единица измерения -килоджоуль (кДж), равный 0,24 ккал. Индивидуальные связи значительно варьируют по силе в зависимости от конкретных атомов в микроокружении, так что приведенные величины могут служить лишь для грубой ориентировки. Обратите внимание на то, что водная среда клетки существенно ослабляет ионные и водородные связи между неводными молекулами.
В опытах с введением в клетки флуоресцентных красителей и других меченых молекул было установлено, что в цитоплазме малые молекулы диффундируют почти так же быстро, как в воде. Молекуле такого размера, как АТР, требуется лишь 0,2 с для диффузии в среднем на расстояние 10 мкм, что составляет диаметр небольшой клетки животного. Однако макромолекулы движутся значительно медленнее. Объясняется это не только тем, что им присуща меньшая скорость диффузии, но и тем, что их движение тормозится частыми столкновениями со многими другими макромолекулами, положение которых в цитоплазме фиксировано (рис. 3-6).
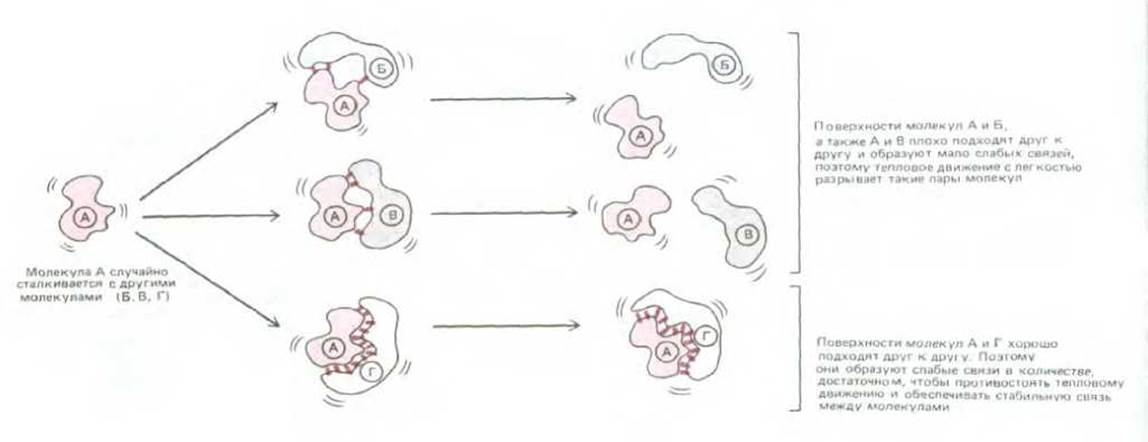
Рис. 3-2. Схема, иллюстрирующая, как макромолекулы узнают друг друга с помощью слабых взаимодействий.

Рис. 3-3. Спираль образуется, когда серии субъединиц подстраиваются друг к другу регулярным образом. На переднем плане показано взаимодействие двух субъединиц, а сзади изображены спирали, получающиеся в результате этого взаимодействия. Эти спирали имеют две (А), три (Б) и шесть (В и Г) субъединиц на один оборот. В верхней части рисунка - вид спирали сверху. Обратите внимание, что спираль Г имеет более широкий шаг, чем В.
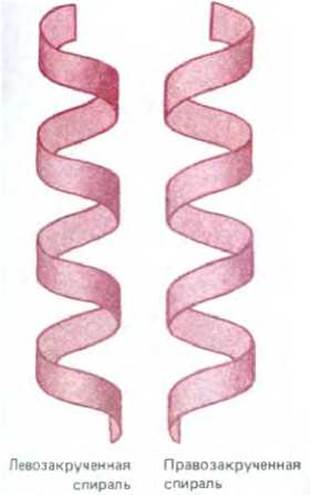
Рис. 3-4. Сравнение лево- и правозакрученной спиралей. Полезно вспомнить, что стандартный винт, который закручивается при вращении по часовой стрелке, является правозакрученным. Отметим, что спираль сохраняет закрученность, если ее перевернуть сверху вниз
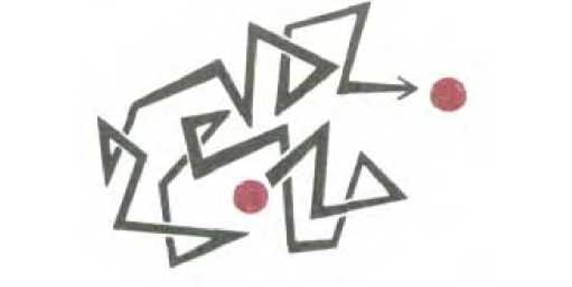
Рис. 3-5. Беспорядочное движение. Молекулы в растворе движутся случайным образом из-за постоянных столкновений с другими молекулами. Благодаря этому малые молекулы диффундируют из одной части клетки в другую за удивительно короткое время - менее чем за секунду.

Рис. 3-6. Электронная микрофотография участка цитоплазмы животной клетки, иллюстрирующая высокую концентрацию содержащихся в ней белков. Макромолекулы в цитоплазме диффундируют относительно медленно, поскольку они взаимодействуют с другими макромолекулами; малые молекулы диффундируют почти столь же быстро, как в водном растворе. Клетка, представленная на этой микрофотографии, обработана по специальной методике быстрого замораживания, позволяющей сохранить цитоплазматические структуры. (Из Р. С. Bridgman and Т. S. Reese, J. Cell Biol. 99: 1655-1668, 1984. С разрешения Rockefeller University Press.)
3.1.4. Тепловое движение не только приводит молекулы в соприкосновение, но и отбрасывает их друг от друга [5]
Две макромолекулы или одна макромолекула и одна малая молекула, сталкиваясь в результате простой диффузии, образуют комплекс. Образование комплекса может произойти либо немедленно (в этом случае говорят, что скорость образования комплекса лимитируется диффузией), либо с некоторой задержкой, если взаимодействующие поверхности оказываются подогнанными друг к другу только после некоторой «подстройки» структуры одной или обеих молекул. В любом случае, если две взаимодействующие молекулы достаточно сблизились, они образуют множественные слабые связи, которые сохраняются до тех пор, пока случайное тепловое движение не вызовет снова диссоциацию молекул.

Рис. 3-7. Принцип равновесия. Равновесие между молекулами А и Б и комплексом АБ поддерживается двумя показанными на схемах 1 и 2, противоположно направленными реакциями. Отношение констант скоростей ассоциации и диссоциации (3) равно константе равновесия реакции К. Поскольку для того, чтобы прореагировать, молекулы А и Б в реакции 2 должны столкнуться, скорость этой реакции пропорциональна произведению концентраций А и Б. В результате в конечном выражении для К появляется произведение [А] ∙ [Б] (квадратные скобки означают концентрацию). Принято, что концентрации продуктов ставятся в числитель, а концентрации реагентов - в знаменатель уравнения константы равновесия. Поэтому константа равновесия на схеме 3 относится к реакции ассоциации А + Б → АБ, а величина, обратная ей, будет константой равновесия для реакции диссоциации АБ → А + Б. Однако, когда мы имеем дело с простыми взаимодействиями связывания, правильнее говорить о константе сродства, или константе ассоциации, выражаемой в литрах на моль; чем больше величина константы ассоциации (Ка), тем сильнее связывание между А и Б. Обратной к Ка является константа диссоциации, выражаемая в молях на литр; чем меньше величина константы диссоциации Kd, тем сильнее связывание между А и Б.
Таблица 3-3. Соотношение между изменением свободной энергии и константой равновесия реакции (К)

Если реакция ![]() АБ достигла равновесия, то относительные количества компонентов А, Б и АБ будут зависеть от разницы в их свободной энергии, ∆G°. Приведенные выше значения рассчитаны для 37°С с помощью уравнения
АБ достигла равновесия, то относительные количества компонентов А, Б и АБ будут зависеть от разницы в их свободной энергии, ∆G°. Приведенные выше значения рассчитаны для 37°С с помощью уравнения
![]()
или
![]()
где ∆C0 выражена в килокалориях на моль и представляет собой изменение свободной энергии данной реакции в стандартных условиях (концентрация всех компонентов составляет 1,0 моль/л).
В общем случае, чем сильнее связывание молекул в комплексе, тем меньше скорость диссоциации. В предельном случае, когда энергия образовавшихся связей пренебрежимо мала по сравнению с энергией теплового движения, две молекулы диссоциируют сразу же после столкновения. В другом предельном случае энергия связей столь велика, что диссоциации практически не происходит. Таким образом, величина энергии взаимодействия - полезный показатель специфичности процесса узнавания.
Чтобы разобраться, как измеряют энергию взаимодействия, рассмотрим реакцию связывания молекулы А с молекулой Б. Эта реакция будет протекать до тех пор, пока не достигнет положения равновесия, при котором скорости образующихся и диссоциирующих комплексов равны. Используя равновесные концентрации молекул А, Б и комплекса АБ, можно определить константу равновесия К реакции (рис. 3-7). Эту константу иногда называют константой сродства и обычно используют в качестве меры силы связывания между двумя молекулами: чем сильнее связывание, тем выше значение константы сродства.
Константа равновесия реакции соединения двух молекул непосредственно связана с изменением в этой реакции стандартной свободной энергии ∆G°. Используя соответствующее уравнение (табл. 3-3), можно вычислить ∆G° для ряда значений К. Константы сродства реакций простого связывания в биологических системах обычно находятся в диапазоне от 103 до 1012 л/моль, что соответствует энергиям связывания от 4 до 17 ккал/моль, или возникновению в среднем от 4 до 17 водородных связей.
Самые сильные взаимодействия имеют место тогда, когда биологическая функция требует, чтобы две макромолекулы оставались тесно связанными в течение долгого времени, например, когда белок регуляторного гена связывается с ДНК, выключая ген (см. разд. 10.2.1). Самые слабые взаимодействия происходят, когда функция требует быстрого изменения в структуре комплекса, например, когда два взаимодействующих белка меняют партнеров при движениях белковой машины (см. разд. 1.3.1).
3.1.5. Атомы и молекулы находятся в постоянном движении [6]
Химические реакции в клетке происходят поразительно быстро. Например, типичная молекула фермента катализирует ~1000 реакций в секунду, а для некоторых ферментов эта величина может достигать более 106 реакций в секунду. Поскольку для каждой реакции требуется отдельное столкновение между ферментом и молекулой субстрата, такие скорости возможны только потому, что молекулы быстро перемещаются. Существует три типа молекулярных движений: 1) перемещение молекулы с одного места на другое (трансляционное движение), 2) быстрые колебания взад и вперед ковалентно связанных атомов друг относительно друга (вибрации) и 3) вращения. Все эти движения важны для приведения в контакт взаимодействующих молекул.
Скорости движения молекул могут быть измерены с помощью многих пектроскопических методов, которые показывают, например, что большой глобулярный белок постоянно находится в движении, вращаясь вокруг оси примерно миллион раз в секунду. Скорости диффузионных столкновений, обусловленных трансляционными движениями, пропорциональны концентрации диффузионных молекул. Например, если типичная внутриклеточная концентрация -1 мМ, то каждый участок белковой молекулы будет испытывать около 106 случайных столкновений в секунду с молекулами АТР; если концентрация на порядок ниже, число столкновений упадет до 105 в секунду и т.д.
Если две молекулы столкнулись и находятся в правильной взаимной ориентации, химическая реакция между ними может произойти очень быстро. Узнав о том, как быстро движутся и реагируют молекулы, мы не должны удивляться наблюдаемой скорости ферментативного катализа.
3.1.6. Процесс молекулярного узнавания не может быть совершенно безошибочным [7]
Все молекулы обладают энергией: кинетической энергией трансляционных движений, вибраций и вращений и потенциальной энергией, запасенной в электронных оболочках. Благодаря молекулярным столкновениям эта энергия случайным образом распределяется по разным атомам, так что, хотя уровень энергии большинства атомов близок к среднему, небольшая часть атомов будет обладать значительной энергией. Благоприятные конформации, или состояния молекул, соответствуют минимуму свободной энергии (см. разд. 2.4.1), но при сильных столкновениях возникают высокие состояния энергии. Зная температуру, можно рассчитать вероятность того, что атом или молекула окажутся в этом энергетическом состоянии (см. табл. 3-3). Вероятность высокого энергетического состояния становится меньше вероятности низкого энергетического состояния по мере того, как увеличивается разность их свободных энергий. Она, однако, обращается в нуль лишь тогда, когда эта разность значений энергий становится бесконечной.
Из-за элемента случайности при молекулярных взаимодействиях время от времени происходит небольшое число «побочных реакций». Поэтому клетка часто ошибается. Иногда происходят даже энергетически невыгодные реакции. Например, два атома, связанные ковалентно, при особо сильном столкновении могут разъединиться. Аналогичным образом специфичность фермента в отношении субстрата не может быть абсолютной, так как способность отличить одну молекулу от другой не может быть совершенной. Ошибки могли бы быть полностью устранены лишь в том случае, если бы в клетке развились механизмы с бесконечно большой разницей энергий альтернативных состояний. Поскольку это невозможно, клетки вынуждены мириться с определенным уровнем ошибок и использовать различные репарирующие реакции, чтобы исправлять те из них, которые являются наиболее опасными.
С другой стороны, как мы уже знаем, ошибки играют важную роль в живом мире. Если бы не случайные ошибки при синтезе ДНК, вряд ли эволюция была возможной (см. разд. 3.2.4).
Заключение
В последовательности субъединиц макромолекул заключена информация, і определяющая пространственную конфигурацию их поверхности. Именно она используется для узнавания друг друга разными молекулами и разными частями одной и той же молекулы посредством слабых нековалентных связей. Молекулы находятся в постоянном быстром движении; если при соударении в результате случайной диффузии, происходит узнавание, они связываются между собой с силой, которую можно выразить с помощью константы равновесия. Поскольку узнавание может быть безошибочным лишь при увеличении энергии взаимодействия до бесконечно большой величины, живые клетки постоянно допускают ошибки. При необходимости ошибки исправляются с помощью специальных механизмов репарации.