Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Молекулярная организация клеток
Преобразование энергии: митохондрии и хлоропласты
Хлоропласты и фотосинтез
Всем животным и большинству микроорганизмов необходимо все время получать из окружающей среды большие количества органических веществ. Эти вещества доставляют углеродные остовы для биосинтезов и метаболическую энергию для всех клеточных процессов. Полагают, что первые организмы древней Земли располагали избытком органических соединений, образовавшихся в результате геохимических процессов (см. разд. 1.1.1). Однако большая часть этих соединений была уже использована миллиарды лет назад. С тех времен почти все органические материалы, необходимые для живых клеток, производятся фотосинтезирующими организмами, в том числе разного рода фотосинтезирующими бактериями. Эволюционно наиболее продвинутые из таких бактерий - цианобактерии - обладают минимальными потребностями в питательных веществах. Для превращения атмосферной двуокиси углерода (СО2) в органические соединения они используют свет солнечную энергию и воду, служащую источником электронов. Кроме того, при расщеплении воды [при реакции nН2О + nСО2→ n(СН2О)n + nО2] они выделяют в атмосферу кислород, необходимый для окислительного фосфорилирования. Как мы объясним позже, вероятно, именно эволюция цианобактерии из более примитивных фотосинтезирующих бактерий сделала возможным развитие первых аэробных форм жизни.
У растений, которые появились позднее, фотосинтез протекает в специализированных внутриклеточных органеллах - хлоропластах. Однако хлоропласты доставляют энергию для метаболизма только в дневные часы; ночью они прекращают синтез высокоэнергетических метаболитов, и в это время суток растения получают АТР в результате деятельности митохондрий, которые у них очень сходны с митохондриями животных клеток.
Основываясь главным образом на биохимических данных, полагают, что хлоропласты - это потомки цианобактерии, которые захватывались эукариотами путем эндоцитоза и перешли к симбиозу с ними. Так же объясняют и происхождение митохондрий. Согласно этой теории, многочисленные различия между хлоропластами и митохондриями обусловлены отчасти их происхождением от разных бактериальных предков, а отчасти последующей эволюционной дивергенцией. Тем не менее фундаментальные механизмы синтеза АТР в хлоропластах и митохондриях очень сходны, хотя в первых он идет за счет энергии света, а во вторых - за счет энергии, доставляемой дыханием.
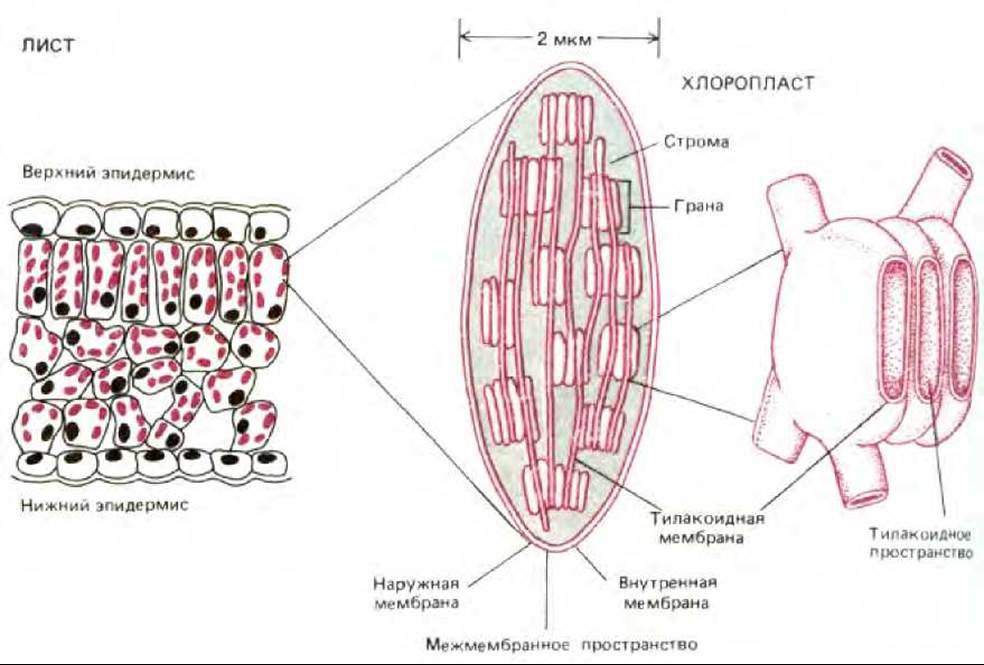
Рис. 7-38. Хлоропласты содержат три мембраны - наружную, внутреннюю и тилакоидную, которые делят органеллу на три внутренних компартмента: межмембранное пространство, строму и тилакоидное пространство. В тилакоидной мембране находятся все энергетические системы хлоропласта. На электронной микрофотографии эти мембраны выглядят разбитыми на отдельные фрагменты, имеющие вид уплощенных пузырьков (см. рис. 7-39), но в хлоропласте они, вероятно, соединены в одну мембрану, образующую многочисленные складки. Как видно из рисунка, отдельные тилакоиды связаны между собой в стопкообразные структуры, называемые гранами.
7.3.1. Хлоропласты сходны с митохондриями, но имеют один дополнительный компартмент
Хлоропласты, так же как и митохондрии, используют для преобразования энергии хемиосмотический механизм, и в основе организации тех и других органелл лежат одни и те же принципы (рис. 7-38 и 7-39). Хлоропласты тоже обладают высокопроницаемой наружной мембраной и гораздо менее проницаемой внутренней, в которую встроены специальные транспортные белки, и эти две мембраны разделены узким межмембранным пространством. Внутренняя мембрана окружает большую центральную область - так называемую строму, представляющую собой аналог митохондриального матрикса и содержащую разнообразные ферменты, рибосомы, РНК и ДНК.
Однако есть и существенное отличие. Внутренняя мембрана хлоропластов не образует крист и не содержит в себе цепи переноса электронов. Фотосинтезирующая поглощающая свет система, электрон-транспортная цепь и АТР-синтетаза находятся в третьей мембране, образующей группу уплощенных дисковидных мешочков - тилакоидов (рис. 7-38). Как полагают, внутренние полости тилакоидов сообщаются между собой, образуя третий, внутренний компартмент хлоропласта, называемый тилакоидным пространством. Это пространство отделено от стромы тилакоидной мембраной.
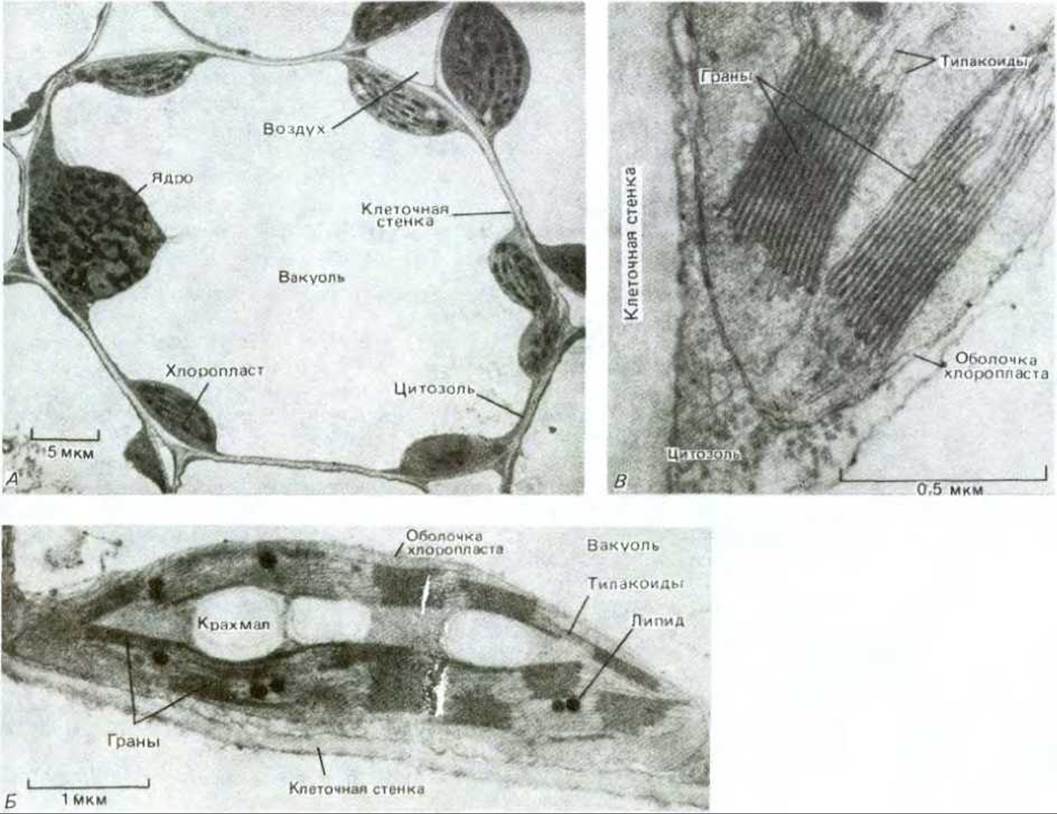
Рис. 7-39. Электронные микрофотографии хлоропластов. А. Клетка из листа пшеницы, в которой тонкий слой цитоплазмы, содержащей хлоропласты, окружает большую вакуоль. Б. Тонкий срез одного хлоропласта; видны зерна крахмала и жировые капельки, накапливающиеся в строме в результате биосинтеза. В. Граны при большом увеличении: видна тилакоидная мембрана, образующая стопки. (С любезного разрешения К. Plaskitt.)
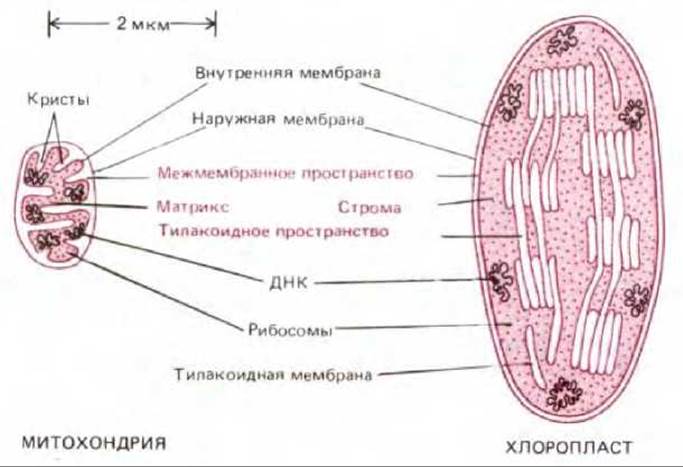
Рис. 7-40. Сравнение структуры митохондрии и хлоропласта. Обычно хлоропласт намного больше и содержит тилакоидную мембрану и тилакоидное пространство. Внутренняя мембрана митохондрий образует кристы.
На рис. 7-40 показаны черты сходства и различия в строении митохондрий и хлоропластов. В общем виде хлоропласт можно представить как сильно увеличенную митохондрию, кристы которой образовали в матриксе цепочки связанных между собой субмитохондриальных частиц. В хлоропластах сферическая часть АТР-синтетазы, где образуется АТР, выступает из мембраны тилакоида в область стромы, точно так же как в митохондриях она выступает из внутренней мембраны в сторону матрикса (см. рис. 7-51).
7.3.2. В хлоропластах осуществляются две уникальные реакции: образование АТР и NADPH за счет энергии света и превращение СО2 в углеводы [26]
Разнообразные реакции, протекающие при фотосинтезе, можно разделить на две большие группы.
1. В реакциях фотосинтетического переноса электронов (иногда называемых световыми реакциями) лучистая энергия возбуждает электрон в молекуле хлорофилла, что делает возможным перенос электрона по окислительной цепи в тилакоидной мембране, аналогичный переносу его по дыхательной цепи во внутренней мембране митохондрий. В результате такого транспорта электронов происходит перекачивание протонов через тилакоидную мембрану, и создающаяся протонодвижущая сила доставляет энергию для синтеза АТР в строме. В то же время высокоэнергетические электроны, образуемые в окислительной цепи, восстанавливают NADP+ до NADPH. Источником электронов, участвующих в этом процессе, служит окисление воды, при котором выделяется О2.
2. В реакциях фиксации углерода (называемых иногда темновыми реакциями) происходит превращение СО2 в углеводы, причем в качестве источника энергии и восстанавливающего агента используются соответственно АТР и NADPH, синтезированные в реакциях фотосинтетического переноса электронов. В результате этих реакций, начинающихся в строме хлоропласта и продолжающихся в цитозоле, в листьях образуется сахароза, откуда она доставляется к другим частям растения, где служит источником энергии для роста и используется при синтезе органических молекул.
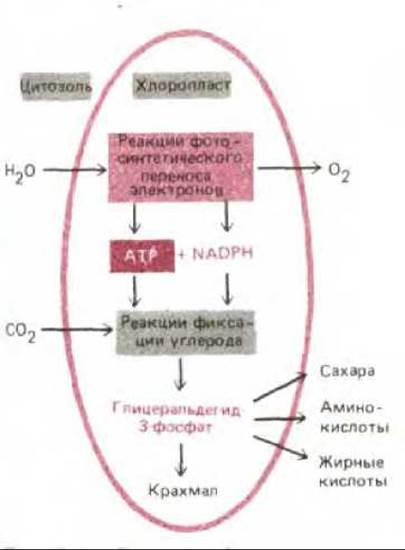
Рис. 7-41. Реакции фотосинтеза, протекающие в хлоропластах, можно подразделить на электрон-транспортирующие реакции и реакции фиксации углерода. В первой группе реакций окисляется вода и выделяется О2, а во второй группе ассимилируется СО2 и образуются органические молекулы.
Таким образом, освобождение молекулярного кислорода (требующее прямого участия лучистой энергии) и превращение СО2 в углеводы (не требующее прямого участия света) - это два отдельных процесса (рис. 7-41). Но, как мы увидим позднее, эти два процесса соединены тонким механизмом обратных связей, что необходимо для регулирования процессов биосинтеза. Например, образование АТР и NADPH в тилакоидных мембранах меняется в зависимости от потребности клетки в этих молекулах, а некоторые ферменты хлоропластов, необходимые для фиксации углерода, инактивируются в темноте и восстанавливают свою активность под влиянием электронтранспортных процессов, стимулируемых светом.
7.3.3. Фиксацию углерода катализирует рибулозобисфосфаткарбоксилаза [28]
В этой главе мы уже познакомились с тем, как клетки используют большое количество энергии, выделяющейся при окислении углеводов до СО2 и Н2О, для синтеза АТР. Из этого должно быть ясно, что обратный процесс - образование углеводов из СО2 и Н2О требует значительных затрат энергии и может происходить только при сопряжении с другими реакциями, при которых, наоборот, много энергии выделяется.
На рис. 7-42 приведена центральная реакция превращения неорганического углерода в органический: СО2 (из атмосферы) реагирует с водой и пятиуглеродным соединением рибулозо-1,5-бисфосфатом, и в результате образуются две молекулы трехуглеродного соединения 3- фосфоглицерата. Эту реакцию, открытую в 1948 г., катализирует в строме хлоропласта большой (мол. масса 500000) фермент, называемый рибулозобисфосфат-карбоксилазой. Так как этот фермент работает очень медленно (одна его молекула за секунду обрабатывает примерно 3 молекулы субстрата, тогда как другие ферменты - обычно около 1000 молекул), требуется очень много копий рибулозобисфосфат-карбоксилазы. Этот фермент часто составляет более 50% всего белка хлоропластов, и утверждают, что по общей массе это самый распространенный белок в мире.
7.3.4. В цикле фиксации углерода на одну связанную молекулу СО2 затрачиваются три молекулы АТР и две молекулы NADPH [29]
Хотя собственно реакция фиксации углерода не требует затраты энергии, для ее протекания нужен непрерывный приток высокоэнергетического соединения-рибулозо-1,5-бисфосфата, с которым связывается СО2 (рис. 7-42). Работа по изучению сложного пути регенерации рибулозо-1,5-бисфосфата явилась одним из самых ранних и наиболее успешных применений радиоизотопов в биохимии. Как показано на рис. 7-43, при участии трех молекул СО2, вступивших в реакцию, катализируемую рибулозобисфосфат-карбоксилазой, образуется шесть молекул 3-фосфоглицерата, в совокупности содержащих 6∙3 = 18 атомов углерода: 3 от СО2 и 15 от рибулозо-1,5-бисфосфата. Затем эти 18 атомов углерода проходят цикл реакций, регенерирующих 3 молекулы рибулозо-1,5-бисфосфата (содержащие 3∙5 = 15 атомов С), использованные в начале цикла. В конечном итоге прибавляется одна молекула глицеральдегид-3-фосфата (3 углеродных атома). В этом цикле фиксации углерода (цикл Кальвина - Бенсона) для связывания одной молекулы СО2 затрачиваются три молекулы АТР и две молекулы NADPH. Суммарное уравнение реакций цикла имеет вид
3СО2 + 9АТР + 6NADPH + Вода → Глицеральдегид-3-фосфат + 8Pi + 9ADP + 6NADP+.
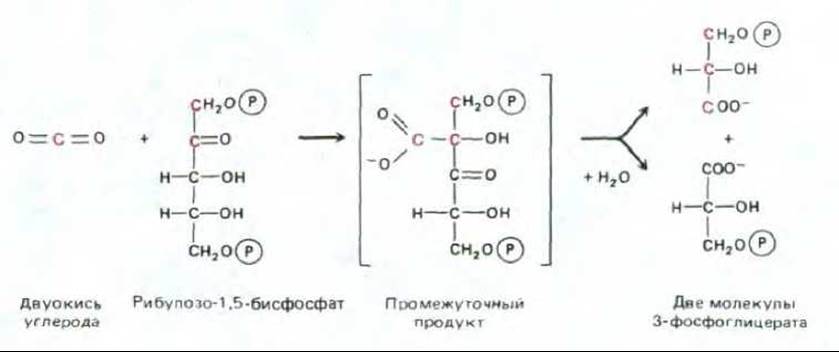
Рис. 7-42. Начальная реакция, в которой двуокись углерода превращается в органический углерод. Эту реакцию катализирует в строме хлоропласта содержащийся там в очень большом количестве ферментрибулозобисфосфат-карбоксилаза, и в результате образуется 3-фосфоглицерат, который является также и важнейшим промежуточным продуктом гликолиза (см. рис. 2-20). В случае если тот же фермент присоединяет кислород, а не СО2 (см. разд. 7.3.5), два атома углерода, выделенные цветом, используются для образования фосфогликолата.
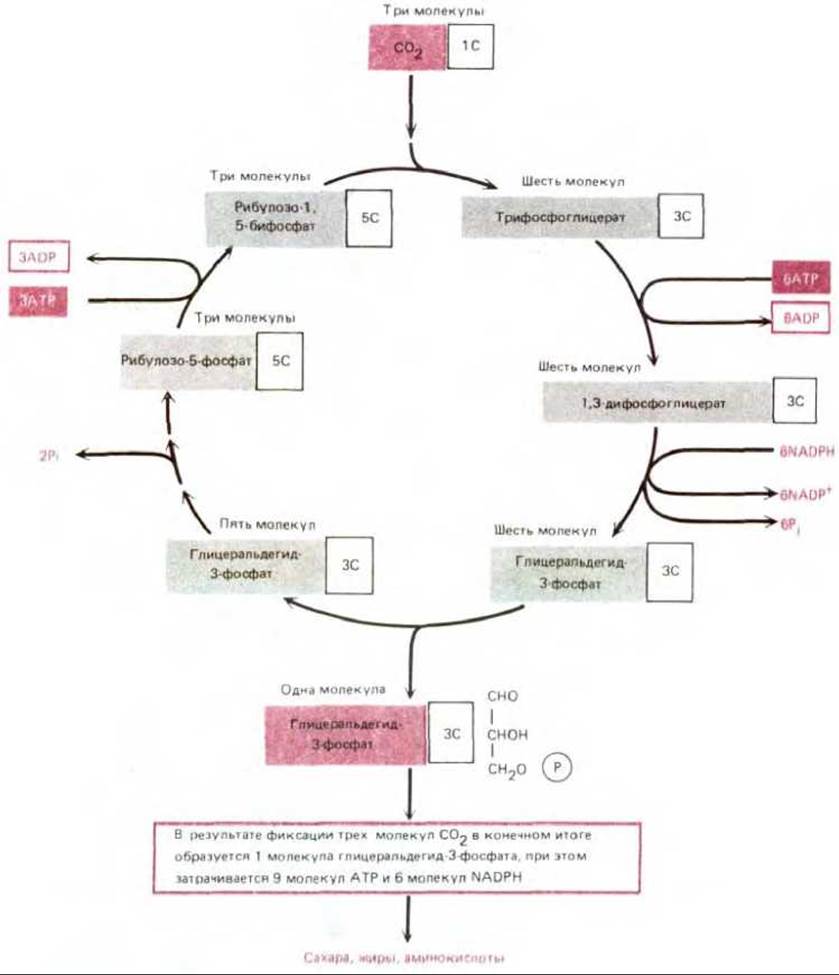
Рис. 7-43. Цикл фиксации углерода, в котором из СО2 и Н2О образуются органические молекулы. Для упрощения схемы многие промежуточные продукты на пути от глицеральдегид-3-фосфата к рибулозо-5-фосфату опущены. Участие воды в цикле также не показано.
Таким образом, на построение органических молекул из СО2 и Н2О затрачивается энергия фосфатных связей (в виде АТР) и восстановителъная сила (в виде NADPH). Позднее мы вернемся к этому моменту.
Глицеральдегид-3-фосфат, образующийся в хлоропластах в цикле фиксации углерода, представляет собой трехуглеродный углевод и является ключевым промежуточным продуктом гликолиза (разд. 2.3.2). Большая часть глицеральдегид-3-фосфата поступает в цитозоль, где быстро превращается в фруктозо-6-фосфат и глюкозо-1-фосфат в результате обратного протекания некоторых реакций гликолиза (разд. 2.5.3). Затем глюкозо-1-фосфат превращается в углеводное производное нуклеотида, UDP-глюкозу, которая реагирует с фруктозо-6-фосфатом с образованием сахарозофосфата - непосредственного предшественника дисахарида сахарозы. У растений сахароза выполняет ту же функцию, что глюкоза у животных: это та основная форма, в которой сахара транспортируются из одних клеток в другие. По мере надобности сахароза переходит из листьев в остальные части растения по проводящим пучкам (см. рис. 7-45), подобно тому как глюкоза переносится с током крови в организме животного.
В строме из большей части оставшегося в хлоропластах глицеральдегид-3-фосфата образуется крахмал. Это высокомолекулярный полимер глюкозы, служащий, так же как гликоген в животных клетках, резервным углеводом. Крахмал образуется в строме хлоропласта во время избыточной фотосинтетической активности и там же запасается в виде крупных зерен (см. рис. 7-39, Б). Синтез крахмала происходит путем обращения реакций гликолиза, протекающих в строме: глицеральдегид-3-фосфат превращается в глюкозо-1-фосфат, из которого затем образуется ADP-глюкоза, представляющая собой непосредственный предшественник крахмала. Ночью крахмал расщепляется для удовлетворения метаболических нужд растения.
7.3.5. Для облегчения роста некоторых тропических растений в условиях низких концентраций СО2 фиксация углерода в их листьях компартментализована [30]
Хотя рибулозобисфосфат-карбоксилаза присоединяет к рибулозо-1,5-фосфату преимущественно СО2, при низких концентрациях углекислоты она будет присоединять к нему О2. Это явно расточительный путь, при котором образуется одна молекула 3-фосфоглицерата и одна молекула двухуглеродного соединения фосфогликолата, а не две молекулы 3-фосфоглицерата (см. рис. 7-42). Фосфогликолат превращается в гликолат и поступает в пероксисомы, где из двух молекул гликолата синтезируется одна молекула 3-фосфоглицерата (три углеродных атома) и одна молекула СО2. Так как в этом процессе потребляется О2 и освобождается СО2, он получил название фотодыхания. У многих растений около трети фиксированного углерода вновь высвобождается в виде СО2 в результате фотодыхания. Пока не ясно, несет ли фотодыхание у растений какую-либо полезную функцию, или же это просто способ возвращения на путь фиксации углерода некоторой его части, превращенной в фосфогликолат из-за нежелательного взаимодействия кислорода с рибулозо-1,5-бисфосфатом.
Фотодыхание может стать серьезной помехой в жарких, засушливых условиях, где растениям приходится закрывать свои устьица (поры в листьях, служащие для газообмена), чтобы избежать чрезмерной потери влаги. В результате уровень СО2 в листьях резко падает, что ведет к усилению фотодыхания. Однако в листьях многих растений, произрастающих в сухом и жарком климате, таких как кукуруза и сахарный тростник, имеется специфический адаптивный механизм. У этих растений реакции цикла фиксации углерода, показанные на рис. 7-43, протекают только в хлоропластах специализированных клеток в обкладке проводящего пучка, в которых содержится вся рибулозобисфосфат-карбоксилаза. Эти клетки защищены от воздуха и окружены слоем клеток мезофилла, «перекачивающих» СО2 в клетки обкладки и тем самым создающих для рибулозобисфосфат-карбоксилазы высокую концентрацию СО2, которая сильно подавляет фотодыхание.
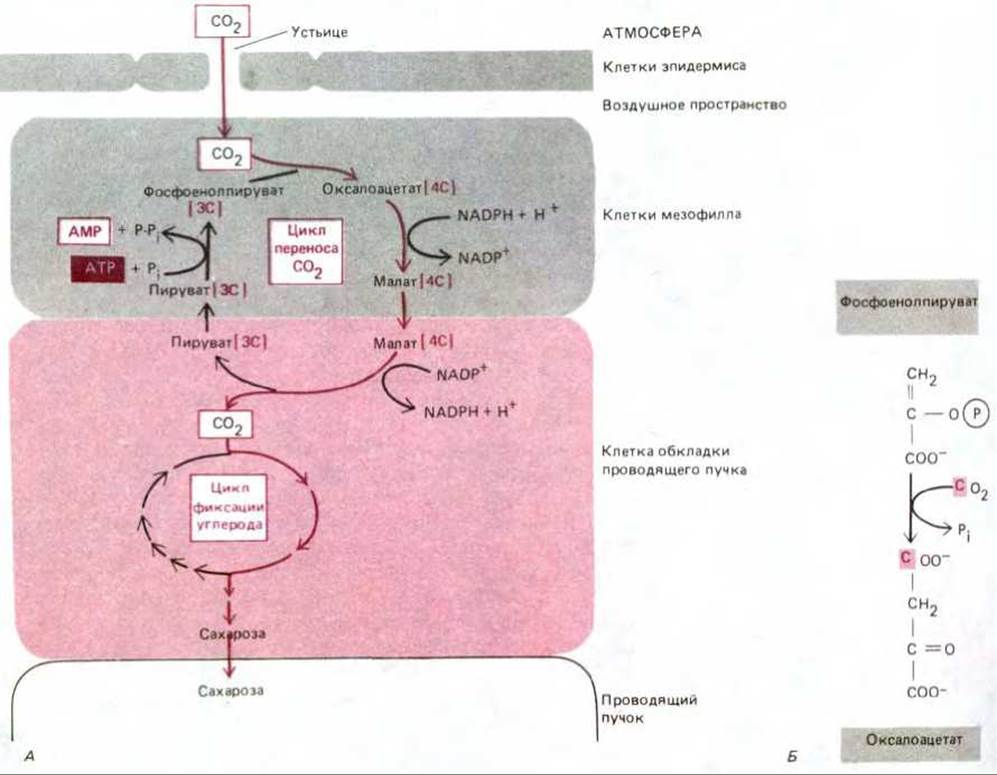
Рис. 7-44. Цикл транспортирования СО2 у таких растений, как кукуруза. А. Образование углеводов происходит только в клетках обкладки проводящего пучка, где находится вся рибулозобисфосфат-карбоксилаза. Цикл перемещения СО2 начинается в клетках мезофилла; в реакциях цикла участвуют четырех- и трехуглеродные соединения, указанные на схеме. Варианты такого цикла встречаются и в других СО2-транспортирующих растениях. Б. Взаимодействие фосфоенолпирувата с СО2 в клетках мезофилла.
«Насосом» для перекачки СО2 служит цикл реакций, начинающийся фиксацией СО2 в цитозоле клеток мезофилла при участии фермента, обладающего высоким сродством к двуокиси углерода (в виде бикарбоната). Образующееся четырехуглеродное соединение переносится в обкладку проводящего пучка и расщепляется там на одну молекулу СО2 и одну трехуглеродную молекулу. Последняя снова переходит в клетки мезофилла, где в ходе реакции, требующей гидролиза АТР, превращается в активную форму, способную присоединить следующую молекулу СО2 и вновь повторить цикл транспортировки СО2 (рис. 7-44).
Путем импульсного введения растению с таким СО2-насосом радиоактивной 14СО2 было установлено, что первое меченое органическое вещество, появляющееся в мезофилле в результате ассимиляции 14СО2, содержит четыре углеродных атома, тогда как в других растениях оно оказывалось трехуглеродным (см. рис. 7-43). По этой причине транспортирующие СО2 виды называют С4-растениями, а все остальные - С3-растениями (рис. 7-45).
Подобно всякому направленному транспортному процессу, перенос СО2 в клетки обкладки проводящего пучка требует затрат энергии. В жарких, сухих условиях эти затраты часто бывают намного меньше потерь от фотодыхания, происходящего в С3-растениях, поэтому С4-растения получают здесь преимущество. Кроме того, так как С4-растения могут осуществлять фотосинтез при низких концентрациях СО2 внутри листа, они меньше открывают устьица и потому способны фиксировать примерно в два раза больше углерода на единицу потерь воды, чем С3-растения.
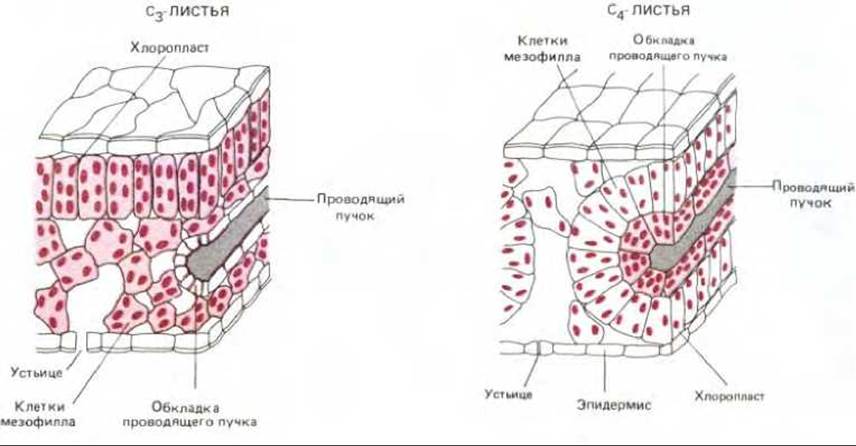
Рис. 7-45. Сравнение анатомического строения листьев у С3-растений и С4-растений. В обоих случаях клетки, хлоропласты которых осуществляют нормальный цикл фиксации углерода, выделены цветом. В С4-растениях клетки мезофилла специализированы для активной транспортировки СО2, а не для фиксации углерода; именно эти клетки создают высокое отношение СО2:O2 в клетках обкладки проводящего пучка. Только в этих клетках у таких растений происходит цикл фиксации углерода (см. рис. 7-44). По проводящим пучкам образовавшаяся в листе сахароза поступает во все остальные ткани растения.
7.3.6. Фотосинтез определяется фотохимией молекулы хлорофилла [31]
Рассмотрев реакции связывания углерода, вернемся теперь к вопросу о том, как в процессе фотосинтетического переноса электронов, протекающем в хлоропласте, образуются АТР и NADH, необходимые для синтеза углевода из СО2 и Н2О (см. рис. 7-41). Необходимая энергия извлекается из солнечного света, поглощаемого молекулами хлорофилла (рис. 7-46). Процесс преобразования энергии начинается с возбуждения молекулы хлорофилла квантом света (фотоном), сопровождающегося переходом электрона на более высокий энергетический уровень. Такая возбужденная молекула нестабильна и стремится вернуться к исходному состоянию одним из трех способов: 1) в результате превращения избыточной энергии в тепло (в молекулярное движение), либо в тепло и свет с большей длиной волны (флуоресценция) в том случае, когда лучистая энергия поглощается отдельной молекулой хлорофилла в растворе; 2) в результате передачи энергии (но не электрона) непосредственно соседней молекуле хлорофилла при помощи процесса, называемого резонансной передачей энергии; или 3) путем передачи высокоэнергетического электрона одной из ближайших молекул (акцептору электрона) и возвращения в первоначальное состояние в результате принятия низкоэнергетического электрона от какой-то другой молекулы (донора электрона, рис. 7-47). Последние два механизма играют ключевую роль в фотосинтезе.
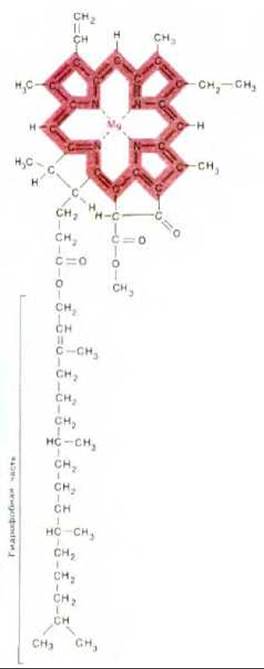
Рис. 7-46. Строение хлорофилла. Атом магния связан в порфириновом кольце, близком по структуре к порфириновому кольцу, связывающему железо в геме (сравните с рис. 7-27). Цветом выделена система сопряженных двойных связей.
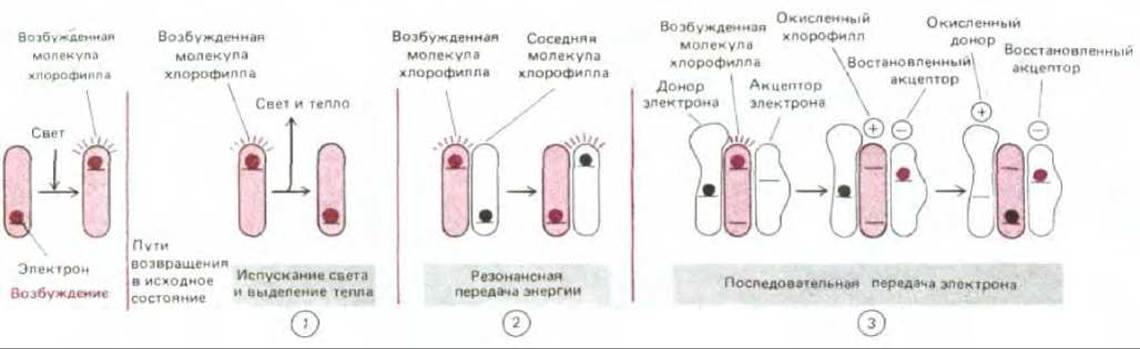
Рис. 7-47. Три возможных пути возвращения активированного хлорофилла (молекулы, содержащей высокоэнергетический электрон) в исходное невозбужденное состояние. В первом случае (1) лучистая энергия, поглощенная изолированной молекулой хлорофилла, полностью высвобождается в виде света и тепла. В отличие от этого при фотосинтезе хлорофилл передает свою энергию другой молекуле в антенном комплексе (2) или отдает возбужденный электрон в реакционном центре (3), как подробнее описано в тексте.
7.3.7. Фотосистема содержит реакционный центр и антенный комплекс [32]
Фотосистемами называют состоящие из множества белков комплексы, которые катализируют преобразование энергии света через энергию возбужденных молекул хлорофилла в биологически полезные формы. Фотосистема содержит два тесно связанных компонента: фотохимический реакционный центр и антенный комплекс (рис. 7-48).
Антенный комплекс необходим для улавливания света. В хлоропластах он представляет собой скопление нескольких сотен молекул хлорофилла, связанных между собой белками, которые прочно удерживают эти молекулы в тилакоидной мембране. В зависимости от вида растения в каждом комплексе находятся также дополнительные пигменты - каротиноиды, которые способны улавливать свет с другими длинами волн. При возбуждении молекулы хлорофилла в антенном комплексе энергия быстро передается от одной молекулы к другой путем резонансного переноса до тех пор, пока не достигнет двух особых молекул хлорофилла в фотохимическом реакционном центре. Таким образом, каждый антенный комплекс действует как «воронка», собирающая энергию и направляющая ее к специальным участкам, где она может быть использована наиболее эффективно (рис. 7-48).
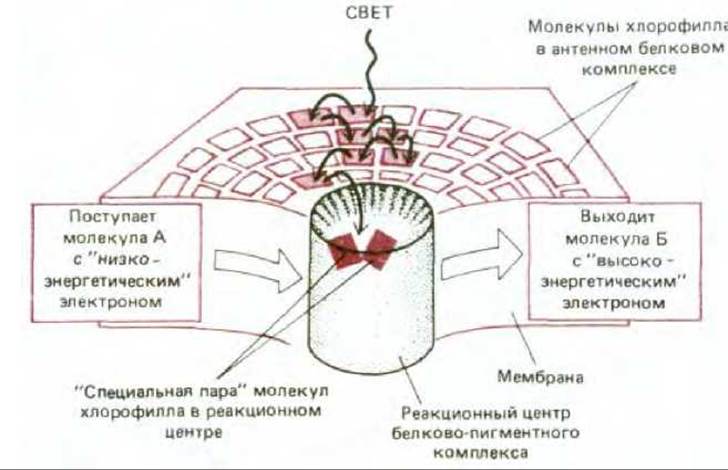
Рис. 7-48. Фотосистема состоит из реакционного центра и антенны. Реакционный центр представляет собой трансмембранный белковый комплекс, удерживающий «специальную пару» молекул хлорофилла в определенном положении относительно других переносчиков электронов (см. рис. 749). Реакционный центр катализирует третий процесс, представленный на рис. 7-47. Если рассматривать этот центр как фермент, то его субстратами будут слабый донор электронов (молекула А) и слабый акцептор электронов (молекула Б), а продуктами реакции - сильный акцептор электронов (окисленная молекула А) и сильный донор электронов (восстановленная молекула Б). Антенный комплекс содержит большую часть хлорофилла тилакоидной мембраны и служит как бы воронкой, направляющей энергию возбужденного электрона к реакционному центру. Многие из этих актов переноса энергии происходят между идентичными молекулами хлорофилла, передающими возбуждение случайным образом (процесс 2 на рис. 747). Однако средний промежуток времени между поглощением возбуждающего кванта и передачей возбуждения в реакционный центр составляет всего лишь 10-10-10-9 с, так что в результате бесполезного процесса 1 теряется очень небольшая доля поглощенных
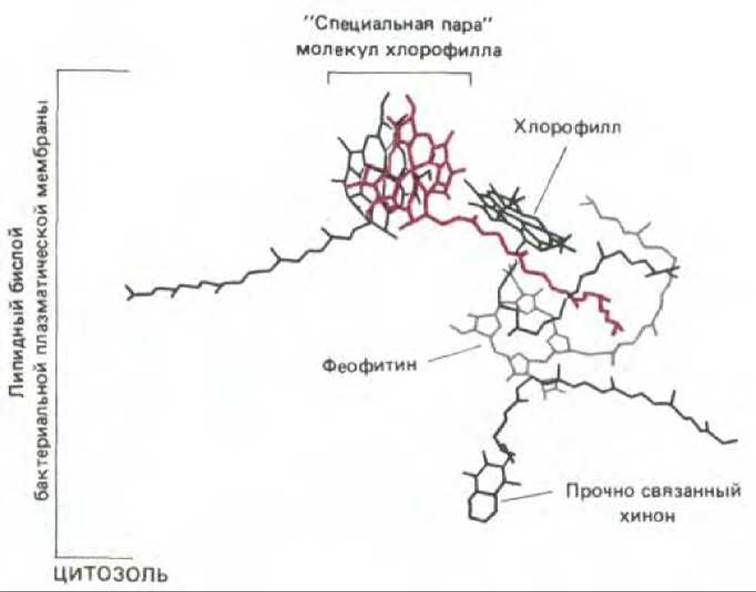
Рис. 7-49. Расположение переносчиков электронов в фотохимическом реакционном центре бактерий, установленное путем рентгеноструктурного анализа. Изображенные молекулы пигмента удерживаются внутри трансмембранного белка и окружены липидным бислоем. От хлорофилла антенного комплекса возбуждение передается электрону специальной пары молекул хлорофилла с помощью резонансного механизма (процесс 2 на рис. 7-47), а затем происходит перенос возбужденного электрона от специальной пары молекул хлорофилла на хинон (через ряд промежуточных этапов, см. рис. 7-50).
Фотохимический реакционный центр это трансмембранный белково-пигментный комплекс, составляющий самое «сердце» фотосинтеза. Полагают, что этот комплекс впервые появился у примитивных фотосинтезирующих бактерий более 3 млрд. лет назад. Особая пара молекул хлорофилла в реакционном центре действует как надежная ловушка для энергии возбуждения благодаря тому, что реакционно-способные электроны этих молекул прямо передаются в цепь акцепторов, расположенных в непосредственной близости к хлорофиллу в том же самом белковом комплексе (рис. 7-49). Быстро удаляя высокоэнергетический электрон от хлорофилла, реакционный центр передает его близлежащим молекулам, в которых электрон может находиться в гораздо более стабильном состоянии. Тем самым электрон становится доступным для последующих фотохимических реакций, протекание которых требует времени. Как мы увидим, суммарный результат этих более медленных реакций заключается в том, что низкоэнергетический электрон в составе слабого донора электронов (такого, как вода) становится высокоэнергетическим в составе сильного донора (такого, как хинон).
7.3.8. Лучистая энергия, поглощенная хлорофиллом реакционного центра, используется для замены слабого донора электронов сильным [33]
Процессы переноса электронов в только что описанных фотохимических реакциях интенсивно изучались с помощью методов скоростной спектроскопии, особенно в фотосистеме пурпурных бактерий, более простой, чем эволюционно близкая к ней фотосистема хлоропластов. Реакционные центры бактерий можно солюбилизировать и выделить в активной форме с помощью детергента. Это крупные белково-пигментные комплексы, и в 1985 г. методом рентгеноструктурного анализа удалось определить их полную трехмерную структуру (см. рис. 6-72 и 7-49). Эта структура в сочетании с данными кинетики дает наилучшее представление о реакциях переноса электронов, лежащих в основе фотосинтеза.
На рис. 7-50 схематически представлена последовательность этих реакций в реакционном центре пурпурных бактерий. Электрон, возбужденный в результате поглощения света, быстро передается от особой пары молекул хлорофилла через ряд других пигментов (рис. 7-49) на прочно связанный хинон - акцептор электронов, обозначенный QA. В результате этого переноса электрона, происходящего менее чем за 10-9 с и практически необратимого, в хлорофилле образуется положительно заряженная «дырка», обладающая очень высоким сродством к электронам. В результате захвата электрона от ближайшего цитохрома (в норме слабого донора электронов) эта «дырка» заполняется. Затем высокоэнергетический электрон, удерживаемый QA, переходит на второй хинон, QB, после чего покидает реакционный центр и переходит на подвижную молекулу хинона (Q) в фотосинтетической мембране. Будучи восстановлен, этот хинон служит сильным донором электронов, восстановительная способность которого может использоваться для перемещения протонов.
Основной принцип описанного процесса заключается в том, что фотосистема дает возможность использовать энергию света для переноса электрона от слабого донора электронов, т. е. молекулы, имеющей большое сродство к электронам (в данном случае от цитохрома), на такую молекулу, как хинон, который в восстановленной форме служит сильным донором электронов. Таким образом, энергия возбуждения, которая в обычных условиях рассеялась бы в виде тепла и/или флуоресценции, используется для повышения энергии электрона и образования сильного донора электронов. Как мы увидим, в хлоропластах высших растений начальным донором электронов служит не цитохром, а вода, чем и объясняется выделение кислорода при фотосинтезе у растений. Прежде чем перейти к рассмотрению процессов, происходящих в более сложной фотосистеме хлоропластов и доставляющих в конечном результате энергию для синтеза АТР и NADPH, посмотрим, как эти конечные продукты образуются у пурпурных бактерий с помощью менее сложного, но похожего механизма.
7.3.9. В процессе бактериального фотосинтеза на плазматической мембране создается электрохимический протонный градиент, энергия которого используется для синтеза как АТР, так и NADPH [34]
Энергия электронов, переносимых восстановленным хиноном, используется в плазматической мембране пурпурных бактерий двумя различными способами для двух целей - для синтеза АТР и образования NADPH. АТР синтезируется с помощью механизма, включающего перекачку протонов и похожего на тот, с которым мы уже познакомились, рассматривая митохондрии (разд. 7.1.8): протоны перемещаются через плазматическую мембрану бактерии в результате переноса высокоэнергетических электронов хиноном на комплекс b-c1, встроенный в эту мембрану. Комплекс b-c1 передает затем свои электроны на растворимый цитохром, от которого электроны (теперь уже с низкой энергией), пройдя через другой, прочно связанный цитохром, вновь попадают в реакционный центр, завершая таким образом циклический процесс (рис. 1-51, А).
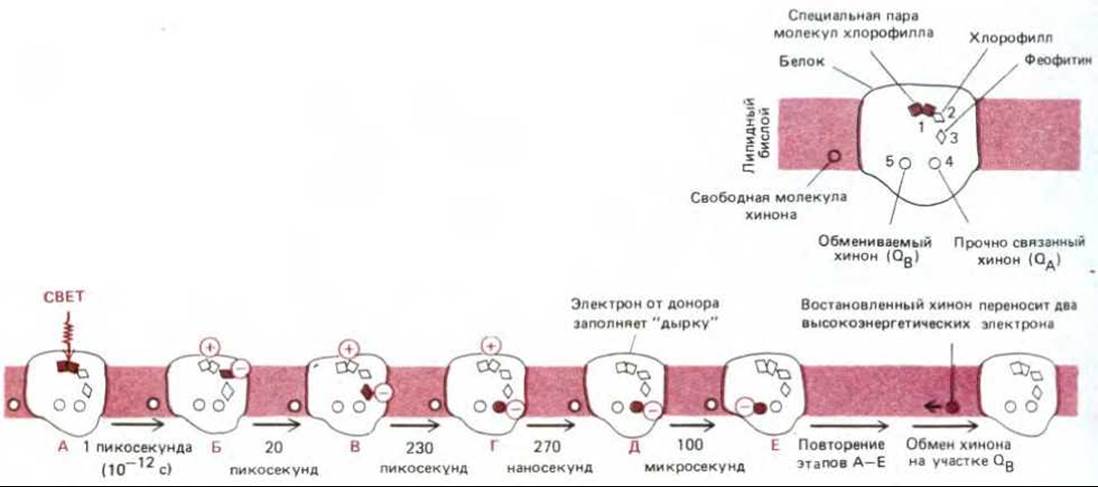
Рис. 7-50. Перенос электронов, происходящий в фотохимическом реакционном центре пурпурных бактерий. Полагают, что сходная цепь реакций осуществляется и в эволюционно близкой фотосистеме II у растений. Вверху справа схематично представлены молекулы, переносящие электроны, - те, что изображены на рис. 7-49, и, кроме того, обмениваемый хинон (Qb) и подвижный хинон Q, растворенный в липидном бислое. Переносчики электронов 1-5 определенным образом связаны с трансмембранным белком, который состоит из 596 аминокислотных остатков, образующих две отдельные субъединицы (см. рис. 6-32). После возбуждения световым фотоном богатый энергией электрон переходит с одной молекулы пигмента на другую, и это ведет к разделению зарядов, что показано на рисунке внизу (стадии В-Д; молекулы пигмента, несущие высокоэнергетические электроны, выделены цветом.) Перейдя в липидный бислой, хинон с двумя электронами захватывает два протона и утрачивает свой заряд (см. рис. 7-30).
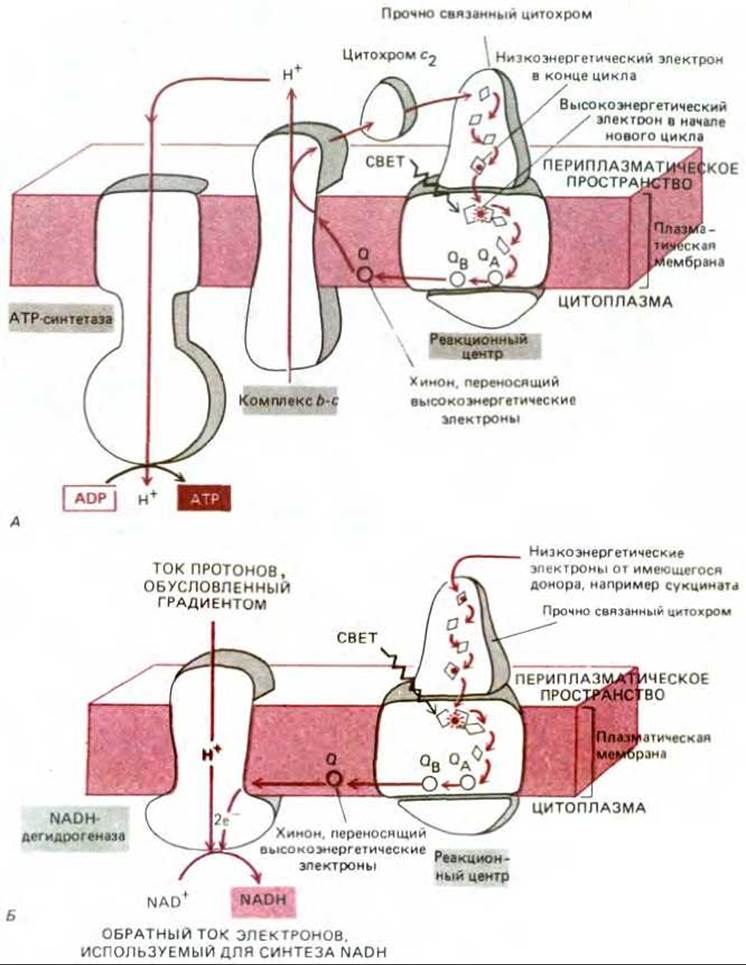
Рис. 7-51. Две реакции переноса электронов в фотосинтетической системе пурпурных бактерий. Эти реакции протекают в плазматической мембране, а цитохром С2 находится в растворимой форме в периплазматическом пространстве под наружной мембраной (см. рис. 6-54). А. В результате циклического потока электронов на плазматической мембране создается электрохимический протонный градиент. Энергия этого градиента используется АТР-синтетазой для синтеза АТР в бактериальной плазматической мембране. Б. Обратный поток электронов через NADH-дегидрогеназу, осуществляемый за счет энергии того же протонного градиента, используется для синтеза NADH.
NADPH образуется в ходе второго электронтранспортного процесса, в котором высокоэнергетические электроны переходят от хинона не на комплекс b-c1, а на NAD. Образующийся при этом NADH превращается затем с помощью трансгидрогеназы в NADPH. Так как переносимые хиноном высокоэнергетические электроны находятся на более низком энергетическом уровне, чем электроны в NADH (напомним, что в митохондриях электроны переносятся с NADH на хинон, а не наоборот - см. рис. 7-34), образование NADH из NAD требует затраты энергии. У пурпурных фотосинтезирующих бактерий электрохимический протонный градиент, создаваемый на плазматической, мембране, заставляет протоны возвращаться в клетку через NADH-дегидрогеназный комплекс, снабжая этот комплекс энергией, необходимой для обратного переноса электронов от хинона на NAD (рис. 7-57, Б).
Таким образом, в плазматической мембране пурпурных бактерий реакционные центры используются для создания большого пула восстановленных молекул. Часть этих молекул обеспечивает создание на плазматической мембране значительного электрохимического протонного градиента. За счет энергии этого градиента осуществляются два процесса: 1) синтез АТР с помощью АТР-синтетазы и 2) создание обратного потока электронов от остальной части восстановленного хинона на NAD, в результате чего генерируется восстановительная сила, необходимая для синтеза органических молекул.
7-24;
7-25;
7-26
7.3.10. У растений и цианобактерий в результате нециклического фотофосфорилирования образуются как NADPH, так и АТР [31, 35]
Наиболее сложен фотосинтез у растений и цианобактерий. Здесь в двухступенчатом процессе, называемом нециклическим фотофосфорилированием, сразу образуются и АТР, и NADPH. Благодаря тому что две фотосистемы последовательно возбуждают электрон, последний способен пройти весь путь от воды до NADPH. По мере прохождения высокоэнергетических электронов через сопряженные фотосистемы часть заключенной в электронах энергии генерирует NADPH, а часть отводится на синтез АТР.
В первой из двух фотосистем, по историческим причинам получившей название фотосистемы II, кислород двух молекул воды связывается группой атомов магния при участии плохо изученного фермента, расщепляющего воду. Извлекаемые по одному электроны сразу же заполняют образовавшиеся под действием света «дырки» в хлорофилле реакционного центра. Как только четыре электрона извлечены (для этого требуются четыре кванта света), фермент освобождает О2; таким образом, фотосистема II катализирует реакцию 2Н2О → 4Н+ + 4е- + О2.
«Ядро» реакционного центра в фотосистеме II гомологично только что описанному бактериальному реакционному центру и точно так же генерирует сильные доноры электронов в форме восстановленных молекул хинона в мембране. Эти молекулы передают электроны на комплекс b6 - f сходный с бактериальным комплексом b-с и комплексом b - c1 в дыхательной цепи митохондрий. Как и в митохондриях, комплекс b6 - f перекачивает протоны через тилакоидную мембрану в тилакоидное пространство (в хлоропластах) или из цитозоля через впячивания плазматической мембраны (у цианобактерий), и создающийся при этом электрохимический градиент доставляет энергию для синтеза АТР АТР- синтетазой (рис. 7-52 и 7-53). Конечным акцептором в этой цепи переноса электронов служит вторая фотосистема (фотосистема I), принимающая электроны в «дырки», образовавшиеся под действием света в хлорофилле ее реакционного центра. В то время как электроны, активированные фотосистемой II, имеют слишком низкую энергию, чтобы перейти на NADP+, каждый электрон, покидающий фотосистему I, находится на очень высоком энергетическом уровне благодаря последовательной активации двумя квантами света. В результате эти электроны способны перейти на железо-серный центр ферредоксина и восстановить NADP+ до NADPH (рис. 7-53); при этом из среды извлекается один протон.
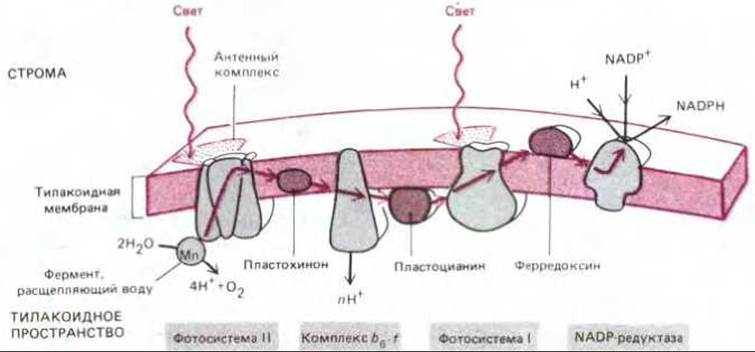
Рис. 7-52. Перенос электронов в процессе фотосинтеза в тилакоидной мембране. Подвижными переносчиками электронов в этой цепи служат пластохинон (очень сходный с убихиноном митохондрий), пластоцианин (небольшой медьсодержащий белок) и ферредоксин (небольшой белок, содержащий железо-серный центр). Комплекс bb-f очень похож на комплекс b-c1 митохондрий и комплекс b-с бактерий (см. рис. 7-63): все три комплекса принимают электроны от хинонов и перекачивают протоны. Обратите внимание, что протоны, высвобождаемые при окислении воды, и протоны, захватываемые при образовании NADPH, тоже участвуют в создании электрохимического протонного градиента, доставляющего энергию для синтеза АТР.
Зигзагообразную схему фотосинтеза, показанную на рис. 7-53, называют Z-схемой. В результате двух отдельных этапов возбуждения, каждый из которых катализируется своей фотосистемой, электрон передается от воды, обычно прочно удерживающей свои электроны (редокс- потенциал +820 мВ), на NADPH, который имеет довольно слабое сродство к электронам (редокс-потенциал -320 мВ). Один квант видимого света не способен сообщить электрону достаточно энергии для прохождения всего пути от начала фотосистемы II до конца фотосистемы I; видимо, для этого нужно столько энергии, сколько требуется для переноса электрона с воды на NADP+. Кроме того, использование двух отдельных следующих друг за другом фотосистем позволяет связать их электронтранспортной цепью, в которой энергия электронов будет достаточна для перемещения Н+ через тилакоидную мембрану (или плазматическую мембрану цианобактерий), и тем самым -направить часть возбуждаемых светом электронов на синтез АТР.
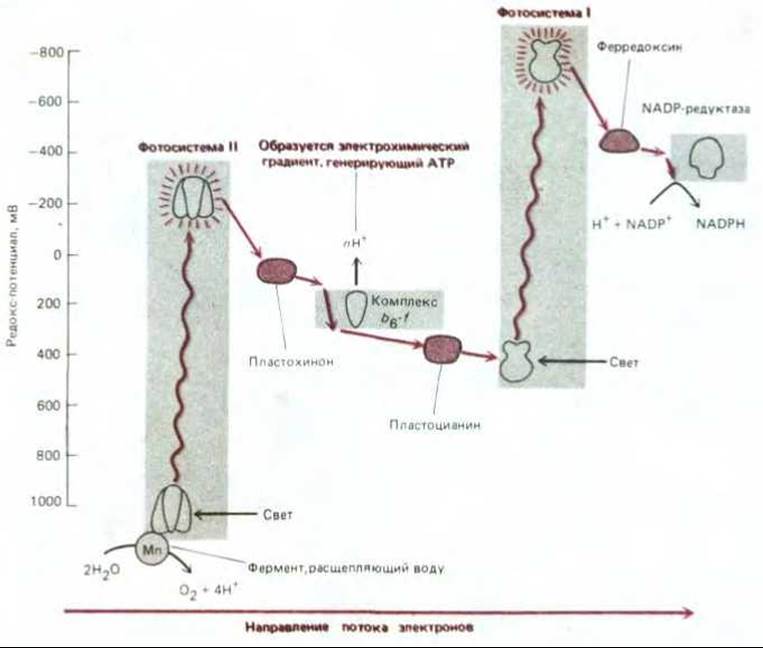
Рис. 7-53. Изменения редокс-потенциала при прохождении электронов в процессе фотосинтеза с образованием NADPH и АТР у растений и цианобактерий. Фотосистема II очень похожа на реакционный центр пурпурных бактерий (см. рис. 7-50), с которым она эволюционно связана. Фотосистема I отличается от этих двух систем: как полагают, она эволюционно родственна фотосистемам другой группы прокариот - зеленых бактерий. В фотосистеме I электроны возбужденного хлорофилла проходят через ряд прочно связанных железо-серных центров. Две последовательно соединенные фотосистемы обеспечивают суммарный поток электронов от воды к NADP+ с образованием NADPH. Кроме того, образуется АТР с помощью АТР-синтетазы (не показана) за счет энергии электрохимического протонного градиента, который создается электронтранспортной цепью, связывающей фотосистему II с фотосистемой I. Эту Z-схему образования АТР называют нециклическим фосфорилированием в отличие от циклической схемы, представленной на рис. 7-54 (см. также рис. 7-52).
7.3.11. В процессе циклического фотофосфорилирования хлоропласты могут синтезировать АТР без образования NADPH [31, 36]
При нециклическом фотофосфорилировании, рассмотренном выше, высокоэнергетические электроны, покидающие фотосистему II, обеспечивают синтез АТР, тогда как энергия электронов, выходящих из фотосистемы I, расходуется на образование NADPH. При этом на одну пару электронов, переходящих с Н2О на NADP+ с образованием молекулы NADPH, синтезируется немногим больше одной молекулы АТР. Однако для фиксации углерода АТР нужен в значительно большем количестве, чем NADPH (см. рис. 7-43). Для получения дополнительного АТР хлоропласты могут переводить фотосистему I на циклический режим работы, при котором энергия системы направляется не на синтез NADPH, а на образование АТР. В этом процессе, называемом циклическим фотофосфорилированием, участвует поток электронов, во многом сходный с тем, энергию которого используют фотосинтезирующие бактерии для получения АТР (см. рис. 7-51, А). При этом высокоэнергетические электроны, активированные фотосистемой I, не переходят к NADP+, а возвращаются на комплекс b6-f, вызывая тем самым перемещение протонов через тилакоидную мембрану. Создающийся в результате электрохимический градиент доставляет энергию для синтеза АТР (рис. 7-54).
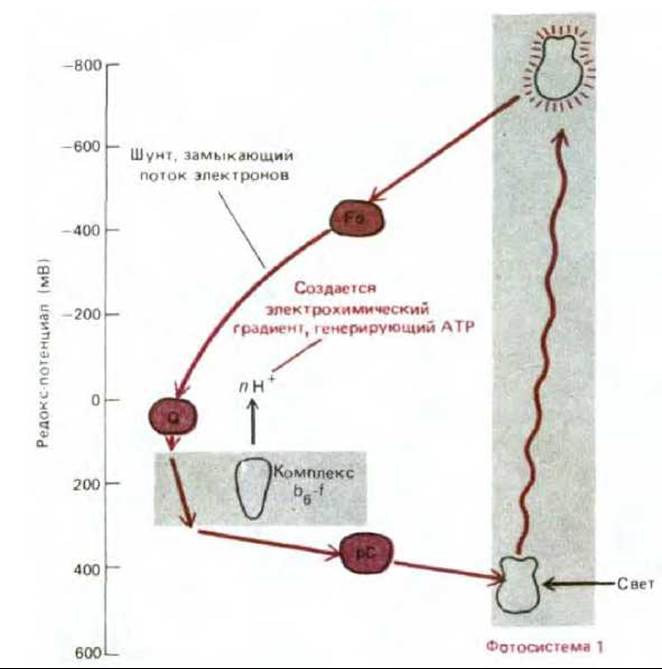
Рис. 7-54. Путь переноса электронов при циклическом фосфорилировании. Этот путь позволяет синтезировать только АТР, без образования NADPH и О2. Будет ли поток электронов нециклическим или циклическим, зависит от того, куда будет передавать свои реакционно-способные электроны ферредоксин - на NADP+, как показано на рис. 7-53, или на компоненты, ведущие обратно к комплексу b6-f. Всякий раз, когда происходит накопление NADPH и соответственно снижается уровень NADP+, создаются благоприятные условия для протекания фотосинтеза по циклической схеме. Другие, менее прямые регуляторные механизмы тоже обеспечивают образование при фотосинтезе АТР и NADPH в надлежащей пропорции. Ф — ферредоксин; ПХ - пластохинон; ПЦ - пластоцианин.
Итак, процесс нециклического фотофосфорилирования, включающий восстановление NADP+ с участием воды как донора электронов, осуществляется при совместном действии фотосистем I и II, и в результате образуются NADPH, АТР и О2. В отличие от этого при циклическом фотофосфорилировании, в котором участвует только фотосистема I, синтезируется один лишь АТР - образования NADPH и О2 не происходит. Таким образом, относительная интенсивность циклического и нециклического переноса электронов будет определять, какая доля световой энергии пойдет на образование восстановительной силы (NADPH) и какая превратится в энергию фосфатных связей (АТР). Этот баланс регулируется в соответствии с потребностью в NADPH. Будет ли поток электронов циклическим или нет, зависит от того, куда будет передавать свои реакционноспособные электроны ферредоксин - на NADP+ или на компоненты, ведущие обратно к комплексу b6-f (сравните рис. 7-53 и 7-54). При низких концентрациях NADP+, обусловленных накоплением NADPH, будет преобладать циклический процесс, приводящий к синтезу АТР.
Влияние уровня NADPH на циклическое фотофосфорилирование - это лишь часть обширной регуляторной сети, контролирующей активность фотосистем I и II. Например, избыточная активность фотосистемы II приводит к повышению соотношения восстановленного и окисленного хинона в тилакоидной мембране, а чрезмерная активность фотосистемы II - к противоположному эффекту (см. рис. 7-53). Однако всякий раз, когда соотношение восстановленного хинона к окисленному превысит определенное пороговое значение, активируется протеинкиназа, фосфорилирующая главный светоулавливающий пигментный белок в антенном комплексе. Это способствует отделению антенного комплекса от фотосистемы и даже переходу его из области локализации фотосистемы II (граны) в тилакоидную мембрану, где сконцентрированы компоненты фотосистемы І. В результате фотосистема I получает большую долю лучистой энергии, до тех пор пока уровень хинонов не возвратится к норме.
7-27
7.3.12. Геометрия перемещения протонов в митохондриях и в хлоропластах сходна [37]
Наличие в хлоропластах третьего внутреннего компартмента-тилакоидного пространства - на первый взгляд сильно отличает их от митохондрий. Однако геометрия перемещения протонов в этих двух органеллах очень сходна. Как видно из рис. 7-55, в хлоропластах протоны откачиваются из стромы (рН8) в тилакоидное пространство (рН около 5), создавая градиент в 3-3,5 единицы рН. Это создает на тилакоидной мембране протонодвижущую силу около 200 мВ (почти целиком обусловленную градиентом рН, а не мембранным потенциалом), за счет которой мембранная АТР-синтетаза осуществляет синтез АТР.
В митохондриальном матриксе, так же как и в строме хлоропласта, величина рН близка к 8, но она создается за счет переноса протонов из органеллы в цитозоль (рН около 7), а не в какой-то ее внутренний компартмент. Поэтому градиент рН относительно мал и протонодвижущая сила на внутренней митохондриальной мембране, близкая к такой же силе на тилакоидной мембране хлоропласта, в основном создается за счет суммарного мембранного потенциала (см. разд. 7.1.7). Однако и в митохондриях, и в хлоропластах каталитический участок АТР-синтетазы находится в большом компаргменте органеллы (соответственно в матриксе и в строме), который имеет рН около 8,0 и заполнен растворимыми ферментами. Поэтому именно здесь образуется весь АТР органеллы (рис. 7-55).
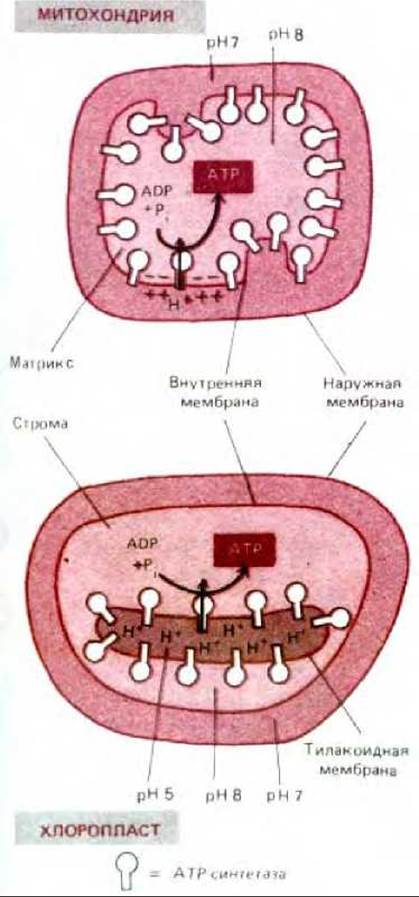
Рис. 7-55. Сравнение потока протонов и ориентации АТР-синтетазы в митохондриях и хлоропластах. Компартменты со сходным рН окрашены одинаково. Протонодвижущая сила на тилакоидной мембране почти полностью обусловлена градиентом рН; высокая проницаемость этой мембраны для ионов Mg2+ и Cl- позволяет потоку этих ионов рассеивать большую часть мембранного потенциала. Как полагают, митохондрии не могли бы выдержать такое защелачивание (до рН 10), какое потребовалось бы для создания протонодвижущей силы без участия мембранного потенциала.
Несмотря на эти черты сходства между митохондриями и хлоропластами, последние устроены таким образом, что происходящие в них процессы переноса электронов и протонов более доступны для изучения, чем в митохондриях. Разрушив внутреннюю и наружную мембраны хлоропластов, можно выделить неповрежденные тилакоидные диски. Они сходны с субмитохондриальными частицами: компоненты электронтранспортной цепи, использующие NADP+, ADP и фосфат, тоже расположены здесь с внешней стороны мембраны. Однако тилакоиды представляют собой интактные естественные структуры и потому гораздо более активны, чем субмитохондриальные частицы, получаемые из митохондрий искусственным путем. Поэтому некоторые из экспериментов, впервые доказавших ключевую роль хемиосмотического механизма, были проведены на хлоропластах, а не на митохондриях.
7.3.13. Внутренняя мембрана хлоропласта, подобно внутренней мембране митохондрии, содержит белки-переносчики, облегчающие обмен метаболитами с цитозолем [38]
Хотя электрон- и протонтранспортирующие реакции фотосинтеза легче всего изучать на препаратах хлоропластов, у которых внутренняя и наружная мембраны разрушены и удалены, такие хлоропласты не способны к фотосинтетической фиксации СО2 из-за отсутствия ряда важных веществ, в нормальных условиях имеющихся в строме. Но хлоропласты можно выделить и так, что их внутренняя мембрана останется неповрежденной. На таких препаратах можно показать, что внутренняя мембрана обладает избирательной проницаемостью и, значит, содержит специальные белки-переносчики. Например, значительная часть глицеральдегид-3-фосфата, образующегося в строме при фиксации углерода, выводится из хлоропластов с помощью эффективной системы антипорта, обменивающей трехуглеродные фосфосахара на неорганический фосфат.
Глицеральдегид-3-фосфат, в изобилии поступающий в цитозоль, используется клеткой как исходный материал для биосинтеза многих других веществ, включая сахарозу, предназначенную на «экспорт». Кроме того, попав в цитозоль, глицеральдегид-3-фосфат легко превращается (в результате некоторых реакций цепи гликолиза) в 3-фосфоглицерат с образованием одной молекулы АТР и одной молекулы NADH (в ходе такой же двустадийной реакции, но идущей в обратном направлении, в цикле фиксации углерода образуется глицеральдегид-3-фосфат - см. рис. 7-43). Таким образом, глицеральдегид-3-фосфат, транспортируемый из хлоропластов, служит не только главным источником связанного углерода, но также доставляет NADPH и АТР для клеточного метаболизма за пределами хлоропласта.
7.3.14. Хлоропласты осуществляют и другие биосинтетические реакции [39]
Помимо фотосинтеза в хлоропластах осуществляется много других биосинтетических процессов. Например, все жирные кислоты клетки и ряд аминокислот образуются с помощью ферментов, находящихся в строме. Кроме того, в хлоропластах происходит восстановление нитрита (NO2-) до аммиака (NH3) за счет энергии электронов, активированных светом; в растениях этот аммиак служит источником азота для синтеза аминокислот и нуклеотидов. Таким образом, значение хлоропластов для метаболизма растений и водорослей не ограничивается их ролью в фотосинтезе.
Заключение
Хлоропласти и фотосинтезирующие бактерии получают высокоэнергетические электроны с помощью фотосистем, улавливающих электроны, возбуждаемые солнечным светом, который поглощается молекулами хлорофилла. В состав фотосистем входит антенный комплекс, связанный с фотохимическим реакционным центром, где в строго определенном порядке расположены белки и пигменты, участвующие в фотохимических реакциях фотосинтеза. До сих пор лучше всего изучен реакционный центр пурпурных фотосинтезирующих бактерий - известна его полная трехмерная структура. У этих бактерий единственная фотосистема создает электрохимический градиент, энергия которого используется для синтеза как АТР, так и NADPH. В хлоропластах и у цианобактерий имеются две фотосистемы. В зависимости от нужд клетки в разных соотношениях осуществляются электронные потоки двух типов: I) нециклический поток, создаваемый при участии двух последовательно соединенных фотосистем, переносит электроны с воды на NADP+ с образованием NADPH, причем попутно синтезируется и АТР; 2) циклический поток, поддерживаемый лишь одной фотосистемой, передающей электроны по замкнутой цепи, приводит к образованию только АТР. В хлоропластах все электронтранспортные процессы происходят в тилакоидной мембране: для синтеза АТР протоны накачиваются в тилакоидное пространство и затем в результате обратного тока протонов через АТР-синтетазу в строме образуется АТР.
Получаемые при фотосинтезе АТР и NADPH служат источниками энергии для многих биосинтетических реакций, происходящих в строме, в том числе для жизненно важного цикла фиксации СО2, в котором из СО2 образуются углеводы. Эти углеводы в виде трехуглеродных фосфосахаров переносятся в цитозоль клетки, где служат источником органического углерода, АТР и восстановительной силы.