Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Внутриклеточная сортировка макромолекул и сохранение клеточных компартментов
ДНК и белки, входящие в состав хромосом
В течение первых 40 лет нашего столетия биологи не принимали всерьез предположения о том, что содержащаяся в хросомах ДНК несет генетическую информацию. Отчасти это было следствием господствовавшего тогда ошибочного мнения, будто бы в нуклеиновых кислотах имеются лишь простые регулярно повторяющиеся тетрануклеотидные последовательности (например, AGCTAGCTAGCT...). Сейчас мы знаем, что ДНК представляет собой чрезвычайно длинный неразветвленный линейный полимер, который может содержать много миллионов нуклеотидов, расположенных в нерегулярной, но отнюдь не случайной последовательности: эта последовательность нуклеотидов в полинуклеотидной цепи ДНК является кодовой формой записи наследственной информации. Линейный четырехбуквенный генетический код, словами-символами которого служат тройки нуклеотидов (кодонов, определяющих аминокислоты, см. разд. 5.1.6), позволяет хранить огромное количество информации в очень малом объеме. В ДНК 1 млн. «букв» (нуклеотидов) умещается на отрезке прямой, длина которого равна 3,4 х 105 нм (0,034 см), и занимает объем, составляющий примерно 106 нм3 (10~15 см3).
Каждая молекула ДНК упакована в отдельную хромосому, а вся генетическая информация, хранящаяся в хромосомах организма, называется геномом. Геном бактерии E.coli содержит 4,7 х 106 нуклеотидных пар, составляющих единственную молекулу ДНК (одна хромосома). Геном человека представлен 6 х 109 парами нуклеотидов, распределенных в 46 хромосомах (22 пары аутосом и 2 отличающиеся друг от друга половые хромосомы), и, следовательно состоит из 24 типов молекул ДНК. У диплоидных организмов, таких как мы с вами, имеется по две копии каждого типа хромосом, одна из этих копий наследуется от матери, а другая от отца (за исключением половых хромосом самцов, которым Y-хромосома всегда достается от отца, а Х-хромосома от матери). Итак, типичная клетка человека содержит 46 хромосом и около 6 х 109 нуклеотидных пар ДНК. Другие млекопитающие имеют геном примерно такого же размера. Теоретически это количество ДНК можно упаковать в куб со стороной 1,9 мкм. Для сравнения, 6 х 109 букв в такой книге заняли бы более миллиона страниц, и ее объем оказался бы в 1017 раз больше.
В данном разделе мы обсудим взаимосвязь между молекулами ДНК и хромосомами и расскажем про разнообразные белки, которые связываются с молекулой ДНК, преобразуя ее в активную эукариотическую хромосому. Некоторые из этих белков контролируют экспрессию генетической информации, регулируя синтез молекул РНК на определенных участках генома. Другие белки, главным образом гистоны, складывают каждую длинную молекулу ДНК таким образом, что она становится компактной и упорядоченной, но при этом сохраняется доступ к необходимой генетической информации.
9-3
9.1.1. Каждая хромосома образуется из одной длинной молекулы ДНК [2]
В каждой отдельной хромосоме человека содержится от 50 х 106 до 250 х 106 нуклеотидных пар. В нескрученном состоянии молекулы ДНК такого размера имели бы длину от 1,7 до 8,5 см, но при удалении хромосомных белков даже самое слабое механическое воздействие приводит к их разрыву. Целые молекулы ДНК можно выделить из некоторых низших эукариотических организмов, таких как дрожжи Saccharomyces cerevisiae, хромосомы которых значительно короче. С помощью метода пульс-гельэлектрофореза удалось показать, что каждая хромосома дрожжей состоит из единственной линейной молекулы ДНК. Эти данные согласуются с результатами весьма сложных измерений, основанных на степени спирализации. Соответствующие эксперименты проводили на хромосомах дрозофилы, молекулы ДНК которой имеют примерно ту же длину, что и хромосомы человека. Полученные разными способами данные позволяют сделать вывод, что все хромосомы содержат только одну молекулу ДНК.
9-4
9-5
9.1.2. Каждая молекула ДНК, образующая хромосому, должна содержать центромеру, две теломеры и точки начала репликации [3]
Для того, чтобы молекула ДНК могла сформировать активную хромосому, она должна обладать способностью реплицироваться, разделяться при митозе и сохраняться в ряду клеточных поколений. Применение метода рекомбинантных ДНК к клеткам дрожжей позволило выделить и определить те элементы, которые «превращают» последовательность нуклеотидов в хромосому. Два из трех этих элементов были идентифицированы при изучении небольших кольцевых молекул ДНК, самостоятельно реплицирующихся в клетках дрожжей Saccharomycos cerevisiae. Оказалось, что для репликации такой молекулы необходима специальная последовательность, которая выполняет роль участка инициации репликации ДНК (называемого также точкой начала репликации). В каждой хромосоме дрожжей таких участков несколько. Второй элемент, необходимый для функционирования последовательности ДНК как хромосомы, называется центромерой. Центромера соединяет содержащую ее молекулу ДНК с митотическим веретеном во время М-фазы (см. разд. 13.5.3). В каждой хромосоме дрожжей имеется только одна центромера. Если участок, выполняющий роль центромеры, встроить в плазмиду, то при делении каждая дочерняя клетка дрожжей обязательно получит одну из двух копий вновь реплицировавшейся молекулы плазмидной ДНК.
Третий необходимый элемент хромосомы - это теломера, она должна присутствовать на каждом конце линейной хромосомы. Если кольцевая плазмида, содержащая участок инициации репликации и центромеру, разрывается по какому-либо сайту, она продолжит свою репликацию и останется прикрепленной к митотическому веретену, однако в последующих поколениях клеток все-таки будет утеряна. Это происходит вследствие того, что репликация на отстающей цепи требует того, чтобы перед копируемым участком имелась последовательность ДНК, которая могла бы служить матрицей для РНК-затравки (см. рис. 5-43). Так как для последних нескольких нуклеотидов линейной молекулы ДНК этих последовательностей нет, ее цепи с каждым новым циклом репликации становятся все короче. У бактерий и вирусов хромосома имеет кольцевую форму, и поэтому подобные затруднения при окончании репликации не возникают. Эукариотические клетки, хромосомы которых линейны, обзавелись специальной теломерной последовательностью ДНК. Это простая повторяющаяся последовательность нуклеотидов, которая периодически наращивается специальным ферментом (см. разд. 9.3.5).
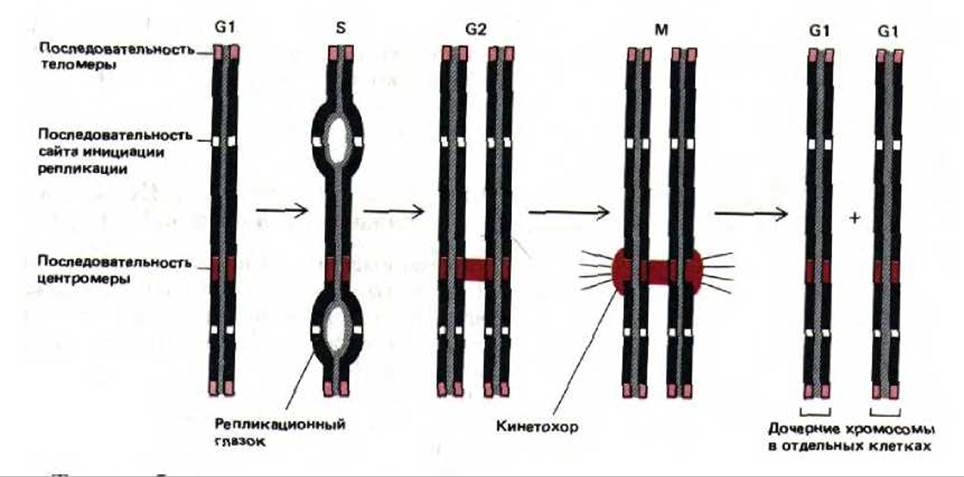
Рис. 9-4. Функционирование трех элементов последовательности ДНК, необходимых для образования стабильных линейных эукариотических хромосом. Теломерные последовательности предотвращают укорачивание хромосом, которое без них происходило бы при каждом цикле репликации ДНК. Центромеры служат для выстраивания молекул ДНК на митотическом веретене в ходе М-фазы. Точки начала репликации (сайты инициации репликации) нужны для формирования реакционных вилок в S-фазе.
Таким образом, потерянная теломерная ДНК восстанавливается, что дает возможность линейной хромосоме реплицироваться полностью. На рис. 9-4 представлены схемы действия трех элементов последовательности ДНК, которые обеспечивают стабильность линейной хромосомы в клетке дрожжей. По-видимому, такие же элементы необходимы и для поддержания стабильности хромосом в клетках человека. Однако до сих пор участки инициации репликации ДНК и последовательности центромер человека охарактеризованы далеко не полностью, а соответствующие дрожжевые последовательности в клетках высших эукариот, как оказалось, не функционируют. С другой стороны, рекомбинантные конструкции, состоящие из ДНК человека и дрожжей, способны реплицироваться в клетках дрожжей как искусственные хромосомы. Таким образом, клетки дрожжей можно использовать для получения геномных библиотек человека (см. разд, 5.6.3), в которых каждый клон ДНК, размноженный в виде искусственной хромосомы, содержит до миллиона нуклеотидных пар последовательности ДНК человека (рис. 9-5).
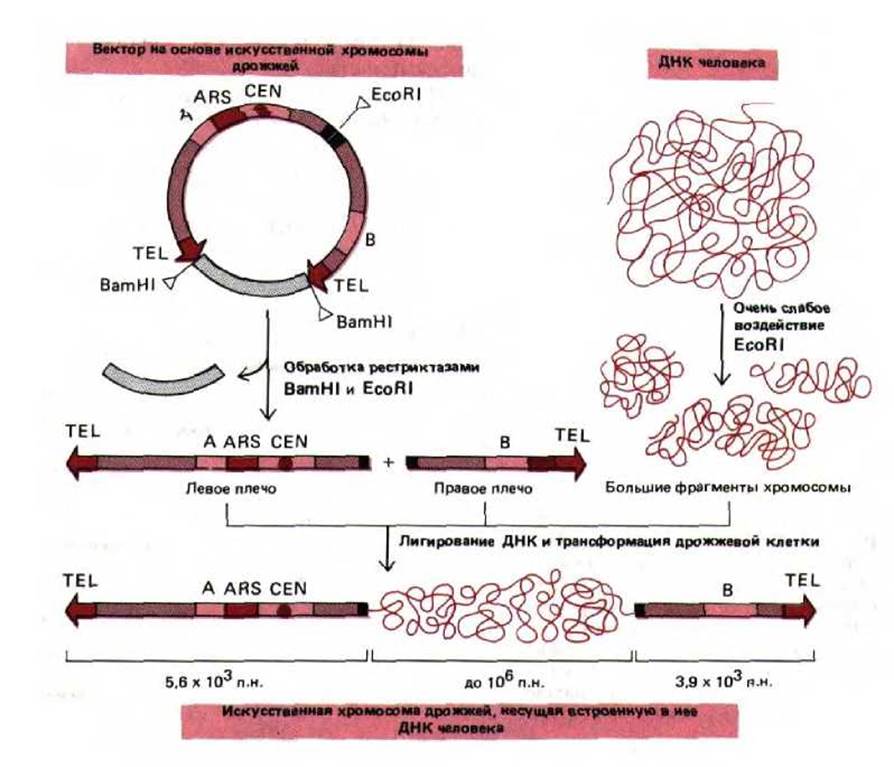
Рис. 9-5. Искусственный хромосомный вектор дрожжей (yeast artificial chromosome, YAC-вектор), позволяющий клонировать очень большие молекулы ДНК. Теломера, центромера и точка начала репликации дрожжей Saccharomyces cerevisiae обозначены соответственно TEL, CEN и ARS (ARS от англ. autonomously replicating sequence - автономно реплициругошиеся последовательности. Точка начала репликации лает возможность плазмиде реплицироваться вне хромосом клеток хозяина). BamHl и EcoRI-рестрикционные эндонуклеазы, которые разрезают двойную спираль ДНК в строго определенных сайтах. Последовательности, обозначенные «А» и «В», кодируют ферменты, которые служат селективными маркерами для отбора трансформированных дрожжевых клеток, несущих искусственную хромосому. (С изменениями из D. Т. Burke, G. Е. Carle and M. V. Olson, Science 236: 806-812, 1987.)
9.1.3. Большая часть ДНК хромосомы не кодирует жизненно важных белков или РНК [4]
Геномы высших организмов содержат, по-видимому, большой избыток ДНК. О том, что относительное содержание ДНК в гаплоидных геномах различных организмов напрямую не связано со сложностью организма, стало ясно уже давно: например, клетки человека содержат в 700 раз больше ДНК, чем Е.соlі, в то же время в клетках некоторых земноводных и растений ДНК в 30 раз больше, чем в клетках человека (рис. 9-6). Более того, содержание ДНК в геномах различных видов земноводных может различаться в 100 раз.
Биологи, изучающие генетику популяций, попытались оценить количество ДНК высших организмов, кодирующей белки клетки или принимающей участие в регуляции генов, ответственных за синтез таких белков. Их подход заключался в следующем: каждый ген всегда с небольшой долей вероятности подвержен мутации-случайному изменению нуклеотидов в ДНК. Чем больше число генов, тем выше вероятность того, что по крайней мере в одном из них произойдет мутация. Так как большинство мутаций приводит к повреждению активности гена, в котором они происходят, скорость мутирования накладывает ограничения на число жизненно важных генов. Принимая во внимание этот довод и исходя из наблюдаемой скорости мутирования, можно заключить, что в регуляции или кодировании жизненно важных белков принимает участие не более нескольких процентов генома млекопитающих. Ниже в поддержку такого вывода будут приведены и другие доказательства. На основании приведенных рассуждений можно сделать весьма важный вывод. Хотя геном млекопитающих в принципе имеет достаточную величину (3 х 109 нуклеотидов), чтобы кодировать почти 3 млн. белков средних размеров, ограничения, накладываемые точностью воспроизведения ДНК, означают, что ни один организм не может иметь более 60000 жизненно важных белков (при этом не учитывается вклад альтернативного сплайсинга РНК). Таким образом с генетической точки зрения человек, вероятно, лишь в 10 раз сложнее, чем плодовая мушка дрозофила, имеющая около 5000 генов.
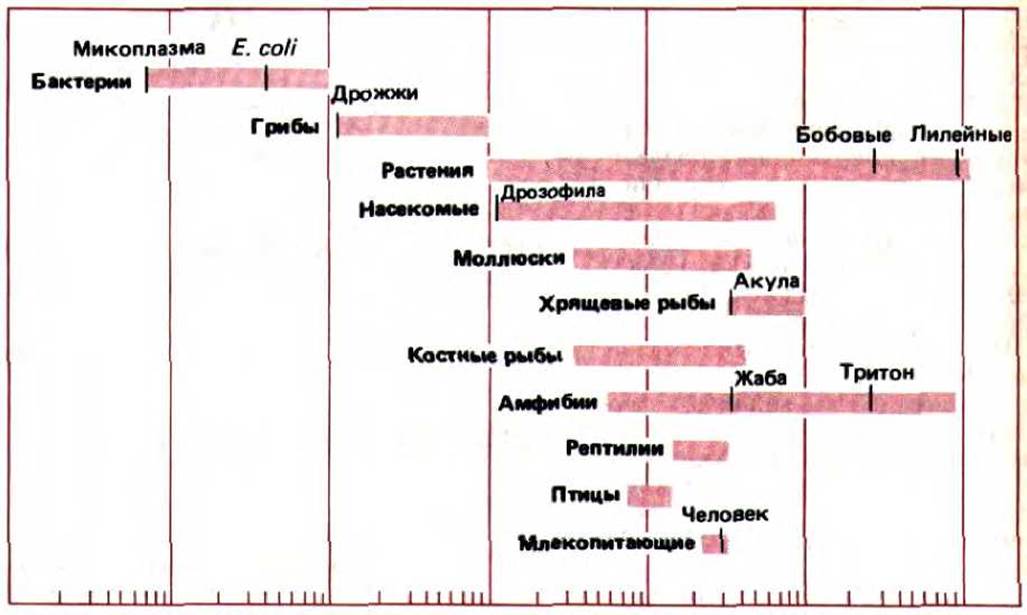
Рис. 9-6. Количество ДНК в гаплоидном геноме самых маленьких прокариотических клеток и самых больших клеток некоторых растений и амфибий может различаться в 100000 раз. Обратите внимание, что размер генома у человека (3 х 109 нуклеотидных пар) намного меньше, чем у некоторых других организмов.
Для чего бы ни служила избыточная ДНК в клетках высших эукариот (см. гл. 10), данные, приведенные на рис. 9-6, доказывают, что клетки высших эукариот, содержащие большое количество дополнительной ДНК, не страдают от этого. И действительно, даже важные кодирующие последовательности у них часто прерываются длинными участками некодирующей ДНК.
9.1.4. Каждый ген-это сложная функционально активная единица, предназначенная для регулируемого синтеза молекулы РНК
Главной функцией генома является образование молекул РНК. Определенные участки последовательности нуклеотидов ДНК копируются с образованием соответствующих последовательностей РНК, которые либо кодируют белки (как мРНК), либо образуют «структурную» РНК, например молекулы тРНК или рРНК. Каждый участок молекулы ДНК, на которой синтезируется активная молекула РНК, носит название «ген».
Гены, входящие в состав хромосом высших эукариот, могут содержать до 2 млн. нуклеотидных пар, а гены, размер которых превышает 100000 нуклеотидных пар, встречаются довольно часто (табл. 9-1). Между тем для кодирования белка среднего размера (содержащего от 300 до 400 аминокислотных остатков) требуется всего лишь 1000 нуклеотидных пар. Большая часть избыточных участков состоит из длинных последовательностей некодирующей ДНК, которая перемежается относительно короткими сегментами кодирующей ДНК. Кодирующие последовательности называются экзонами, а разделяющие их некодирующие последовательности - нитронами. Молекула РНК, синтезированная с такого гена, носит название первичного транскрипта. Для того чтобы первичный транскрипт превратился в мРНК, он подвергается процессингу. При этом некодирующие последовательности удаляются, а кодирующие как бы «сращиваются» в единую молекулу (сплайсинг РНК).
Большие гены состоят из длинной вереницы чередующихся экзонов и нитронов. Кроме того, в каждом гене имеются регуляторные последовательности ДНК, с которыми связываются регуляторные белки, контролирующие транскрипцию. Многие регуляторные последовательности расположены перед (на 5'-конце) сайтом, с которого начинается транскрипция РНК, однако они могут также находиться в нитронах, за (на 3'-конце) сайтом, где кончается транскрипция РНК или даже внутри экзонов. Типичная хромосома позвоночных схематически изображена на рис. 9-7, кроме того, на рисунке представлен один из многих генов, входящих в ее состав.
Таблица 9-1. Размер некоторых генов человека в тысячах нуклеотидов
|
Размер гена 1) |
Размер мРНК |
Число нитронов |
|
|
ß-глобин |
1,5 |
0,6 |
2 |
|
Инсулин |
1,7 |
0,4 |
2 |
|
Протеинкиназа С |
11 |
1,4 |
7 |
|
Альбумин |
25 |
2,1 |
14 |
|
Каталаза |
34 |
1,6 |
12 |
|
Рецептор ЛНП |
45 |
5,5 |
17 |
|
Фактор VIII |
186 |
9 |
25 |
|
Тироглобулин |
300 |
8,7 |
36 |
|
Дистрофии1) |
более |
17 |
более |
|
2000 |
50 |
1) В указанный размер гена входит его транскрибируемая часть вместе с близлежащими регуляторними последовательностями ДНК (По данным Victor McKusick).
2) Измененная форма этого гена вызывает мышечную дистрофию Дюшенна.
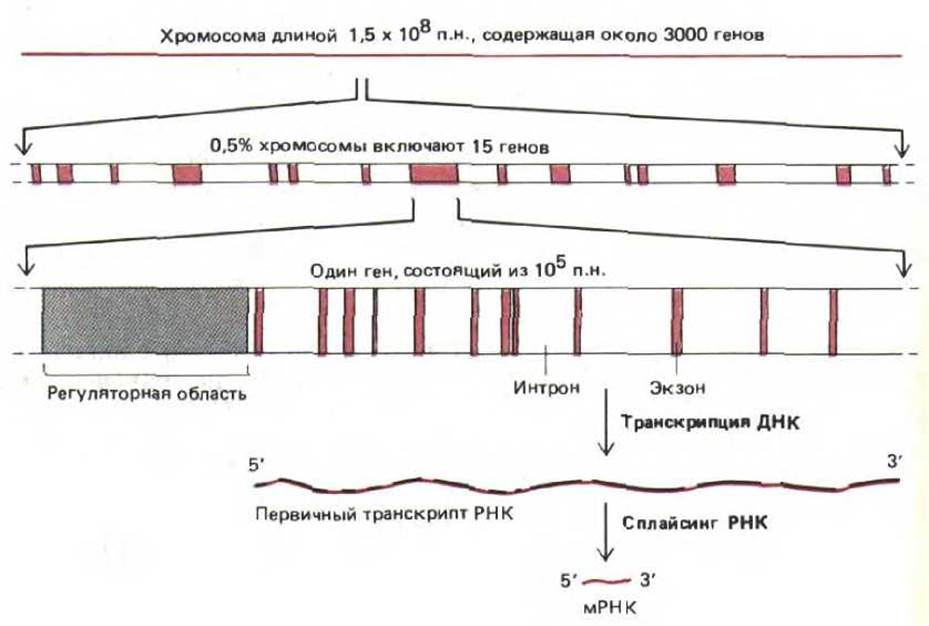
Рис. 9-7. Организация генов в типичной хромосоме позвоночных. Белки, связывающиеся с ДНК в регуляторных областях, определяют транскрипцию гена. Регуляторные последовательности, как правило, расположены на 5'-конце гена (как показано на схеме), но могут находиться в нитронах, экзонах и на 3'-конце. При образовании молекул информационной РНК (мРНК) последовательности интронов из первичных транскриптов РНК удаляются. Приведенные здесь данные по количеству тенов в хромосоме соответствуют минимальной оценке.
9-6
9.1.5. Сравнение ДНК родственных организмов позволяет выявить в ней консервативные и неконсервативные области [5]
По мере совершенствования методов определения нуклеотидной последовательности ДНК все более реальной представляется идентификация всех 3 х 109 нуклеотидов, составляющих геном человека. Однако необходимы специальные подходы, чтобы выявить ту небольшую часть последовательности (менее 10%), которая собственно и является смысловой. Один из путей решения этой задачи - определение последовательности соответствующих областей генома родственного вида, например, мыши. Полагают, что человек и мышь произошли от общего предка около 80 х 106 лет назад. Это дейстаточно продолжительное, время дм того, чтобы примерно два из каждых трех нуклеотидов подверглись изменениям при случайных мутациях. Следовательно, те немногие области, которые в обоих геномах оказались схожими (консервативные последовательности), представляют собой именно те участки, в которых мутация приводит к повреждению активности. Организмы, несущие такую вредную мутацию, очевидно, при естественном отборе будут элиминироваться. Неконсервативные области соответствуют некодирующей ДНК, расположенной между генами и входящей в состав нитронов. Последовательности такой ДНК не оказывают столь сильного влияния на функцию. Напротив, консервативные участки содержат функционально важные экзоны и регуляторные области. Изучая результаты столь длительного «эксперимента», поставленного природой, можно выявить наиболее интересные области геномов. Сравнение нуклеотидной последовательности ДНК у разных видов свидетельствует о том, что у позвоночных более чем 90% ДНК не имеет существенного значения.
9.1.6. Хромосомы содержат разнообразные белки, связанные с определенными последовательностями ДНК
Информация, хранящаяся в ДНК, организуется, реплицируется и считывается разнообразными белками, связывающимися с ДНК (ДНК-связанные белки). Некоторые из этих белков связываются по всей длине молекулы относительно неспецифически и участвуют в ее упаковке, не мешая при этом функционированию других белков. Эти упаковывающие белки будут обсуждены ниже (см. разд. 9.1.17). Другие белки объединяются с определенными короткими последовательностями ДНК, которые часто в ходе эволюции оказываются в различных геномах консервативными (см. рис. 10-34). Такие сайт-специфические ДНК-связывающие белки имеют самые разнообразные функции. Некоторые из них, вероятно, участвуют в сворачивании длинной молекулы ДНК с образованием различных доменов, другие способствуют инициации репликации ДНК; многие из них контролируют транскрипцию генов. Каждый тип клеток многоклеточного организма содержит разнообразную смесь таких регуляторних белков. Действуя совместно, они определяют характер экспрессии различных генов (см. разд. 10.2.8).
Контроль экспрессии генов обсуждается в гл. 10. Здесь мы рассмотрим только вопрос о том, каким образом белок связывается с ДНК. Все до сих пор описанные сайт-специфические ДНК-связывающие белки узнают свою последовательность с внешней стороны молекулы и ассоциируют с ДНК, не влияя на спаренные основания. Это оказывается возможным благодаря тому, что части каждой нуклеотидной пары расположены в двух отдельных «бороздках» - большой и малой (рис. 9-8, А). В большой бороздке каждая из четырех возможных пар (А-Т, Т-А, G-C или C-G) однозначно узнается по специфическому расположению выступающих атомов, малая бороздка менее информативна в этом отношении. Как будет показано ниже, аминокислоты в связывающемся участке сайт-специфического белка расположены таким образом, чтобы усилить электростатические и водородные связи, возникающие при взаимодействии белка и определенной последовательности ДНК. Как и ожидалось, большая часть водородных связей с нуклеотидными парами, по-видимому, приходится на большую бороздку. Схема взаимодействия между боковой аминокислотной цепью и одной парой оснований в этой бороздке представлена на рис. 9-8, Б.
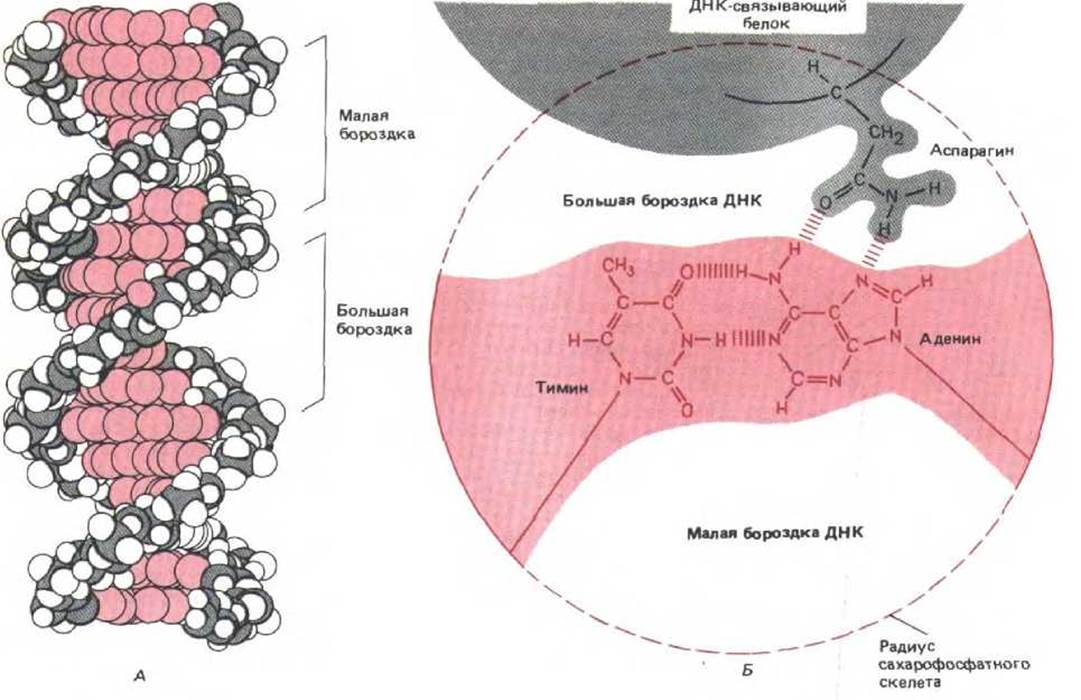
Рис. 9-8. Узнавание ДНК-связывающими белками определенных пар оснований в составе молекулы ДНК. А. Двойная спираль ДНК (В-форма): цветом выделены большая и малая бороздки. «Края» каждой пары оснований выступают в эти бороздки, что дает возможность ДНК-связывающим белкам опознавать различные последовательности нуклеотидов, образуя с ними водородные связи. Предполагаемое взаимодействие аминокислоты и А-Т-пары схематически изображено на Б (вид вдоль оси спирали). Расположение водородных связей донорных и акцепторных групп в этой бороздке различно для каждого из четырех возможных сочетаний нуклеотидных пар. Необходимо отметить, что В-форма спирали ДНК правозакручена (см. рис. 3-4). Сайт-специфические ДНК-связывающие белки могут узнавать последовательности длиной от 4 до 50 нуклеотидных пар.
10-3
10-12
9.1.7. Уменьшение подвижности в геле позволяет выявить сайт-специфические ДНК-связываюшие белки в экстрактах клеток [6]
Молекула ДНК обладает высоким отрицательным зарядом и, следовательно, в электрическом поле быстро движется к положительному электроду. При электрофорезе в полиакриламидном геле молекулы ДНК разделяются по размеру, так как меньшие молекулы легче и быстрее проходят через поры геля. Молекулы белка, связавшись с ДНК, вызывают уменьшение подвижности ее молекул в геле. Чем больше связавшийся белок, тем медленнее движется связанная с ним ДНК. Это явление лежит в основе метода, регистрирующего сдвиг подвижности в теле. С помощью этого метода удается обнаруживать даже следовые количества сайт-специфического ДНК-связывающего белка. Короткие фрагменты ДНК, длина и последовательность которых известна (полученные либо при клонировании ДНК, либо путем химического синтеза), метят радиоактивной меткой и смешивают с экстрактом клеток; полученную смесь наносят на полиакриламидный гель и проводят электрофорез. Если фрагмент ДНК соответствует области хромосомы, с которой связываются многие сайт-специфические белки, то при радиоавтографии выявляется серия полос, обладающих разной подвижностью. Белки, связанные с ДНК в каждой из полос геля, можно отделить, фракционируя затем клеточные экстракты (рис. 9-9).
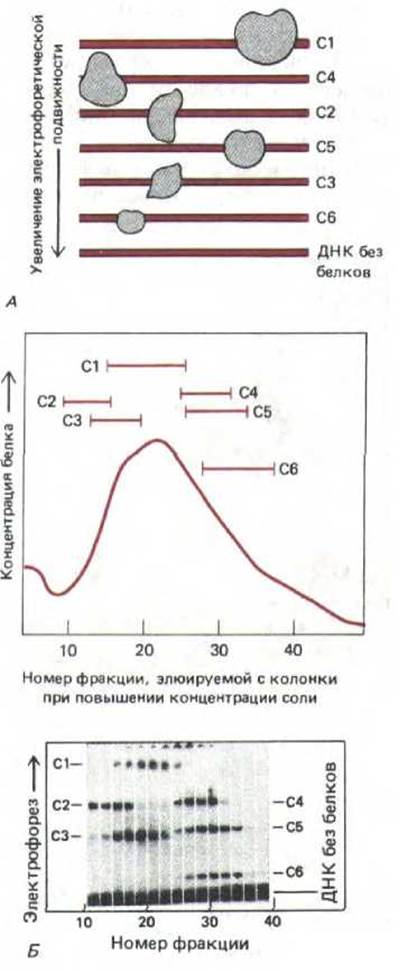
Рис. 9-9. Замедление в геле. Принцип метода схематически изображен на рис. 9-9, А. Экстракт, полученный из линии клеток, продуцирующих антитела, смешивают с радиоактивными фрагментами ДНК, содержащими последовательность от точки —131 до + 36 (относительно сайта инициации транскрипции в положении +1) гена, кодирующего легкую цепь соответствующей молекулы антитела. Воздействие белков, входящих в состав экстракта, на подвижность фрагмента ДНК определяют методом электрофореза в полиакриламидном геле с последующей радиоавтографией. Свободные фрагменты ДНК быстро передвигаются к концу геля, тогда как фрагменты, связанные с белком, задерживаются. Обнаружение шести зон с замедленным движением указывает на присутствие в экстракте шести различных сайт-специфических ДНК-связывающих белков (обозначенных С1-С6). На схеме Б экстракты фракционировали с помощью стандартной хроматографической методики, каждую фракцию смешивали с радиоактивным фрагментом ДНК, наносили на одну дорожку полиакриламидного геля и анализировали далее, как указано на схеме А. (Б-с изменениями из С. Scheidereit, A. Heguy, R.G. Roeder, Cell 51: 783-793, 1987.)
9.1.8. Сайт-специфические ДНК-связывающие белки можно выделить и охарактеризовать, используя их сродство к ДНК [7]
Впервые сайт-специфические белки, связывающиеся с ДНК, были обнаружены у бактерий. С помощью генетического анализа у этих микроорганизмов удалось доказать существование регуляторных белков, таких как репрессор lac-оперона, репрессор бактериофага лямбда и сrо-белок. Эти белки были выделены при последовательном фракционировании клеточных экстрактов на хроматографических колонках, а специфически связывающие их участки ДНК определены методом футприн-тинга (см. разд. 4.6.6). Аналогичными методами были выделены и охарактеризованы первые сайт-специфические ДНК-связывающие белки у эукариот: Т-антиген вируса SV40, фактор транскрипции TF11IA и рецептор стероидного гормона.
В настоящее время для выделения сайт-специфических ДНК-связывающих белков разработаны гораздо более совершенные методы. Процедура обычно начинается с определения сдвига подвижности в геле. Благодаря этому можно выяснить, с каким именно участком на фрагменте ДНК связывается неизвестный белок в клеточном экстракте (см. рис. 9-9). Затем химическим способом синтезируется соответствующий этому связывающему участку двухцепочечный олигонуклеотид, который можно использовать двумя способами. При аффинной хроматографии олигонуклеотид связывают с нерастворимым пористым носителем, например агарозой, а затем таким нагруженным носителем заполняют колонку, которая селективно связывает белки, узнающие определенные последовательности ДНК. Этот относительно нетрудоемкий метод позволяет добиться 10000-кратной очистки.
Большинство белков, связывающихся с определенной последовательностью ДНК, присутствуют в клетках высших эукариот в количестве нескольких тысяч копий на клетку (что соответствует примерно одной молекуле из 50000 молекул всех белков клетки). Этого количества оказывается достаточно, чтобы методом аффинной хроматографии выделить белок той степени чистоты, которая позволяет определять у него аминоконцевую последовательность аминокислот. Это дает возможность синтезировать олигонуклеотидный зонд и с его помощью идентифицировать соответствующий клон кДНК. Имея в руках нужный клон кДНК, исследователь может определить полную аминокислотную последовательность белка и получать его в неограниченных количествах. В некоторых случаях клон кДНК, кодирующий сайт-специфический ДНК-связывающий белок, легче получить более простым путем, используя второй метод, еще более эффективный, чем аффинная хроматография ДНК. Этот метод начинается с получения библиотеки кДНК в соответствующим образом подобранном векторе. Отдельная колония бактерий (если экспрессирующий вектор - плазмида) или негативная колония (если вектор-бактериофаг) будет продуцировать большое количество белка, закодированного в содержащейся в ней кДНК. Чтобы найти ту редкую колонию, которая образует нужный белок, олигонуклеотид, содержащий соответствующий сайт связывания, метят радиоактивной меткой и используют его в качестве зонда на бумаге, куда нанесены аликвоты отдельных колоний (см. разд. 5.6.5). Те немногие колонии, которые синтезируют белки, специфически связывающие меченый олигонуклеотид, выращивают отдельно и испытывают дальше, чтобы найти среди них ту единственную, продуцирующую искомый белок.
Этот высоко эффективный метод разработан сравнительно недавно и поэтому на сегодняшний день из многих сотен сайт-специфических ДНК-связывающих белков, которые, как полагают, присутствуют в клетках высших эукариот, удалось выделить лишь небольшую часть.
9.1.9. Многие сайт-специфические ДНК-связывающие белки имеют одинаковые области [8]
Фактор транскрипции III A (TFIIIA) эукариот необходим для инициации синтеза небольших рибосомных РНК (5S-pPHK); он связывается в виде мономера с последовательностью ДНК размером около 50 нуклеотидных пар, расположенной почти в середине очень маленького гена 5S-pPHK. Аминокислотная последовательность этого белка дает основание предполагать, что он организован в виде серии девяти повторяющихся доменов, каждый из которых содержит по 30 аминокислот, сложенных в одну структурную единицу вокруг атома Zn, связывающего два остатка цистеина и два-гистидина. Другие белки, предположительно участвующие в регуляции генов, содержат меньшее число доменов со сходной структурой. Такие домены обычно называют «цинковыми пальцами». Белки, их содержащие, функционируют на ранних стадиях развития дрозофилы, более пяти таких белков участвуют в процессе скрещивания дрожжей; к этому же классу относится обычный фактор транскрипции млекопитающих Spl (см. разд. 10.2.8) и большая группа белков-рецепторов стероидного гормона (см. рис. 10-25).
Пока не определена трехмерная структура белков этого типа, и, следовательно, остается неизвестным, как они связываются с ДНК. На рис. 9-10 представлена гипотетическая схема, которую подтверждают данные футпринтинга.
9.1.10. Симметричные димеры ДНК-связывающих белков часто узнают симметричные последовательности нуклеотидов [8]
Для определения трехмерной структуры белка обычно необходим дифракционный рентгеноструктурный анализ больших кристаллов, получение которых часто представляет собой нелегкую задачу. Один из первых регуляторных белков, изученных таким методом - сrо-белок бактериофага лямбда. Это небольшой белок (66 аминокислотных остатков), который не имеет «цинковых пальцев», однако, связывается с кластером специфических последовательностей ДНК, каждая из которых содержит по 17 нуклеотидных пар. Одна из этих последовательностей приведена на рис. 9-11. Выделенная цветом часть последовательности является симметричной, т.е. при повороте спирали ДНК на 180° она не изменится. Симметрией обладают и многие участки связывания сайт-специфических белков. Такую симметрию можно объяснить исходя из структуры сrо-белка, определенной методом дифракции рентгеновских лучей.
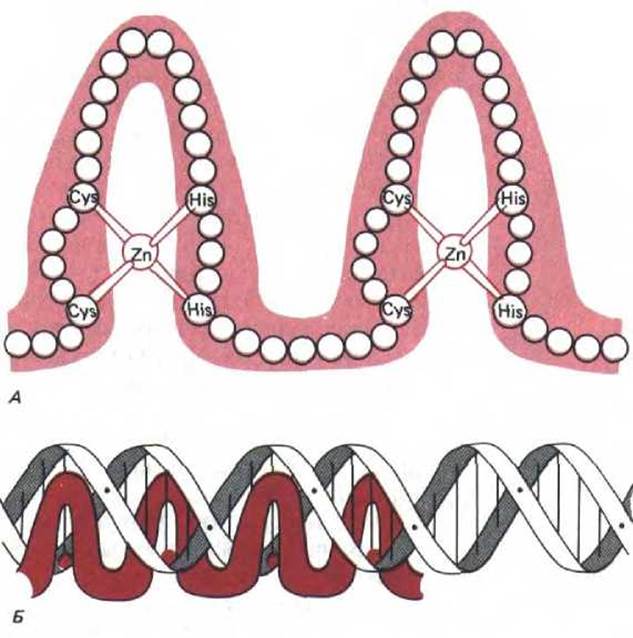
Рис. 9-10. Семейство сайт-специфических ДНК-связывающих белков типа «цинковые пальцы» А. Упрощенная схема строения ДНК- связывающего домена; кружочками обозначены отдельные аминокислоты. В настоящее время считается, что полипептидная цепь, образующая каждый «палец», имеет сложную глобулярную структуру. Б. Схема взаимодействия четырех «цинковых пальцев» с последовательностью ДНК. Согласно этой модели, каждый палец узнает определенную последовательность, состоящую примерно из пяти нуклеотидных пар. (С изменениями из A. Klug, D. Rhodes, Trends in Biochem. Sci. 12: 464-469, 1987.)
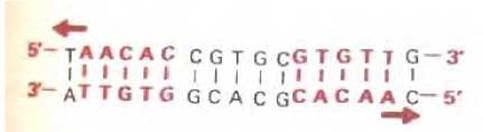
Рис. 9-11. Специфическая последовательность ДНК, узнаваемая сrо-белком бактериофага лямбда. Выделенные цветом нуклеотиды в этой последовательности расположены симметрично, что позволяет половине димерного белка распознавать каждую половину данного сайта.
Сrо-белок представляет собой симметричный гомодимер, который связывается с ДНК способом, изображенным на рис. 9-12. В связи с тем, что ось симметрии второго порядка последовательности белка расположена на оси симметрии второго порядка последовательности ДНК, каждая из одинаковых половин димера может образовывать одинаковые связи с теми нуклеотидными парами ДНК, которые она узнает. Во всех случаях, когда последовательность связывающего сайта ДНК симметрична, белок, узнающий ее, скорее всего оказывается димером или симметричным образованием большего размера.
9.1.11. Сrо-белок принадлежит к семейству ДНК-связывающих белков, построенных по принципу «спираль-виток-спираль» [9]
Сайт мономера белка его, контактирующий с ДНК, образован последовательностью из 20 аминокислот, формирующих две а-спирали, которые разделены коротким витком. Такой фрагмент спираль-виток-спираль обнаружен и у ряда других бактериальных сайт-специфических ДНК-связывйющих белков, трехмерные структуры которых известны (рис. 9-13). Более того, анализ аминокислотных последовательностей (обнаруженная при этом гомология) свидетельствует о том, что такой фрагмент присутствует и в составе других белков, участвующих в регуляции активности генов у бактерий, дрожжей и дрозофилы.
Все белки, содержащие структуру спираль-виток-спираль, изображенные на рис. 9-13, представляют собой симметричные гомодимеры. Одна из а-спиралей в каждом мономере, называемая узнающей, располагается в большой бороздке, где выступающая часть ее аминокислотной последовательности образует водородные связи с определенными основаниями ДНК. Важно, что две идентичные узнающие спирали в димере разделены только одним витком цепи ДНК (3,4 нм). Такое разделение дает возможность каждой узнающей спирали одинаковым образом взаимодействовать с симметрично расположенными парами оснований в участке связывания (рис. 9-14).
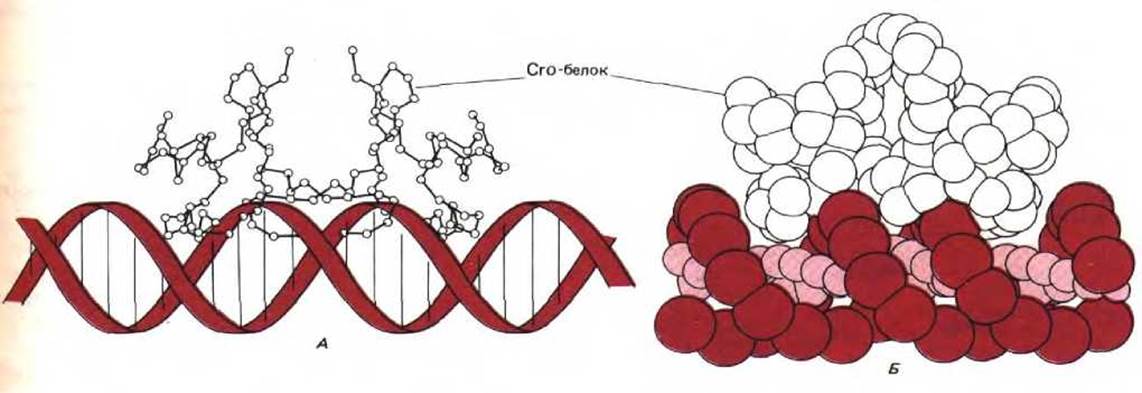
Рис. 9-12. Схема связывания сrо-белка бактериофага лямбда с ДНК. Белок представляет собой симметричный гомодимер, который связывается с симметричной последовательностью ДНК, представленной на рис. 9-11. Способ связывания с ДНК определен путем анализа молекулярных моделей. А. Проволочная модель молекулы белка, совмещенная со схематическим изображением двойной спирали ДНК. Б. Пространственная модель ДНК-белкового комплекса, показанного на А. На этой модели каждая аминокислота в белковой цепи изображена в виде сферы; цветные шары представляют остов ДНК. (С любезного разрешения Brian W. Matthews по W. F. Anderson, D. H. Ohlendorf, Y. Takoda and B. W. Matthews, Nature 290: 754-758, 1981, © 1981, Macmillan Journals Ltd.)
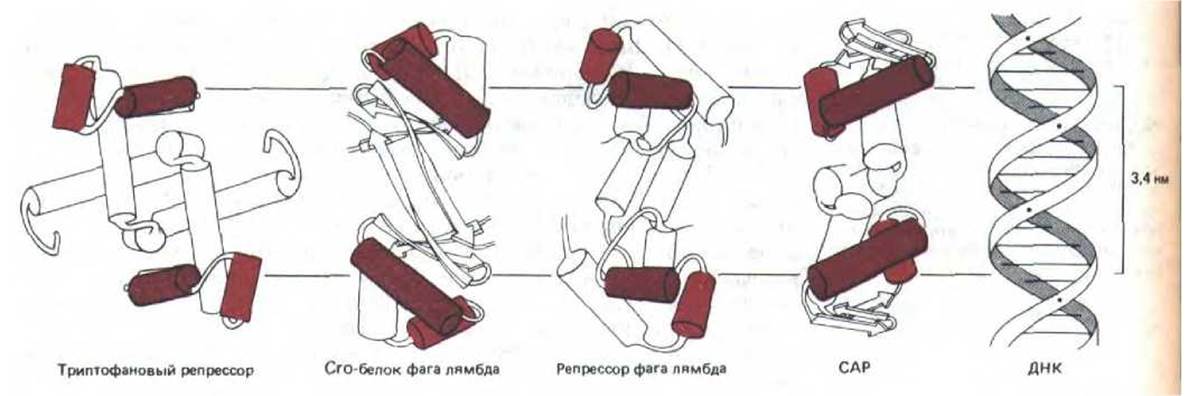
Рис. 9-13. Семейство димерных ДНК-связывающих белков. Эти регуляторные белки работают в бактериальных системах: репрессор лямбда и cro-белок контролируют экспрессию генов бактериофага лямбда, а белок активатор катаболизма (САР) регулирует экспрессию ряда генов Е. coli, которые могут включаться лишь в отсутствие глюкозы. В каждом случае рентгеноструктурный анализ выявил наличие двух копий узнающей спирали (коричневый цилиндр), разделенных одним витком спирали ДНК (3,4 нм).
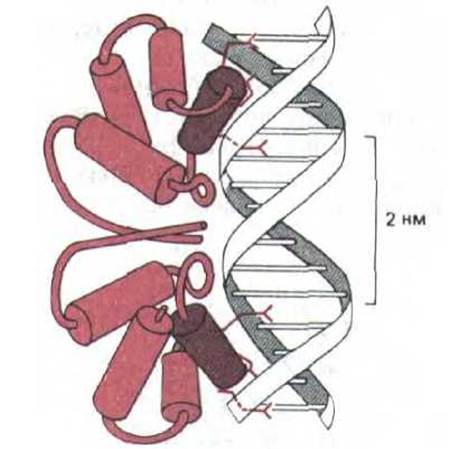
Рис. 9-14. Спаривание боковой цепи аминокислот с парами оснований ДНК при узнавании нуклеотидной последовательности регуляторним белком-репрессором, влияющим на активность гена бактериофага 434. Комплекс ДНК с этим белком изучали методом рентгеноструктурного анализа. (С изменениями из J. Е. Anderson, M. Ptashne and S.C. Harrison, Nature 326: 846-852, 1987.)
Молекула аллостерического эффектора, связываемая белком такого типа, может значительно повышать или снижать его сродство с ДНК, меняя расстояние между двумя узнающими спиралями. Аналогичным образом аллостерические эффекторы могут изменять сродство с ДНК других типов белков, регулирующих активность генов. Подобные изменения имеют большое значение при включении и выключении генов в ответ на изменения в окружающей среде (см. разд. 10.2.10).
9.1.12. Молекулы белков при связывании с ДНК частоконкурируют или кооперируются друг с другом [10]
Большинство генетических процессов зависит от взаимодействия между молекулами белков, которые одновременно связываются с близлежащими сайтами ДНК. В простейшем случае два сайт-специфических белка, участки связывания которых частично или полностью перекрываются, конкурируют друг с другом за место на спирали ДНК (рис. 9-15, А). Например, белок-репрессор может подавлять транскрипцию гена, блокируя связывание активирующего белка с ДНК. Однако белки могут и помогать друг другу более прочно удерживаться на ДНК. Такое кооперативное связывание может происходить как между двумя различными молекулами белка (рис, 9-15, Б), так и между двумя копиями молекул одного типа. В последнем случае белки, как правило, связываются по типу «все или ничего» и образуют на ДНК кластеры. При повышении концентрации этих белков, их связывание с ДНК резко возрастает (рис. 9-15, В). В качестве примера кооперативно связывающихся белков такого типа можно привести спираль-дестабилизирующий белок, белок rесА (гл. 5) и гистон H1.
Механизм взаимодействия при кооперативном и конкурентном связывании на примере двух различных сайт-специфических ДНК-связывающих белков будет обсуждаться дальше в связи с проблемой регуляции транскрипции (гл. 10).
9.1.13. Геометрия спирали ДНК зависит от последовательности нуклеотидов [11]
В течение 20 лет после открытия двойной цепи ДНК в 1953 г. полагали, что эта молекула имеет одинаковую структуру на всем своем протяжении, причем поворот спирали между соседними парами оснований составляет точно 36° (10 нуклеотидных пар на поворот спирали). Последующие эксперименты выявили, что ДНК гораздо более полиморфна, а варианты ее формы определяются последовательностью нуклеотидов. Форма спирали оказывает значительное влияние на ее взаимодействие с белками.
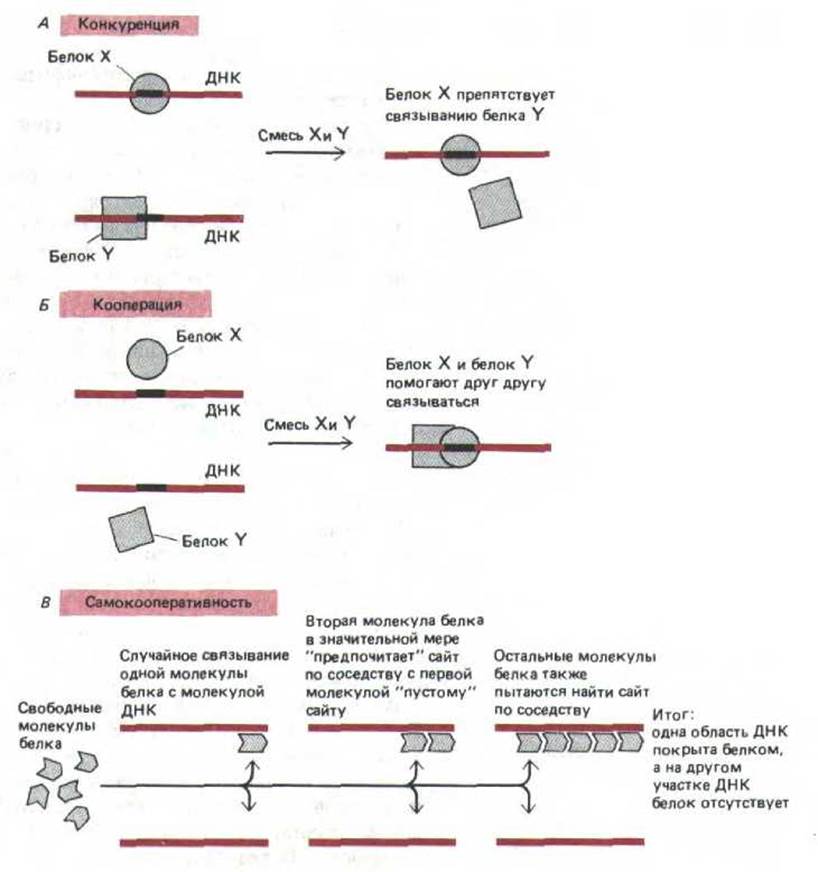
Рис. 9-15. Примеры конкурентного и кооперативного взаимодействия при связывании белков с ДНК. А. Конкуренция происходит, когда связывание белков X и Y со специфическими сайтами ДНК взаимно исключается. Б. Кооперация имеет место, если связывание одного белка с ДНК повышает сродство другого белка к близлежащему сайту. В. Самокооперативность приводит к связыванию отдельного белка в виде кластера молекул, в результате связывание с какой-либо областью ДНК происходит по типу «все или ничего».

Рис. 9-16. Три формы спирали ДНК, каждая из которых содержит 22 нуклеотидные пары. Все эти структуры образованы двумя антипараллельными цепями ДНК, которые удерживаются вместе благодаря спариванию комплементарных нуклеотидов. Каждая форма показана сбоку и сверху. Сахарно-фосфатный остов и пары оснований выделены разными оттенками серого: темно-серым и светло-серым, соответственно. А. В-форма ДНК, которая чаще всего встречается в клетках. Б. А-форма ДНК, которая становится преобладающей при высушивании любой ДНК, независимо от ее последовательности. В. Z-форма ДНК: такую форму приобретают некоторые последовательности при определенных условиях. В-форма и А-форма-правозакрученные, а Z-форма-левозакрученная (см. рис. 3-4). (С любезного разрешения Richard Feldmann.)
Существует несколько типов спирали ДНК, причем в некоторых случаях изменения в ее структуре оказываются весьма значительными. Самая стабильная форма ДНК - это правозакрученная спираль В-формы (рис. 9-16, А). Изучение рассеяния рентгеновских лучей показало, что небольшие области последовательности образуют правозакрученную спираль, отличающуюся от В-формы и известную как А-форма ДНК. Для этой формы характерен более сильный наклон оснований, в результате чего спираль оказывается более короткой и более широкой, чем в случае В- формы (рис. 9-16, Б). Вероятно, в некоторых случаях это имеет большое значение, например, когда нить ДНК спаривается с РНК в затравочной части фрагментов Оказаки (дополнительная гидроксильная группа рибозы не позволяет спирали РНК-ДНК образовывать В-форму). По тем же причинам А-форму имеет и спираль РНК-РНК. А-форма характерна для спиральных областей шпилечных структур всех одноцепочечных РНК и, следовательно, чрезвычайно важна для жизнедеятельности клетки. Биологическая роль третьей спиральной формы ДНК менее ясна. Последовательности ДНК, состоящие из чередующихся пуринов и пиримидинов (GCGCGCGC) легко образуют левозакрученную двойную спираль, известную как Z-форма ДНК (рис. 9-16, В). Считается, что короткие области с такой структурой редко встречаются в хромосоме. Можно предположить, однако, что они особым образом распознаются белками, а значит, тоже способны играть существенную роль в жизнедеятельности клетки.
А- и Z-формы ДНК, которые сильно отличаются от стабильной В-структуры, весьма редки, но менее сильные изменения В-цепи являются обычными, и, несомненно, имеют важное биологическое значение. У нуклеиновых кислот, находящихся в В-форме, наклон оснований и угол поворота спирали между их парами существенно зависят от того, какие именно нуклеотиды соседствуют друг с другом в последовательности. В результате атомы спирали отклоняются от идеального положения. Даже ДНК-связывающие белки, которые не обладают способностью специфически узнавать определенные нуклеотидные пары, могут «чувствовать» такие искажения. Значение вариаций в структуре ДНК-спирали для связывания сайт-специфических белков четко показано на примере репрессора бактериофага X. С помощью рентгеноструктурного анализа установлено, что ДНК при связывании с этим белком приближается к идеальной В-форме (рис. 9.17).
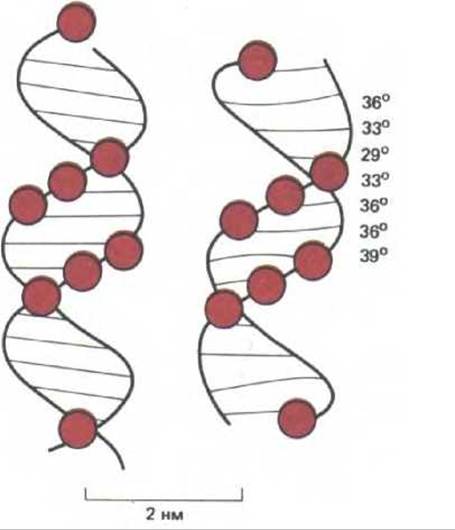
Рис. 9-17. Сравнение конформации ДНК в составе комплекса с репрессором бактериофага 434 (справа) с идеальной спиралью В-формы (слева). Фосфаты ДНК, контактирующие с белком, обозначены цветными кружочками. Углы, образующиеся при повороте спирали между парами оснований, указаны для искаженной спирали. Считается, что отклонения от идеальной спирали необходимы для более тесного связывания белка. Энергия связывания частично зависит от «неспецифического» взаимодействия между NH-группами и фосфатами ДНК. Такие, способствующие связыванию контакты, может образовывать лишь несколько искаженная спираль В-формы: середина малой бороздки в области связывающего сайта должна быть слегка сужена, и спираль немного изогнута. Поскольку для получения такого изгиба и уплотнения спирали в центральной области должны присутствовать АТ-пары, их замена на GC значительно ослабляет связывание белков. Таким образом, пары оснований, расположенные в центре, узнаются репрессором даже если белок не контактирует непосредственно с этими основаниями (см. также рис. 9-14). (С изменениями из J. E. Anderson, M. Ptashne and S.C Harrison, Nature 326: 846-852, 1987.)
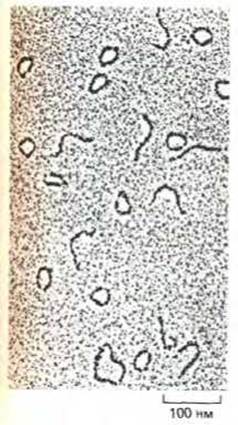
Рис. 9-18. Электронная микрофотография фрагментов, несущих сильно изогнутый сегмент спирали ДНК. Фрагменты ДНК, выделенные из миниколец кинетопластов трипаносоми Crithidia fasciculata содержит всего лишь 200 пар нуклеотидов, однако некоторые из них изогнуты так, что весь фрагмент замыкается в кольцо. Нормальная спираль ДНК такой длины может при изгибе образовать в среднем лишь четверть кольца (один равномерный правый виток). (По J. Griffith, М. Bleyman, С. A. Rauch, P. A. Kitchin and P. T. Englund, Cell 46: 717-724, 1986.)
9-7
9.1.14. Некоторые последовательности ДНК сильно изогнуты [12]
Спираль ДНК обладает достаточной конформационной свободой, чтобы выдерживать пружинящие изгибы и вращательные движения. Однако в связи с тем, что эта спираль обладает и жесткостью, для того чтобы она могла изогнуться под углом 90°, в молекуле ДНК должно содержаться приблизительно 200 нуклеотидных пар. Некоторые последовательности ДНК оказываются необычайно гибкими и намного легче остальных принимают изогнутую форму.
Есть последовательности ДНК, которые склонны всегда оставаться изогнутыми. К числу последних принадлежат последовательности, в которых через каждые 10-11 нуклеотидов встречаются повторы AAAAANNNNN (где N-любой нуклеотид) (рис. 9-18). Сильный изгиб таких молекул представляет собой крайнюю форму вариаций структуры спирали. Еще не ясно, обусловлен ли такой изгиб суммарным вкладом небольших наклонов между определенными парами оснований, большим изгибом в месте соединения коротких областей или же обоими типами воздействий.
Даже если специфические последовательности, влияющие на изгиб спирали, отсутствуют, структуру ДНК в значительной мере может исказить связывание белков, принимающих участие в формировании высококонденсированных комплексов белка и ДНК.
9.1.15. Белки могут сворачивать ДНК в плотную спираль [13]
Многие белки при связывании с ДНК изгибают ее, а если подобных ДНК-белковых связей много, то нить ДНК может сформировать плотную спираль вокруг белкового комплекса с образованием нуклеопротеиновой частицы. Известно, что у бактерий такие нуклеопротеиновые частицы образуются при связывании инициаторных белков с точкой начала репликации (см. разд. 5.3.9), а также при связывании ДНК с интегразой фага лямбда для катализа сайт-специфической рекомбинации (рис. 9-19). По-видимому, в таком сложном трехмерном соединении участвуют как конкурентное, так и кооперативное взаимодействия. Аналогичные типы взаимодействий используются при регуляции каталитической активности нуклеопротеиновых частиц, как показано на примере белкового комплекса, содержащего интегразу фага лямбда (рис. 9-20). В связи с тем, что при экспрессии эукариотических генов происходит связывание кластеров белков, регулирующих активность генов, с определенными регуляторными последовательностями ДНК, аналогичные белковые комплексы могут принимать участие в контроле транскрипции ДНК и у эукариот (см. рис. 10-23).
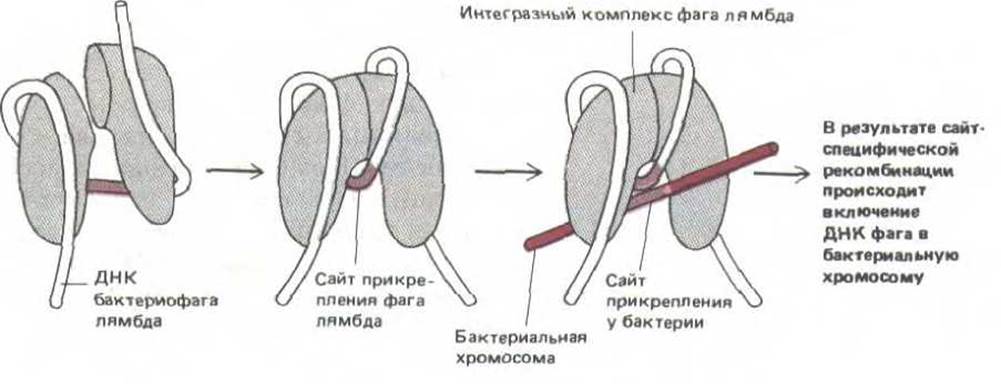
Рис. 9-19. Схема комплекса ДНК—белок, образуемого интегразой фага лямбда, ферментом, осуществляющим встраивание ДНК бактериофага в хозяйскую хромосому Е. coli. Этот комплекс катализирует сайт-специфическую рекомбинацию, разрывая и воссоединяя спирали ДНК бактериофага лямбда и бактерии по определенным участкам, называемым сайтами прикрепления (см. рис. 5-66). (С изменениями по Е. Richet, P. Abcarian, Н.А. Nash, Cell 52: 9-17, 1988.)
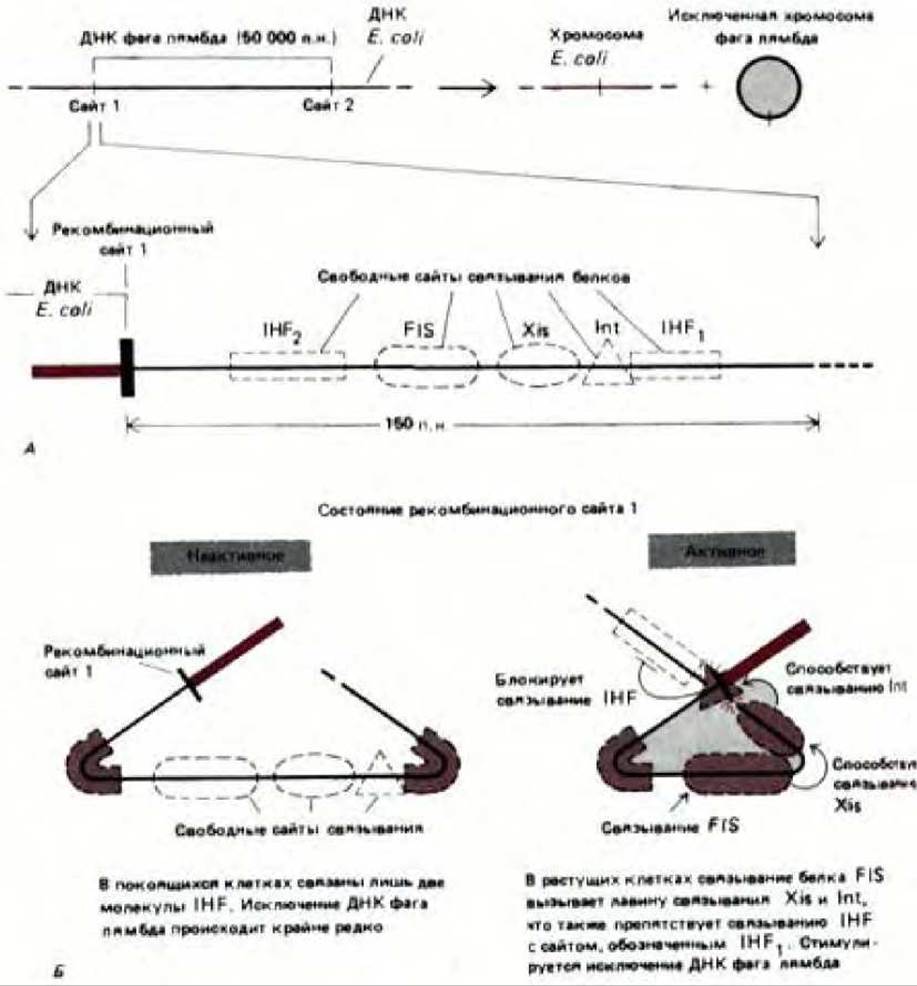
Рис. 9-20. Исключение бактериофага лямбда из хромосомы бактерии контролируется посредством кооперативного и конкурентного взаимодействия между сайт-специфическими ДНК-связывающими белками. Реакция катализируется интегразой фага лямбда и является противоположной по своему действию сайт-специфической рекомбинации, показанной на рис. 9-19. А. Общая схема реакции и некоторые участвующие в ней сайты связывания белков (указаны не все сайты). Для исключения необходимы разрыв и воссоединение двойной спирали ДНК в сайтах рекомбинации 1 и 2; при этом образуется кольцевая хромосома фага лямбда. Int-интеграза фага лямбда, Xis-эксцизионаза фага лямбда, a IHF и FIS-белки, образуемые бактериальной клеткой-хозяином. Б. Активация исключения белком FIS; указанные стадии, по-видимому, имеют место при низких концентрациях белков Int и Xis. Как показано, ряд белков при связывании сильно изгибают ДНК. Хотя белок Int катализирует реакцию сайт-специфической рекомбинации, его активность катализируется другими белками. (С любезного разрешения Arthur Landy.)
Очевидно, что любые комплексы, имеющие отношение к регуляции определенных генов, должны встречаться относительно редко. В структуре хромосом эукариот присутствует главным образом другой тип нуклеопротеиновых частиц; речь идет о нуклеосоме, которая играет ведущую роль в упаковке и организации ДНК в клеточном ядре.
9.1.16. Гистоны - основные структурные белки хромосом эукариот [14]
Наиболее изученные структурные белки хромосом - это несомненно гистоны, которые имеются только в эукариотическвх клетках. Количество их в клетках столь велико, что у эукариот принято делить белки, связывающиеся с ДНК, на два класса: гистоны и негистоновые белки хромосом. Комплекс обоих классов белков с ядерной ДНК клеток эукариот известен под названием хроматин. Гистоны присутствуют в таких огромных количествах (около 60 млн. молекул каждого типа на клетку по сравнению с 10000 на клетку для типичного сайт-специфического белка), что их общая масса в хромосоме примерно равна содержанию ДНК.
Гистоны представляют собой относительно небольшие белки с очень высоким содержанием положительно заряженных аминокислот (лизина и аргинина). Суммарный положительный заряд позволяет им прочно связываться с ДНК независимо от ее нуклеотидного состава. Скорее всего гистоны постоянно находятся в комплексе с ДНК и, следовательно, играют существенную роль во всех процессах, связанных с функционированием генома.

Рис. 9-21. Аминокислотная последовательность гистона Н4-одного из нуклеосомных гистонов. Аминокислоты обозначены однобуквенными сокращениями, положительно заряженные аминокислоты выделены цветом. Как и в случае других нуклеосомных гистонов, протяженная аминоконцевая последовательность молекулы обратимо модифицируется в клетке путем ацетилироваиия отдельных остатков лизина. Приведенная последовательность соответствует гистону Н4 быка. У гороха этот гистон имеет почти такую же аминокислотную последовательность, за исключением того, что в нем один остаток валина замещен на изолейцин, а один остаток лизина - на аргинин.
Пять типов гистонов можно разделить на две основные группы: 1) нуклеосомные гистоны и 2) НІ гистоны. Нуклеосомные гистоны - это небольшие белки (102-135 аминокислотных остатков), отвечающие за формирование нуклеосом. К ним относятся четыре гистона: Н2А, Н2В, Н3 и Н4. Н3 и Н4 образуют внутреннюю часть нуклеосомы и, как установлено, являются наиболее консервативными из известных белков: например, аминокислотные последовательности гистонов Н4 у гороха и коровы различаются всего лишь по двум аминокислотным остаткам (рис. 9-21). Такая эволюционная стабильность предполагает, что почти каждая аминокислота, входящая в состав таких белков, играет важную роль, и изменение в любом положении может оказаться вредным для клетки.
Размер гистонов НІ больше (около 220 аминокислотных остатков), и эти белки оказались эволюционно менее стабильными, чем нуклеосомные гистоны. У дрожжей Saccharomyces cerevisiae HI, по-видимому, вообще отсутствует (см. разд. 10.3.15).
9-8
9-9
9.1.17. Связывание гистонов с ДНК приводит к образованию нуклеосом - частиц, представляющих собой единицу хроматина [15]
Если бы оказалось возможным растянуть нить ДНК каждой хромосомы человека, ее длина в тысячи раз превышала бы размер ядра. Гистоиы играют важную роль в упаковке очень длинной молекулы ДНК в ядре, диаметр которого составляет всего несколько микрон. Эти белки важны и по другой причине. Известно, что ДНК может быть упакована по-разному и способ упаковки какой-либо области генома в хроматин в определенной клетке может, по-видимому, влиять на активность содержащихся в этой области генов (см. разд. 10.3.8).
Начало углубленному изучению структуры хроматина положило открытие в 1974 г. его основной структурной единицы-нуклеосомы. Благодаря наличию нуклеосом частично декомпактизованныи хроматин на электронных микрофотографиях напоминает нитки бус (рис. 9-22). «Бусину»-нуклеосому можно отделить от длинной нити ДНК путем обработки препарата хроматина ферментами, расщепляющими ДНК. Ферменты, вызывающие деградацию как ДНК, так и РНК, называют нуклеазами, а ферменты, действующие только на ДНК,- дезоксирибонуклеазами или ДНКазами. Нуклеаза, с помощью которой выделяют индивидуальные нуклеосомы, получена из клеток микрококков (микрококковая нуклеаза). При непродолжительной обработке этим ферментом расщепляются только те участки ДНК, которые расположены между нуклеосомами; остальная ДНК защищена связанными с ней гистонами, вследствие чего вся молекула полимера распадается на двухцепочечные фрагменты длиной 146 пар оснований. Эти ДНК-гистоновые комплексы на электронных микрофотографиях выглядят как частицы дисковидной формы, имеющие диаметр около 11 нм. Каждая нуклеосома содержит набор из восьми молекул гистонов - по две молекулы каждого из четырех высококонсервативных нуклеосомных гистонов: Н2А, Н2В, НЗ и Н4. Этот гистоновый октамер является по сути белковой сердцевиной нуклеосомы или ее гистоновым кором, на который накручивается фрагмент двухцепочечной ДНК (рис. 9-23).
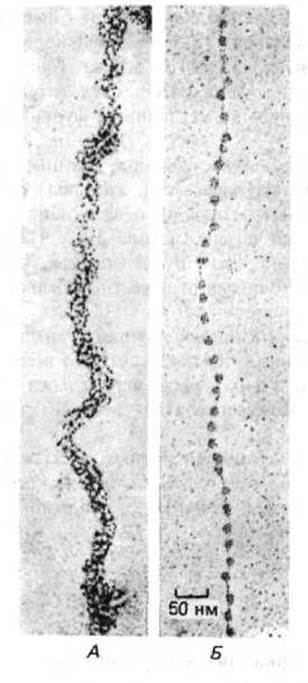
Рис. 9-22. Электронные микрофотографии хроматиновых нитей до и после обработки, приводящей к деконденсации нативной структуры и образованию «бус на нитке». А. Нативная структура, характерная для основных хроматиновых фибрилл диаметром 30 нм. Б. Деконденсированная форма хроматиновой фибриллы «бусы на нитке», показанная при том же увеличении. Схематическое изображение обеих форм хроматина приведено на рис. 9-38. Электронные микрофотографии получены с помощью модифицированной процедуры, описанной на рис. 9-71. (А-с любезного разрешения Barbara Hamkalo, Б-с любезного разрешения Victoria Foe.)
В интактном хроматине ДНК тянется в виде непрерывной нити от нуклеосомы к нуклеосоме. Каждая нуклеосомная бусина отделена от следующей линкериой последовательностью, длина которой варьирует от 0 до 80 нуклеотидных пар. В среднем нуклеосомные частицы (нуклеосомный кор плюс линкерная последовательность) повторяются через каждые 200 нуклеотидов (см. рис. 9-23). Таким образом, эукариотический ген, состоящий из 10000 нуклеотидных пар, связан с 50 нуклеосомами, а в каждой клетке человека, ДНК которой насчитывает 6 х 109 нуклеотидных пар, содержится 3 х 107 нуклеосом.
9-10
9.1.18. Некоторые нуклеосомы расположены на ДНК неслучайным образом [16]
Опыты, проведенные in vitro с изолированным хроматином, дают основание полагать, что при физиологических условиях гистоновые октамеры остаются зафиксированными в одном положении, поскольку их тесная связь с нуклеиновой кислотой препятствует перемещению по спирали ДНК. Остается открытым вопрос, случайно или нет расположены эти октамеры на ДНК (случайность следует понимать так, что в одной клетке определенная последовательность ДНК плотно обвита вокруг гистонового октамера, а в другой - та же последовательность отделяет друг от друга бусины нуклеосом).
Для того чтобы определить положение нуклеосом в клетках, нужно обработать их ферментом или реагентом, вносящим разрывы в ДНК, а затем изучить защищенные от воздействия участки методом, аналогичным футпринтингу ДНК (см. разд. 4.6.6). Хотя большинство нуклеосом, по-видимому, расположены случайным образом, известны поразительные примеры из неслучайного расположения. Так, у дрожжей Saccharomyces cerevisiae 15 нуклеосом строго фиксированным образом окружают ДНК центромеры (последовательность CEN) (разд. 13.5.3). Единственный сайт локализации имеет и нуклеосома, связанная с очень маленьким по размеру геном 5S-pPHK. Известно также, что по крайней мере одна нуклеосома расположена перед точкой начала синтеза РНК ß-глобина.
Чем же объясняется такое неслучайное расположение нуклеосом? Показано, что в некоторых случаях (например, для нуклеосом, связанных с генами 5S-pPHK) смесь четырех очищенных гистонов, составляющих нуклеосому, in vitro образует ее точно на том же месте, где она расположена in vivo. Возможно, причина заключается в том, что нуклеосомы стремятся связаться таким образом, чтобы максимально заполнить богатую AT малую бороздку ДНК. Такое предпочтение вызвано тем, что двойную спираль ДНК трудно уложить двумя плотными витками вокруг гистонового октамера, и для этого требуется значительное уплотнение на малой бороздке спирали ДНК (рис. 9-24). Как установлено на примере белка репрессора бактериофага (см. рис. 9-17), кластер, состоящий из двух или трех пар AT и расположенный в малой бороздке, облегчает возникновение такого уплотнения. На характер расположения нуклеосом должны влиять и другие неизвестные пока свойства последовательности ДНК.
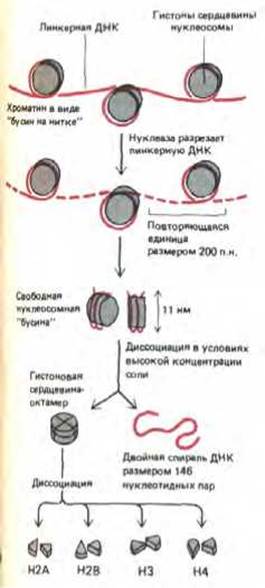
Рис. 9-23. Строение нуклеосом. Нуклеосомные частицы состоят из двух полных витков ДНК (83 нуклеотидных пары на виток), закрученных вокруг кора, представляющего собой гистоновый октамер, и соединяются между собой линкерной ДНК. Нуклеосомная частица выделена из хроматина путем ограниченного гидролиза линкерных участков ДНК микрококковой нуклеазой. В каждой нуклеосомнои частице фрагмент двойной спирали ДНК, имеющий в длину 146 пар оснований, закручен вокруг гистонового кора. Этот белковый кор содержит по две молекулы каждого из гистонов Н2А, Н2В, НЗ и Н4. Полипептидные цепи гистонов насчитывают от 102 до 135 аминокислотных остатков, а общий вес октамера составляет приблизительно 100000 Да. В деконденсированной форме хроматина каждая «бусина» связана с соседней частицей нитевидным участком линкерной ДНК.
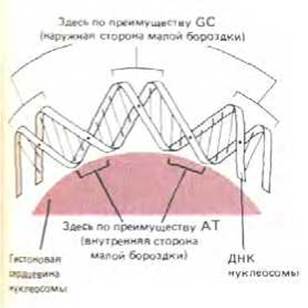
Рис. 9-24. Изгиб ДНК на нуклеосоме. Спираль ДНК делает два оборота вокруг гистонового октамера, причем на каждый виток приходится по 83 нуклеотидные пары. Соотношение ДНК и белка на схеме приближено к реальному, чтобы показать сдавливание малой бороздки на внутренней части витка. Как указывалось выше (см. рис. 9-17), в узкой малой бороздке расположены главным образом АТ-пары оснований.
9.1.19. Определенные сайты на хромосомах не содержат нуклеосом [17]
На некоторых участках ДНК нукдеосомы отсутствуют, несмотря на то, что длина этих участков составляет сотни нуклеотидных пар. Такие области можно выявить, обработав ядро клетки следовыми количествами дезоксирибонуклеазы (ДНКаза 1). Использование минимальных концентраций фермента обеспечивает разрушение длинных областей безнуклеосомной ДНК, при этом короткие участки линкерной ДНК, расположенной между нуклеосомами, останутся целыми. Хроматин, обработанный таким образом, расщепляется преимущественно по участкам, которые, по-видимому, не содержат нуклеосом. Обычно такие сайты отстоят друг от друга на расстояние нескольких тысяч нуклеотидных пар.
Первое доказательство биологической значимости сайтов, сверхчувствительных к нуклеазе, было получено в экспериментах с вирусом SV40. Его хромосома помимо кольцевой ДНК содержит гистоны, продуцируемые клеткой-хозяин ом. В составе этой хромосомы имеется участок длиной 300 нуклеотидных пар, который свободен от нуклеосом и быстро разрушается под воздействием ДНКазы!. Этот участок расположен очень близко от последовательностей ДНК, с которых начинается как репликация ДНК вируса, так и синтез его РНК. Здесь же локализуются и несколько сайт-специфических ДНК-связывающих белков, которые защищают лишь небольшой участок этой молекулы, по-видимому, совершенно лишенный нуклеосом, от нуклеазной деградации. Аналогичным образом, многие участки хроматина в клетке, обладающие гиперчувствительностью к ДНКазе, расположены в регуляторных областях генов (рис. 9-25); в клетках, где эти гены активны, таких сайтов больше, нежели в других клетках. Полагают, что за удаление нуклеосом ответственны сайт-специфические ДНК-связывающие белки, которые принимают участие в регуляции эукариотических генов (см. рис. 9-27).
9.1.20. Нуклеосомы обычно упаковываются вместе, образуя при этом упорядоченные структуры высшего порядка [18]
В живых клетках хроматин, вероятно, редко имеет вид растянутых «бус на нитке». Напротив, нуклеосомы связаны друг с другом и образуют регулярные структуры, в которых ДНК еще больше конденсирована. Электронномикроскопический анализ лизированных прямо на сеточке ядер показывает, что большая часть хроматина имеет форму фибрилл диаметром около 30 нм (рис. 9-22, А). Один из возможных способов упаковки нуклеосом в фибрилле хроматина диаметром 30 нм приведен на рис. 9-26. Эта модель представляет идеальную структуру. В действительности и разброс длин линкерных участков (что связано с определенным расположением нуклеосом), и наличие образовавшихся случайным образом безнуклеосомных последовательностей придают различным участкам 30 нм-фибриллы различные свойства (рис. 9-27).
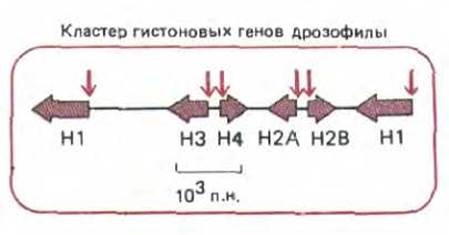
Рис. 9-25, Расположение сайтов, сверхчувствительных к нуклеазе (цветные стрелки), в регуляторних областях активных генов. Хотя такие участки хроматина обычно расположены на 5'-конце гена, как показано на этом рисунке на примере кластера генов, кодирующих гистоны (Н1, Н2А, Н2В, НЗ и Н4) у дрозофилы, эти сайты могут находиться и в других областях (см. рис. 10-40, А).
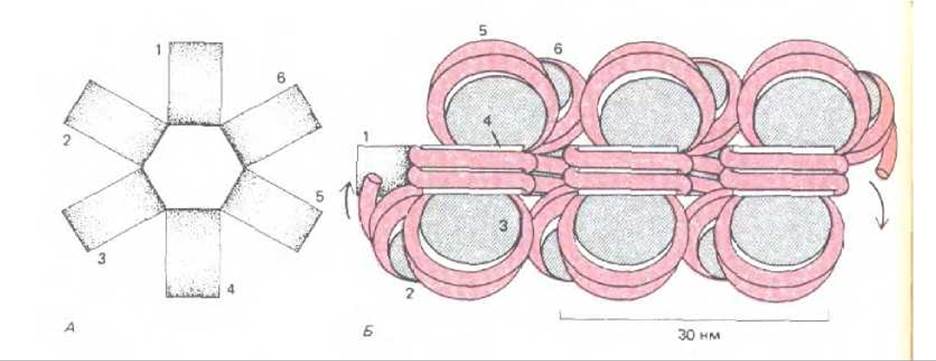
Рис. 9-26. Модель, предложенная для объяснения упаковки нуклеосомной нити в составе 30 нм - фибриллы, наблюдаемой под электронным микроскопом (см. рис. 9-22, А). А. Вид сверху. Б. Вид сбоку. При таком типе упаковки на нуклеосому приходится одна молекула гистона Н1 (не указано). Хотя место прикрепления гистона Н1 к нуклеосоме определено, расположение молекул Н1 на этой фибрилле неизвестно (см. также рис. 9-27).
Если бы хроматин типичной хромосомы человека существовал в виде фибриллы диаметром 30 нм, то в растянутом состоянии он имел бы длину 0,1 см, т.е. в 100 раз превышал бы размеры ядра. Микроскопический анализ интактных хромосом дает основание полагать, что внутри клеток происходит дальнейшая упаковка фибрилл диаметром 30 нм, при этом образуются нити хроматина толщиной 100 нм. Как расположены нуклеосомы в такой структуре, неясно.
9.1.21. Гистоновые белки Н1 помогают соединять нуклеосомы [19]
В клетках млекопитающих имеется приблизительно шесть близкородственных вариантов (подтипов) гистонов Н1, которые несколько отличаются друг от друга по аминокислотной последовательности. По-видимому, эти молекулы ответственны за упаковку нуклеосом в фибриллу диаметром 30 нм. Молекулы Н1 имеют эволюционно консервативную глобулярную центральную область, соединенную с выступающими аминоконцевыми и карбоксильными «ручками», аминокислотная последовательность которых эволюционирует быстрее. Каждая молекула Н1 связывается своей глобулярной частью с уникальным сайтом на нуклеосоме, а «ручка», как полагают, захватывают область шире и контактируют с другими сайтами, расположенными на гистонах, входящих в состав соседних нуклеосом. При этом нуклеосомы стягиваются вместе, образуя регулярную повторяющуюся структуру (рис. 9-28). Согласно разным гипотезам, молекулы Н1 располагаются либо внутри хроматиновой 30 нм-фибриллы, либо снаружи.
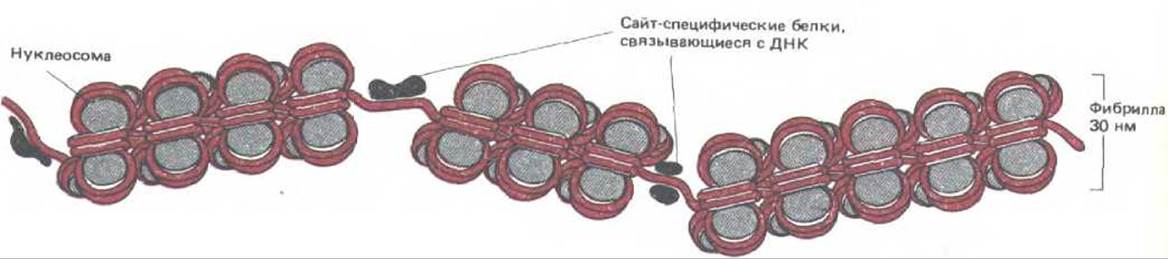
Рис. 9-27. Схема, иллюстрирующая прерывание правильной нуклеосом-нон структуры хроматина короткими областями, в которых ДНК необычно чувствительна к обработке ДНКазой І. В каждом из этих сайтов, сверхчувствительных к нуклеазе, нуклеосомы на ДНК, вероятно, замещены одним или несколькими сайт-специфическими ДНК-связывающими белками.
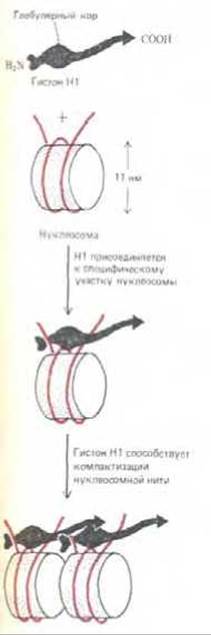
Рис. 9-28. Схема, показывающая, каким образом гистон Н1 (220 аминокислот) мог бы обеспечить контакт соседних нуклеосом. Глобулярная часть Н1І связывается с каждой нуклеосомой вблизи сайта, в котором спираль ДНК входит и выходит с гистонового октамера. В присутствии гистона Н1 два полных витка ДНК (166 нуклеотидных пар) защищены от действия микрококковой нуклеазы (см. рис. 9-23). Однако до сих пор неизвестны ни трехмерная структура гистона Н1І, ни точные области взаимодействия выступающих аминоконцевых и карбоксиконцевых плечей этого гистона с нуклеосомой.
Гистоновый октамер, образующий сердцевину каждой нуклеосомы, представляет собой симметричную структуру, а единственная молекула гистона Н1, связывающаяся с каждой нуклеосомой, симметрией не обладает. Таким образом, связывание молекул Н1 с хроматином создает локальную полярность (рис. 9-29).
Опыты, проведенные in vitro, показывают, что при связывании гистона H1 с ДНК к ней присоединяется сразу по восемь или более белковых молекул, что может служить примером кооперативного связывания. Весьма вероятно, что хроматин организован именно за счет кооперативных взаимодействий такого типа, а при их нарушении белками-регуляторами происходит локальная деконденсация хроматина (что и имеет место в области активных генов). Образовавшиеся области «активного хроматина», по-видимому, обладают необычайно низкой способностью связывать гистон Н1. В этом отношении ограниченная область хроматина может напоминать крошечный кристалл, который способен в ходе процессов, приводящих к активации гена, менять свою конформацию по типу все или ничего (рис. 9-30).
9.1.22. Нуклеосомы не мешают синтезу РНК [20]
Результаты биохимических исследований свидетельствуют о том, что при транскрипции большая часть ДНК остается связанной с нуклеосомами; электронномикроскопическое изучение препаратов распластанного по специальной методике хроматина обычно выявляет одинаковое расположение нуклеосом как в транскрибируемых, так и в нетранскрибируемых областях (рис. 9-31). По-видимому, гистоновый октамер так прочно связан с ДНК, что остается на ней постоянно. Тем не менее трудно себе представить, как РНК-полимераза транскрибирует ДНК, связанную с нуклеосомой, не внося никаких временных изменений в строение нуклеосом. По мере прохождения РНК-полимеразы, ДНК, входящая в состав нуклеосомы, вероятно, раскручивается с гистонового октамера, не освобождая его полностью. Возможно, вся нуклеосома временно приоткрывается, разделяя гистоновый октамер на две половинки. Не исключено также, что октамер остается интактным, но как бы «покачивается», давая пройти полимеразе (рис. 9-32). Очевидная трудность подобных маневров может служить объяснением столь высокой консервативности, которая характерна для аминокислотных последовательностей гистонов. Если бы нуклеосома представляла собой лишь устройство для наматывания ДНК, было бы логично ожидать большей вариабельности аминокислотной последовательности у нуклеосомных гистонов.
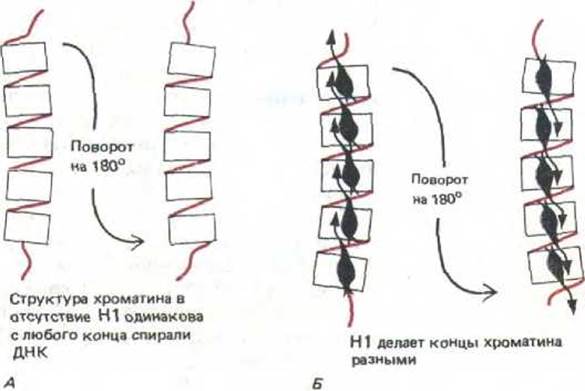
Рис. 9-29. Полярность хроматина обусловлена связыванием его с гистоном Н1. А. В отсутствие гистона Н1 хроматин не обладает полярностью, так как каждая нуклеосома симметрична. Б. В присутствии Н1 хроматин становится полярным. Остается неизвестным, для чего нужна такого рода полярность.
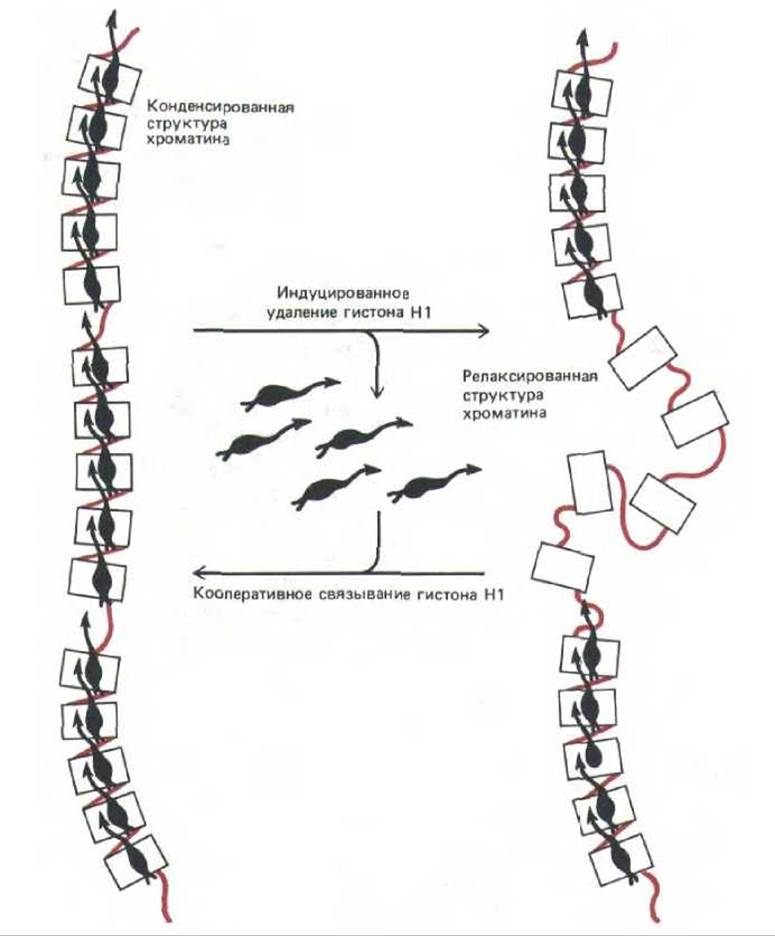
Рис. 9-30. Отдельные участки хроматина могут вести себя как структурные единицы вследствие кооперативного характера упаковки нуклеосом с помощью гистона Н1. Приведенная схема показывает момент внезапной деконденсации такой единицы (фибриллы 30 им или более компактной структуры), вызванной внешним регуляторним сигналом. Деконденсация хроматина подобного типа может сопутствовать активации гена (см. рис. 9-50).
Как уже обсуждалось выше, большая часть нуклеосом клетки упакована в хроматиновую фибриллу 30 нм, которая затем подвергается дальнейшей конденсации. Трудно себе представить, что хроматин, находящийся в таком состоянии, транскрибируется РНК-полимеразой, и при этом упаковка нуклеосом, входящих в его состав, не подвергается значительным изменениям (рис. 9-33). Некоторые эксперименты дают основание предполагать, что отчасти такое изменение структуры имеет место (см. рис. 9-50).
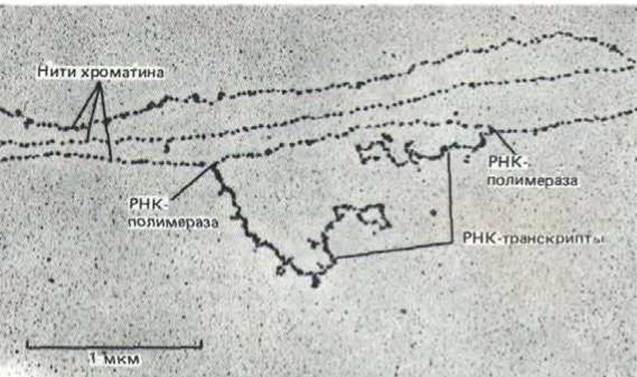
Рис. 9-31. Участок хроматина в форме нуклеосомной нити. Показаны три нити хроматина, на одной из которых две молекулы РНК- полимеразы транскрибируют ДНК. Большая часть хроматина в ядре высших эукариот не содержит активных генов, и, следовательно, свободна от РНК-транскриптов. Следует отметить, что нуклеосомы имеются как в транскрибируемых, так и в нетранскрибируемых областях, и что они связаны с ДНК непосредственно перед и сразу же за движущимися молекулами РНК-полимераз. (С любезного разрешения Victoria Foe.).
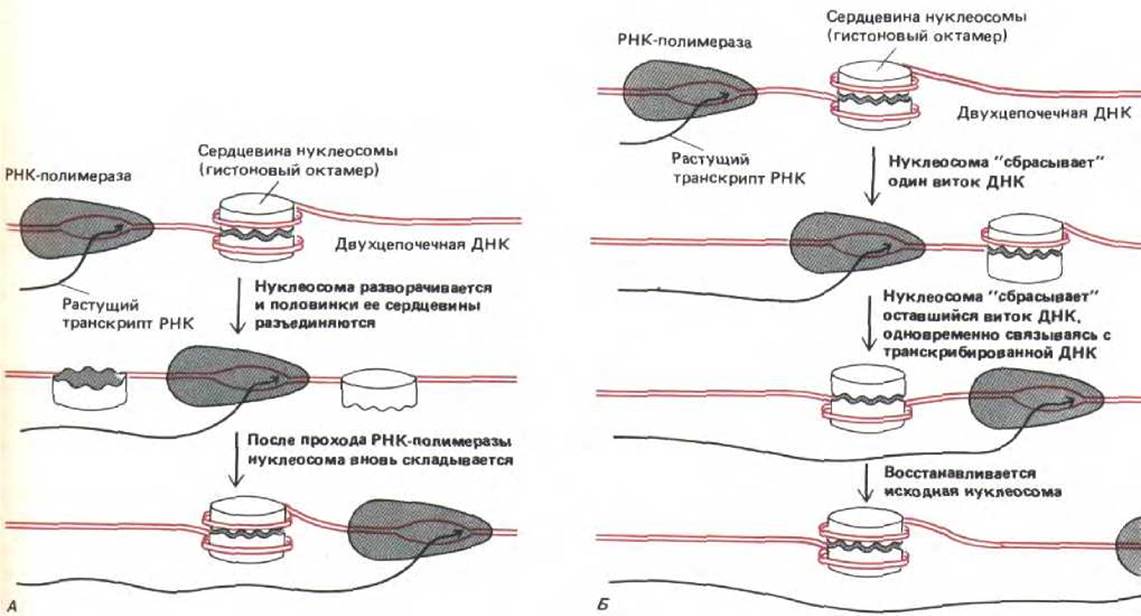
Рис. 9-32. Две возможные модели, объясняющие, как РНК-полимераза может транскрибировать хроматин, не вытесняя с него нуклеосомы. А. Транскрипция через временно приоткрытые полинуклеосомы. Б. Транскрипция через целый гистоновый октамер.
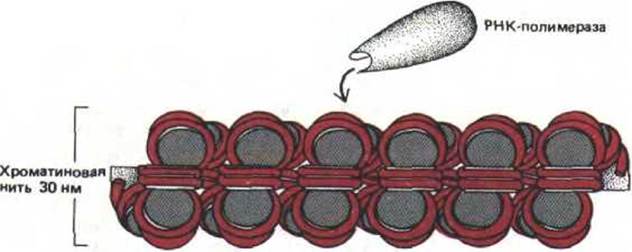
Рис. 9-33. Схема, представляющая молекулу РНК-лолимеразы, которая приближается к 30 нм-фибрилле хроматина. Число изображенных нуклеосом соответствует примерно 7000 парам оснований ДНК, что сопоставимо с геном среднего размера у человека (табл. 9-1). Вся эта ДНК, не соскальзывая с гистоновых октамеров хроматина, каким-то образом должна оказаться доступной для действия РНК-полимеразы.
Очевидно, что для этого необходимо развернуть хроматин.
Заключение
Ген - это последовательность нуклеотидов, представляющая собой единицу активности для образования молекулы РНК. Хромосома состоит из одной-единственной невероятно длинной молекулы ДНК, содержащей множество генов. В молекуле хромосомной ДНК имеются и другие типы нуклеотидных последовательностей, необходимых для ее функционирования: сайт инициации репликации и теломера (они обеспечивают репликацию молекулы ДНК), а также центромера (она служит для прикрепления ДНК к митотическому веретену). Гаплоидный геном человека содержит 3 х 10 нуклеотидных пар, которые распределены между 22 различающимися аутосомами и 2 половыми хромосомами. По-видимому, лишь несколько процентов этой ДНК кодируют белки.
ДНК эукариот тесно связана с большим количеством гистонов, которые служат для образования множества повторяющихся частиц, содержащих белки и ДНК и называемых нуклеосомами. Нуклеосомы обычно упакованы вместе в регулярную структуру — фибриллу, имеющую диаметр 30 нм. Однако в областях ДНК, содержащих гены, гистоновый октамер, образующий каждую нуклеосому, должен конкурировать с разнообразными сайт-специфическими белками за участки связывания на ДНК. Такие участки, на которых нуклеосома замещена ДНК-связывающими белками, обычно выявляются как области более активной транскрипции ДНК.
В эукариотической клетке имеются сотни самых разнообразных сайт-специфических ДНК-связывающих белков. Каждый из них узнает короткую последовательность ДНК по водородным связям с парами оснований и по форме спирали. Эти белки при образовании белковых комплексов на определенных участках ДНК вступают друг с другом в кооперативное или конкурирующее взаимодействие.