Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Внутриклеточная сортировка макромолекул и сохранение клеточных компартментов
Репликация хромосом
Перед каждым делением клетка должна синтезировать копии всех своих хромосом. Таким образом, делению клетки предшествует ее переход из состояния интерфазы (фазы G1) в фазу синтеза ДНК (S-фаза). В типичной клетке высших эукариот S-фаза длится 8 часов. После ее окончания каждая хромосома представлена двумя копиями, которые продолжают оставаться соединенными в области центромер до наступления М-фазы. (см. рис. 9-35). Для удвоения хромосомы необходима репликация ее ДНК и последующая сборка на этой молекуле хромосомных белков, образующих хроматин. В гл. 5 мы обсуждали ферменты, участвующие в репликации ДНК, и строение репликационной вилки, обеспечивающей синтез (см. рис. 5-39). Переход клетки в S-фазу будет рассмотрен в гл. 13 как часть более общей проблемы контроля клеточного цикла. В данном разделе мы изложим принципы механизма репликации эукариотической хромосомы, укажем время, необходимое для этого, и, кроме того, проанализируем взаимосвязь процесса репликации и структуры хромосомы.
9-18
9.3.1. В хромосомах высших эукариот сайты инициации репликации активируются группами [31]
Как отмечалось ранее, репликационные вилки возникают на бактериальной хромосоме в участках с определенной последовательностью ДНК, называемых точками начала репликации (сайтами инициации репликации) (см. разд. 5.3.9). В каждом таком сайте образуется две вилки, которые движутся в противоположных направлениях со скоростью около 500 нуклеотидов в секунду пока не закончится репликация всей кольцевой ДНК бактериальной хромосомы. Бактериальный геном столь мал, что эти две репликационные вилки могут его полностью удвоить менее, чем за 40 минут.
В начале 60-х гг. был разработан метод, позволяющий в общих чертах изучать репликацию хромосом эукариот. В культуру клеток человека на короткое время вводят радиоактивную метку (Н-тимидин), затем клетки мягко лизируют и ДНК дают расправиться на поверхности предметного стекла, покрытого фоточувствительной эмульсией; после чего радиоавтограф изучают в световом микроскопе. Реплицировавшаяся ДНК выявляется в виде цепочки гранул серебра. Этим методом можно определить как скорость, так и направление движения репликационной вилки (рис. 9-55). Исходя из скорости, с которой увеличивается длина треков реплицировавшейся ДНК эукариот при увеличении времени мечения, репликационные вилки у этих организмов перемещаются примерно на 50 нуклеотидов в секунду, т. е. в десять раз медленнее, чем у бактерий. Возможно, это связано с тем, что ДНК, упакованную в хромосому, реплицировать труднее.
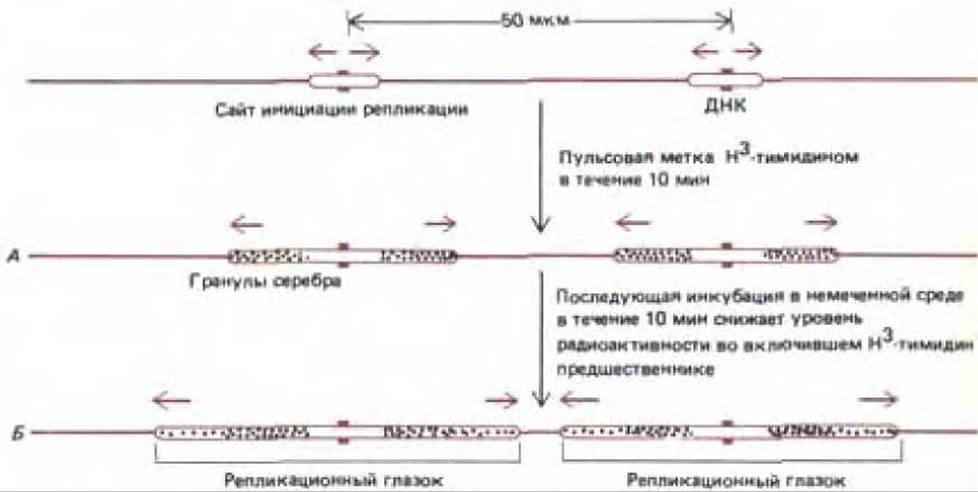
Рис. 9-55. Схема эксперимента, позволяющего судить о характере перемещения в течение S-фазы. Вновь синтезированную ДНК в культуре клеток человека подвергали импульсному мечению [3Н]-тимидином. А. Клетки лизировали и ДНК растягивали на предметном стекле, которое затем покрывали светочувствительной эмульсией. Через несколько месяцев светочувствительный слой проявляли, при этом становился видимым ряд серебряных зерен вдоль радиоактивной ДНК. Б. Тот же эксперимент с последующей инкубацией в среде, не содержащей метку. Синтезированная в этих условиях дополнительная ДНК характеризуется пониженным уровнем радиоактивности. Оказалось, что гранулы серебра в паре темных треков (Б) как бы расходятся в противоположных направлениях, что свидетельствует о продвижении вилки в разные стороны от точки начала репликации (см. рис. 5-49). ДНК на данном рисунке выделена цветом только для того, чтобы облегчить понимание радиоавтографа. В действительности немеченая ДНК в таких экспериментах не видна.
Согласно современным представлениям, средняя хромосома человека состоит из единственной молекулы ДНК, содержащей около 150 млн. пар нуклеотидов. Для репликации такой молекулы от начала до конца репликационной вилки, движущейся со скоростью 50 нуклеотидов в секунду, потребуется 0,02 х 150 х 106 = 3,0 х 106 с (около 800 ч). При анализе радиоавтографов выяснилось, однако, что по каждой эукариотической хромосоме движется одновременно много вилок. Более того, часто в одной и той же области ДНК обнаруживается много вилок, тогда как в других участках той же хромосомы их нет совсем. Дальнейшие более детальные эксперименты выявили следующее: 1) сайты инициации репликации обычно активируются группами по 20-80 сайтов (их называют репликационными единицами); 2) в ходе S-фазы, по-видимому, активируются всё новые решшкационные единицы, пока вся ДНК не будет реплицирована; 3) отдельные точки начала репликации внутри репликационной единицы отстоят друг от друга на расстояние от 30000 до 300000 нуклеотидных пар, следовательно, в среднем на одну петлю хроматина может приходиться одна такая точка; 4) у эукариот, как и у бактерий, образуется сразу пара репликационных вилок, а по мере их расхождения от сайта инициации репликации формируется репликационный глазок. Остановка вилки происходит только при столкновении с репликационной вилкой, движущейся в противоположном направлении (или при достижении конца хромосомы). Таким образом, по каждой хромосоме может двигаться независимо друг от друга много репликационных вилок, образующих две целые дочерние спирали ДНК (рис. 9-56).
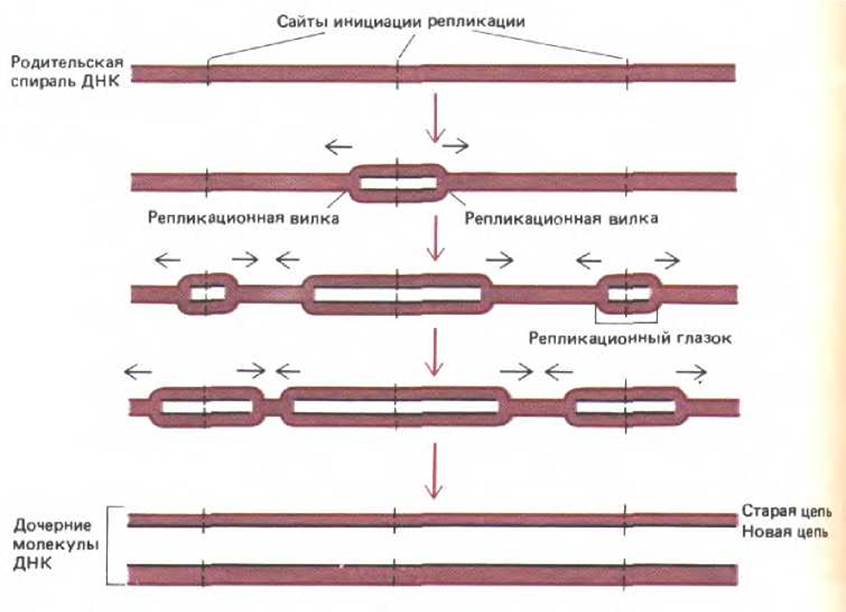
Рис. 9-56. Особенности репликации ДНК в хромосомах эукариот. Точки начала репликации в большинстве клеток расположены на расстоянии от 30000 до 300000 нуклеотидных пар друг от друга. Полагают, что репликационные вилки останавливаются только при встрече с аналогичной структурой, двигающейся в противоположном направлении или по достижении конца хромосомы. В результате вся ДНК оказывается реплицированной.
9-19
9-21
9.3.2. Сайтами инициации репликации служат определенные последовательности ДНК [32]
У бактерий и ряда вирусов животных в роли сайтов инициации репликации (точек начала репликации) выступают вполне определенные последовательности ДНК. Можно предположить, что и у эукариот точками начала репликации служат конкретные последовательности ДНК. Наибольшим успехом завершились поиски таких участков у дрожжей Saccharomyces cerevisiae. Для их обнаружения использовали клетки, дефектные по жизненно важному гену. Эти клетки могут расти на селективной среде лишь при условии, что они несут плазмиду, содержащую активную копию отсутствующего гена. Если бактериальную плазмиду, несущую жизненно важный ген переносят в дефектную клетку дрожжей, то плазмида не реплицируется, поскольку сайт инициации репликации бактерии в составе плазмидной ДНК не способен инициировать репликацию в клетке дрожжей. Однако если встроить в плазмиду (до ее переноса в клетки дрожжей) случайные фрагменты дрожжевой ДНК, то небольшая часть молекул плазмидной ДНК получит дрожжевой сайт инициации репликации и, следовательно, сможет реплицироваться. Клетки дрожжей, несущие такие плазмиды, способны расти, так как они получили жизненно важный ген (рис. 9-57). Последовательности ДНК дрожжей, присутствующие в плазмидах, которые выделены из этих клеток, названы автономно реплицирующимися (autonomously replicating sequences, ARS). ARS-последовательности встречаются в геноме дрожжей примерно с той же частотой, которая постулируется для точек начала репликации (приблизительно одна на каждые 40000 нуклеотидных пар). Для функционирования ARS необходима консенсусная последовательность, состоящая из 11 нуклеотидов [(А или Т) ТТТАТ (А или G)TTT(A или Т)]. Искусственно сконструированный тандем, состоящий из таких последовательностей, при встраивании в плазмиду функционирует в дрожжевой клетке как ARS. Отсюда следует, что инициаторный белок, чтобы начать репликацию, должен узнать расположенные рядом друг с другом копии этой последовательности. Были сделаны попытки идентифицировать участки ДНК, которые в клетках высших эукариот выступают в роли сайтов инициации репликации, однако подобные последовательности еще недостаточно хорошо изучены.
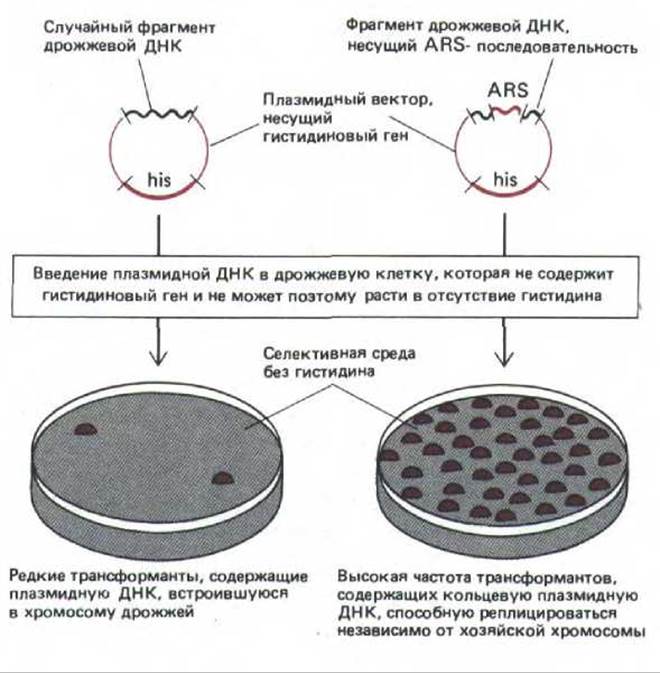
Рис. 9-57. Метод выявления автономно реплицирующихся последовательностей (ARS-элементов) у дрожжей. Эти последовательности выступают в роли точек начала репликации, содержащие их плазмиды способны самостоятельно реплицироваться в хозяйской клетке, не включаясь в состав хромосом.
9-20
9.3.3. Хромосома вируса SV40 реплицируется в бесклеточной системе млекопитающих [33]
В репликационных системах прокариот движение репликационной вилки обеспечивает комплекс, состоящий из нескольких ферментов: ДНК-полимеразы, ДНК-праймазы и ДНК-геликазы (см. разд. 5.3.6). Этот комплекс собирается в точке начала репликации в результате реакции с участием инициаторного белка, который специфически связывается с точкой начала репликации ДНК (см. рис. 5-50). Чтобы выявить все ферменты, участвующие в репликации ДНК млекопитающих, было предпринято много попыток реконструировать этот процесс in vitro. В наиболее удачных системах in vitro, разработанных до сих пор, удалось реплицировать небольшую кольцевую хромосому вируса обезьяны (SV40). Все белки, необходимые для его репликации (за исключением одного), обеспечиваются клеткой-хозяином. Исключение составляет Т-антиген SV40, большой многофункциональный белок (90000 дальтон), который позволяет этому вирусу избежать блокировки повторной репликации ДНК (см. разд. 9.3.11) и, таким образом, реплицироваться быстрее, чем ДНК клетки-хозяина. Множественные копии Т-антигена специфически связываются с точкой начала репликации SV40 и действуют одновременно и как инициаторный белок, и как ДНК-геликаза для того, чтобы раскрыть спираль ДНК в этом сайте. Затем к одной из цепей в этом участке присоединяется комплекс ДНК-полимеразы (ДНК-полимераза а) и ДНК-праймазы (оба фермента принадлежат клетке-хозяину). Образующаяся репликационная вилка напоминает репликационную вилку прокариот, но отличается от нее тем, что в ней функционируют два типа ДНК-полимераз: ДНК-полимераза а на отстающей цепи и ДНК-полимераза 5 на ведущей цепи. У прокариот же на обеих сторонах репликациониой вилки действуют разные молекулы одной и той же ДНК-полимеразы (см. разд. 5-47).
Белок, инициирующий репликацию на хромосомах эукариотических клеток, еще не обнаружен. Таким образом, остается неизвестным, действует ли этот белок подобно Т-антигену в качестве ДНК-геликазы или же, как у прокариот, инициаторные и геликазные функции берут на себя разные белки.
9.3.4. По мере репликации ДНК новые гистоны образуют хроматин [34]
Для образования нового хроматина в каждом клеточном цикле требуется огромное количество гистонов, масса которых примерно равна массе вновь синтезированной ДНК. В связи с этим у большинства организмов для каждого из гистонов имеется много копий генов. Например, в клетках позвоночных обнаружено приблизигельно 20 одинаковых генных блоков, каждый из которых содержит все пять гистоновых генов.
В отличие от большинства клеточных белков, которые синтезируются во время интерфазы, гистоны образуются главным образом в S- фазе. За это время в результате усиления транскрипции и уменьшения распада гистоновой мРНК ее содержание в клетке увеличивается примерно в 5 раз. Вследствие необычного строения 3'-конца (см. разд. 10.4.13) основные гистоновые мРНК чрезвычайно нестабильны и подвергаются распаду через несколько минут после окончания синтеза ДНК в конце S-фазы (или при добавлении ингибитора, прерывающего синтез ДНК). В противоположность этому сами молекулы гистонов очень стабильны и могут существовать в течение всей жизни клетки. Тесная связь между синтезом гистонов и синтезом ДНК может быть, по крайней мере отчасти, обусловлена механизмом обратной связи, который контролирует уровень свободных гистонов, чтобы обеспечить соответствие количества гистонов количеству вновь синтезированной ДНК.
После сборки нуклеосом молекулы гистонов редко либо вообще никогда не покидают ДНК, с которой они связаны. Следовательно, по мере своего продвижения регшикационная вилка должна преодолевать родительские нуклеосомы, которые, по-видимому, устроены так, чтобы не препятствовать ходу транскрипции и репликации. В соответствии с одной из гипотез каждая нуклеосома при репликации ДНК временно раскрывается с образованием двух «полунуклеосом», что дает возможность ДНК-полимеразе копировать развернувшуюся молекулу (рис. 9-58). Вновь синтезированная ДНК, остающаяся позади репликационной вилки, наследует старые гистоны, и кроме того, чтобы завершить упаковку в хроматин, требует такого же количества новых гистонов (см. рис. 9-58). Новые гистоны обычно связываются в первые несколько минут после прохождения репликационной вилки. Однако для полного формирования вновь образованному хроматину необходим целый час. Именно в этот период новые гистоны проявляют большую чувствительность к модифицирующим ферментам, чем старые гистоны. Неизвестно, чем отличается по своему химическому составу зрелый хроматин от незрелого; полагают, что для созревания необходимы как ковалентная модификация гистонов, так и изменения в способности связываться с другими белками, входящими в состав хроматина.
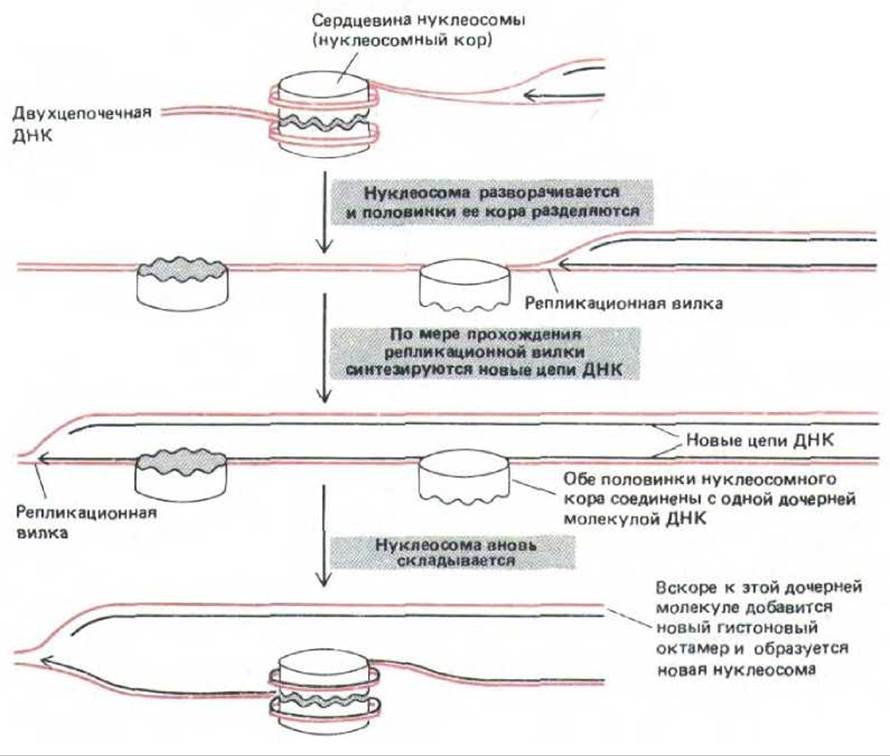
Рис. 9-58. Гипотетическая схема, показывающая, как нуклеосома может открываться для репликации ДНК и затем вновь собираться после прохождения репликационной вилки. При этом гистоны, входящие в состав нуклеосомы, остаются постоянно связанными с ДНК. На данном рисунке старая нуклеосома наследуется в прежнем виде спиралью ДНК, образовавшейся на ведущей цепи, однако в действительности пока неизвестно, как она наследуется. Представлена лишь одна из многих возможных моделей.
9-5
9.3.5. Теломеры состоят из коротких G-богатых повторов, которые добавляются к концам хромосом [35]
Как отмечалось выше, невозможность полностью реплицировать конец молекул линейных ДНК с помощью ДНК-полимеразы привела к появлению на концах эукариотических хромосом специфических последовательностей ДНК, названных теломерами (см. разд. 9.1.2). У таких разных организмов, как простейшие, грибы, растения и млекопитающие, эти участки имеют одинаковое строение. Они состоят из многих, расположенных друг за другом повторов одной короткой последовательности, которая содержит блок G-нуклеотидов (рис. 9-59, А). G-богатая теломерная последовательность всегда расположена на 3'-конце молекулы ДНК и, по-видимому, складывается в специальную структуру, которая защищает конец хромосомы. Предполагаемый механизм репликации ДНК теломеры ресничного простейшего Tetrahymena приведен на рис. 9-59, Б.
9.3.6. Различные области одной и той же хромосомы в S-фазе реплицируются в разное время [36]
Учитывая скорость движения репликационной вилки и расстояние, отделяющее две соседние точки начала репликации, можно сделать вывод, что синтез ДНК на этом участке, по-видимому, в норме занимает около часа. Несмотря на это, S-фаза в клетках млекопитающих обычно длится примерно 8 часов. Отсюда следует, что не все точки начала репликации активируются одновременно, и время репликации каждой группы этих сайтов (20-80 сайтов) занимает лишь небольшую часть всей S-фазы.
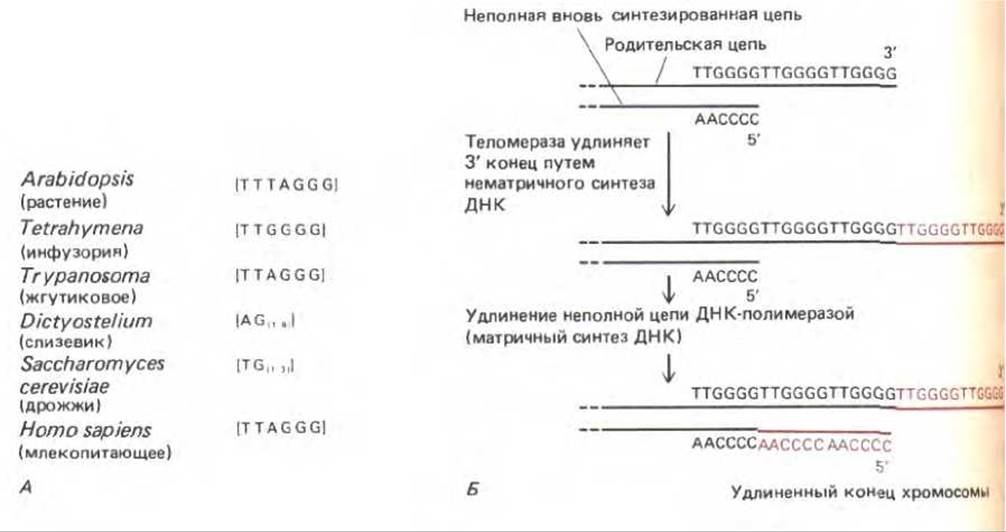
Рис. 9-59. А. Повторяющиеся G-богатые последовательности, которые образуют теломеры различных эукариотических организмов. Б. Возможный путь образования теломер (по данным, полученным на Tetrahymena). На отстающей цепи матричной молекулы ДНК синтезируется неполная цепь (см. рис. 5-39). При соединении с теломерой, теломераза Tetrahymena узнает структурную особенность G-богатой последовательности. Поскольку в качестве субстрата этот фермент использует нуклеозидтрифосфаты, нуклеотид на 3'-конце должен сигнализировать теломеразе, какой нуклеотид G или Т присоединять на данной стадии. Реакции, сокращающие и удлиняющие последовательность теломеры, не совсем сбалансированы, в результате концы хромосом состоят из разного числа повторов (примерно сотни нуклеотидных пар).
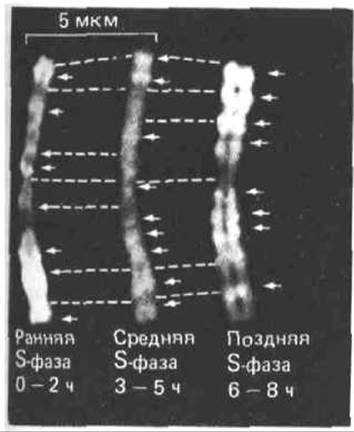
Рис. 9-60- Световая микрофотография окрашенных митотических хромосом. Реплицирующуюся ДНК метили в предшествующей митозу S-фазе. Для этого клетки выращивали в присутствии синтетического нуклеозида 5'-бромдезоксиуридина (BrdU), а затем в течение коротких промежутков времени метили тимидином в ранней, средней или поздней S-фазе. Поскольку у ДНК, синтезировавшейся в период пульс-мечения, одна из цепей несет тимидин, а другая BrdU, эти участки окрашиваются более интенсивно, чем остальная ДНК, у которой BrdU входит в состав обеих цепей. Пунктиром соединены соответствующие участки на трех копиях хромосомы. (С любезного разрешения Elton Stubblefield.)
Активируются ли различные единицы репликации случайным образом или же существует строгий порядок, согласно которому и удваиваются определенные области генома? Для того, чтобы ответить на этот вопрос, была проведена серия экспериментов. Синхронизированную клеточную культуру, находящуюся в S-фазе, в течение коротких промежутков времени метили аналогом тимидина 5-бромдезоксиуридином (BrdU). Области митотических хромосом, включившие метку в свою ДНК, можно обнаружить в М-фазе по снижению окрашивания определенным красителем или по связыванию со специфическими антителами. Такие опыты показали, что области хромосом реплицируются в виде больших единиц, а очередность их удвоения в S-фазе для каждой хромосомы строго регламентирована (рис. 9-60).
9.3.7. Высококонденсированный хроматин реплицируется в поздней S-фазе [37]
В клетках высших эукариот некоторые участки ДНК более конденсированы по сравнению с другими. Например, в интерфазе гетерохроматин остается в сильно конденсированном состоянии (которое сходно с кон-формацией хромосом в митозе), тогда как активный хроматин становится менее компактным, что, по-видимому, необходимо для синтеза РНК (см. разд. 10.3.11).
Для понимания механизма, определяющего момент репликации конкретного участка, очень важны данные о том, что гетерохроматиновый блок (включая околоцентромерные области), остающийся конденсированным в интерфазе, реплицируется в поздней S-фазе. По-видимому, поздняя репликация связана с упаковкой ДНК в хроматин. Такой вывод подтверждается хронометрированием репликации двух Х-хромосом в клетках самок млекопитающих. Известно, что эти две хромосомы содержат одинаковые последовательности ДНК, но одна из них активна, а другая нет (см. разд. 10.3.9). Почти все неактивные Х-хромосомы состоят из гетерохроматина и их ДНК реплицируется в поздней S-фазе; активная Х-хромосома менее конденсирована и реплицируется, как оказалось, в течение всей S-фазы. Напрашивается вывод, что менее конденсированный в интерфазе хроматин более доступен для репликационной машины и состоящие из него области реплицируются в первую очередь.
С другой стороны, по данным радиоавтографии все репликационные вилки в течение S-фазы движутся со сравнимыми скоростями; таким образом, степень конденсации хромосом, вероятно, не влияет на работу этой вилки, если она уже образовалась. Однако порядок активации точек начала репликации, по-видимому, по крайней мере отчасти зависит от структуры хроматина данного участка.
9.3.8. Гены в составе активного хроматина реплицируются в ранней S-фазе [38]
Связь между строением хроматина и временем репликации ДНК подтверждается данными о времени репликации отдельных генов. Популяцию растущих клеток метили бромдезоксиуридином, после чего клетки тут же разделяли по размеру центрифугированием. Так как рост клеток связан с клеточным циклом, клетки большего размера окажутся «старше», и их ДНК, таким образом, будет помечена на более поздней стадии S-фазы. Из клеток каждого типа выделяли ДНК, меченную BrdU, и гибридизовали ее с серией известных ДНК-зондов, чтобы определить, какие гены она содержит. Поскольку ДНК, в состав которой входит BrdU, более плотная, ее легко можно отделить от обычной ДНК путем центрифугирования в градиенте плотности хлористого цезия (см. разд. 4.4.1).
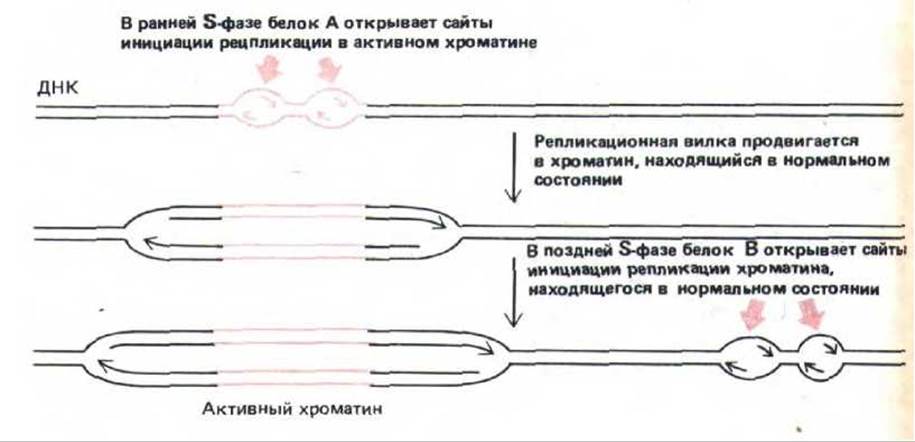
Рис. 9-61. Одна из моделей, объясняющих почему активный хроматин (выделен цветом) реплицируется в ранней S-фазе, а неактивный - в поздней S-фазе. Предполагают, что в точке начала репликации на активный и неактивный хроматин действуют различные инициаторные белки.
Согласно другой гипотезе, два типа сайтов инициации репликации используют один и тот же молекулярный механизм, но в различное время, просто потому, что конденсированная структура обычного хроматина затрудняет доступ необходимых для репликации белков.
Таким образом, исследователи владеют эффективным методом, позволяющим определить время репликации любого гена, для которого имеется ДНК-зонд. Оказалось, что во всех изученных клетках гены «домашнего хозяйства» (т. е. те, которые активны во всех клетках) реплицируются в ранней S-фазе. Напротив, гены, активные в некоторых типах клеток, реплицируются рано лишь в тех клетках, где они активны, и позже в других типах клеток. Например, при изучении таким способом длинных последовательностей гена иммуноглобулина размером 300000 нуклеотидных пар оказалось, что в клетках, где этот ген активен, все области хроматина, в состав которого он входит, завершают свою репликацию в начале S-фазы. Вероятно, это связано с существованием внутри гена нескольких точек начала репликации, активирующихся примерно в одно и то же время. Иная картина наблюдается в тех клетках, где синтез иммуноглобулина отсутствует. С помощью ДИК-зондов была выявлена единственная репликационная вилка, которая возникла на одном конце этого участка хромосомы примерно через час после начала S-фазы и затем двигалась вдоль ДНК с постоянной скоростью около 3000 нуклеотидов в минуту.
На рис. 9-61 представлена простая модель, объясняющая эти результаты. Согласно этой модели, все точки начала репликации, расположенные в активном хроматине, начинают работать в самом начале S-фазы. Затем репликационные вилки, возникшие на этих участках, обязательно передвинутся в соседние области хромосомы, где хроматин характеризуется более конденсированной структурой, поэтому любой ген, расположенный менее, чем за миллион нуклеотидных пар от точки начала репликации, будет реплицироваться в середине S-фазы. Чтобы стало понятным, как могут реплицироваться неактивные области хромосомы, расположенные далеко от активного хроматина, необходимо допустить, что в середине или в поздней S-фазе активируется вторая группа точек начала репликации, которые могут инициировать возникновение репликационных вилок в хроматине, обладающем любой структурой.
9.3.9. Поздно реплицирующиеся участки совпадают с АТ-богатыми полосами на метафазных хромосомах [23]
Вероятно, многие репликационные единицы соответствуют различным сегментам хромосом, выявляемым с помощью специальных методов фиксации и окрашивания, которые используются для кариотипирования.
Как отмечалось выше (см. разд. 9.2.3), в гаплоидном наборе митотических хромосом млекопитающих при окрашивании можно обнаружить приблизительно 2000 темных АТ-богатых сегментов (G-полосы), разделенных светлыми GC-богатыми участками (R-полосы). Примечательно, что АТ-богатая и GC-богатая ДНК различаются по времени репликации в S-фазе. Эксперименты, подобные приведенному на рис. 9-60, показали, что большая часть GC-богатых полос реплицируются в первой половине S-фазы, а большинство АТ-богатых - во второй ее половине. Отсюда можно сделать вывод, что гены «домашнего хозяйства» (конститутивные) находятся главным образом в GC-богатых полосах, а гены, активность которых характерна для специализированных клеток, относятся к АТ-богатым сегментам. Остается загадкой, почему геном млекопитающих должен подразделяться на такие большие чередующиеся блоки хроматина, многие из которых по размеру приближаются к целому бактериальному геному. Неизвестно также, сколько точек начала репликации из каждой репликационной единицы активируется одновременно. Возможно, в поздно реплицирующихся репликонах хроматин остается в конденсированном состоянии даже после окончания М-фазы и деконденсируется лишь в середине S-фазы, открывая в репликоне сразу все точки начала репликации. В таком случае координированная репликация ДНК в пределах одной репликационной единицы, проходящая по принципу «все или ничего», может отражать кооперативную природу процесса деконденсации хроматина (см. разд. 9.1.21).
9.3.10. Для чего необходим контроль времени включения точек начала репликации? [39]
S-фаза завершается необычайно быстро в дробящихся яйцеклетках многих видов, где запасено большое количество компонентов хроматина (таких как гистоны), необходимых для быстрого снабжения ими новых ядер. Как показано на рис. 9-62, короткая S-фаза требует использования чрезвычайно большого числа точек начала репликации, расположенных на расстоянии всего нескольких тысяч нуклеотидных пар (а не десятков или сотен тысяч нуклеотидов, разделяющих соответствующие сайты на более поздних стадиях развития). Поскольку любая чужеродная ДНК, введенная в оплодотворенную яйцеклетку шпорцевой лягушки (включая небольшие кольцевые фрагменты ДНК бактерий) реплицируется, можно сделать вывод, что в качестве точки начала репликации в этой клетке функционирует очень короткая простая последовательность, имеющаяся в любой молекуле ДНК. Репликация ДНК представляет собой процесс, который может протекать с довольно высокой скоростью и который в большинстве клеток регулируется сложной системой, обеспечивающей такой механизм возникновения репликационных вилок, при котором различные части генома реплицируются в совершенно разное время. Возможно, время репликации влияет на структуру хроматина. Например, согласно одной из гипотез, хроматин, реплицирующийся рано, собирается из специального запаса хромосомных белков, синтезированных в течение G1-фазы, которые способствуют поддержанию хроматина в активном состоянии и, таким образом облегчают транскрипцию экспрессируемых генов.
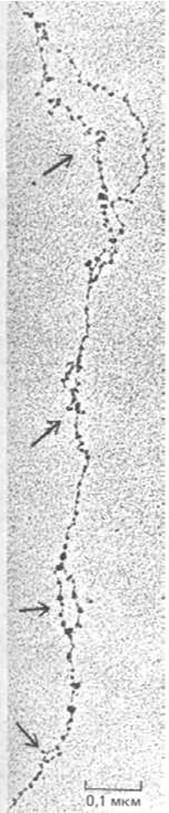
Рис. 9-62. Электронная микрофотография расправленного хроматина из клеток эмбриона дрозофилы. Обратите внимание, что репликационные глазки расположены очень близко друг к другу (указано стрелками). У этих эмбрионов между делениями ядер проходит лишь 10 мин. Точки начала репликации, которые мы видим на микрофотографии, расположены так близко (их разделяют несколько тысяч нуклеотидных пар), что для репликации ДНК, заключенной между ними, требуется только одна минута. (С любезного разрешения Victoria Foe.)
9-21
9-22
9.3.11. Факторы, связанные с хроматином, обеспечивают однократную репликацию ДНК в каждой S-фазе, блокируя повторение этого процесса [40]
У нормальной клетки в S-фазе весь геном должен реплицироваться только один раз. Как было показано выше, репликация ДНК в большинстве эукариотических клеток протекает асинхронно в течение определенного промежутка времени. В связи с тем, что точки начала репликации в разных участках хромосомы активируются в разное время, к середине S-фазы некоторые части хромосом еще не начинают реплицироваться, тогда как другие уже реплицированы полностью. Таким образом, в середине и в поздней S-фазе возникает сложная «бухгалтерская» задача. К этому времени некоторые точки начала репликации уже удвоились, тогда как другие (вероятно, с аналогичной последовательностью ДНК) ещё не были задействованы. Однако известно, что каждая точка начала репликации в каждой S-фазе может использоваться только один раз. Как же это достигается?
Ключ к решению данной проблемы дали опыты по слиянию клеток. Если клетки, находящиеся в S-фазе, слить с клетками, находящимися в G1-фазе, то в G1-ядре индуцируется синтез ДНК. Можно предположить, что переход из фазы G1 в S-фазу обусловлен действием диффундирующего активатора синтеза ДНК. Иная картина имела место, когда с клетками, находящимися в S-фазе, сливали клетки на стадии G2 (т.е. только что закончившие S-фазу). В этом случае в G2-ядре синтез ДНК не начинался, а в ядре, находящемся в S-фазе, он по-прежнему шел. Таким образом, ядро, находящееся на стадии G2 (его ДНК уже реплицировалась), ведет себя так, как будто оно защищено от вхождения в последующие циклы репликации неким недиффундирующим ингибитором, тесно связанным с ДНК. Подобный ингибитор, если бы он действительно существовал, мог бы помочь каждой репликационной вилке решить «бухгалтерскую» задачу: модифицируя хроматин вновь синтезированной ДНК, он предотвращал бы повторную репликацию уже реплицировавшейся ДНК в одной и той же S-фазе (рис. 9-63, А). В качестве альтернативы можно также предположить существование иного механизма, основанного на том, что с ДНК тесно связаны инициаторные белки, которые после прохождения репликационной вилки инактивируются (рис. 9-63, Б). Чем бы ни объяснялась блокировка повторной репликации ДНК, она должна исчезнуть к началу митоза или во время его, так как после деления клетки ДНК, попадающая в дочернюю клетку, ядро которой находится на стадии G1, уже не защищена. Оказалось, что механизм блокировки повторной репликации действует и на фрагменты бактериальной ДНК, инъецированные в оплодотворенную яйцеклетку лягушки. Следовательно, механизм, ответственный за блокировку, не требует присутствия высокоспецифической точки начала репликации. Блокировка не действует на вирус SV40, вероятно, потому, что его Т-антиген обладает как инициаторной, так и геликазной активностью и замещает собой аналогичные компоненты хозяйских клеток, функция которых еще не ясна (см. разд. 9.3.3.)
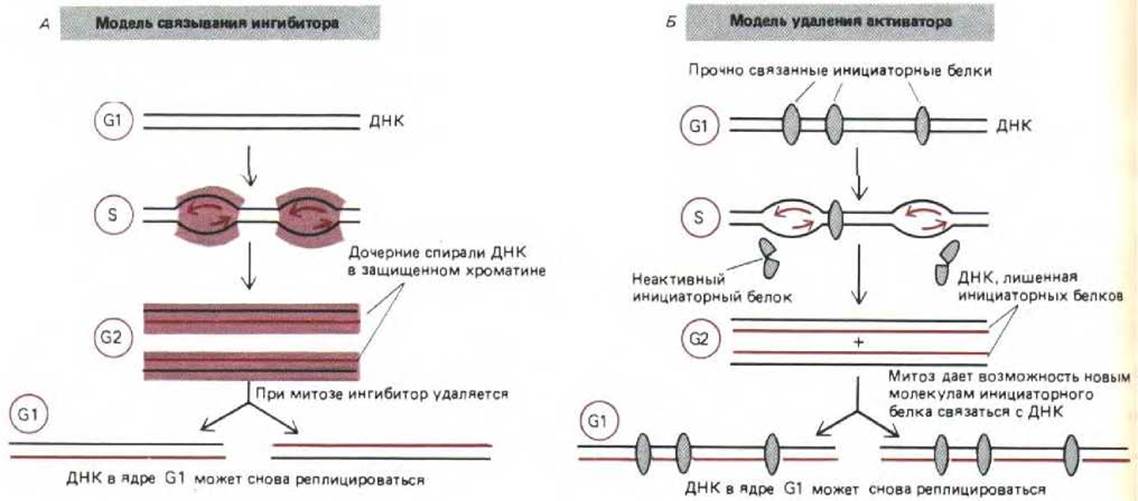
Рис. 9-63. Два возможных механизма блокировки повторной репликации ДНК, которая препятствует удвоению в данном клеточном цикле уже реплицированной ДНК. Отсутствие такой блокировки в некоторых типах клеток (например, в клетках слюнных желез дрозофилы) приводит к образованию гигантских политенных хромосом А. Модель, согласно которой с вновь синтезировавшимся хроматином соединяется ингибитор. Б. Модель, предполагающая существование инициаторных белков, действующих однократно и связывающихся с ДНК лишь во время митоза.
Заключение
Использование различных модельных систем при изучении репликации ДНК показало, что у эукариот, как и у прокариот, этот процесс начинается с посадки геликазы на ДНК с помощью инициаторного белка, связывающегося с точкой начала репликации. По мере удаления двух репликационных вилок друг от друга образуется репликационный глазок. У высших эукариот в течение S-фазы соседние точки начала репликации, по-видимому, активируются группами (их называют репликационными единицами). Так как репликационная вилка движется со скоростью около 50 нуклеотидов в секунду, для завершения репликации ДНК в пределах одной единицы требуется приблизительно час. В ходе S-фазы, длящейся 8 ч, по очереди активируются различные кластеры сайтов начала репликации. Порядок активации определяется отчасти структурой их хроматина, наиболее конденсированные области хромосом реплицируются последними. Взаимосвязь между единицами репликации и сегментами на митотических хромосомах эукариот позволяет предположить, что единицы репликации могут соответствовать структурно различающимся доменам интерфазного хроматина.
После прохождения репликационной вилки структура хроматина переформируется путем добавления новых гистонов и других хромосомных белков к старым гистонам, унаследованным дочерней молекулой ДНК. Для предотвращения второго цикла репликации, следующего непосредственно за первым (т.е. до того, как хромосома вступит в митоз), в клетке предусмотрена блокировка. Она необходима для того, чтобы в каждой S-фазе любая область ДНК реплицировалась только один раз.