Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Цитоскелет
Актиновые филаменты и клеточный кортекс
Во многих эукариотических клетках актин содержится в больших количествах, составляя нередко до 5% и более от общего белка клетки. Хотя он распределен по всей цитоплазме, в большинстве животных клеток существует особенно густая сеть из актиновых филаментов и ассоциированных с ними белков под самой плазматической мембраной. Эта сеть образует клеточный кортекс, который придает механическую прочность поверхностному слою клетки и позволяет клетке изменять свою форму и двигаться. Структура кортекса может быть различной у разных клеток и даже в разных участках одной и той же клетки. Иногда это плотная трехмерная сеть из поперечностних актиновых филаментов, в которую не могут проникать органеллы и другие крупные частицы из прилежащих слоев цитоплазмы (рис. 11-29); в других случаях кортекс заметно тоньше и больше похож на двумерную структуру. В одни участках животных клеток небольшие пучки актиновых филаментов, отходящие от наружной стороны кортекса, заполняют выступы клеточной поверхности, тогда как в других актиновые филаменты втягивают мембрану внутрь. Плазматическая мембрана настолько тесно связана с кортикальным актиновым слоем, что для некоторых целей лучше считать их единым функциональным образованием.
В большинстве животных клеток примерно половина всех молекул актина находится в неполимеризованной форме - в виде свободных мономеров или небольших комплексов с другими белками. Между этим пулом актина и актиновыми филаментами существует динамическое равновесие, что помогает осуществлять движения клеточной поверхности. В этом разделе мы расскажем о том, как актин-связывающие белки регулируют сборку актиновых филаментов, соединяют их в пучки или сети и определяют их расположение, длину и другие свойства.
11.2.1. Актин-связывающие белки «сшивают» актиновые филаменты в обширные сети [18]
Актиновые филаменты часто связаны между собой в жесткие трехмерные сети с помощью специальных сшивающих белков. Наиболее распространенный из них - филамин; его длинная гибкая молекула состоит из двух одинаковых полипептидных цепей, соединенных «голова к голове», а участки связывания актиновых филаментов находятся на «хвостовых» концах (рис. 11-30). Во многих клетках белки такого типа составляют почти 1 % всего белка (примерно 1 димер на 50 мономеров актина).
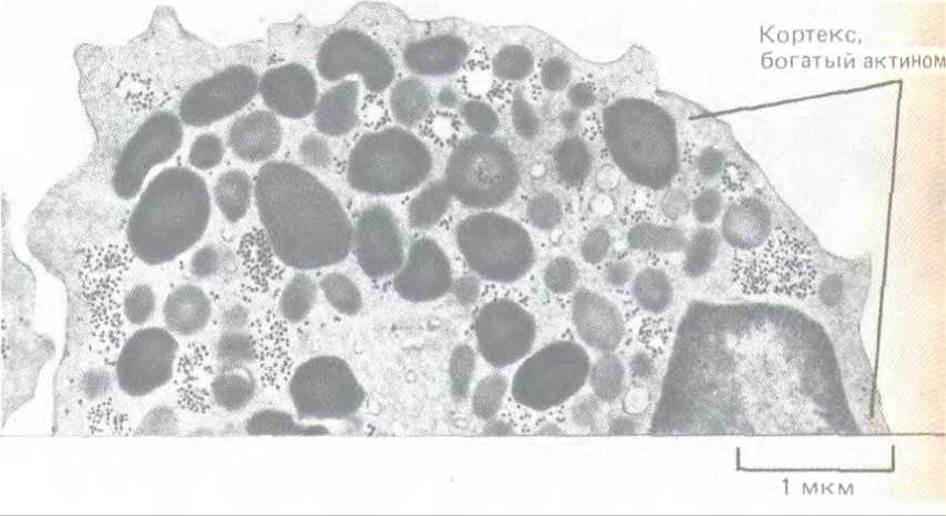
Рис. 11-29. Актиновый кортекс на электронной микрофотографии тонкого среза лейкоцита. Хотя цитоплазму заполняют гранулы различного типа, в тонкий слой под самой плазматической мембраной (кортекс) они не попадают. Кортекс содержит сеть актиновых филаментов и связанных с ними белков, определяющих движения клеточной поверхности. (С любезного разрешения Dorothy Bainton.)
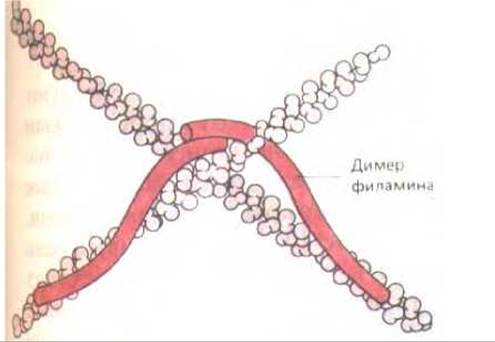
Рис. 11-30. Образуя гибкие сшивки между соседними актиновыми нитями, филамин создает из них трехмерную сеть, обладающую механическими свойствами геля. Каждый димер филамина, если его полностью выпрямить, имеет длину около 160 нм.
Гели, образуемые in vitro актиновыми филаментами и сшивающими белками, обладают любопытными механическими свойствами: они сохраняют свою форму, если к ним приложить резкое короткое усилие, но легко деформируются под действием более слабой постоянной силы. Предполагаемый молекулярный механизм, лежащий в основе такого поведения, характерного и для кортикальной цитоплазмы, показан на рис. 11-31. По-видимому, именно такие актиновые сети позволяют клетке легко восстанавливать свою фирму за счет упругости после мелких толчков, но в то же время подвергаться значительным деформациям при длительном воздействии слабых сил.
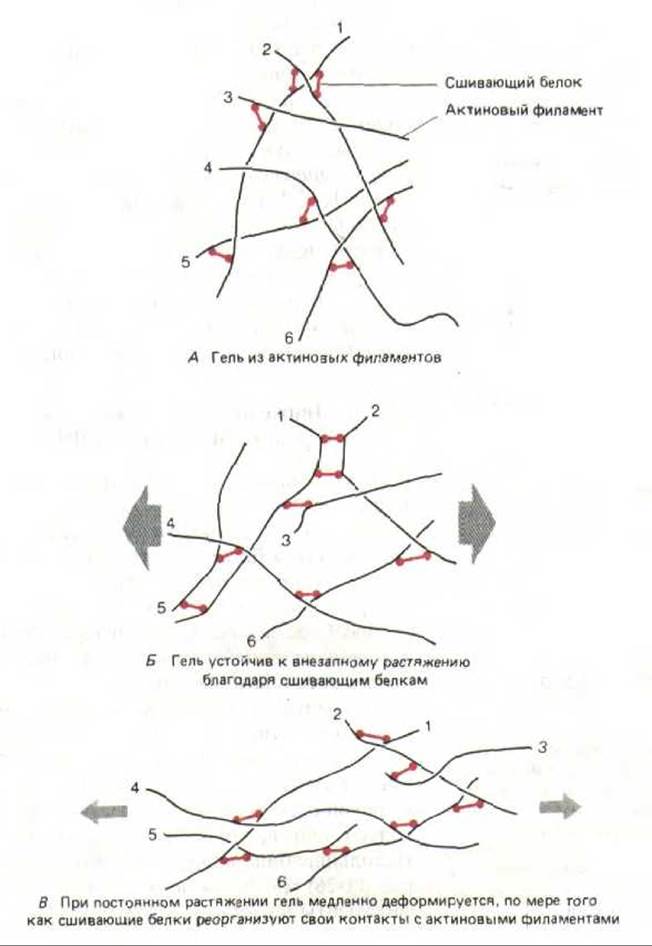
Рис. 11-31. Механические свойства геля из актиновых филаментов, образованного с помощью белков, сшивающих актин. Гель противостоит резким деформациям (Б), так как сшивающие белки не успевают отделиться от актиновых филаментов. Сопротивление медленным деформациям гораздо слабее: сшивающим белкам хватает времени, чтобы диссоциировать и вновь связаться с актиновыми филаментами в других положениях. (По М. Sato, W.H. Schwartz, T.D. Pollard, Nature 325: 828-830, 1987.)
11.2.2. Гельзолин, активированный ионами Са2+, вызывает фрагментацию актиновых филаментов [19]
Экстракты, полученные из животных клеток многих типов, образуют гель, если к ним добавить АТР и прогреть до 37 °С. Этот процесс связан со взаимодействием актиновых филаментов и сшивающего белка, например филамина, однако поведение такого геля оказывается более сложным, чем у простой смеси филамина с актиновыми филаментами. Так, при увеличении концентрации Са2+ выше 10-7 М актиновый гель начинает разжижаться. Под микроскопом в участках, где происходит такой переход геля в золь, можно увидеть весьма энергичные локальные «течения». Очевидно, в экстрактах помимо актиновых филаментов и филамина должны присутствовать еще какие-то компоненты, благодаря которым ионы Са2+ вызывают превращение геля в золь и движение жидкости. Вероятно, именно эти компоненты ответственны за течение цитоплазмы, наблюдаемое в некоторых крупных клетках, где оно необходимо для равномерного распределения метаболитов и других веществ. Эти внутриклеточные движения связаны, по-видимому, с быстрыми локальными изменениями в консистенции цитоплазмы - переходами гель/золь.
Из клеточных экстрактов удалось выделить несколько белков, которые разжижают актиновый гель в присутствии Са2+. Из них лучше всего изучен гельзолин - компактный белок с мол. массой около 90 000. Связывая ионы Са2+, гельзолин активируется, разрывает актиновные филаменты и образует «шапки» на появляющихся при этом плюс-концах филаментов, что ведет к разрушению сети из сшитых актиновых нитей. Сходные белки содержатся в кортексе многих клеток позвоночных. фрагмонтирующие белки активируются при таких концентрациях Са2+ (около 10-6 М), которые создаются в цитозоле лишь на короткое время; как полагают, они служат посредниками в реакциях клеточного кортекса на внешние сигналы. Например, когда фагоцитирующий лейкоцит вступает в контакт с микроорганизмом, сеть актиновых филаментов в этом участке кортекса распадается, что позволяет поверхностному слою цитоплазмы окружить и поглотить микробную клетку. К механизмам, лежащим в основе таких движений, мы вернемся несколько позже.
11.2.3. Движение цитоплазмы может осуществляться с участием миозина [20]
В искусственных смесях из актиновых филаментов, филамина и гельзолина наблюдаются Са2+-зависимые переходы геля в золь и обратно, однако к сокращению эти смеси не способны и в них не возникают такие потоки, как в богатых актином гелях, получаемых из клеток. Судя по всему, для этого необходим миозин: неочищенные актиновые гели, из которых миозин избирательно экстрагирован, теряют сократимосгь и способность создавать течения. Поэтому можно предполагать, что источником силы для таких движений служит какое-то взаимодействие между актином и миозином.
Поскольку в исходном экстракте актиновые филаменты, видимо, образуют неупорядоченную трехмерную сеть, возникает вопрос: как могут актин и миозин производить согласованные движения? Актиновые филаменты, как мы знаем, обладают отчетливой полярностью, и миозиновые головки могут связываться с ними и скользить вдоль них только при правильной ориентации относительно этой полярности, Небольшие биполярные комплексы молекул немышечного миозина (см. рис. 11-26) могли бы до некоторой степени «упорядочивать» актиновые филаменты в растворе, просто подтягивая одну их группу относительно другой, даже если эти миозиновые комплексы и актиновые филаменты вначале не были хорошо ориентированы (рис. 11-32).
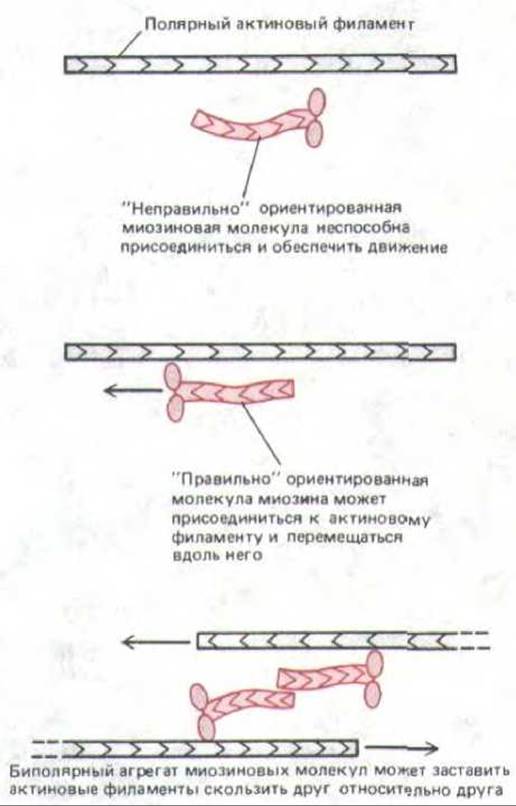
Рис. 11-32. Биполярные агрегаты молекул немышечного миозина (см. рис. 11-26) вызывают скольжение двух актиновых филаментов противоположной полярности (как и в мышце). Этим способом миозин может вызывать сокращение даже в сети из случайно ориентированных актиновых нитей.
11.2.4. Цитоплазм этические потоки в гигантских клетках водорослей создаются при участии актина и миозина [21]
Растительные клетки могут достигать гораздо больших размеров, чем животные клетки, так как они обладают жесткой клеточной стенкой и содержат обширную центральную вакуоль (см. гл. 20, разд. 20.4.9). Диффузия при таких расстояниях недостаточно эффективна, поэтому очень крупным клеткам для перемешивания цитоплазмы нужны мощные цитоплазматические потоки. Гигантские многоядерные клетки зеленых водорослей Chara и Nitella достигают в длину 2-5 см, и белковой молекуле потребовались бы недели для диффузии от одного конца клетки до другого. Неудивительно, что у таких организмов мы находим самые яркие примеры цитоплазматических потоков. Непрерывный узкий поток цитоплазмы движется вдоль клетки в виде бесконечной спиральной ленты, обходя огромную центральную вакуоль (рис. 11-33, А). Этот поток увлекает с собой внутренние мембранные структуры, митохондрии и ядра со скоростью до 75 мкм/с.
Система, создающая потоки в таких клетках, находится между движущимся слоем цитоплазмы и неподвижным монослоем хлоропластов, лежащих под самой плазматической мембраной (рис. 11-33, Б). На электронных микрофотографиях в этой промежуточной области видны большие пучки актиновых филаментов с одинаковой полярностью. Эта полярность такова, что направленное движение вдоль них молекул миозина (от минус-конца к плюс-концу) совпадает с направлением наблюдаемых потоков цитоплазмы. Более того, можно «вскрыть» гигантскую клетку Nitella так, чтобы обнажились актиновые пучки на поверхности слоя хлоропластов; если теперь добавить к препарату шарики латекса, покрытые миозином, то эти шарики в присутствии АТР будут двигаться по актиновой сети, причем движение их окажется очень похожим на перемещение органелл в интактной клетке. Таким образом, весьма вероятно, что цитоплазматические потоки создаются в клетке при участии миозина.
Для такого движения цитоплазмы, как у Nitella, биполярные миозиновые филаменты не нужны - ведь здесь происходит не сокращение, а непрерывное однонаправленное перемещение. Помимо немышечного миозина, организованного в филаменты (см. рис. 11-26), многие клетки содержат относительно небольшие молекулы так называемых мини-миозинов. Эти молекулы впервые были экстрагированы из крупных амеб (Acanthamoeba); они состоят из единственной глобулярной головки с которой гибким хвостом, который, вместо того чтобы образовать спираль с таким же хвостом другой молекулы, связывается с мембранами-непосредственно или через другой белок. Очищенные мини-миозины in vitro присоединяются к мембранным органеллам и могут перемещать их вдоль ориентированных пучков актиновых филаментов. По-видимому, именно так осуществляется активный транспорт многих органелл в клетках.
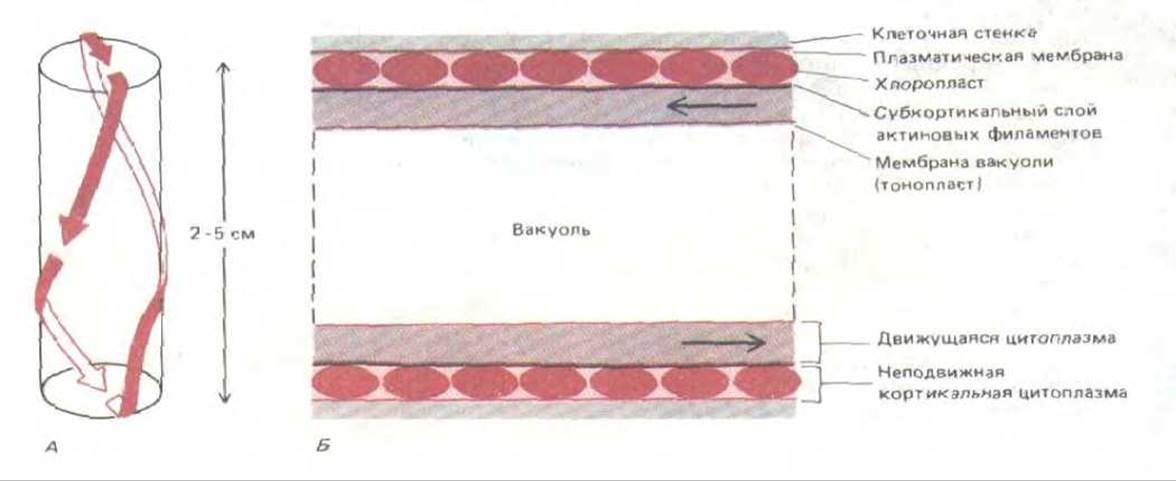
Рис, 11-33. Схема токов цитоплазмы в гигантской клетке водоросли Nitella. А. Путь движения цитоплазмы в цилиндрической клетке. Для простоты диаметр клетки относительно ее длины преувеличен. Б. Продольный разрез участка такой клетки; показана организация неподвижных и движущихся слоев цитоплазмы. В неподвижном кортикальном слое лежат хлоропласты, которые связаны с подлежащими пучками актиновых филаментов; под этими пучками расположен движущийся слой цитоплазмы, в нем находятся ядра, митохондрии к другие органеллы. На самом деле относительные размеры вакуоли гораздо больше, чем на рисунке.
11.2.5. Организация кортекса определяется взаимодействием актиновых филаментов с плазматической мембраной
До сих пор мы обходили вопрос, который является основным для понимания структуры и функций актинового кортекса: какова природа связи актиновых филаментов с плазматической мембраной? Полагают, что находящиеся в мембране специальные белки служат центрами организации для актиновой сети. Силы, возникающие в кортикальном слое актиновых нитей и ответственные за движения клеточной поверхности, должны передаваться на мембрану именно через эти или другие мембранные белки. О том, каковы эти белки и как они взаимодействуют с актином, мало что известно. Очевидно, однако, что есть по крайней мере три функциональных типа присоединения актина к плазматической мембране: первый главным образом придает мембране прочность и определяет ее форму; второй дает возможность актиновым филаментам втягивать участки мембраны внутрь; и наконец, третий тип-тот, при котором актиновые филаменты вызывают быстрое выпячивание участков мембраны наружу. Рассмотрим по порядку каждый из этих типов.
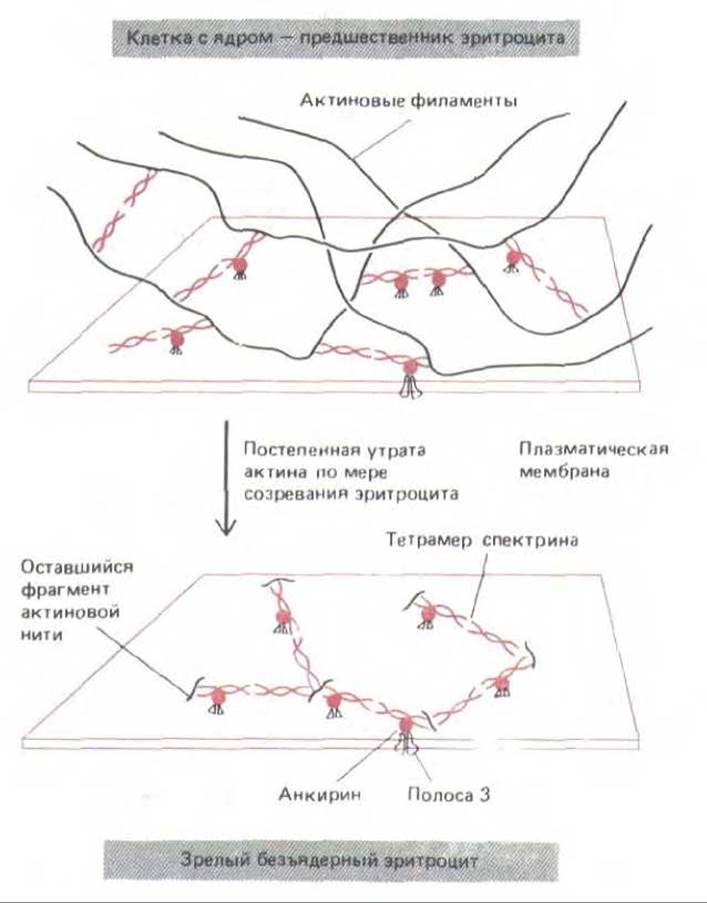
Рис. 11-34. Эта гипотетическая схема показывает, как цитоскелет, подстилающий мембрану эритроцитов у млекопитающих, мог бы получиться из более обычного кортекса с преобладанием актина. Клетка-предшественник с ядром имеет связанный с мембраной кортекс, состоящий из актиновых филаментов, удерживаемых вместе тетрамерами спектрина и другими сшивающими белками. Когда эта клетка созревает и превращается в эритроцит, большая часть ее актина теряется. В результате актиновые филаменты деполимеризуются и сшивающие белки в основном отделяются от них - остается лишь тонкая двумерная сеть из спектрина и коротких «отрезков» актиновых филаментов, связанных с плазматической мембраной.
11.2.6. Цитоскелетные сети, связанные с мембраной, создают для нее механический «каркас» [22]
В гл. 6 (разд. 6.2.4) мы уже говорили о спектрине и анкирине - белках, которые впервые были открыты в эритроцитах млекопитающих как важнейшие компоненты цитоскелета, связанного с мембраной. В зрелых эритроцитах млекопитающих ядро и внутренние мембраны утрачены, так что из всех мембран остается только плазматическая. Ее поддерживает двумерная сеть из тетрамеров спектрина, концы которых соединены с помощью очень коротких актиновых филаментов; через анкириновые мостики эти тетрамеры связаны с трансмембранным белком полосы 3 (см. рис. 6-26). Белки, очень сходные и со спектрином, и с анкирином, имеются в кортексе многих клеток позвоночных. Было высказано предположение, что необычайно тонкая (всего около 20 нм) цитоскелетная сеть, лежащая под плазматической мембраной зрелого эритроцита, образуется из более толстого кортекса клетки-предшественницы, обладающей ядром, в результате постепенной деполимеризации актиновых филаментов (рис. 11-34). В этом случае пространственную организацию белков кортекса в эритроците можно было бы рассматривать как модель цитоскелетных сетей на актиновой основе, которые служат опорой для плазматической мембраны во всех других животных клетках.
11-10
11.2.7. Микроворсинки - пример того, как пучки поперечносшитых актиновых филаментов могут стабилизировать локальные выпячивания плазматической мембраны [23]
Микроворсинки - это пальцевидные выступы плазматической мембраны на поверхности многих животных клеток. Микроворсинок особенно много у тех эпителиальных клеток, которым для эффективного выполнения их функций необходима большая поверхность. Например, в тонкой кишке человека одна такая клетка несет на своей апикальной поверхности несколько тысяч микроворсинок. Каждая микроворсинка имеет длину около 1 мкм и ширину около 0,08 мкм; в результате всасывающая поверхность клетки оказывается в 20 раз больше, чем если бы она была гладкой. Высокоспециализированная плазматическая мембрана микроворсинок покрыта снаружи плотным слоем из полисахаридов и пищеварительных ферментов.
Внутри каждой кишечной микроворсинки находится жесткий пучок из 20-30 параллельных актиновых филаментов, тянущихся от ее верхушки к основанию, где они погружены в клеточный кортекс. Все филаменты в пучке ориентированы плюс-концами наружу (от клетки) и удерживаются вместе на одинаковых расстояниях друг от друга несколькими актин-связывающими белками, в частности фимбрином и фасцином (рис. 11-35). В отличие от филамина и других сшивающих актиновые филаменты белков, молекулы которых гибки и объединяют филаменты в рыхлую сеть, эти актин-связывающие белки относительно невелики и компактны, причем полипептидная цепь такого белка образует два раздельных участка для связывания актина. Поэтому актиновые филаменты оказываются объединенными в плотные пучки, где они прочно удерживаются параллельно друг другу на расстоянии около 10 нм.
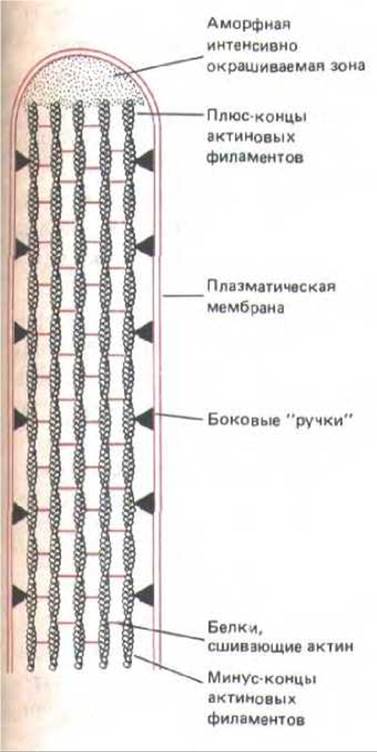
Рис. 11-35. Сердцевину микроворсинки образует пучок параллельных актиновых филаментов, удерживаемый белками, сшивающими актин. Поверхность этого пучка соединена с окружающей его плазматической мембраной боковыми «ручками». Плюс-концы всех актиновых филаментов находятся в кончике микроворсинки, где они погружены в аморфный интенсивно окрашиваемый материал неизвестного состава.
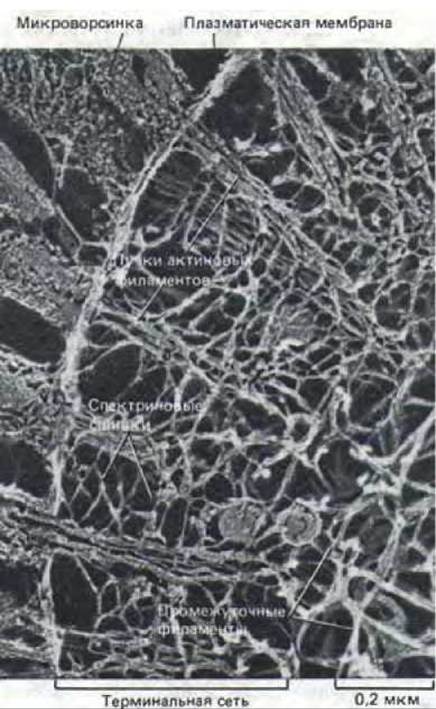
Рис. 11-36. Эпителиальная клетка кишечника, в которой видна терминальная сеть, лежащая под апикальной плазматической мембраной (электронная микрофотография, метод замораживания-травления). Пучки актиновых филаментов, образующих сердцевину микроворсинок, продолжаются в терминальную сеть, где они соединены главным образом спектрином. Под терминальной сетью находится слой промежуточных филаментов. (N. Hirokawa, J. E. Heuser, J. Cell Biol. 91: 399-409, 1981. С разрешения Rockefeller University Press.)
Нижний конец актинового пучка микроворсинки заякорен в специализированном кортексе апикальной части клетки. Этот кортекс. называемый терминальной сетью, содержит густое сплетение из молекул спектрина, лежащее поверх слоя промежуточных филаментов (рис. 11-36); по-видимому, именно терминальная сеть фиксирует актиновые пучки, а тем самым и микроворсинки, под прямым углом к апикальной поверхности клетки.
Каким образом пучок актиновых филаментов микроворсинки присоединен к одевающей его плазматической мембране? Электронная микроскопия выявляет два различных типа такого соединения: по всей длине пучка, подобно ступенькам винтовой лестницы, расположены контактирующие с мембраной боковые отростки, а на верхушке микроворсинки плюс-концы актиновых филаментов соединены с мембраной через «шапочку» из бесструктурного, интенсивно окрашиваемого вещества (см. рис. 11-35).
Если плазматическую мембрану эпителиальной клетки кишечника растворить с помощью неионного детергента, боковые отростки актиновых пучков останутся связанными с обнажившимся цитоскелетом. Однако их можно отделить, добавив к такому препарату АТР, и оказалось, что каждый отросток состоит из молекулы мини-миозина, к которой прочно присоединен кальций-связывающий белок кальмодулин. Своим АТР-зависимым головным участком мини-миозин связывается с актиновыми филаментами срединного пучка микроворсинки, а коротким хвостовым участком-с плазматической мембраной. Почему для образования такой связи используется «двигательный» белок, неизвестно; но, поскольку молекулы миозина движутся по актиновым филаментам в направлении к плюс-концу, следует ожидать, что в микроворсинке они должны тянуть компоненты мембраны к ее верхушке. Возможно, что такой механизм способствует непрерывному слущиванию плазматической мембраны с конца микроворсинки в просвет кишки, где связанные с мембраной пищеварительные ферменты продолжают свое действие.
О природе аморфной «шапочки» на кончике микроворсинки известно еще меньше. Как мы увидим, есть основания подозревать, что находящиеся в этой области белки контролируют толщину и длину пучка актиновых филаментов, определяя тем самым размеры микроворсинки (разд. 11.6.10). Если это так, то взаимодействие актиновых филаментов с плазматической мембраной микроворсинки на ее верхушке должно быть весьма сложным.
11.2.8. Благодаря фокальным контактам актиновые филаменты могут создавать тянущую силу, приложенную к субстрату [24]
Пучки актиновых филаментов часто присоединяются к плазматической мембране способом, который позволяет им передавать тянущее усилие на субстрат - будь то внеклеточный матрикс или другая клетка. Мы уже упоминали о таких способах прикрепления пучков актиновых филаментов у фибробластов и гладкомышечных клеток (разд. 11.14 и 11.17). В подобном соединении конца пучка с плазматической мембраной участвуют трансмембранные линксрныс гликопротеины. Лучше всего изучены места прикрепления культивируемых фибробластов к внеклеточному матриксу. Когда фибробласты растут в культуральной чашке, большая часть их обращенной к субстрату поверхности отделена от него промежутком более 50 нм. Однако в некоторых местах, называемых фокальными контактами или адгезионными пластинками, этот промежуток уменьшается до 10-15 нм. В отражательном интерференционном микроскопе, который собирает только свет, отраженный от нижней поверхности клетки, эти места имеют вид темных пятен. Окрасив клетку антителами к актину, можно показать, что именно здесь концы стрессовых волокон прикрепляются к плазматической мембране (рис. 11-37). В фокальном контакте клеточный кортекс соединяется при помощи трансмембранных белков-линкеров с компонентами внеклеточного матрикса (в частности, с фибронектином; см. разд. 14.2.13), которые адсорбированьт на чашке; Типичным трансмембранным линкером является рецептор фибронектина-построенный из двух цепей гликопротеин из группы интегринов (разд. 14.2.17). Его наружный домен связывается с фибронектином, а цитоплазматический соединен с актиновыми филаментами в стрессовых волокнах (рис. 11-38, А). Это соединение непрямое, в нем участвуют еще по меньшей мере четыре прикрепительных белка, в том числе талин и винкулин талин связывается как с цито-плазматическим доменом рецептора фибронектина, так и с винкулином. Ни один из этих белков, однако, прямо с актиновыми филаментами не соединен; по-видимому, с ними непосредственно связаны другие белки: белок, кэпирующий актиновые филаменты, который присоединяется к их плюс-концам, и а-актинин, который в мышцах прикреплен к актиновым, филаментам около плюс-конца в области Z-диска (разд. 11.1.13). Возможное расположение всех этих белков в фокальном контакте показано на рис. 11-38, Б.
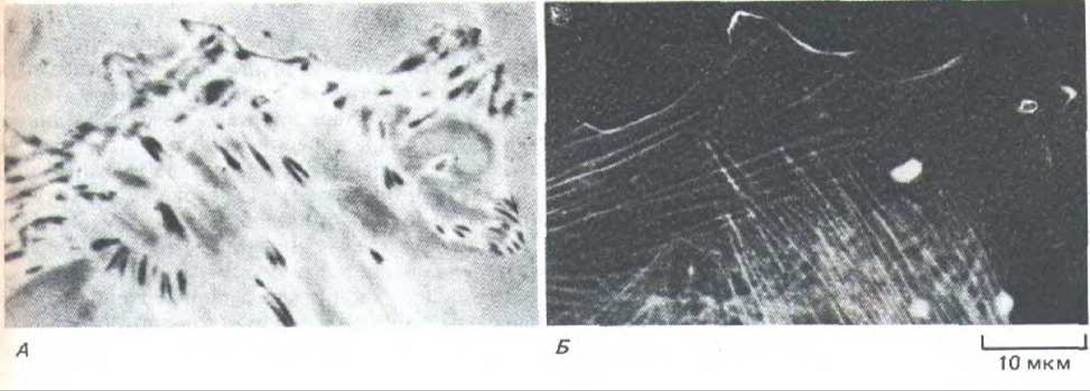
Рис. 11-37. Взаимоотношения междуфокальными контактами и стрессовыми волокнами в фибробласте invitro. Фокальные контакты лучше всего видны в живой клетке при использовании отражательной интерферснционной микроскопии (А). Свет при этом отражается от нижней поверхности клетки, прикрепившейся к предметному стеклу, и фокальные контакты имеют вид темных пятнышек. На фото Б та же клетка окрашена (после фиксации) антителами к актину; видно, что большая часть пучков ее актиновых филамснтов (или стрессовых волокон) оканчивается в фокальных контактах или в непосредственной близости от них. (С любезного разрешения Grenham Ireland.)
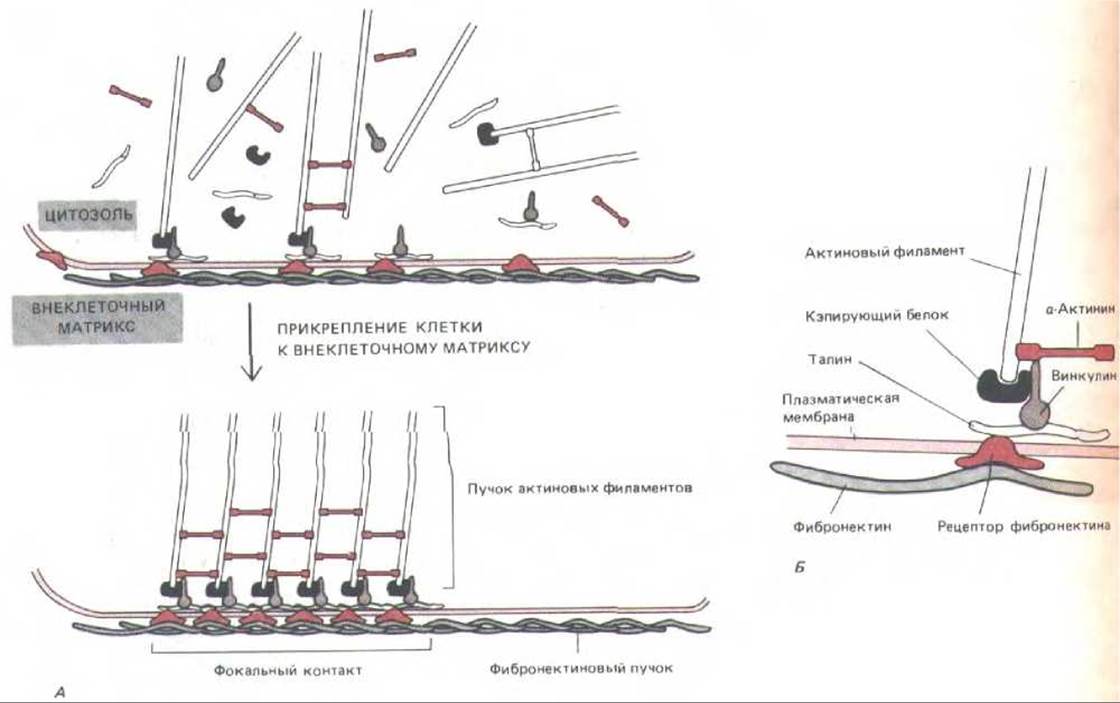
Рис. 11-38. Модель, показывающая, как трансмембранные линкерные гликопротеины плазматической мембраны могут соединять внутриклеточные актиновые филаменты с внеклеточным матриксом в фокальных контактах. Фокальные контакты образуются, когда связывание гликопротеинов матрикса с поверхностью клетки приводит к группировке трансмембранных линкеров в области контакта (А). Справа (Б) показано возможное расположение внутриклеточных прикрепительных белков, осуществляющих связь между трансмембранными гликопротеинами-линкерами (например, рецептором фибронектина) и актиновыми филаментами.
С фокальными контактами весьма сходны места прикрепления актиновых филаментов к плазматической мембране гладкомышечных клеток (разд. 11.1.14). Другая сходная (но уже в меньшей степени) структура - это опоясывающие десмосомы (адгезионные пояса), соединяющие эпителиальные клетки в пласты и позволяющие сократимым пучкам актиновых филаментов взаимодействовать через две смежные плазматические мембраны (разд. 14.1.3). В этих межклеточных контактах имеются винкулин и а-актинин, но нет талина, так что способ присоединения актиновых филаментов к плазматической мембране должен быть несколько иным, чем в фокальных контактах.
До сих пор мы обсуждали такие примеры прикрепления актиновых филаментов к мембране, где филаменты либо играют структурную роль (как в микроворсинках), либо способны передавать на мембрану тянущее усилие (как в фокальных контактах). В обоих этих случаях мы имеем дело с постоянными структурами - продуктами относительно стабильной ассоциации актиновых филаментов. Быстрые же изменения формы клеточной поверхности (например, при движении клетки) часто зависят от кратковременной регулируемой полимеризации актина. Но прежде чем рассматривать механизм быстрого выпячивания плазматической мембраны в результате полимеризации актина, мы сделаем краткое отступление и выясним, что известно о процессах такой полимеризации in vitro.
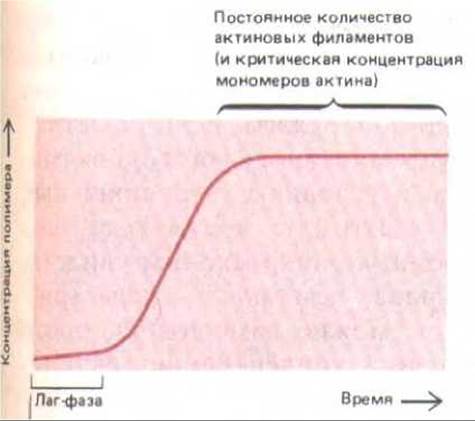
Рис. 11-39. Кинетика полимеризании актина in vitro. Полимеризацию инициируют повышением ионной силы в растворе актина, и она обычно начинается после некоторой вдержки (лаг-фазы).
11-11
11.2.9. Рост актинового филамента происходит главным образом на плюс-конце [25]
Как уже упоминалось, in vitro молекулы актина могут спонтанно полимеризоваться в присутствии АТР, образуя филаменты. Обычно этот процесс инициируют повышением ионной силы раствора актина, а следить за его протеканием проще всего, измеряя увеличение светорассеяния раствора или флуоресценции ковалентне связанного красителя. Полимеризация актина развивается нелинейно - вначале наблюдается лаг-фаза, отражающая первую стадию, самую медленную и затрудненную, в которой три молекулы актина должны соединиться в определенной геометрической конфигурации (рис. 11-39). Эта стадия называется нуклеациеп. Когда нуклеация произошла, дальнейшее присоединение новых молекул актина к концам филамента происходит быстро. Процесс сборки филаментов обратим, и в конце концов концентрация мономеров падает до уровня, при котором скорости ассоциации и диссоциации мономеров становятся равными. Такую концентрацию называют критической. Если быстро разбавить раствор актина так, чтобы концентрация мономеров упала ниже критической, актиновые филаменты начнут распадаться, и их деполимеризация будет продолжаться до тех пор, пока не восстановится критическая концентрация мономеров. Как мы увидим, и нуклеация, и полимеризация актина в клетке находятся под контролем различных актин-связывающих белков, которые и определяют таким образом местоположение и длину актиновых филаментов. У полимеризации актина есть еще одна особенность, которая позволяет объяснить направленность роста филаментов при осуществлении различных клеточных движений. Как мы уже достаточно хорошо знаем, актиновые филаменты обладают полярностью, и важное следствие этой полярности - различная кинетика полимеризации плюс- и минус-концах. Это различие можно обнаружить, если пометить небольшой участок актинового филамента миозиновыми головками, а затем добавить к ним мономеры актина в условиях, благоприятных для полимеризации. Зафиксировав через некоторое время растущие актиновые филаменты, можно под электронным микроскопом увидеть, что их плюс-концы выросли гораздо больше, чем минус-концы (рис, 11-40). Проведя серию таких экспериментов, можно измерить скорость роста обоих концов филамента при различных концентрациях актиновых мономеров. В среде, соответствующей по ионному составу внутриклеточным условиям, очищенные актиновые филаменты растут на плюс-концах в 5-10 раз быстрее, чем на минус-концах. По-видимому, in vivol рост почти всегда происходит на плюс-конце; поэтому, закрепив плюс-конец филамента в определенной ориентации, клетка может предопределить скорость и направление роста филамента.
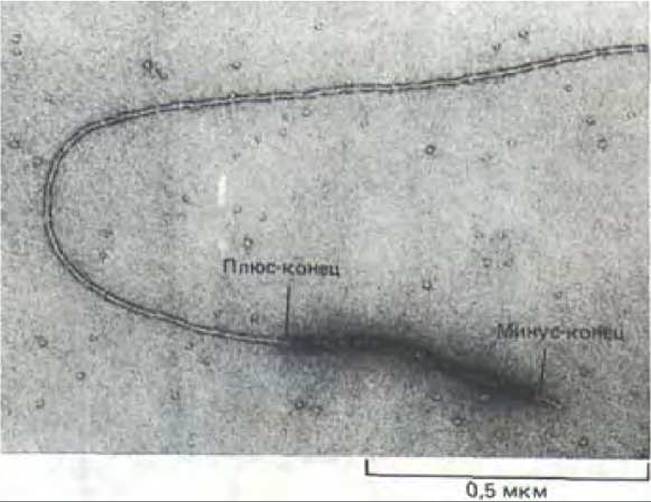
Рис. 11-40. Асимметричный рост актинового филамента. Если в качестве «затравки» для полимеризации актина использовать небольшие фрагменты актиновых нитей, помеченных головками миозина, можно увидеть, что сборка происходит гораздо быстрее на плюс-конце первоначального фрагмента, чем на минус-конце. (С любезного разрешения M.S. Runge, Т. D. Pollard.)
11-12
11.2.10. В актиновых филаментах происходит «тредмиллинг» составляющих их субъединиц [25]
Эксперименты in vitro (вроде показанного на рис. 11-40) говорят о том, что концентрация актина, при которой рост филаментов прекращается, т. е. критическая концентрация, различна для разных концов филамента. Поэтому при полимеризации актина в пробирке достигается стационарное состояние, в котором присоединение мономеров происходит в основном на плюс-конце, а их отделение - на минус-конце. Скорости этих двух процессов в стационарном состоянии одинаковы, и потому концентрация свободных мономеров остается постоянной. Хотя общая длина полимера при этом не изменяется, отдельные молекулы актина непрерывно перемещаются от одного конца филамента к другому (рис. 11-41). Этот процесс, получивший название тредмиллинга, можно сравнить с продвижением людей в очереди.
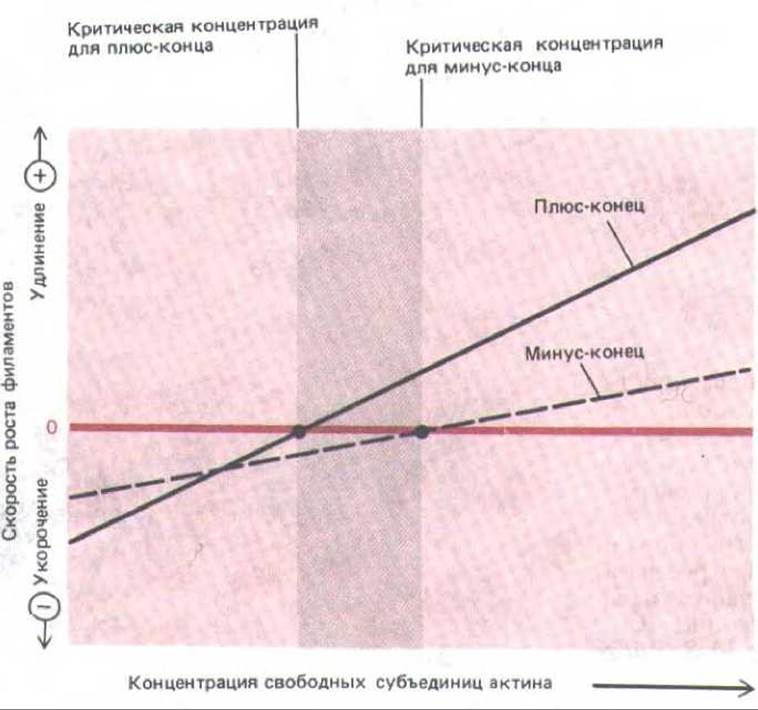
Рис. 11-41. Скорость роста актиновых филаментов на разных концах при различных концентрациях мономеров актина. График показывает, что два конца растут с разными скоростями и критические концентрации для них различны. Поэтому существует некоторый диапазон концентраций свободного актина (темная полоса), при которых плюс-конец актинового филамента полимеризуется, а минус-конец деполимеризуется. Когда in vitro свободный актин находится в равновесии с актиновыми филаментами, в целом роста не происходит, так как скорости отделения молекул от минус-конца и присоединения их к плюс-концу равны. При такой концентрации свободных актиновых субъединиц (промежуточной между критическими концентрациями для двух концов-показано цветной стрелкой) длина филаментов не изменяется, но молекулы актина в них все время движутся от одного конца полимера к другому. Этот процесс называют тредмил-лингом (см. схему 11-1).
Рис. 11-42. Ламеллоподии и микро-шипы на переднем крае человеческого фибробласта, передвигающегося в культуре (микрофотография, ученная с помощью сканирующего электронного микроскопа). Стрелкой указано направление движения. По мере того как клетка продвигается вперед, ламеллоподии и микрошипы перемещаются назад по ее верхней стороне, что создает картину «раффлинга». (С любезного разрешения Julian Heath.)
Для тредмиллинга необходима энергия, иначе на его основе можно было бы создать вечный двигатель - машину, способную совершать работу, не расходуя энергии, т. е. нарушая законы термодинамики. В случае тредмиллинга энергию доставляет гидролиз АТР: каждый мономер актина связывает молекулу АТР, которую после своего присоединения к филаменту быстро гидролизует до ADP и фосфата. Каким образом гидролиз АТР делает возможным тредмиллинг, объясняется на схеме 11-1. Вскоре мы увидим (разд. 11.2.11), что тредмиллинг может быть одним из механизмов, с помощью которого актиновые нити и связанные с ними компоненты выполняют в клетке двигательные функции.
11.2.11. Многие клетки образуют на своей поверхности подвижные структуры, содержащие актин, - микрошипы и ламеллоподии [26]
Динамичные выступы клеточной поверхности с актиновыми филаментами внутри - весьма обычная черта животных клеток, особенно тех, которые в данный момент мигрируют или изменяют свою форму. Культивируемые клетки, например, часто образуют множество тонких жестких выростов толщиной около 0,1 мкм и длиной 5-10 мкм, называемых микрошипами, которые содержат рыхлые пучки примерно из 20 актиновых филаментов, ориентированных плюс-концами наружу. Растущий конец аксона нервной клетки-конус роста - выпускает еще более длинные микрошипы - филоподии, длина которых может достигать 50 мкм (разд. 19.7.7). Эти выступы клеточной поверхности весьма подвижны, они могут очень быстро появляться и исчезать. Видимо, они действуют подобно щупальцам, которыми клетка исследует окружающее пространство; те микрошипы, которые прочно прикрепляются к какому-то субстрату, направляют движущуюся клетку к этому более адгезивному участку, а те, которым прикрепиться не удалось, перемещаются по верхней стороне клетки назад и там втягиваются.
Помимо микрошипов ползущие клетки и конусы роста периодически выбрасывают из своего активно продвигающегося («переднего») края тонкие пластинчатые отростки, получившие название ламеллоподии. Как и микрошипы, одни ламеллоподии успешно прикрепляются к субстрату.
СКОРОСТИ РОСТА НА ПЛЮС- И МИНУС-КОНЦАХ РАЗЛИЧНЫ
Сборка (полимеризация) и разборка (деполимеризация) актиновых филаментов осуществляются путем присоединения и отделения мономеров на концах филамента. В процессе сборки фипамент растет на одном из концов быстрее, чем на другом; быстро растущий конец называют плюс-концом, а медленно растущий - минус-концом. Различие в скоростях роста противоположных концов обусловлено тем, что каждая субъединица, присоединяясь к полимеру, изменяет свою конформацию.
![]()
Это конформационное изменение влияет на присоединение субъединицы преимущественно на одном из концов.

КРИТИЧЕСКАЯ КОНЦЕНТРАЦИЯ СУБЪЕДИНИЦ
Число субъединиц, присоединяющихся к полимеру за 1 с, пропорционально концентрации свободных субъединиц (kacc [C]); в то же время субъединицы диссоциируют от концов полимера с постоянной скоростью (kдисс), от [С] не зависящей. По мере роста полимера свободные субъединицы расходуются и [С] снижается до тех пор, пока не достигает постоянной величины — критической концентрации (Cc), при которой скорость присоединения субъединиц к полимеру равна скорости их отделения от него. В этом состоянии равновесия
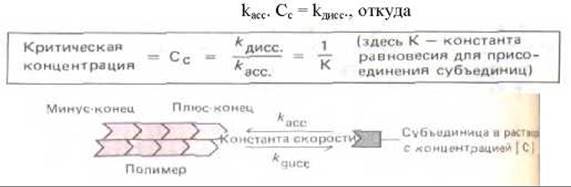
И хотя значения kасс и kдисс для плюс- и минус-концов будут различны, их отношения kдисс/kасс значит и Сс, должны быть одинаковы на обоих концах. Это обусловлено тем, что при отделении субъединицы от любого конца полимера разрушаются совершенно одинаковые связи, а конечные состояния субъединиц после этого тоже идентичны. Таким образом, изменение свободной энергии ДС при отделении субъединицы, определяющее константу равновесия для ассоциации субъединицы С концом (см. табл. 3-3), на обоих концах одно и то же; если плюс-конец растет вчетверо быстрее, чем минус-конец, то и укорачиваться он должен тоже вчетверо быстрее.
Итак, при [С] <С0 оба конца растут;
при [С1 > С0 оба конца укорачиваются (см. рис. 11 41)
ГИДРОЛИЗ АТР ПРИВОДИТ К ИЗМЕНЕНИЮ КОНСТАНТЫ РАСНОВЕСИЯ НА КАЖДОМ ИЗ КОНЦОВ
Каждая молекула актина несет прочно связанную молекулу АТР. Вскоре после коформационного изменения субъединицы актина при ее присоединении к полимеру этот АТР гидролизуется до ADP. который остается прочно связанным с актином.

любого конца. Обычно присоединяется к филаменту форма ![]() а покидает его форма
а покидает его форма ![]() (которая затем в растворе превращается в
(которая затем в растворе превращается в ![]() так что процесс отделения субъединицы от полимера не является просто обращением реакции присоединения.
так что процесс отделения субъединицы от полимера не является просто обращением реакции присоединения.
Расмотрим события, происходящие на плюс-конце:
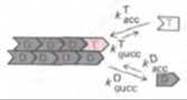
Как и прежде, полимер будет расти, пока [ С ] не снизится до Сс. Для большей наглядности мы можем пренебречь величинами kасс и kдисс как малый; рост полимера прекратится при ![]() Это не истинное равновесие, а стационарное состояние, поскольку гидролизованныи АТР должен быть восполнен путем обмена нуклеотидов на свободной субъединице
Это не истинное равновесие, а стационарное состояние, поскольку гидролизованныи АТР должен быть восполнен путем обмена нуклеотидов на свободной субъединице ![]()
ТРЕДМИЛЛИНГ
Так как kасс и kдасс относятся к различным реакциям, их отношение kдисс/kасс не обязательно будет одинаковым на разных концах полимера. Действительно, оказалось, что гидролиз АТР создает для противоположных концов различные критические концентрации, причем
Сс (для минус-конца) > сс (для плюс-конца).
Если оба конца полимера "открыты", полимеризация будет преобладать, пока [С] не достигнет некоторого уровня выше С для плюсконца и ниже Сс для минус-конца (см. рис. 11-14). В этом стационарном состоянии на плюс-конце будет идти сборка субьединиц в полимер, а на минус-конце — разборка полимера, причем скорости этих процессов будут одинаковы, так что длина полимера не будет изменяться, несмотря на перемещение субъединиц в полимере — тредмиллинг:
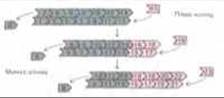
Для сборки филаментов гидролиз АТР не нужен. В подходящих условиях полимеризуются и мономеры актина, несущие негидролизуемый аналог АТР. Однако образующиеся при этом филаменты не способны к тредмиллингу - он возможен лишь благодаря гидролизу АТР, который сопутствует полимеризации. Гидролиз АТР уменьшает сродство субъединицы к соседним субъединицами и тем самым увеличивает вероятность ее отделения от другие же «соскальзывают» и в этом случае тоже волнообразно перемещаются назад по верхней поверхности клетки - этот процесс получил название «раффлинга» (ruffling-волнение, рябь) (рис. 11-42).
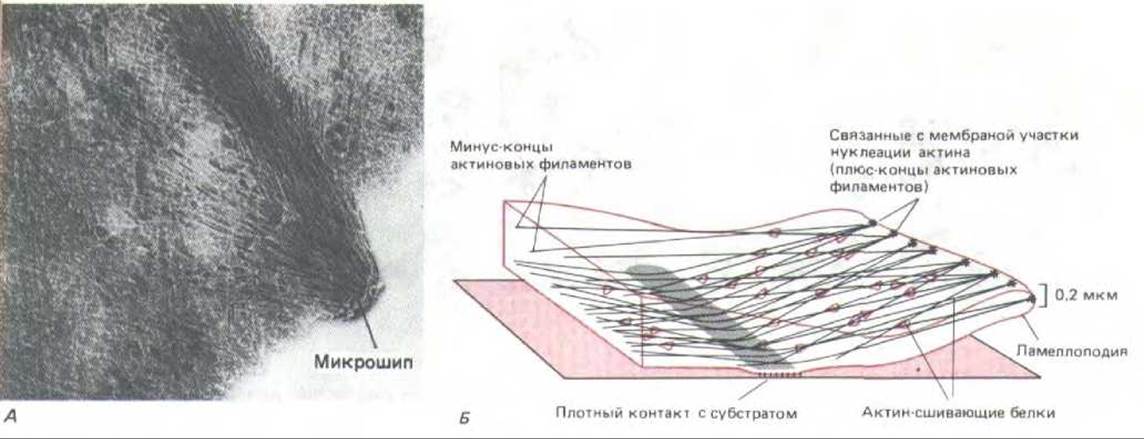
Рис. 11-43. Актиновые филаменты в переднем крае культивируемого фибробласта. А. Электронная микрофотография цельного переднего края клетки, экстрагированной неионным детергентом для удаления плазматической мембраны и основной массы растворимых белков. Обратите внимание на ориентированную сетку актиновых филаментов в ламеллоподии, в которую погружен микрошип. Б. Схема расположения актиновых филаментов ламеллоподии. (А-J.V. Small, J. Cell Biol. 91: 695-705, 1981. С разрешения Rockefeller University Press.)
Ламеллоподию можно рассматривать как двумерный вариант микрошипа; на ее переднем крае нередко находится ряд коротких микрошипов. Если клетку осторожно зафиксировать и окрасить для электронной микроскопии, актиновые филаменты в ламеллоподиях двигавшейся клетки будут выглядеть гораздо более организованными, чем в других участках кортекса; упорядоченные группы филаментов вытянуты к переднему краю, где их плюс-концы упираются в плазматическую мембрану (рис. 11-43).
Исследование движущихся клеток в культуре показывает, что тредмиллинг мономеров в актиновых филаментах на переднем крае клетки идет гораздо быстрее, чем в филаментах, образованных in vitro. Движение молекул актина в клетке можно выявить в экспериментах с «гашением» флуоресценции. Если флуоресцентно меченные молекулы актина инъецировать в движущуюся клетку, они быстро включаются во все актиновые филаменты. Если теперь с помощью лазерного луча разрушить флуоресцирующую метку в небольшом пятнышке на тонком переднем крае клетки, то можно увидеть, как это темное пятнышко постепенно перемещается от края клетки внутрь со скоростью около 0,8 мкм/мин, что указывает на быстрый тредмиллинг молекул актина в филаментах ламеллоподии и микрошипов (рис. 11-44). Очевидно, мономеры актина все время присоединяются к плюс-концам у плазматической мембраны и отделяются от минус-концов в глубине клетки.
Если таким же образом погасить флуоресценцию актиновых филаментов на небольшом участке в любой другой области клетки, свечение через несколько минут восстановится без всякого видимого перемещения: очевидно, в организации или поведении актина в переднем крае клетки есть какие-то особенности. Было высказано предположение, что непрерывная полимеризация актина непосредственно под плазматической мембраной может использоваться для вытягивания переднего края клетки и помогать тем самым ее движению вперед (см. разд. 11.6.5). Изучение механизма перемещения спермиев некоторых беспозвоночных действительно показало участие в этом процессе полимеризации актина.
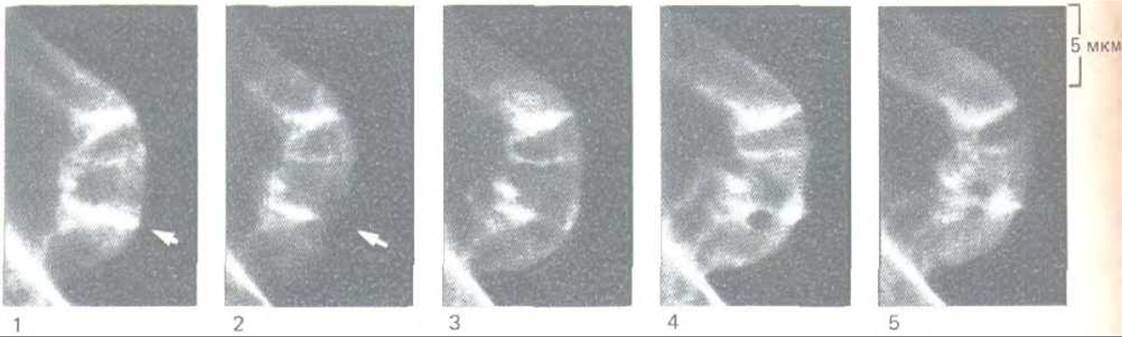
Рис. 11 -44. Тредмиллинг актина в культивируемых фибробластах. Флуоресцирующие молекулы актина были введены путем микроинъекции в клетку, где они включились в актиновые филаменты. Небольшое пятнышко на актиновом филаменте в переднем крае клетки было «погашено» лучом лазера. Затем клетку фотографировали через определенные промежутки времени при помощи флуоресцентного микроскопа с видеоприставкой (разд. 4.1.6). Быстрое перемещение пригашенного пятна назад говорит о том, что молекулы актина непрерывно движутся по филаменту, удаляясь от переднего края.
11-13
11.2.12. Взрывообразная полимеризация актина способствует образованию акросомалыгого отростка у спермиев некоторых беспозвоночных [27]
Хотя появление многих выступов на клеточной поверхности, как полагают, зависит от полимеризации актиновых филаментов, о механизме запуска этого процесса мало что известно. Одно из исключений-акросомальная реакция у спермиев некоторых беспозвоночных (разд. 15.4.1). У спермия голотурии, например, область акросомы (в головке) «битком набита» неполимеризованным актином, связанным с небольшим белком профилином, которого довольно много в большинстве животных клеток. Профилин образует с молекулами актина эквимолярный комплекс и блокирует тем самым стадию нуклеации при самопроизвольной полимеризации актиновых филаментов, однако на рост плюс-концов уже имеющихся филаментов он значительного влияния не оказывает. Когда спермий вступает в контакт с наружной оболочкой яйцеклетки, рН его цитоплазмы возрастает и актин отделяется от профилина. Происходит взрывообразная полимеризация актина, благодаря которой быстро формируется одетый мембраной длинный и тонкий акросомальный отросток, который, как гарпун, прокалывает оболочку яйца, позволяя мембранам яйца и спермия слиться (рис. 11-45). Кроме полимеризации актина вытягиванию акросомального отростка, видимо, способствует также поступление воды в головку спермия, создающее в ней гидростатическое давление.
Процесс образования акросомального отростка указывает на то, что полимеризация актина, вероятно, может вызывать быстрое выпячивание плазматической мембраны, не нарушая ее непрерывности. Хотя маловероятно, что ламеллоподии и микрошипы образуются за счет изменения доступного для полимеризации пула мономеров актина, все же выпячивание их, по-видимому, происходит точно так же - благодаря локальному росту актиновых филаментов у самой плазматической мембраны.
11.2.13. Сборка актина находится под контролем плазматической мембраны [28]
Клетка должна каким-то образом регулировать образование актинсодержащих выростов на своей поверхности, чтобы они появлялись только там, где нужно, и тогда, когда нужно. Например, макрофаг выпускает псевдоподии для захвата бактерии только в области контакта с ней (разд. 6.5.15), а полимеризация актина, помогающая выбросу акросомального отростка у активированного спермия голотурии, происходит лишь тогда, когда головка спермия соприкасается со студенистым слоем на поверхности яйца.
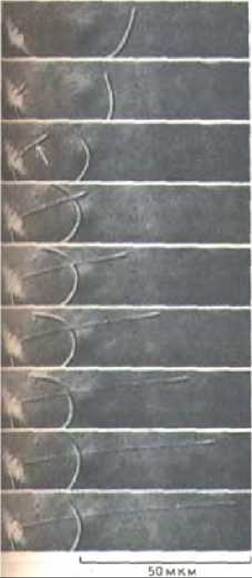
Рнс. 11-45. Последовательные стадии удлинения акросомального отростка у спермия голотурии. Фотографии сделаны с помощью светового микроскопа, первая - через 2 с после искусственной стимуляции акросомальной реакции, остальные - с интервалами 0,75с. Дуга справа от головки спермия - часть его изогнутого хвоста, попавшая в поле зрения. (L. G. Tilney, S, Inoufe, J. Cell Biol. 93: 820-827, 1982. С разрешения Rockefeller University Press.)
«Время и место» для таких актин-зависимых ответов, по-видимому, регулируются путем контроля над участками нуклеации для роста актиновых филаментов около плазматической мембраны. В качестве иллюстрации можно взять хемотаксическую реакцию нейтрофилов. При местной бактериальной инфекции эти фагоцитирующие лейкоциты в больших количествах проникают сквозь стенки кровеносных капилляров и ползут сквозь ткани, пробираясь к очагу инфекции. К цели их направляют небольшие, свободно диффундирующие молекулы, которые высвобождаются в инфицированном участке. Процесс этот носит название хемотаксиса: клетки «чувствуют» градиент химического вещества и реагируют на него, изменяя направление своего движения. На поверхности нейтрофилов имеются белки-рецепторы, с помощью которых они могут обнаруживать очень низкие концентрации (~10-10 М) специфических хемоаттрактантов. При благоприятных условиях нейтрофилы способны воспринимать разницу концентраций пептида-хемоаттрактанта на противоположных сторонах клетки всего лишь в 1 % и соответствующим образом переориентировать свой передний край, чтобы двигаться вверх по градиенту.
Некоторый свет на то, как связаны активация рецепторов и переориентация, пролили эксперименты, где изучали реакцию нейтрофилов на внезапное повышение концентрации пептида-хемоаттрактанта. Нейтрофилы при этом начинали выбрасывать микрошипы и ламеллоподии по всей своей поверхности, а доля полимеризованного актина в клетке за 20 секунд возрастала с 30 до 60%. Такая быстрая полимеризация актина происходила, вероятнее всего, благодаря увеличению числа участков нуклеации в плазматической мембране: когда такие обработанные хемоаттрактантом клетки подвергали лизису, лизат обладал повышенной способностью к нуклеации роста актиновых филаментов in vitro; кроме того, каждый активированный рецептор клеточной поверхности индуцировал рост значительного числа актиновых филаментов. К роли контролируемой полимеризации актина в направленной миграции клеток мы вернемся позже, когда будем рассматривать клеточную подвижность как интегрированный ответ целой клетки (разд. 11.6.3).
11.11.
11.2.14. Некоторые вещества влияют на поведение клеток, изменяя состояние полимеризации актина [29]
Можно было бы думать, что многие из производимых клеточным кортексом движений, как, например, фагоцитоз или локомоция, зависят от динамического равновесия между свободным (неполимерным) актином и актиновыми филаментами. Однако по сравнению со «взрывными» изменениями, происходящими в активированном спермин, изменения в полимеризации актина при этих движениях обычно слишком малы и краткоеременны, чтобы их легко было обнаружить. Однако на важную роль полимеризации и деполимеризации актина в таких движениях указывают эффекты ряда веществ, которые предотвращают изменения в состоянии актина и тем самым нарушают его двигательную функцию. Например, цитохалазины (рис. 11-46) - семейство метаболитов, выделяемых различными плесневыми грибами, - подавляют многие формы подвижности клеток позвоночных, включая локомоцию, фагоцитоз, цитокинез, образование ламеллоподии и микрошипов и сворачивание эпителиальных пластов в трубки. В то же время эти вещества не влияют на расхождение хромосом в митозе, которое зависит в основном от функции микротрубочек веретена, и на мышечное сокращение, в котором участвуют стабильные актиновые филаменты, не подвергающиеся сборке и разборке. Главная «точка приложения» для цитохалазинов - быстро растущие плюс-концы актиновых филаментов, с которыми цитохалазины специфически связываются и блокируют присоединение к ним новых мономеров актина.
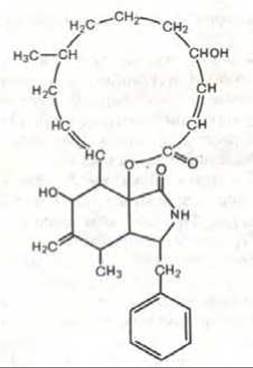
Рис. 11-46. Химическая структура цитохалазина В.
Фаллоидин - высокотоксичный алкалоид бледной поганки (Amnita phalloides) - в отличие от цитохалазинов стабилизирует актиновые филаменты, подавляя их деполимеризацию. Однако он очень плохо проникает сквозь плазматическую мембрану, и для того, чтобы он подействовал, его нужно вводить в клетку путем микроинъекции. При таком способе введения фаллоидин блокирует миграцию как амеб, так и культивируемых клеток позвоночных, что указывает на ключевую роль динамической сборки-разборки актиновых филаментов в этой форме подвижности. Так как фаллоидин специфически связываете именно с нитями актина, его флуоресцентные производные часто используют вместо антител к актину для выявления актиновых филаментов в клетке.
11.2.15. Свойства клеточного кортекса зависят от баланса кооперативных и конкурентных взаимодействий обширной группы актин-связывающих белков
Об актин-связывающих белках сейчас известно куда больше, чем о белках, взаимодействующих с двумя другими важными видами нитчатых цитоскелетных структур - промежуточными филаментами и микротрубочками. Наши знания о тех актин-связывающих белках немышечных клеток позвоночных, которые мы рассмотрели в этой главе, резюмированы на рис. 11-47. Эта картина далека от завершения; каждая из указанных здесь функциональных категорий включает несколько их представителей, свойства которых слегка различаются. Кроме того, известны актин-связываюшие белки без каких-либо очевидных функций, и несомненно также, что существуют еще не открытые актин-связывающие белки. В частности, клетки должны как-то различать противоположные концы актиновых филаментов и контролировать их ориентацию и местонахождение в цитоплазме. По-видимому, в механизмах такого различения используются «кэшрующие белки», которые избирательно связываются с плюсконцами актиновых филаментов, удерживают их вблизи плазматической мембраны и регулируют присоединение мономеров актина. В отличие от этого минус-концы, относительно инертные в отношении как полимеризации, так и деполимеризации, возможно, часто остаются «открытыми». Немало еще предстоит узнать о природе мембраносвязанных центров организации актина; например, почти ничего не известно о молекулярной природе электроне плотного вещества в кончиках микроворсинок, которое, по-видимому, ответственно за организацию актиновой сердцевины этих выступов и за контроль их роста и регенерации (разд. 11.2.7).
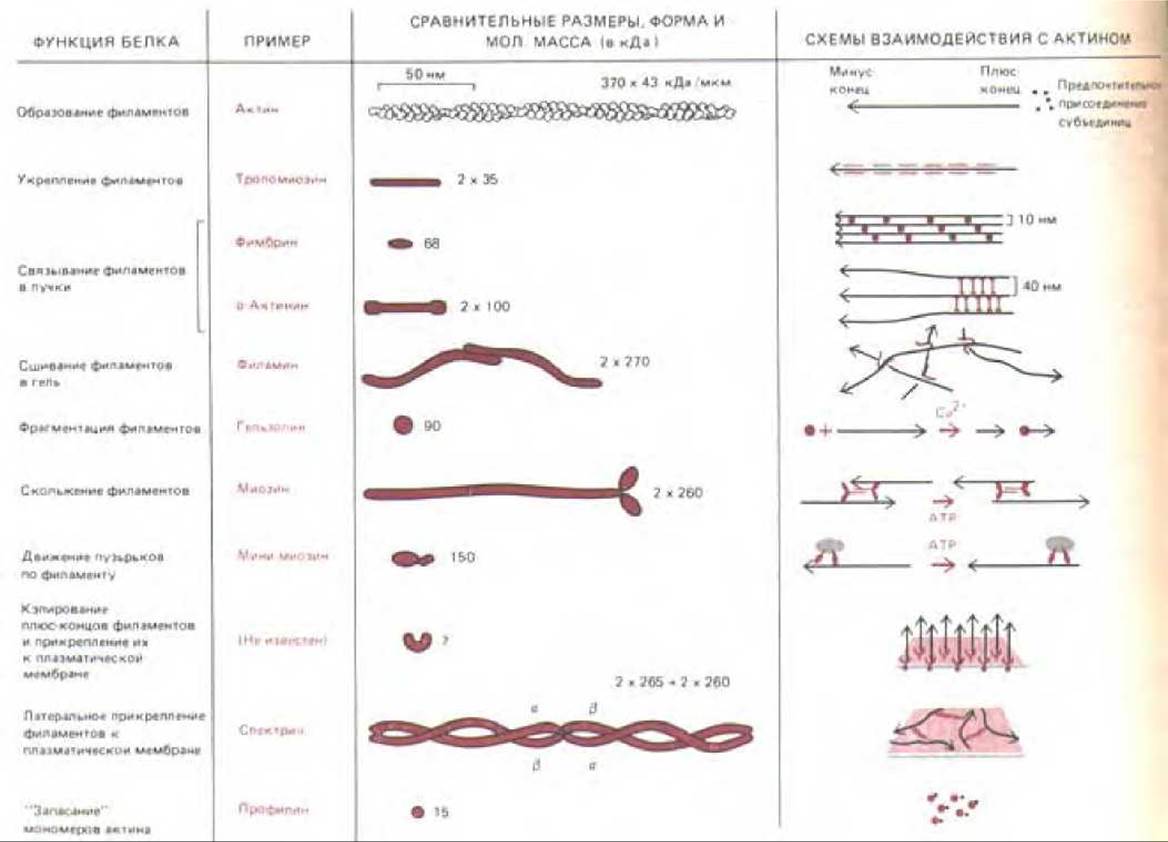
Рис. 11-47. Некоторые главные классы актин-связывающих белков, имеющихся в большинстве клеток позвоночных.
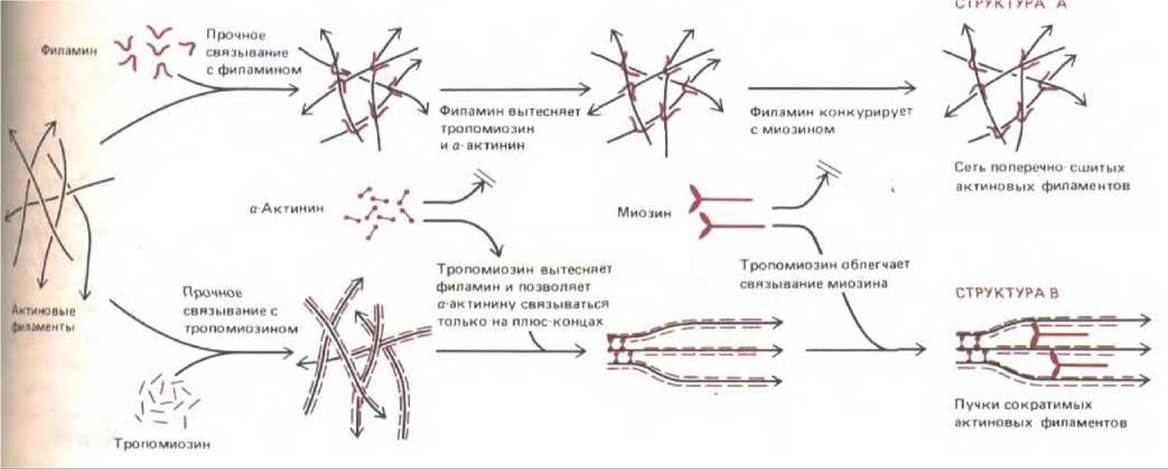
Рис 11-48. Некоторые примеры конкурентных и кооперативных взаимодействий между актин-связывающими белками. Тропомиозин и филамин прочно связываются сатиновыми филаментами, но при этом конкурируют друг с другом. Так как тропомиозин связывается с актиновыми нитями кооперативно, на обширных участках их сети будет преобладать либо тропомиозин, либо филамин. Другие актин-связывающие белки, такие как и актинин или миозин, будут конкурентно вытесняться из специфических участков; например, а-актинин in vitro связывается по всей длине очищенных актиновых филаментов, но с такими же филаментами в клетке он связывается относительно слабо - там он находится в основном вблизи плюс-концов из-за конкуренции с другими белками. Напротив, кооперативные взаимодействия могут усиливать связывание; так, тропомиозин, по-видимому, способствует связыванию миозина. Как полагают, множество подобных взаимодействий между актин-связывающими белками, представленными на рис. 11-47 (и некоторыми другими), обусловливает необычайное многообразие актиновых структур во всех эукариотических клетках.
Даже после того, как все компоненты актиновых сетей будут идентифицированы, останется еще более трудная задача - выяснить, к каким последствиям приводят их многочисленные взаимодействия. Белки, представленные на рис. 11-47, связываются с актином не одновременно и не случайным образом: они кооперируются или(и) конкурируют друг с другом, благодаря чему и возникает упорядоченная картина их взаимоотношений, столь важная для клетки (рис. 11-48). Кроме того, взаимодействия компонентов сети модулируются локальными изменениями в концентрациях ионов и механическими силами, растягивающими или сжимающими сеть и тем самым сдвигающими ее компоненты относительно друг друга. В связи с этим понятно, что изучение всей этой ключевой части цитоскелета находится еще в начальной стадии.
Заключение
В эукариотических клетках имеется особый кортикальный слой акт новых филаментов, лежащий непосредственно под плазматической мембраной. В целом он представляет собой однородную трехмерную сеть обладающую благодаря поперечным сшивкам, свойствами геля. Вместе с тем кортикальные актиновые филаменты образуют и ряд специализированных структур. Например, пучки актиновых филаментов, находящихся в комплексе с миозином, прикрепляются к плазматической мембране и обеспечивают клетку структурами, способными к сокращению. В других участках контролируемая полимеризация актиновых филаментов на их плюс-концах способна выпячивать плазматическую мембрану наружу, создавая подвижные выступы клеточной поверхности. Разнообразие структур кортекса и выполняемых ими функций зависит от обширного спектра актин-связывающих белков, которые сшивают актиновые филаменты в рыхлый гель, объединяют их в жесткие пучки, движутся по актиновым филаментам, создавая механическое усилие, или прикрепляют их к плазматической мембране. Некоторые из белков, выполняющих эту последнюю функцию, прикрывают плюс-концы актиновых филаментов, контролируя тем самым их полимеризацию и деполимеризацию в клетке. Именно этим белкам, как полагают, принадлежит ключевая роль в сложных движениях клеточной поверхности, например при фагоцитозе или при перемещении клеток по субстрату.