Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Цитоскелет
Цитоплазматические микротрубочки
Почти во всех животных клетках актин и тубулин содержатся в больших количествах, но тубулина в них все же, как правило, меньше. Кроме того, поскольку микротрубочки толще, чем актиновые филаменты, для образования полимера одинаковой длины тубулина требуется примерно в 10 раз больше, чем актина (см. табл. 11-4). Поэтому общая длина актиновых филаментов в клетке по крайней мере в 30 раз больше общей длины микротрубочек. Это отражает фундаментальную разницу в структурной организации и функциях этих двух цитоскелетных полимеров: в то время как актиновые филаменты образуют соединенные сшивками сети и небольшие пучки в периферической цитоплазме, микротрубочки обычно существуют в виде отдельных нитей, которые расходятся в стороны через всю цитоплазму из небольшой области вблизи ядра. Микротрубочки образуют систему волокон, по которой могут перемещаться различные пузырьки и другие органеллы, ограниченные мембраной; тем самым они влияют на полярность клетки, могут регулировать ее форму и движение и определяют ориентацию плоскости клеточного деления.
11.4.1. Микротрубочки - это высоколабильные структуры, чувствительные к антимитотическим агентам [41]
Многие системы микротрубочек в клетках весьма лабильны, причем эта лабильность важна для их функции. Один из наиболее ярких примеров-митотическое веретено, которое образуется после того, как в начале митоза микротрубочки цитоплазмы распадаются (разд. 13.5.2).
Рис 11-61. Химическая структура колхицина.

Рис. 11-62. Полярность микротрубочек, выявленная методом «навешивания крючков». В данной группе все микротрубочки (они видны на этой электронной микрофотографии в поперечном разрезе) имеют одинаковую полярность. Крючки, образованные присоединившимися сбоку молекулами тубулина, изогнуты по часовой стрелке, и это означает, что мы смотрим на микротрубочки вдоль в направлении от плюс-конца к минус-концу. Полярность микротрубочки можно также выявить путем присоединения молекул динеина (не показано). (По U. Euteneuer, Cell Muscle Motil. 5: 1-82, 1984, с изменениями.)
Таблица 11-3. Некоторые вещества, связывающиеся с тубулином (антимитотические агенты)
|
Вещество |
Механизм действия |
|
Колхицин, колцемид, нокодазол |
Ингибируют присоединение молекул тубулина к микротрубочкам, вызывая деполимеризацию последних |
|
Винбластин, винкристин |
Вызывают образование паракристаллических агрегатов тубулина, что приводит к деполимеризации микротрубочек |
|
Таксол |
Стабилизирует микротрубочки, прочно связываясь с полимером |
Микротрубочки митотического веретена пребывают в состоянии необычайно быстрой сборки и разборки, что объясняет крайнюю чувствительность веретена к различным препаратам, способным связываться с тубулином (разд. 13.5.2). Один из алкалоидов безвременника осеннего, колхицин, использовался в лечебных целях еще древними египтянами. Молекулы колхицина (рис. 11-61) прочно связываются с молекулами тубулина (образуя эквимолярный комплекс) и препятствуют тем самым их полимеризации; поэтому обработка делящихся клеток колхицином вызывает через несколько минут исчезновение митотического веретена и блокирует клетки в митозе. Вещества, обладающие подобным действием, называются антимитотическими агентами (табл. 11-3). Во многих случаях их действие обратимо, и удаление препарата дает возможность веретену образоваться вновь, а митозу завершиться. Так как разрушение микротрубочек веретена избирательно убивает многие быстро делящиеся клетки, ряд антимитотических препаратов, в частности вин-бластин и винкристин, широко используются в терапии рака.
Другое вещество - таксол - оказывает противоположное действие. Он прочно связывается с микротрубочками и стабилизирует их. Будучи добавлен к клеткам, он заставляет значительную часть тубулина включиться в микротрубочки. Подобно тому как стабилизация актиновых филаментов фаллоидином останавливает миграцию клеток, стабилизация микротрубочек таксолом фиксирует делящиеся клетки в митозе.
Так же как и полимеризация актиновых филаментов, сборка микротрубочек имеет сложную кинетику, что играет важную роль во многих клеточных процессах. Большая часть наших знаний о динамическом поведении микротрубочек была получена при изучении полимеризации очищенного тубулина in vitro.
11.4.2. Противоположные концы микротрубочек различны и растут с разной скоростью [42]
Мы уже говорили о том, что микротрубочки обладают полярностью: мономеры тубулина в них определенным образом ориентированы. Как и в случае актиновых филаментов, структурная полярность микротрубочек обусловливает различия между их двумя концами, важные для понимания того, как образуются микротрубочки в клетках. Если растворенному тубулину дать возможность некоторое время полимеризоваться на фрагментах аксонемы, а затем исследовать в электронном микроскопе то, что получилось, будет видно, что одни концы микротрубочек удлиняются втрое быстрей других. Быстро растущие концы были названы плюс-концами, а медленно растущие - минус-концами.
Полярность микротрубочек можно определить и на их поперечных срезах, если предварительно добавить к ним растворенные молекулы тубулина; в определенных условиях мономеры тубулина будут присоединяться к микротрубочкам не с концов, а с боков, образуя искривленные листки из протофиламентов. На поперечном срезе эти листа напоминают крючья, загнутые в ту или другую сторону в зависимости от полярности микротрубочки (рис. 11-62). Таким способом, например, удалось показать, что в аксонах нервных клеток и в ресничках все микротрубочки имеют одинаковую полярность: те их концы, что расположены дальше от тела клетки, всегда бывают плюс-концами. Когда микротрубочки растут от центров их организации (от центросом или полюсов веретена), их плюс-концы тоже всегда обращены вперед по направлению роста (рис. 11-63).
11-23
11.4.3. Гидролиз нуклеотида усиливает нестабильность медленно растущих микротрубочек [43]
В некоторых отношениях сборка молекул тубулина в микротрубочкя напоминает полимеризацию актина. Она самопроизвольно протекает in vitro и в норме сопровождается гидролизом одной молекулы связанного нуклеотида на каждый присоединенный мономер (нуклеотид в случае сборки тубулина - не АТР, a GTP, см. табл. 11-4). Энергия, освобождаемая при гидролизе нуклеотида, для полимеризации не нужна: тубулин благополучно полимеризуется и тогда, когда с ним связан негидролизуемый аналог GTP-GTPyS. Однако гидролиз нуклеотида приводит к тому, что критическая концентрация для полимеризации на плюс-конце оказывается ниже, чем для полимеризации на минус-конце; иными (словами, с плюсконцом мономеры актина или тубулина связываются прочнее (см. схему 11-1 в разд. 11.2.10). Благодаря этому в случае актиновых филаментов возможен непрерывный тредмиллинг субъединиц по полимеру (разд. 11.2.10). Хотя в принципе тредмиллинг может происходить и в микротрубочках, фактически здесь, видимо, доминирует явление, получившее название динамической нестабильности.
Динамическую нестабильность можно продемонстрировать просто с помощью светового микроскопа, оборудованного темнопольной оптикой и видеоприставкой, наблюдая за процессом сборки микротрубочек из очищенного тубулина на предметном стекле. В этих условиях видно, что концы отдельных микротрубочек либо медленно растут, либо быстро укорачиваются; каждая стадия длится многие секунды, а переход от роста к укорочению и обратно происходит случайным образом
Таблица 11-4. Сравнение полимеров актина и тубулина
|
Актин |
Тубулин |
|
|
Мол. масса полипептида |
42000 |
50000 (а-тубулин) 50000 (ß-тубулин) |
|
Неполимерная форма |
Глобулярный мономер |
Глобулярный димер (1а + 1ß) |
|
Нуклеотид, связываемый неполимерной формой |
АТР (1 на мономер) |
GTP (2 на димер) |
|
Структура полимера |
Спиральная нить |
Полая трубка из 13 протофиламентов |
|
Толщина фибриллярной структуры |
8 нм |
25 нм |
|
Число субъединиц на 1 мкм длины полимера |
370 мономеров |
1600 димеров |
|
Мол. масса на 1 мкм длины полимера |
370 х 42000 = 15,5 х 106 |
1600 х 100000 =160 х 106 |
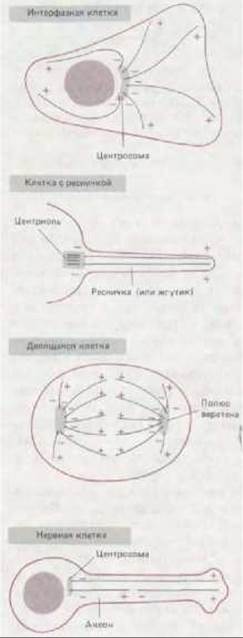
Рис. 11-63. Минус-концы микротрубочек в клетках обычно находятся в центре организации микротрубочек, а плюс-концы часто располагаются вблизи плазматической мембраны.
НАБЛЮДАЕМОЕ ПОВЕДЕНИЕ МИКРОТРУБОЧЕК
Микротрубочки - динамичные структуры, и процессы их сборки и разборки определяют, где и когда они будут существовать в клетке. Подобно актиновым филаментам, они растут за счет обратимого присоединения субъединиц, которое сопровождается их информационным изменением и гидролизом нуклеотида (см. схему 11-1 в разд. 11.2.10). Однако полимеризация микротрубочек имеет некоторые особенности, отличающие ее от сборки актиновых филаментов.
В клетках минус-концы микротрубочек прочно связаны с центрами организации микротрубочек, что предотвращает (или контролирует) сборку и разборку субъединиц на этих концах (разд. 11.4.4). Поэтому мы будем рассматривать только плюс-концы. In vitro плюс-конец отдельной микротрубочки самопроизвольно переходит от состояния медленного роста к состоянию быстрого укорочения и обратно, причем каждое состояние продолжается много секунд. В любой данный момент популяция микротрубочек в целом состоит из полимеров двух типов, переходы между которыми происходят относительно медленно:

Это поведение, названное динамической нестабильностью, можно объяснить, если вспомнить, как влияет на полимеризацию задержка гидролиза GTP.
СТРУКТУРНАЯ ОСНОВА ДИНАМИЧЕСКОЙ НЕСТАБИЛЬНОСТИ
Изменения, которые происходят с молекулами тубулина при их полимеризации, в основе своей такие же, как и в случае с актином. Поэтому мы воспользуемся теми же обозначениями, что и в схеме ![]() будет означать мономер, несущий GTP,
будет означать мономер, несущий GTP, ![]() — субъединицу в составе полимера, уже претерпевшую конформационное изменение, но все еще с GTP (до его гидролиза), а
— субъединицу в составе полимера, уже претерпевшую конформационное изменение, но все еще с GTP (до его гидролиза), а ![]() - субъединицу в составе полимера, несущую GDP (после гидролиза GTP). Поскольку гидролиз GTP осуществляется лишь после включения субъединицы в полимер, субъединицы типа
- субъединицу в составе полимера, несущую GDP (после гидролиза GTP). Поскольку гидролиз GTP осуществляется лишь после включения субъединицы в полимер, субъединицы типа ![]() будут обычно обнаруживаться только на растущем конце мТІкротрубочки. Эта "шапка" из субъединиц типа
будут обычно обнаруживаться только на растущем конце мТІкротрубочки. Эта "шапка" из субъединиц типа ![]() должна быть тем больше, чем быстрее растет трубочка:
должна быть тем больше, чем быстрее растет трубочка:

Так как субъединицы типа ![]() диссоциируют легче, чем
диссоциируют легче, чем ![]() всякий конец, потеряв "шапку" из
всякий конец, потеряв "шапку" из ![]() начнет терять субъединицы (деполимеризоваться) с большей скоростью. (От конца с
начнет терять субъединицы (деполимеризоваться) с большей скоростью. (От конца с ![]() микротрубочки отделяются примерно в 100 раз быстрее, чем от конца с
микротрубочки отделяются примерно в 100 раз быстрее, чем от конца с ![]() Поэтому, если началась быстрая деполимеризация, новой
Поэтому, если началась быстрая деполимеризация, новой ![]() шапке образоваться трудно. Вдобавок микротрубочки, видимо, могут претерпевать дальнейшее структурное изменение, в результате которого они теряют способность легко присоединять субъединицы тубулина.
шапке образоваться трудно. Вдобавок микротрубочки, видимо, могут претерпевать дальнейшее структурное изменение, в результате которого они теряют способность легко присоединять субъединицы тубулина.

В показанном здесь случае "шапка" на микротрубочке зачастую так и не образуется, и тогда микротрубочка продолжает укорачиваться вплоть до полного распада.
У ОТДЕЛЬНОЙ МИКРОТРУБОЧКИ СТАЦИОНАРНОЕ СОСТОЯНИЕ ОТСУТСТВУЕТ
При стационарном состоянии концентрация свободных субъединиц - [С] -постоянна, так что
[доля укорачивающихся микротрубочек] х [скорость деполимеризации] =
= [доля растущих микротрубочек] х [скорость полимеризации]
Так как скорость деполимеризации гораздо выше скорости роста, в любой момент времени много микротрубочек растет и лишь малая доля их укорачивается. Критической концентрации свободного тубулина, при которой отдельная микротрубочка имела бы неизменную длину, просто не существует; вместо этого в широком диапазоне [С] мы находим смесь растущих и укорачивающихся микротрубочек. Хотя при высоких [С] наблюдаемая доля растущих микротрубочек возрастает, каждая отдельная микротрубочка (в отличие от актинового филамента) никогда не достигает стабильного "стационарного состояния".
ВАЖНОСТЬ "ЗАЩИТЫ" КОНЦОВ ПОЛИМЕРА
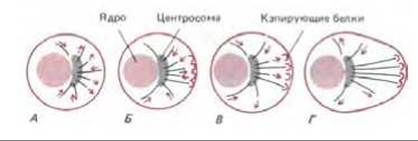
Из-за своей динамической нестабильности вновь организованная микротрубочка сможет сохраниться лишь в том случае, если оба конца защищены от деполимеризации. Минус-концы микротрубочек в клетках обычно защищены тем центром организации микротрубочек, из которого они растут, а некоторые плюс-концы, как полагают, прикрыты специальными белками, контролирующими стабильность, а тем самым и расположение микротрубочек в клетке. Так, в неполяризованной клетке (А) новые микротрубочки могут расти и укорачиваться равновероятно во всех направлениях от центросомы. Затем какая-то часть их вступает в определенном участке в контакт со структурами клеточного кортекса, которые могут кэпировать свободные плюс-концы микротрубочек (Б). Избирательная стабилизация тех микротрубочек, которые случайно столкнулись с этими кэпирующими структурами, приведет в результате к быстрому перераспределению всей массы микротрубочек и превращению клетки в полярную (В и Г).
Схема 11-2. Полимеризация микротрубочек.
Вообще говоря, можно было бы ожидать, что и актиновые филаменты будут проявлять динамическую нестабильность. Однако концы этих филаментов устроены много проще, чем концы микротрубочек, и сами филаменты, судя по всему, так легко переходят от фазы роста к фазе укорочения и обратно, что их поведение выглядит иначе — см. схему 11-1.
(рис. 11-64). Вероятное объяснение этой динамической нестабильное приведено на схеме 11-2. Как полагают, это следствие «запаздывающего» гидролиза GTP, происходящего при сборке микротрубочки. При ее быстром росте присоединение молекул тубулина к полимеру идет быстрее, чем гидролиз связанных с ними молекул GTP. В результате на растущем конце микротрубочки образуется «шапочка» из GTP; а так как молекулы тубулина, несущие GTP, связываются между собой с большим сродством, чем несущие GDP, эта «шапочка» благоприятствует дальнейшему росту микротрубочки. Если же микротрубочка почему-либо лишится своей шапочки из GTP (например, вследствие замедлении полимеризации), то она начнет укорачиваться и будет склонна продолжать укорачиваться и дальше. Следует отметить, правда, что укорочению микротрубочек, по-видимому, существенно способствуют и другие факторы, например устойчивое искажение упаковки тубулина, обычно возникающее на конце микротрубочки (см. схему 11-2).
Как мы сейчас увидим, динамическая нестабильность позволяет клетке контролировать расположение своих микротрубочек с помощью специальных цитоплазматических структур, которые связываются с концами микротрубочек и стабилизируют их.
11-24
11.4.4. Большинство микротрубочек в животных клетках растет от центросомы, которая служит центром организации микротрубочек [44]
Микротрубочки в цитоплазме интерфазной клетки, растущей in vitro, можно увидеть, если клетку зафиксировать и окрасить флуоресцентными антителами к тубулину. Наиболее густо они расположены вокруг ядра, откуда расходятся радиально к периферии в виде тонких переплетенных нитей (рис. 11-65, А). Откуда начинается рост микротрубочек в клетке, становится ясно, если их деполимеризовать с помощью колхицина, а затем позволить вырасти заново (рис. 11-65, Б). Регенерирующие микротрубочки вначале появляются в виде небольшой околоядерной лучистой структуры, называемой звездой. Затем ее лучи удлиняются по направлению к периферии клетки, пока не восстановится их первоначальное распределение. Если пометить микротрубочки культивируемой клетки тубулиновыми «крючками» (для определения полярности), можно увидеть, что у всех у них плюс-концы обращены в сторону от центра организации микротрубочек - точки, в которой образуется звезда, Главным центром образования микротрубочек почти во всех животных клетках служит клеточный центр, или центросома. Центросома расположена сбоку от ядра и содержит пару центриолей, лежащих под прямым углом друг к другу (в форме буквы L, см. рис. 11-60). Однако не во всех центрах организации микротрубочек есть центриоли. Например, в митотических клетках высших растений концы микротрубочек погружены в слабо структурированную электроноплотную область, где никаких центриолей нет. Центриоли не обнаруживаются также в мейотическом веретене мышиных ооцитов, хотя позже в ходе развития эмбриона они появляются.

Рис. 11-64. Изменения длины одной микротрубочки, выявленные с помощью видеосъемки в темном поле микроскопа. Изображения регистрировали с интервалом 1 -2 мин и располагали в последовательном порядке на экране монитора. Два конца проходят через циклы удлинения и укорочения независимо, причем флуктуации на плюс-конце сильнее. (Т. Ноrіо и Н. Hotani, Nature 321: 605-607, 1986.)
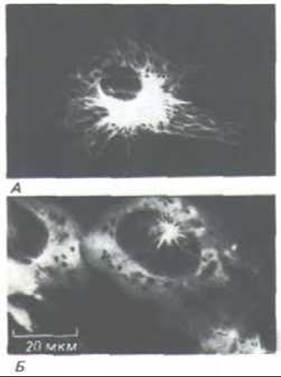
Рис. 11-65. Распределение микротрубочек в культивируемых клетках (иммунофлуоресцентные микрофотографии, окраска антителами к тубулину). А. Нормальная клетка. Б. Клетки были обработаны колцемидом в течение часа, чтобы деполимеризовать их микротрубочки, после чего им дали возможность восстановиться: микротрубочки появляются вначале как маленькие звездочки, а затем удлиняются по направлению к периферии клетки. (А-с любезного разрешения Eric Karsenti и Marc Kirschner; Б-из М. Osborn, К. Weber, Ргос. Natl. Acad. Sci. USA 73: 867-871, 1976.)
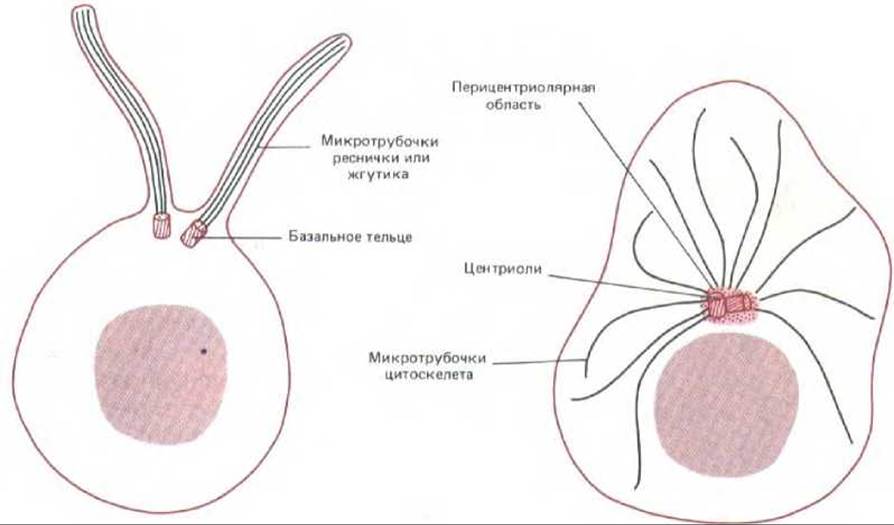
Рис. 11-66. Центриоли могут быть центрами организации для систем микротрубочек совершенно разного типа. Две центриоли в клетке слева служат базальними тельцами для аксонем ресничек, тогда как в клетке справа две центриоли образуют часть организующего центра (центросомы) для микротрубочек, радиально расходящихся по всей цитоплазме. Обратите внимание, что во втором случае микротрубочки растут не из самой центриоли, а из аморфного перицентриолярного материала.
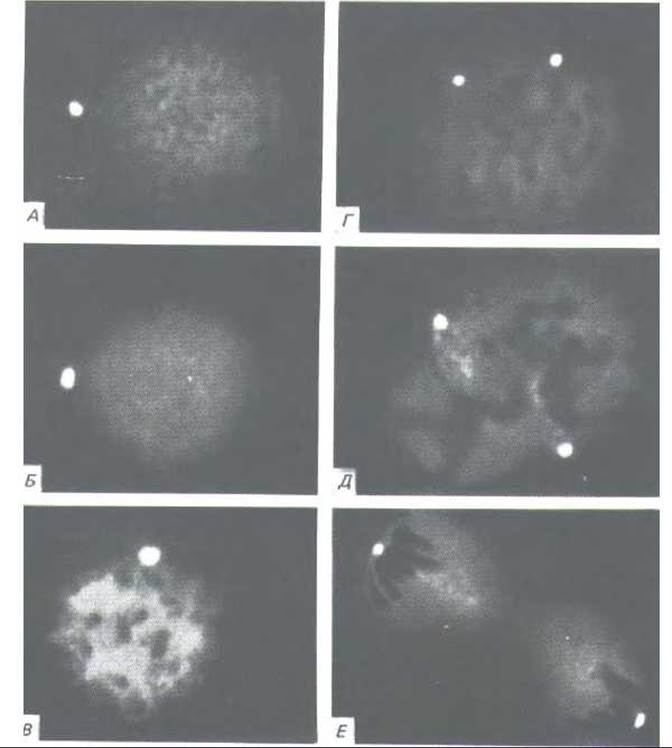
Рис. 11-67. Центросоми в интерфазных и митотических животных клетках, окрашенных флуоресцентными антителами к центросомному белку. Эти микрофотографии иллюстрируют удвоение и расхождение центросом в процессе деления клетки. А и Б-интерфаза; В и Г-профаза; Д-метафаза; Е-телофаза. Описание стадий митоза см. в разд. 13.5.1. (S. L. Brenner, B.R. Brinkley, Cold Spring Harbor Symp. Quant. Biol. 46: 241-254, 1981. С любезного разрешения Bill Brinkley.)
Таким образом, в отличие от аксонемы ресничек, которая вырастает непосредственно из края центриоли (разд. 11.3.10), цитоплазматические микротрубочки прямо от центриоли не растут: для их нуклеации необходимо только облако окружающего центриоль аморфного материала (рис. 11-66). Из чего он состоит, в точности не известно, однако антителами к одному из его белковых компонентов можно окрашивать центр организации микротрубочек как в растительных, так и в животных клетках; значит, этот белок эволюционно очень консервативен (рис. 11-67). Если центросомы (центриоли вместе с перицентриолярным веществом) выделить из клетки и смешать с очищенным тубулином, они будут быстро инициировать сборку микротрубочек in vitro. В таких микротрубочках, как и в образующихся in vivo, минус-концы погружены в перицентриолярное вещество. При этом каждая изолированная центросома, по-видимому, может дать начало строго определенному числу микротрубочек, и это число близко к тому, которое образует центросома в соответствующей клетке (например, в интерфазном фибробласте - около 250). Создается впечатление, что центросома имеет фиксированное число нуклеирующих элементов.
У растений и простейших встречаются разные типы центров организации микротрубочек. Например, клеточный рот инфузорий снабжен корзинкой - сложной структурой, которая играет роль глотки и состоит из рядов микротрубочек, расходящихся от нижней поверхности трехслойной пластинки (рис. 11-68). С самого начала процесса сборки эти микротрубочки расположены в виде гексагональной решетки: по- видимому, этот центр организации содержит соответственно упорядоченную систему нуклеирующих элементов.
11-25
11.4.5. Динамическая нестабильность микротрубочек может служить одной из основ клеточного морфогенеза [45]
В животных клетках цитоплазматические микротрубочки расходятся во всех направлениях от центросомы, к которой прикреплены их минус-концы. Однако большинство животных клеток обладает полярностью и сборка молекул тубулина в них регулируется таким образом, что многие микротрубочки направляются к определенным участкам клетки. Еще не вполне ясно, как это достигается, но кажется вероятным, что механизм этого процесса основан на динамической нестабильности микротрубочек.
Как мы уже видели, in vitro отдельные микротрубочки чаще всего находятся в одном из двух состояний: в состоянии постепенного роста или же быстрой, «катастрофической» деполимеризации. В клетке они тоже, по-видимому, существуют в этих двух состояниях. Например, в интерфазных фибробластах в культуре среднее время жизни микротрубочи весьма мало, менее 10 мин. Это означает, что весь массив расходящихся от центросомы микротрубочек непрерывно обновляется - одни микротрубочки деполимеризуются, но вместо них вырастают новые.
Присущая микротрубочкам нестабильность позволяет объяснить, как может регулироваться их рост в определенных нужных направлениях в ползущей клетке, например, к переднему краю, а в делящейся к конденсированным хромосомам (разд. 13.5.4). Микротрубочка, у которой оба конца «открыты», в цитоплазме быстро исчезает. Однако центр организации все время порождает новые трубочки. Они направлены случайным образом, а их минус-концы защищены от деполимеризации, так как заякорены в центре организации. Растущая из такого центра микротрубочка может стать стабильной при условии, что ее плюс-конец окажется каким-то образом закрыт - «кэпирован» - и поэтому не будет распадаться. Если микротрубочку кэпировала структура, находящаяся в определенном участке клетки, то между этой структурой и центром организации микротрубочек образуется довольно устойчивая связь. Таким образом, микротрубочки, берущие начало в своем центре организации, могут избирательно стабилизироваться событиями, происходящими в других участках клетки. Как полагают, именно таким путем какие-то не известные пока структуры или факторы, локализованные в определенных областях клеточного кортекса и «захватывающие» плюс-концы микротрубочек, влияют на полярность клеток. Аналогичным образом могла бы определяться и плоскость деления клетки (разд. 13.5.13).

Рис. 11-68. Большой и необычайно упорядоченный центр организации микротрубочек в области ротовой корзинки (цитофаринкса) инфузории Nassula. Микротрубочки растут регулярным гексагональным пучком от поверхности плоского трехслойного листка, образующего один из элементов сложного ротового аппарата этой клетки. (J. В. Tucker, J. Cell Sci. 6: 385-429, 1970.)
Во многих клетках первоначальная стабилизация микротрубочек путем кэпирования их плюс-концов в дальнейшем закрепляется другими механизмами, обеспечивающими более устойчивую поляризацию клетки. К рассмотрению этих механизмов мы сейчас и перейдем.
11.4.6. Микротрубочки постепенно «созревают» благодаря посттрансляционным модификациям, которым подвергаются их тубулиновые субъединицы [46]
Непрерывное образование и исчезновение микротрубочек характерно: для клеток, претерпевающих значительную внутреннюю реорганизацию, например делящихся или ползущих по субстрату. Если же клетки становятся частью сформировавшейся ткани, их микротрубочки превращаются в относительно постоянные структуры, особенно в таких клетках, которые, дифференцировавшись, больше уже не делятся (например, нейронах). Это своеобразное «созревание» микротрубочек отчасти зависит от посттрансляционной модификации молекул тубулина и отчасти - от взаимодействия со специфическими белками, ассоциированными с микротрубочками.
Ряд ферментов модифицирует определенные аминокислоты в тубулине. Один из них - тубулин-ацетилтрансфераза, ацетилирующая один из лизиновых остатков а-тубулина. У Chlamydomonas этот фермент находится главным образом в аксонеме жгутика; по-видимому, он ацетилирует молекулы тубулина после их присоединения к дистальному концу аксонемы (разд. 11.3.2). Специфическая дезацетилаза содержится в цитоплазме и удаляет ацетильные группы с неполимерного тубулина. В результате такой локализации этих двух ферментов у Chlamydomonas молекулы тубулина в микротрубочках аксонемы ацетилированы, а в цитоплазматических микротрубочках, большая часть которых быстро обновляется, в основном неацетилированы. Ниже мы еще коснемся вопроса о возможных последствиях ацетилирования тубулина.
Второй, менее обычный способ модификации тубулина - это удаление С-концевого тирозина у молекул а-тубулина, включенных в микротрубочку. Отщепление тирозина катализируется специальным ферментом, имеющимся в цитоплазме многих клеток позвоночных. Как и в случае ацетилирования, есть и фермент, осуществляющий обратную реакцию-восстановление тирозина на С-конце деполимеризованных молекул тубулина. В клетках с быстро обновляющимися микротрубочками большинство молекул тубулина находится в их составе в исходной форме (с тирозином), так как просто не успевают детирозилироваться до отделения от полимера. Зато все более «старые» микротрубочки те, что «сумели сохраниться» за короткое время обновления, оказываются обогащены детирозилированным тубулином. Таким образом, и ацетилирование, и детирозилирование служат маркерами превращения микротрубочек из временно стабилизированной формы в гораздо более устойчивую (рис. 11-69). Если культуру фибробластов обработать препаратом, вызывающим деполимеризацию микротрубочек (разд, 11.4.1), то окажется, что немногие сохранившиеся микротрубочки способны избирательно связывать антитела, узнающие ацетилированную или детирозилированную форму тубулина.
Микротрубочки, образующиеся из ацетилированного и детирозилированного тубулина in vitro, ничуть не более устойчивы, чем образованные из обычного, немодифицированного тубулина; значит, модификации, видимо, служат лишь «сигналом» для связывания специфических белков, которые уже стабилизируют микротрубочки и изменяют их свойства в клетках.
11.4.7. Свойства цитоплазматических микротрубочек изменяются под влиянием белков, которые с ними связаны[47]
Посттрансляционные модификации тубулина, во-первых, маркируют микротрубочки как «зрелые» и, во-вторых, способствуют их стабилизации. Однако наиболее значительные и важные модификации, которым подвергаются микротрубочки, обусловлены присоединением к ним других белков. Эти- белки, ассоциированные с микротрубочками (БАМ, или MAPs-microtubule-associated proteins), повышают устойчивость микротрубочек к деполимеризации и обеспечивают взаимодействие их с другими компонентами клетки. Зная, сколь разнообразны в клетках функции микротрубочек, можно ожидать, что должно существовать много разных видов БАМ.
Две важные группы БАМ, которые можно выделить из мозга вместе с микротрубочками, - это высокомолекулярные белки (с мол. массой около 200-300 тыс. и даже больше) и may-белки (с мол. массой 40-60 тыс.). Белки обеих групп имеют два домена, один из которых ответствен за связывание с микротрубочками; так как этот домен соединяется одновременно с несколькими неполимерными молекулами тубулина, БАМ ускоряют нуклеацию микротрубочек in vitro. Другой домен, как полагают, обеспечивает взаимодействие микротрубочек с другими клеточными компонентами (рис. 11-70). И высокомолекулярные БАМ, и тау-белки «сидят» на микротрубочках цитоплазмы по всей их длине, что показано с помощью антител к этим белкам.
Выделено уже немало белков, которые избирательно связываются с микротрубочками. Функции большинства из них не известны.
Некоторые, вероятно, играют роль структурных компонентов, стабилизируя микротрубочки и обеспечивая постоянную связь их с другими компонентами клетки (в том числе с другими элементами цитоскелета и мембранами некоторых органелл); другие же ответственны за перемещение органелл вдоль по микротрубочкам.
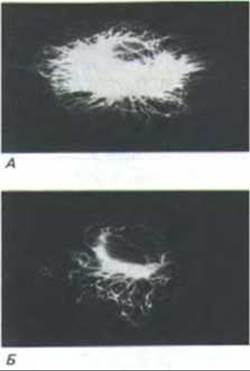
Рис. 11-69. Иммунофлуоресцентные микрофотографии, на которых видно, что одни микротрубочки в цитоплазме культивируемой клетки весьма динамичны (А), а другие относительно стабильны (В). В клетку инъецировали тубулин, ковалентне связанный с небольшой молекулой - биотином; через час клетку окрашивали сначала меченными флуоресцеином антителами к биотину, а затем антителами к тубулину, меченными другим флуоресцентным красителем - родамином. Быстро обновлявшиеся микротрубочки включали биотинилированный тубулин и поэтому выявлялись антителами к биотину (А), которые покрывали микротрубочки и препятствовали связыванию антител к тубулину. В стабильные микротрубочки биотинилированный тубулин не включался, поэтому они не окрашивались антителами к биотину, но зато красились антителами к тубулину (Б). Стабильные микротрубочки окрашиваются также антителами, узнающими детирозилированный или ацетилированный тубулин. (С любезного разрешения Eric Schulze и Marc Kirschner.)

Рис. 11-70. Регулярно расположенные «боковые ручки», образованные на микротрубочке крупным ассоциированным с микротрубочками белком (БАМ-2) из мозга позвоночных. На электронной микрофотографии показан участок микротрубочки, с которым связано много молекул БАМ-2. Часть молекулы БАМ-2 отходит от микротрубочки в сторону, как показано на схеме внизу (Фото любезно предоставили William Voter и Harold Erickson.)
11-32
11.4.8. Микротрубочки часто направляют передвижение органелл в цитоплазме [48]
Если мы рассмотрим живую клетку позвоночного животного в фазово-контрастный микроскоп или в микроскоп с дифференциальным интерференционным контрастом (разд. 4.1.5), мы увидим, что ее цитоплазма находится в непрестанном движении. Митохондрии и более мелкие мембранные органеллы за несколько минут успевают изменить свое местоположение в клетке путем характерных периодических скачков, которые слишком упорядоченны и направленны, чтобы их можно было спутать со столь же безостановочным броуновским движением-результатом случайного теплового движения молекул. Многие из таких внутриклеточных перемещений происходят в тесной связи с микротрубочками. Если клетку, в которой движутся органеллы, быстро зафиксировать и приготовить из нее срезы для электронной микроскопии, то можно увидеть, что мембрана таких органелл зачастую соединена с микротрубочками цитоплазмы тонкими нитевидными структурами. Можно предположить поэтому, что микротрубочки играют важную роль в подобном движении, хотя, как мы уже говорили (разд. 11.2.4), некоторые перемещения пузырьков в цитоплазме происходят вдоль актиновых филаментов, а не микротрубочек. Наиболее яркой демонстрацией транспортной роли микротрубочек явилось изучение быстрого аксонного транспорта в нервных клетках, где перемещение мембранных пузырьков в обоих направлениях по аксону - между телом клетки и нервным окончанием - идет с большой интенсивностью.
11.4.9. Кинезин и цитоплазматический динеин осуществляют движение пузырьков вдоль микротрубочек аксона в противоположных направлениях, используя энергию гидролиза АТР [49]
Гигантский аксон кальмара можно извлечь из тела животного, а его цитоплазму выдавить, как зубную пасту из тюбика. Если капельку выдавленной аксоплазмы расплющить покровным стеклом и заснять через микроскоп на видеопленку (разд. 4.1.6), то можно увидеть, как органеллы движутся вдоль тонких нитевидных «дорожек». Методом иммунофлуоресценции в сочетании с электронной микроскопией удается показать, что эти «дорожки» представляют собой отдельные микротрубочки.
Выделенные внутриклеточные пузырьки и даже искусственные частицы вроде полистироловых шариков способны связываться с микротрубочками в выдавленной аксоплазме и двигаться вдоль этих микротрубочек практически так же, как это происходит в живой клетке. Поскольку выдавленная аксоплазма больше не укрыта плазматической мембраной, можно без труда изменять содержание в ней различных ионов и низкомолекулярных веществ и исследовать их влияние на аксонный транспорт. Таким образом было показано, что AMPPNP-негидролизуемый аналог АТР - останавливает транспорт и фиксирует органеллы в неподвижном, связанном с микротрубочками состоянии.
Такой эффект AMPPNP позволяет выявить компоненты, ответственные за перемещение пузырьков. При поиске в экстрактах аксоплазмы белков, которые связываются с микротрубочками в присутствии AMPPNP, но отделяются от них при добавлении АТР, был выделен крупный белковый комплекс, названный кинезином. Кинезин оказался АТРазой, использующей энергию гидролиза АТР для однонаправленного перемещения пузырьков вдоль по микротрубочке (разд. 3.4.11). Это движение осуществляется со скоростью от 0,5 до 2 мкм/с, без перерывов и скачков, характерных для движения в интактном аксоне и обусловленных, как полагают, частыми столкновениями перемещаемого пузырька с различными элементами цитоплазмы.
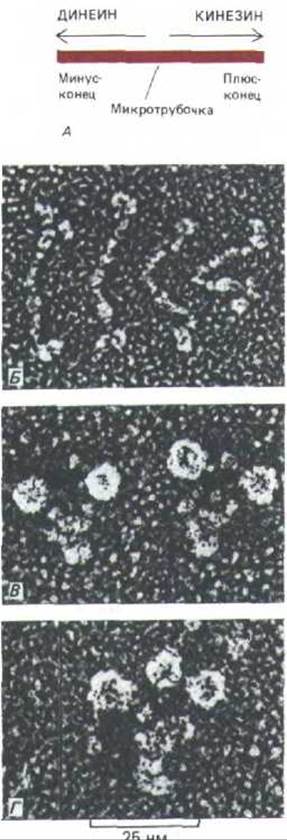
Рис. 11-71. Кинезин и цитоплазматический динеин-крупные белки, ассоциированные с микротрубочками (БАМ), которые способны двигаться по микротрубочке в противоположных направлениях, используя энергию гидролиза АТР (А). Эти белки представляют собой комплексы из двух одинаковых «тяжелых цепей» и нескольких меньших «легких цепей». Каждая тяжелая цепь образует глобулярную головку, с помощью которой белок при участии АТР присоединяется к микротрубочке. Таким образом, подобно миозину, кинезин (Б, показаны четыре молекулы) и цитоплазматический динеин (В, две молекулы) имеют две головки. В отличие от этого динеин ресничек (Г) имеет три головки (см. рис. 11-57). [Электронные микрофотографии получил John Heuser методом замораживания-травления; белки выделили Trina Schroer, Jeff Gelles, Michael Scheetz (£); Eric Steuer (B); Ursula Goodenough (Г).]
Направление движения, создаваемого кинезином, было определено с помощью полистироловых шариков, которые перемещались по микротрубочкам, полимеризованным in vitro на центросомах. В то время как неочищенные экстракты аксоплазмы перемещают частицы в обоих направлениях, очищенный кинезин обеспечивает транспорт только в одном направлении-« наружу», т.е. к плюс-концам микротрубочек (напомним, что динеин в ресничках осуществляет движение в противоположном направлении-см. разд. 11.3.10). Поскольку микротрубочки в аксоне, как известно, ориентированы плюс-концами от тела клетки (см. рис. 11-63), перемещение пузырьков с помощью кинезина должно быть направлено от тела к кончику аксона. Кажется вероятным, что за транспорт в обратном направлении ответствен динеиноподобный белок. И действительно, недавно из нескольких источников, включая мозг млекопитающего, был выделен высокомолекулярный БАМ с такими свойствами (рис. 11-71). Этот белок был назван цитоплазматическим динеином.
11.4.10. Микротрубочки определяют местоположение эндоплазматического ретнкулума и аппарата Гольджи внутри клетки [50]
Двигательные белки, сходные с кинезином и динеином, существуют не только в нейронах. По-видимому, они имеются во всех клетках, где есть микротрубочки, и ряд важных организующих функций микротрубочек осуществляется, судя по всему, именно благодаря этим белкам. Как показали недавние исследования in vitro, кинезин прикрепляется к мембране эндоплазматического ретикулума и может растягивать ее вдоль ориентированных микротрубочек, превращая эту органеллу в характерную сложную сеть. Работы, проведенные на интактных клетках, тоже указывают на то, что ретикулум растягивается по ходу микротрубочек в направлении от центросомы, как и следует ожидать, если это происходит при участии кинезина. Наконец, иммунофлуоресцентными методами показано, что тонкие края цистерн ретикулума в периферических участках клеток часто располагаются вдоль микротрубочек (рис. 11-72, А и Б).
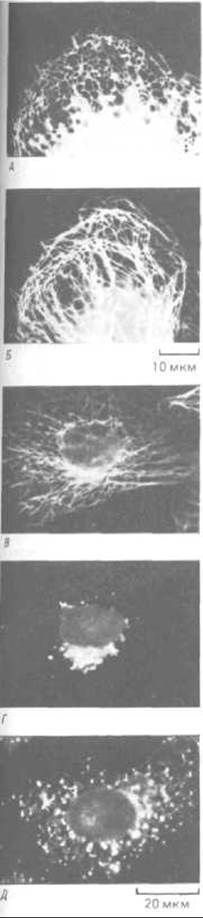
Рис. 11-72. Расположение мембран эндоплазматического ретикулума (ЭР) и микротрубочек в культивируемых клетках. А.
Иммунофлуоресцентное окрашивание белков ЭР выявляет цистерны ЭР в виде кружевной сети на периферии клеток. Б. Расположение микротрубочек в той же клетке. В, Г и Д. Влияние микротрубочек на аппарат Гольджи. Если в культивируемой клетке одновременно окрасить флуоресцентными антителами и микротрубочки (В), и мембраны Гольджи (Г), последние обнаружатся в виде скопления вокруг центросомы. Но если клетку обработать нокодазолом, вызывающим деполимеризацию микротрубочек, то мембраны Гольджи будут распределены по всей цитоплазме (Д), как это бывает во время митоза. [С любезного разрешения Mark Terasaki и Lan Во Chen (A, Б); Viki Allan и Thomas Kreis (В, Г. Д).]
В то время как мембрана эндоплазматического ретикулума активно перемещается в сторону от центросоми по «дорожкам» из микротрубочек (оставаясь соединенной на другом конце с ядерной оболочкой), мембраны цистерн Гольджи, по-видимому, транспортируются в обратном направлении, как если бы они были связаны с динеиноподобными белками; в результате аппарат Гольджи оказывается вблизи центросомы (рис. 11-72,5 и Г). И аппарат Гольджи, и эндоплазматический ретикулум во время митоза подвергаются сильной фрагментации (разд. 13.5.16), и когда потом в цитоплазме вновь образуются микротрубочки, именно их ориентация, вероятно, направляет восстановление этих органелл из мелких пузырьков и фрагментов мембран (рис. 11-72, Д).
Заключение
Микротрубочки образуются путем полимеризации молекул тубулина, после чего эти молекулы гидролизуют прочно связанный с ними GTP (этот процесс несколько отстает от полимеризации). Микротрубочки растут медленно, нестабильны и склонны к взрывообразной, «катастрофической» деполимеризации: однако они могут стабилизироваться при ассоциации с другими структурами, которые прикрывают («кэпируют») их концы. Центры организации микротрубочек, такие как центросомы, все время инициируют образование новых микротрубочек, которые растут в случайных направлениях. Любая микротрубочка, которая натолкнется на какую-либо структуру, способную кэпировать свободный плюс-конец этой микротрубочки, будет избирательно стабилизирована, тогда как другие со временем деполимеризуются. Полагают, что именно этот процесс в основном определяет полярность и расположение систем микротрубочек в клетке.
В тех микротрубочках, которые образовались в нужных местах, субъединицы тубулина подвергаются модификации - ацетилированию и детирозилированию. Эти модификации играют роль «маркеров» зрелых микротрубочек и создают участки для связывания специальных белков, ассоциированных с микротрубочками (БАМ), которые еще больше повышают устойчивость микротрубочек к деполимеризации и адаптируют их для выполнения специфических функций в клетке. Особая группа таких белков использует энергию гидролиза АТР для однонаправленного перемещения вдоль по микротрубочке, обеспечивая этим направленное движение в цитоплазме клеточных органелл и их правильную пространственную организацию.