Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Межклеточная сигнализация
Механизмы передачи сигнала с участием рецепторних белков клеточной поверхности
Все водорастворимые сигнальные молекулы (в том числе нейромедиаторы, пептидные гормоны и факторы роста), как, впрочем, и некоторые жирорастворимые, присоединяются к специфическим белковым рецепторам на поверхности клеток-мишеней. Поверхностные рецепторы связывают сигнальную молекулу (лиганд) с высоким сродством, и это внеклеточное событие порождает внутриклеточный сигнал, изменяющий поведение клетки.
Используя лиганды, меченные радиоактивными атомами, флуоресцентными красителями или электроноплотными частицами (типа коллоидного золота), можно изучать распределение рецепторов на поверхности клетки. Было показано, что число рецепторов для конкретного лиганда может варьировать в пределах от 500 до более чем 100000 на клетку и что они либо располагаются на мембране случайным образом, либо сосредоточены в определенных ее участках. Подобно другим мембранным белкам, рецепторы клеточной поверхности с трудом поддаются выделению в чистом виде и изучению, особенно в связи с тем, что они составляют менее 0,1% общей массы белка плазматической мембраны. Методы клонирования последовательностей ДНК, кодирующих поверхностные рецепторы, и здесь позволили преодолеть многие трудности и в корне изменили наши представления о структуре и функциях рецепторов.
В отличие от внутриклеточных рецепторов для стероидных и тиреоидных гормонов, рецепторы клеточной поверхности не регулируют непосредственно экспрессию генов. Они лишь передают сигнал через плазматическую мембрану, а влияние, которое они оказывают на процессы в цитозоле или в ядре, связано с образованием новых внутриклеточных сигналов. Можно было бы подумать, что рецепторы клеточной поверхности просто переносят внешние сигнальные молекулы через мембрану в цитозоль, превращая их во внутриклеточный сигнал, однако это не так. Правда, многие белковые сигнальные молекулы, например инсулин, действительно поглощаются клеткой путем эндоцитоза при участии рецептора (разд. 12.5.1), но они не выходят из эндосомных или лизосомных пузырьков в цитозоль. По-видимому, задача внешнего лиганда сводится к тому, чтобы вызвать конформационное изменение белка-рецептора, находящегося на поверхности клетки. В самом деле, действие нормального лиганда нередко могут имитировать связывающиеся с рецептором антитела; этот феномен лежит в основе ряда патологических состояний. Например, весьма обычной причиной гипертиреоза - избыточной функции щитовидной железы - у человека бывает аномальная выработка антител, присоединяющихся к рецепторам тиреотропного гормона; рецепторы при этом активируются и вызывают гиперфункцию железы.
В этом разделе мы рассмотрим, как конформационное изменение белкового рецептора на клеточной поверхности, вызванное присоединением внеклеточного лиганда, позволяет рецептору прямо или косвенно превращать внешний сигнал в сигнал, действующий внутри клетки.
12.3.1. Известны по меньшей мере три класса белковых рецепторов клеточной поверхности: образующие канал, сопряженные с G-белками и каталитические [9]
Большинство белковых рецепторов клеточной поверхности можно отнести к одному из трех классов в зависимости от механизма, используемого для передачи сигнала. Каналообразующие рецепторы - это регулируемые медиаторами ионные каналы, участвующие главным образом в быстрой синаптической передаче сигналов между электрически возбудимыми клетками. Для управления такого рода каналами используется небольшое число нейромедиаторов, которые на короткое время открывают или закрывают образуемый рецепторами канал, изменяя таким образом ионную проницаемость плазматической мембраны, а тем самым и возбудимость постсинаптической клетки. Изучение последовательностей ДНК, кодирующих эти рецепторы, показало, что они относятся к одному семейству гомологичных белков, насквозь пронизывающих мембрану. Эти рецепторы обсуждаются в гл. 19 (разд. 19.3) и здесь рассматриваться не будут.
Каталитические рецепторы при активации лигандом начинают работать как ферменты. Большинство известных каталитических рецепторов - трансмембранные белки с цитоплазматическим доменом, обладающим тирозин-специфической протеинкиназной активностью.
Рецепторы, сопряженные с G-белками, опосредованно активируют или ингибируют определенные ферменты или ионные каналы, связанные с плазматической мембраной. Взаимодействие между рецептором и ферментом или ионным каналом происходит через третий белок, который называют GTP-связывающим регуляторным белком (или G-белком). Рецепторы, связанные с G-белком, обычно запускают целую цепь событий, изменяющих концентрацию одного или нескольких малых внутриклеточных сигнальных молекул, часто называемых внутриклеточными посредниками или внутриклеточными медиаторами. Эти молекулы в свою очередь действуют, изменяя поведение других белков-мишеней в клетке. Два наиболее важных посредника-это циклический AMP (cAMP) и Са2+. Передаваемые ими сигналы генерируются разными путями (те и другие с участием G-белков) и используются во всех животных клетках (см. рис. 12-13). Мы рассмотрим эти пути, прежде чем вернемся к каталитическим рецепторам с тирозин-специфической протеинкиназной активностью; начнем с экспериментов, которые привели к открытию сАМР и проложили путь к нынешнему пониманию того, каким образом внутриклеточные посредники появляются в ответ на внеклеточный сигнал.
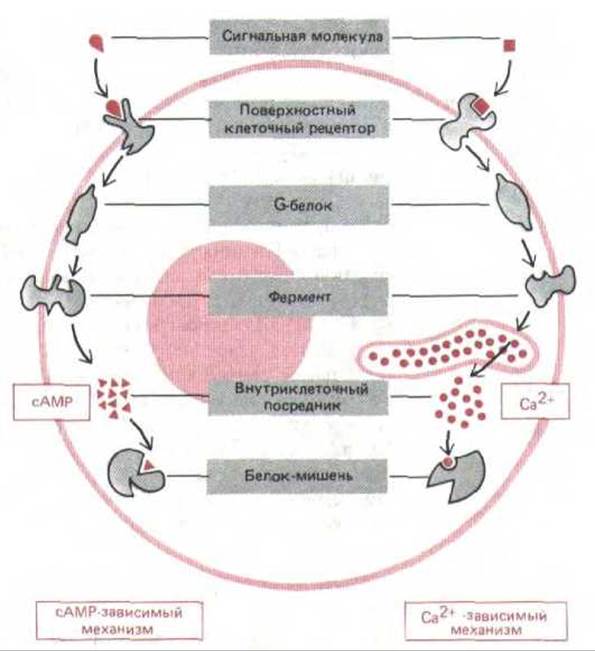
Рис. 12-13. Два главных механизма, с помощью которых рецепторы клеточной поверхности, сопряженные с G-белками, запускают образование внутриклеточных посредников. В обоих вариантах связывание внеклеточного лнганда изменяет конформацию цитоплазматического домена рецептора так, что он связывается с G-белком, который затем активирует (или ингибирует) определенный фермент плазматической мембраны. В некоторых случаях G-белок взаимодействует не с ферментом, а с ионным каналом. В сАМР-пути активируемый Gs-белком фермент синтезирует циклический AMP. В Са2+ -пути с помощью фермента образуется растворимый посредник, который освобождает из внутриклеточных хранилищ ионы Са2+ И сАМР, и Са2+ связываются в клетке с другими специфическими белками, изменяя их активность.
12.3.2. Циклический AMP-вездесущий посредник в животных клетках [10]
В клетках мышц или печени воздействие адреналина стимулирует расщепление запасов гликогена. Оказалось, что адреналин активирует фермент гликогенфосфорилазу, катализирующий это расщепление. Далее удалось выяснить, что обработка изолированных мембран печеночных клеток адреналином (в присутствии АТР) вызывает образование низкомолекулярного термостабильного фактора, способного заменять гормон и активировать фосфорилазу в экстракте тех же клеток, не содержащем мембран. В 1959 г. этот медиатор был идентифицирован как циклический AMP (cAMP, рис. 12-14), который, как было позже установлено, регулирует многие внутриклеточные реакции во всех до сих пор изученных прокариотических и животных клетках.
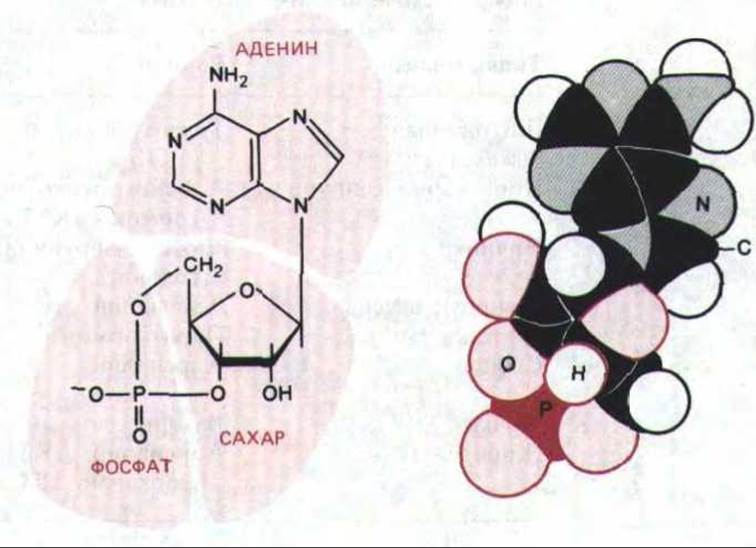
Рис. 12-14. Структурная формула и объемная модель циклического AMP (С, Н, N, О и Р-атомы углерода, водорода, азота, кислорода и фосфора соответственно).
Идентификация циклического AMP привела к изучению ферментов, участвующих в его синтезе и разрушении. Чтобы сАМР мог служить внутриклеточным посредником, его концентрация в клетке (обычно < 10-6 М) должна быть подвержена быстрым изменениям в ту и другую сторону под действием определенных внеклеточных сигналов (при гормональной стимуляции она может за несколько секунд увеличиться в 5 раз). Как мы увидим (разд. 12.4.7), для этого быстрый синтез молекул должен уравновешиваться быстрым их расщеплением или удалением. Циклический AMP синтезируется из АТР ферментом аденилатциклазой, связанным с плазматической мембраной клетки, но быстро расщепляется одним или несколькими ферментами - сАМР-фосфодиэстеразами, которые гидролизуют его до аденозин-5'-монофосфата (5'-АМР) (рис. 12-15).
12-16
12.3.3. Рецептор и аденилатциклаза - это отдельные белки, которые функционально взаимодействуют в плазматической мембране
Многие гормоны и локальные химические медиаторы действуют, изменяя концентрацию сАМР, причем они делают это, активируя (или в некоторых случаях ингибируя) аденилагциклазу, а не влияя на активность фосфодиэстеразы. Подобно тому как один и тот же стероидный гормон неодинаково действует на различные клетки-мишени, разные клетки весьма по-разному реагируют на изменение внутриклеточной концентрации сАМР (табл. 12-2). Любой лиганд, активирующий адени-латциклазу в данной клетке, обычно вызывает одну и ту же реакцию. Например, в жировых клетках аденилатциклазу активируют по крайней мере четыре разных гормона, и все они вызывают расщепление триглицеридов (резервная форма жира) до жирных кислот (табл. 12-2). Похоже, что различные рецепторы для этих гормонов активируют общий пул молекул аденилатциклазы. То, что рецепторы и аденилатциклаза - отдельные молекулы, было показано в экспериментах с «трансплантацией» рецепторов. Например, рецепторы адреналина, выделенные из солюбилизированных детергентами плазматических мембран, не обладают никакой аденилатциклазной активностью, но если поместить их в плазматическую мембрану других клеток, не имеющих собственных рецепторов для адреналина, то такие «пересаженные» рецепторы после активации их гормоном способны к функциональному взаимодействию с аденилатциклазой клетки-реципиента (рис. 12-16).
Таблица 12-2. Некоторые клеточные ответы на гормоны, опосредуемые циклическим AMP
|
Ткань-мишень |
Гормон |
Главный ответ |
|
Щитовидная железа |
Тиреотропный гормон (ТТГ) |
Синтез и секреция тироксина |
|
Кора надпочечников |
Адренокортикотропный гормон (АКТГ) |
Секреция кортизола |
|
Яичники |
Лютеинизирующий гормон |
Секреция прогестерона |
|
Мышцы, печень |
Адреналин |
Распад гликогена |
|
Костная ткань |
Паратгормон |
Резорбция кости |
|
Сердце |
Адреналин |
Увеличение частоты и силы сокращений |
|
Почки |
Вазопрессин |
Реабсорбция воды |
|
Жировая ткань |
Адреналин, АКТГ, глюкагон, ТТГ |
Расщепление триацил-глицеролов |
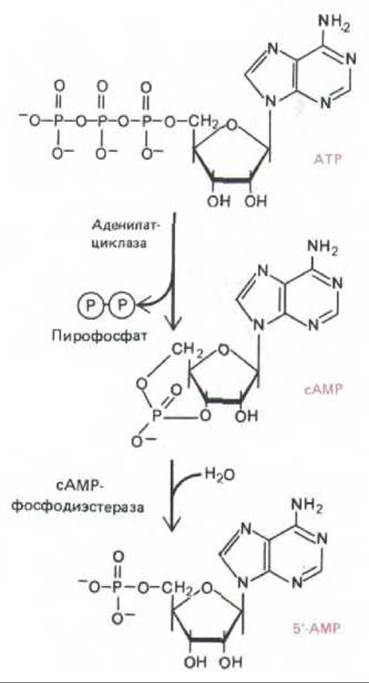
Рис. 12-15. Синтез и расщепление сАМР. Пирофосфатаза делает синтез сАМР необратимой реакцией, гидролизуя освобождаемый пирофосфат.
12.3.4. Рецепторы активируют аденилатциклазу через стимулирующий G-белок (Gs) [12]
У бактерий рецепторы и молекулы аденилатциклазы сопряжены напрямую, но в животных клетках это сопряжение осуществляется еще одним белком. На мысль о таком опосредованном механизме впервые навел тот факт, что для гормональной активации аденилатциклазы в разрушенных клетках необходим GTP. Позднее были выделены мутантные клеточные линии, у которых связывание адреналина аденилатциклазу не активирует, несмотря на наличие нормальных количеств рецепторов и самой циклазы. Смешивая препараты плазматических мембран таких «разобщенных» клеток с экстрактами мембран других клеток, полученными с помощью детергентов, можно было реконструировать чувствительную к гормону аденилатциклазную систему, для работы которой необходим GTP. Оказалось, что упомянутые экстракты содержат особый мембранный GTP-связывающий белок (G-белок), которого нет в «разобщенных» мутантных клетках. Поскольку этот белок участвует в активации фермента, он получил название стимулирующего G-белка (Gs). Индивидуумы с наследственным дефицитом Gs слабо реагируют на многие гормоны и поэтому страдают нарушениями роста в полового созревания, умственной отсталостью и целым рядом метаболических аномалий. Не так давно удалось реконструировать активируемую адреналином аденилатциклазную систему из очищенных компонентов (рецептора адреналина, белка Gs и каталитического компонента аденилатциклазы), встроив их в липосомы из синтетических фосфолипидов (разд. 6.2.2). Эти эксперименты показали, что для активации аденилатциклазы гормоном достаточно этих трех белков.
Чтобы Gs-белок мог передать сигнал от рецептора аденилатциклазе, он должен каким-то образом изменять свою структуру при получении сигнала. Для этого используется GTP. Когда Gs активируется комплексом гормон-рецептор, он одновременно связывает молекулу GTP, после чего и приобретает способность активировать молекулу аденилатциклазы. Gs поддерживает аденилатциклазу в активном состоянии до тех пор, пока цела молекула GTP. Когда Gs, который является GTP-азой, гидролизует GTP до GDP, активация циклазы прекращается.
12-17
12.3.5 Gs -белок - гетеротример, диссоциирующий при активации на субъединицы [13]
Функция Gs -белка решающим образом зависит от его субъединичной структуры. В его состав входят три полипептида: a-цепь (Gsa), которая связывает и гидролизует GTP и активирует аденилатциклазу, и прочный комплекс ß-цепи и у-цепи (Gβy), который заякоривает Gs на внутренней стороне цитоплазматической мембраны. На рис. 12-17 показана современная модель сопряжения активации рецептора с активацией аденилат-циклазы при помощи Gs. В своей неактивной форме Gs существует как тример, с а-субъединицей которого связан GDP. При активации гормонрецепторным комплексом участок связывания гуаниловых нуклеотидов на Gs изменяется, и теперь вместо GDP здесь может присоединиться GTP. Как полагают, в результате присоединения GTP Gsa отделяется от Gßy и прочно связывается с молекулой аденилатциклазы, которая при этом активируется и начинает синтезировать сАМР. Менее чем за минуту Gsa гидролизует связанный с нею GTP до GDP, что приводит к отделению Gsa от аденилатциклазы (которая становится неактивной) и обратному присоединению Gsa к Gßy с восстановлением неактивной молекулы Gs.
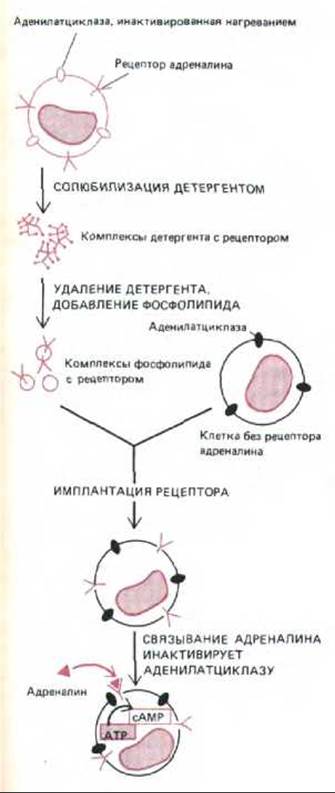
Рис. 12-16. Функционально активные адреналиновые рецепторы можно экстрагировать из клеток, в которых аденилатциклаза инактивирована нагреванием, и встроить в плазматическую мембрану клеток, не имеющих таких рецепторов. При активации адреналином «пересаженные» рецепторы активируют аденилатциклазу в плазматической мембране клеток-реципиентов (сопрягающий рецепторы и циклазу G-белок на схеме не показан). Существует по меньшей мере три типа адреналиновых рецепторов (называемых также адренэргическими) - a1, a2 и ß; аденилатциклазу активируют только ß-рецепторы.
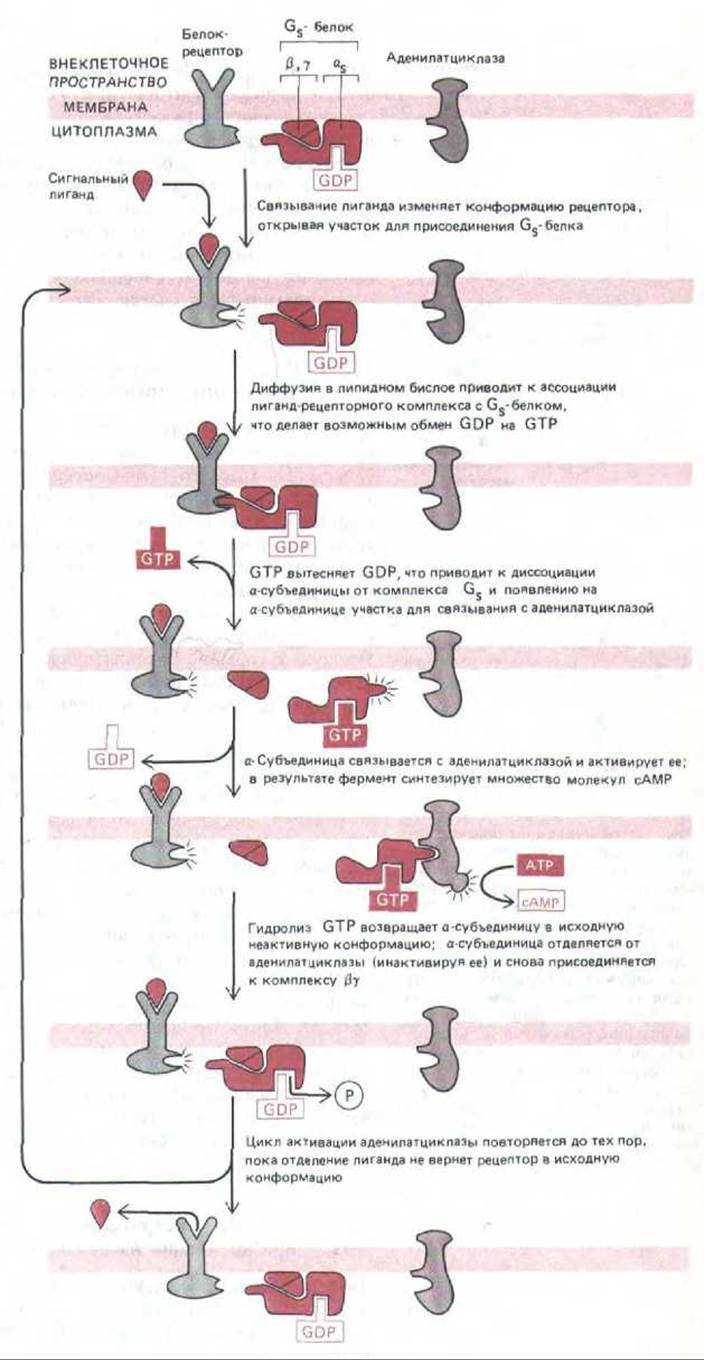
Рис. 12-17. Современная модель, иллюстрирующая, каким образом белковые рецепторы могут функционально сопрягаться с аденилат-циклазой через стимулирующий О-белок-Gs. Пока сигнальный лиганд остается связанным, рецепторный белок может активировать все новые молекулы Gs-белка, усиливая таким образом ответ. Дополнительный механизм усиления (который в некоторых сигнальных системах имеет большее значение) заключается в удержании связанного GTP на а-субъединице Gs,-белкa на протяжении многих секунд, так что все это время аденилатциклаза остается активированной. Согласно другой модели, аденилатциклаза остается связанной с Gs и в активированном, и в неактивном состоянии.
В аденилатциклазной системе бактерий нет промежуточного звена в виде Gs. Почему же тогда у животных клеток выработался столь сложный многоступенчатый механизм передачи сигнала с участием G-белка, «вставленного» между рецептором и активируемым ферментом? Одной из причин может быть необходимость усиления сигнала (см. разд. 12.4.6), а другой-нужда в дополнительных уровнях для контроля.
Gs позволяет создать два вида усиления. В простейшем случае единичный активированный белковый рецептор может в принципе успеть столкнуться с многими молекулами Cs-белка (и тем самым активировать их), а они затем вызовут активацию многих молекул аденилатциклазы. В ряде случаев, однако, внеклеточный лиганд может не связываться со своим рецептором на достаточно длительное время, чтобы мог сработать этот механизм усиления: некоторые лиганды, например, отделяются от своих рецепторов быстрее чем за секунду. Между тем сам Gs, как полагают, остается активным более 10-15 с, прежде чем произойдет гидролиз связанного с ним GTP. Таким образом, он будет удерживать аденилатциклазу в активном состоянии довольно долго даже после отделения внеклеточного лиганда. Подобный эффект можно продемонстрировать в преувеличенном виде, если к разрушенным клеткам добавить негидролизуемый аналог GTP: последующая обработка гормоном приводит к весьма продолжительному синтезу сАМР.
G-белки не только усиливают сигнал, но и служат важным звеном, где может регулироваться весь процесс активации. В принципе эффективность взаимодействия между рецепторами и ферментом может быть изменена ковалентной модификацией G-белка или изменением его концентрации в плазматической мембране. Наиболее впечатляющая иллюстрация этого - действие бактериального токсина, ответственного за симптомы холеры. Холерный токсин представляет собой фермент, катализирующий перенос ADP-рибозы с внутриклеточного NAD на а-субъединицу Gs-белка. Последняя при этом теряет способность гидролизовать связанный с нею GTP. Аденилатциклаза, активированная такой видоизмененной а-субъединицей Gs-белка, может оставаться в активном состоянии неопределенно долго. В результате длительное повышение уровня сАМР в клетках кишечного эпителия вызывает массированный выход воды и натрия из этих клеток в просвет кишечника, что и приводит к тяжелому поносу - характерному симптому холеры.
Gs - только один из представителей большого семейства G-белков, обеспечивающих сопряжение рецепторов с разнообразными ферментами и ионными каналами в мембранах эукариотических клеток. Как мы сейчас увидим, другой представитель этого семейства не активирует, а, наоборот, ингибирует аденилатциклазу.
12.3.6 Рецепторы подавляют активность аценилатциклазы через ингибирующий G-белок (Gi) [13]
Одна и та же сигнальная молекула может как повышать, так и понижать внутриклеточную концентрацию сАМР в зависимости от типа рецептора, с которым она связывается. Например, есть несколько типов рецепторов для адреналина: ß-адренэргические рецепторы активируют адени-латциклазу, а а2-адренэргические ингибируют ее. Различный конечный эффект определяется G-белками, осуществляющими сопряжение этих рецепторов с аденилатциклазой: ß-рецепторы действуют через Gs, а а2-рецепторы - через ингибиторный G-белок (Gi), который содержит тот же ßy-комплекс, что и Gs, но другую а-субъединицу (Gia). Будучи активирован, а2-адренэргический рецептор взаимодействует с Gßy приводя к замене GDP на GTP в участке связывания гуаниловых нуклеотидов на а-субъединице. При этом, как полагают, Gia отделяется от Gβy и обе эти субъединицы участвуют в ингибировании аденилатциклазы: Gia прямо подавляет активность аденилатциклазы, тогда как действие Gβy обусловлено связыванием свободной Gsа-субъединицы и, как следствие, устранением ее активирующего влияния на аденилатциклазу.
Подобно тому как холерный токсин повышает уровень сАМР, ADP-рибозилируя субъединицу Gsa и инактивируя ее GTP-азную активность, коклюшный токсин-продукт бактерий, вызывающих коклюш, - дает тот же эффект, ADP-рибозилируя Gia. В этом случае, однако, модификация G-белка препятствует его взаимодействию с рецепторами; поэтому при активации рецептора аденилатциклаза не ингибируется.
Хотя G-белки были открыты благодаря их влиянию на аденилатциклазу, они могут действовать и другими путями (см. табл. 12-3). В частности, активируя фосфолипазу С (разд. 12.3.9), некоторые G-белки могут связывать активацию рецептора с изменением концентрации Са2+ в цитозоле, а Са2+ используется как внутриклеточный посредник еще более широко, чем сАМР.
Таблица 12-3. Некоторые GTP-связывающие регуляторные белки, участвующие в передаче сигнала в клетке
|
Тип G-белка |
а-Субъединица1 |
Функция |
Модифицирующий бактериальный токсин |
|
Gs |
as |
Активация аденилатциклазы |
Холерный |
|
Gi |
ai |
Инактивация аденилатциклазы |
Коклюшный |
|
Gp |
? |
Активация фосфоинозитид-специфической фосфолипазы С |
Коклюшный (только в некоторых клетках) |
|
GO |
a0 |
Главный G-белок головного мозга; может регулировать ионные каналы |
Коклюшный |
|
Трансдуцин |
Ta |
Активация cGMP-фосфо-диэстеразы в палочках сетчатки позвоночных (см. разд. 12.3.12) |
Коклюшный и холерный |
|
ras-Белки |
2 |
Участвуют в стимуляции клеточного деления факторами роста (см. разд. 12.3.11 и 13.4.5) |
1 За исключением ras-белков (и Gp, структура которого не ясна), G-белки - гетеротримеры, в которых а-субъединица непрочно связана с димером ßy. Все известные а-субъединицы (мол. масса 40000-50000) гомологичны, и у большинства из них одинаковые (или очень сходные) ß- субъединицы (мол. масса 35 000) и у-субъединицы (мол. масса 8000).
2 ras-Белки-одиночные полипептиды (мол. масса 21 000), гомология которых с субъединицами других G-белков незначительна; участвуют ли они в сопряжении рецепторов с эффекторными белками таким же образом, как другие G-белки, не известно.
12.3.7 Ионы Са2+ запасаются в специальном внутриклеточном компартменте [14]
Концентрация свободных ионов Са2+ в цитозоле клеток очень низка (порядка 10-7 М), тогда как концентрация их во внеклеточной жидкости (более 10-3 М) и в специальном внутриклеточном запасающем Са2+ компартменте довольно высока. Столь значительный градиент ионов Са2+ стремится «проталкивать» их в цитозоль через плазматическую мембрану и мембрану запасающих внутриклеточных органелл. Когда какой-то сигнал на короткое время открывает в этих мембранах Са2+-каналы, ионы Са2+ буквально врываются в цитозоль, резко повышая свою локальную концентрацию и активируя чувствительные к ним механизмы в клетке.
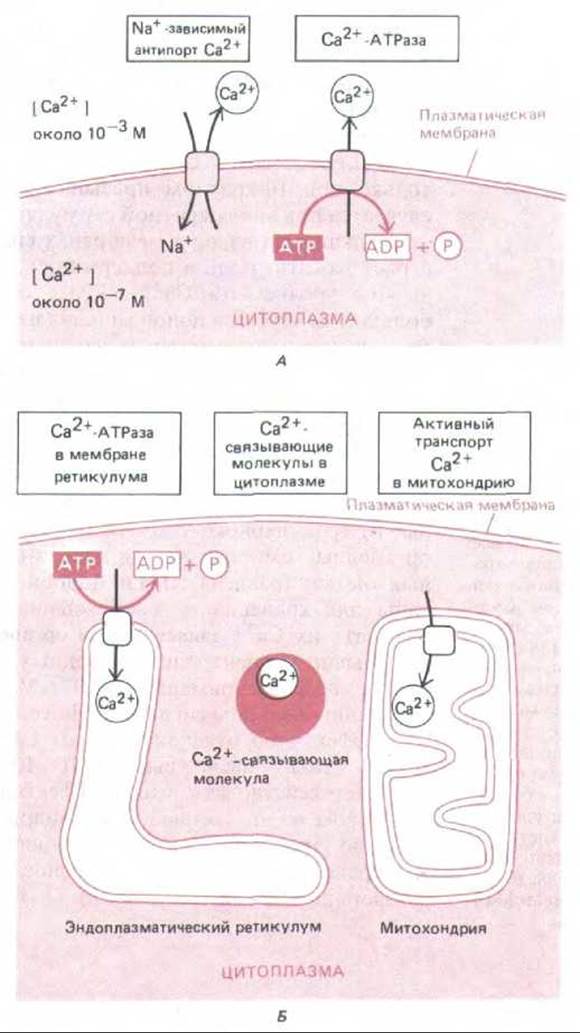
Рис. 12-18. Важнейшие механизмы, позволяющие клетке поддерживать очень низкую концентрацию свободных ионов Са2+ в цитозоле, несмотря на их высокую концентрацию во внеклеточной жидкости. Са2+ активно откачивается из цитозоля во внеклеточное пространство (А) и в окруженные мембраной внутриклеточные органеллы, запасающие Са2+ (Б). Кроме того, свободные ионы кальция прочно связываются различными внутриклеточными молекулами. Митохондрии тоже способны откачивать Са2+ из цитозоля, но делают это эффективно только при очень высокой концентрации Са2+, создающейся обычно при повреждении клетки.
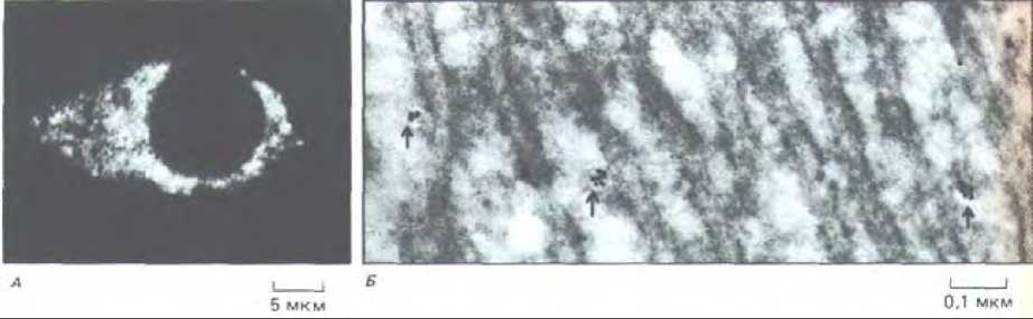
Рис. 12-19. Внутриклеточные депо для ионов Са2+, выявляемые с помощью антител к Ca2+-связывающему белку кальсеквестрину. А.
Иммунофлуоресцентная микрофотография нервной клетки крысы в культуре; видно, что места связывания кальция встречаются во всей цитоплазме. Б. Электронная микрофотография замороженного тонкого среза крысиной печени. Судя по распределению антител, меченных коллоидным золотом (указаны стрелкой), ионы Са2+ запасаются не в гранулярном эндоплазматическом ретикулуме, хотя они могут быть в каких-то элементах гладкого ретикулума. Количественный анализ таких электронных микрофотографий позволил оценить объем запасающих органелл - он составляет менее 1% объема клетки. (А - P. Volpe et al., Proc. Natl. Acad. Sci. USA 85: 1091-1095, 1988; Б-любезно предоставлено J. Meldolesi.)
Для работы этого сигнального механизма в цитозоле должна поддерживаться низкая концентрация Са2+, и это достигается несколькими способами (рис. 12-18). Все эукариотические клетки имеют в своей плазматической мембране Са2+-зависимую АТРазу, которая использует энергию расщепления АТР для откачивания ионов Са2+ из цитозоля. У мышечных и нервных клеток, особенно широко использующих сигнализацию с помощью Са2+, в плазматических мембранах есть дополнительный кальциевый насос, который связывает выход Са2+ с поступлением в клетку Na+. Этот Na+-Са2+-обменник обладает относительно низким сродством к Са2+ и поэтому начинает действовать эффективно только при 10-кратном превышении нормального уровня Са2+, что случается при многократной стимуляции мышечной или нервной клетки.
Кальциевый насос в мембранах специализированных органелл тоже играет важную роль в поддержании концентрации Са2+ в цитозоле на низком уровне: эта Са2+-АТРаза способна закачивать в органеллы большие количества ионов кальция из цитозоля против крутого градиента концентрации даже тогда, когда их уровень в цитозоле низок. Ионы Са2+ хранятся в полости запасающей органеллы в состоянии непрочной ассоциации с Са2+-связывающим белком кальсеквестрином, который обладает низким сродством к Са2+ (Кл = 103 л/моль), но высокой емкостью (~50 ионов Са2+ на молекулу). Если окрасить клетки антителами к кальсеквестрину и Са2+-АТР-азе, то выявятся одни и те же ограниченные мембранами органеллы, меньшие по размерам и отличные от гранулярного эндоплазматического ретикулума (рис. 12-19). Эти органеллы гомологичны саркоплазматическому ретикулуму в мышечных клетках (разд. 11.1.11) и, подобно этому ретикулуму, специализированы для хранения и освобождения Са2+. В дальнейшем мы будем называть их Са2+-запасающнми органеллами.
Обычно концентрация свободных ионов кальция в цитозоле варьирует в пределах примерно от 10-7 М во время покоя до 5-10-5 М при активации внешним сигналом. Но если клетка повреждена и не в состоянии эффективно откачивать ионы Са2+ из цитозоля, их концентрация может стать опасно высокой (> 10-5 М). В этих обстоятельствах начинает действовать высокоэффективный кальциевый насос с низким сродством во внутренней митохондриальной мембране, использующий энергию электрохимического градиента, который создается на этой мембране за счет энергии переноса электронов при окислительном фосфорилировании (разд. 7.1.8).
12.3.8 Ион Са2+ действует как вездесущий внутриклеточный посредник [15]
Первые данные о роли иона Са2+ как внутриклеточного посредника были получены в 1947 г., когда выяснилось, что инъекция в клетку скелетной мышцы небольшого количества Са2+ вызывает ее сокращение. В последние годы стало ясно, что Са2+ служит внутриклеточным посредником в весьма разнообразных клеточных реакциях, включая секреторные процессы и пролиферацию. Были выявлены два типа передачи сигнала с участием ионов Са2+ (рис. 12-20), один из которых реализуется главным образом в электрически активных клетках, а другой - почти во всех клетках эукариот. Первый из этих путей был подробно исследован на нервных клетках, где деполяризация плазматической мембраны вызывает поглощение Са2+ нервным окончанием, инициируя секрецию нейромедиатора; Са2+ входит через потенциал-зависимые кальциевые каналы, которые открываются при деполяризации плазматической мембраны нервного окончания в момент прихода потенциала действия (разд. 19.3.2). При втором, повсеместно распространенном способе связывание сигнальной молекулы с рецептором клеточной поверхности ведет к освобождению Са2+ из внутриклеточных хранилищ; события на поверхности клетки сопряжены с открытием кальциевых каналов во внутриклеточной мембране с помощью другого внутриклеточного посредника-инозитолтрисфосфата. Он образуется в плазматической мембране в результате быстрого гидролиза минорных фосфолипидов (инозитолфосфолипидов).
12-14
12.3.9 Инозитолтрисфосфат (ІnsР3) сопрягает активацию рецептора с освобождением Са2+ из внутриклеточных хранилищ [16]
Предположение о роли инозитолфосфолипидов (фосфоинозитидов) в передаче сигнала впервые возникло в 1953 г., когда было обнаружено, что некоторые внеклеточные сигналы стимулируют включение радиоактивного фосфата в фосфатидилинозитол (РІ) - минорный фосфолипид клеточной мембраны. Позднее было показано, что это включение обусловлено реакциями расщепления и ресинтеза инозитолфосфолипидов, запускаемыми рецептором, который активирует фермент фосфоинозитид-специфическую фосфолипазу С. Из инозитолфосфолипидов наиболее важную роль в передаче сигнала играют два фосфорилированных производных PI-Р1-фосфат (PIP) и Р1-6исфосфат (Р1Р2), которые, как полагают, находятся главным образом во внутреннем листе липидного бислоя плазматической мембраны (рис. 12-21). Хотя Р1Р2 содержится в мембранах животных клеток в гораздо меньших количествах, чем PI, наибольшее значение имеет именно гидролиз Р1Р2.
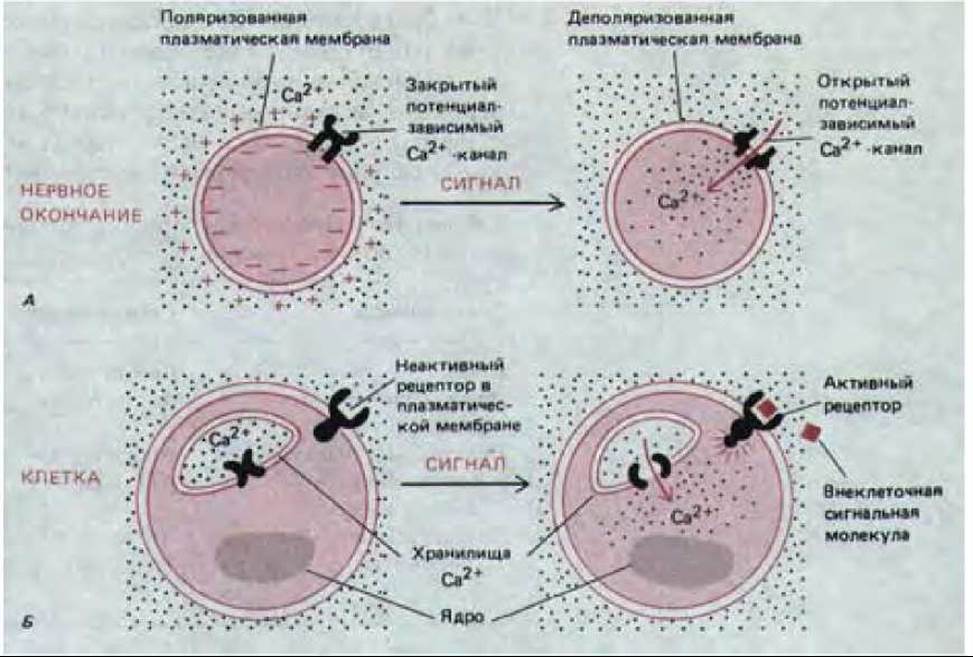
Рис. 12-20. Два главных пути, которыми Ca2+ может проникнуть в цитозоль, чтобы выполнить свою функцию внутриклеточного посредника для внеклеточных сигналов. В случае А кальций входит в нервное окончание из внеклеточной жидкости через потенциал-зависимые кальциевые каналы, когда мембрана нервного окончания деполяризуется потенциалом действия. В случае Б связывание внеклеточной сигнальной молекулы с поверхностным рецептором стимулирует выход Са2+ из его хранилищ внутри клетки.
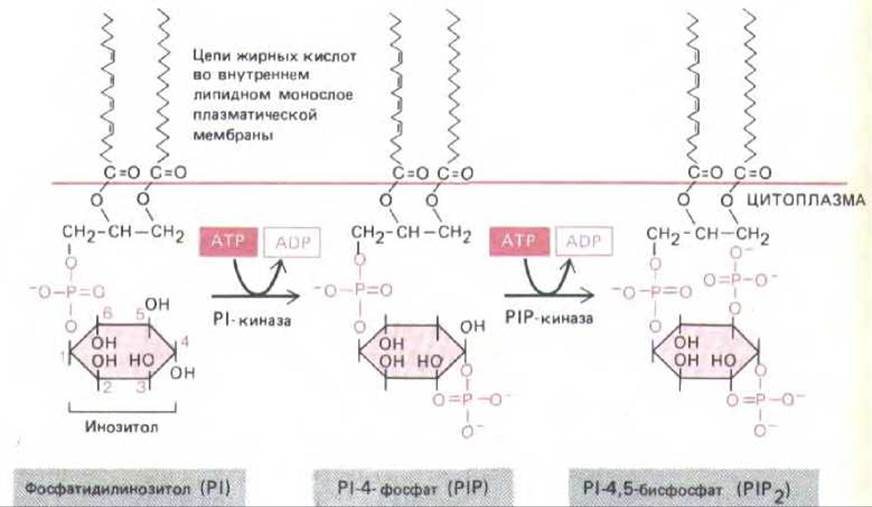
Рис. 12-21. Инозитолфосфолипиды (фосфоинозитиды) в клетках млекопитающих составляют менее 10% всех фосфолипидов клеточной мембраны. Полифосфоинозитиды (PIP и Р1Р2)-продукты фосфорилирования фосфатидилинозитола (РІ). Хотя при воздействии внешнего сигнала могут расщепляться все три инозитолфосфолипида, наибольшую роль играет расщепление Р1Р2, хотя он составляет менее 10% общего количества инозитолфосфолипидов и менее 1% всех фосфолипидов клетки.
Цепь событий, соединяющих внешний сигнал и внутренний ответ через гидролиз Р1Р2, начинается с присоединения сигнальной молекулы к ее рецептору в плазматической мембране. В настоящее время установлено, что гидролиз инозитолфосфолипидов участвует в передаче сигнала более чем от 25 различных рецепторов клеточной поверхности (табл. 12-4). Хотя детали этой активации менее ясны, чем в случае аденилатциклазы, накапливается все больше данных о том, что и здесь, в плазматической мембране, работает аналогичный многоступенчатый механизм. Вероятно, активированный рецептор активирует G-белок (пока условно названный Gp), а тот в свою очередь активирует фосфолипазу С. Менее чем за секунду этот фермент превращает РІР2 в два продукта: инозитол-трисфосфат и диацилглицерол (рис. 12-22). Здесь путь передачи сигнала разделяется на две ветви. Поскольку обе названные молекулы играют важнейшую роль в последующем развитии ответа, мы рассмотрим их по отдельности.
Таблица 12-4. Некоторые клеточные реакции, осуществляемые через фосфоинозитидный каскад.
|
Ткань-мишень |
Сигнальная молекула |
Главный ответ |
|
Печень |
Вазопрессин |
Распад гликогена |
|
Поджелудочная железа |
Ацетилхолин |
Секреция амилазы |
|
Гладкая мускулатура |
Ацетилхолин |
Сокращение |
|
ß-Клетки поджелудочной железы |
Ацетилхолин |
Секреция инсулина |
|
Тучные клетки |
Антиген |
Секреция гистамина |
|
Тромбоциты |
Тромбин |
Секреция серотонина и PDGF |
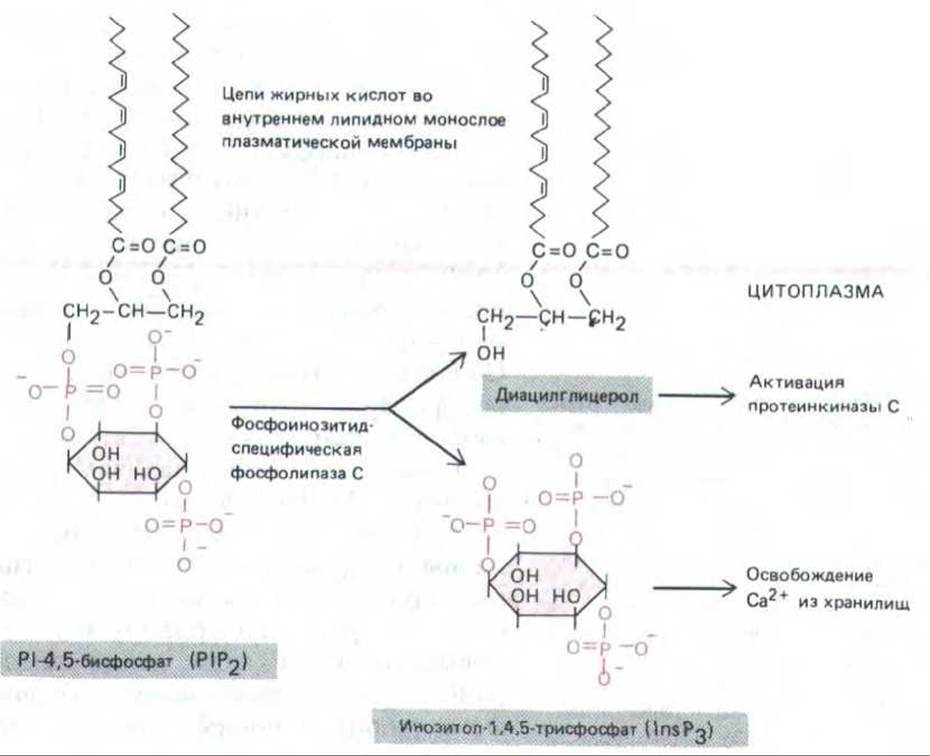
Рис. 12-22. При гидролизе Р1Р2образуется инозитолтрисфосфат (InsР3), который диффундирует через цитозоль и освобождает Са2+ из Са2+-запасающих органелл. Другой продукт гидролиза - диацил-глицерол - тоже играет важную роль во внутриклеточной передаче сигнала, активируя протеинкиназу С (см. ниже в тексте).
Инозитолтрисфосфат (InsР3)-небольшая водорастворимая молекула, которая освобождает ионы Са2+ из их хранилищ внутри клетки (рис.
12-22). Когда lnsP3 добавляют к пермеабилизованным клеткам (мембрана которых путем специальной обработки сделана проницаемой) или к выделенным внутриклеточным везикулам, он вызывает выход Са2+ в среду. Очевидно, связывание InsP3 с рецептором на цитоплазматической поверхности внутриклеточной органеллы открывает кальциевые каналы в ее мембране. Два механизма делают выброс кальция кратковременным: 1) ионы Са2+, поступающие в цитозоль, быстро откачиваются оттуда, в основном за пределы клетки (позже, после удаления стимула, клетка постепенно восполнит свой запас Са2+, поглощая его через плазматическую мембрану); 2) часть InsP3 быстро дефосфорилируется (и тем самым инактивируется) специальной фосфатазой. Однако дефосфорилируется не весь InsP3: часть его, напротив, фосфорилируется до инозитол-1,3,4,5-тетракисфосфата (InsP4), при участии которого в клетке, возможно, развиваются более медленные и продолжительные реакции. В некоторых клетках освобождение Са2+ происходит в виде серии «импульсов», каждый из которых длится 10 с или более.
12.3.10. Диацилглицерол, образующийся при гидролизе Р1Р2, активирует протеинкиназу С [17]
В то время как InsP3, образующийся при гидролизе Р1Р2, повышает концентрацию Са2+ в цитозоле, другой продукт расщепления Р1Р2-диацилглицерол - производит совершенно другие эффекты. У него есть две потенциально «сигнальные» роли: он может распадаться дальше с образованием арахидоновой кислоты, необходимой для синтеза простагландинов и родственных им медиаторов липидной природы (см. рис. 12-8), или, что важнее, способен активировать специфическую протеинкиназу, которая затем фосфорилирует ряд белков с различными функциями в клетке-мишени.
Фермент, активируемый диацилглицеролом, называется протеннкниазой С или С-киназой, так как активность его зависит от Са2+. Диацил-глицерол - продукт активации рецептора - вместе с фосфолипидом внутреннего слоя плазматической мембраны фосфатидилсерином присоединяются к протеинкиназе С, повышая ее сродство к Са2+ настолько, что она становится активной уже при низких концентрациях Са2+ в цитозоле. Во многих клетках, однако, С-киназа в норме активируется, вероятно, совместным воздействием диацилглицерола и ионов Са2+, концентрация которых в цитозоле повышается под влиянием InsP3. Активация С-киназы кратковременна, так как через несколько секунд диацилгдицерол фосфорилируется до фосфатидной кислоты или расщепляется с высвобождением арахидоновой кислоты.
С-киназа, активированная диацилглицеролом и Са2+, переносит концевую фосфатную группу с АТР на специфические сериновые или треониновые остатки белков-мишеней, которые в разных клетках различны. Например, во многих животных клетках С-киназа, по-видимому, фосфорилирует и тем самым активирует На+/Н+-обменник плазматической мембраны, контролирующий внутриклеточный рН (разд. 6.4.10); повышение рН в клетке может способствовать пролиферации. Концентрации С-киназы выше всего в головном мозгу, где помимо прочего она фосфорилирует ионные каналы нейронов, изменяя таким образом их свойства и возбудимость клеток (разд. 19.5). В некоторых клетках активация С-киназы усиливает транскрипцию определенных генов. В промоторах по меньшей мере некоторых из этих генов есть общая энхансерная последовательность, узнаваемая регуляторним белком, активность которого растет при активации С-киназы (см. табл. 10-1). Пока, однако, остается невыясненным, как С-киназа активирует этот белок - фосфорилируя (и соответственно активируя) его прямо или же действуя косвенно, через каскад протеинкиназ.
Каждый из двух путей фосфоинозитидного сигнала можно имитировать, добавляя к иутактным клеткам подходящий фармакологический агент. Эффекты InsP3 имитируются кальциевыми ионофорами, такими как А23187 или иономицин, которые позволяют ионам Са2+ входить в цитозоль из внеклеточного пространства (разд. 6.4.19). Действие диацилглицерола может быть имитировано моноацильными производными диацилглицерола или форболовыми эфирами - веществами растительного происхождения, которые присоединяются к С-киназе и непосредственно активируют ее (рис. 12-23). С помощью этих реагентов было показано, что часто для получения полноценного клеточного ответа обе ветви должны действовать совместно. Например, пролиферацию клеток многих типов в культуре можно стимулировать, одновременно применяя кальциевый ионофор и активатор С-киназы, тогда как поодиночке эти реагенты неэффективны.
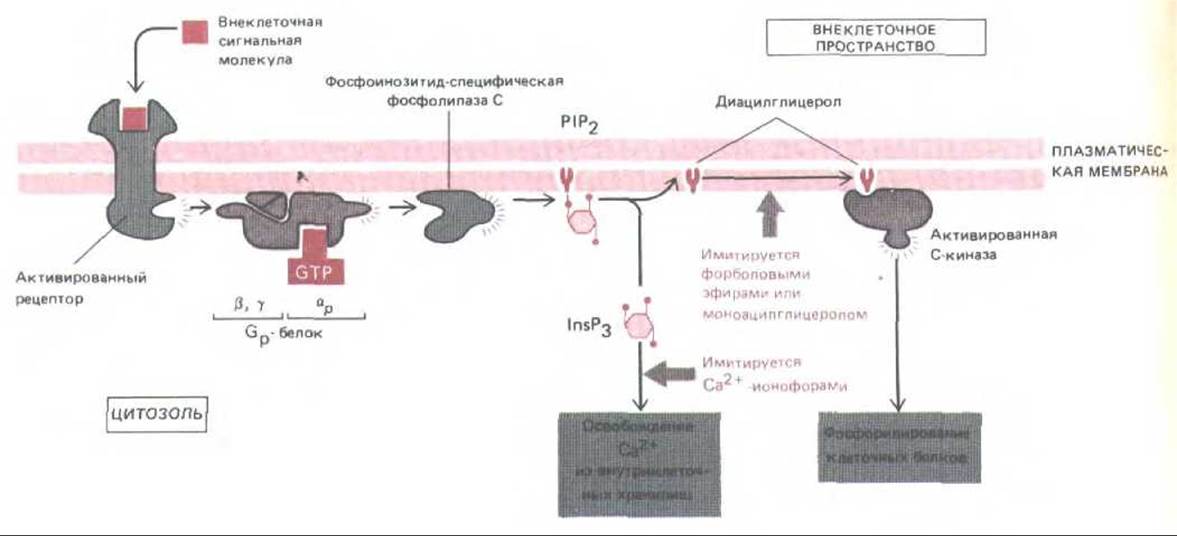
Рис. 12-23. Две ветви инозитолфос-фолипидного пути. Как полагают, активированный рецептор связывается со специфическим G-белком (Gp), заставляя его а-субъединицу диссоциировать и активировать фосфолипазу С, которая расщепляет Р1Р2 с образованием InsP3 и диацилглицерола. Истинная структура белка до сих пор не ясна. Диациглицерол (при участии не показанных на схеме связанных ионов Са2+ и фосфатидилсерина) активирует С-киназу. Оба фермента и фосфолипаза С, и С-киназа-присутствуют в клетках как в растворимой, так и в мембраносвязанной форме; в процессе активации одна из них или обе они перемещаются из цитозоля на внутреннюю поверхность плазматической мембраны. Эффект InsP3 можно имитировать экспериментально на интактных клетках обработкой Са2+-ионофором, а эффект диацилглицерола- обработкой моноацилпроизводными диацилглицерола или форбодовыми зфирами, которые связываются с С-киназой и активируют ее.
Когда по какой-то причине клетки начинают чрезмерно размножаться, это, разумеется, привлекает к себе внимание. Именно поэтому влияние форболовых эфиров на клеточную пролиферацию впервые было открыто благодаря их действию как «опухолевых промоторов» в организме животных. Опухолевые промоторы - это вещества, которые сами по себе рака не вызывают, но могут индуцировать опухолевый рост у животного после воздействия небольшой дозы канцерогена, недостаточной, чтобы вызвать рак. Когда позднее оказалось, что форболовые эфиры непосредственно активируют С-киназу, это помогло выяснить один из внутриклеточных механизмов реакции клеток на ростовые сигналы. Вообще фундаментальные исследования причин рака, и в особенности онкогенных вирусов животных, дали немало ценных сведений о путях передачи сигналов внутри клеток.
12.3.11. Так называемые ras-онкогены кодируют новый класс G-белков, участвующих в регуляции клеточного деления
По-видимому, для регуляции роста и деления клеток используется несколько различных сигнальных путей. Некоторые гены, в норме кодирующие белки - компоненты этих путей, иногда случайным образом захватывались ретровирусами и встраивались в их геном, нередко в модифицированной форме (эти ретровирусы известны также как онкогенные РНК-содержащие вирусы). Такие «украденные» у клетки вирусные гены в некоторых случаях придают вирусам способность вызывать неконтролируемую пролиферацию зараженных клеток и таким образом становятся причиной развития опухолей. Такие гены получили название вирусных онкогенов. Изучение опухолей привело к открытию опухолеродных вирусов, затем онкогенов, а это в свою очередь к открытию нормальных клеточных генов-протоонкогенов, из которых произошли вирусные онкогены (разд. 13.4.2).
Большой класс онкогенов и протоонкогенов, открытых таким путем, был назван ras-генами (так как они впервые были обнаружены в вирусах, вызывающих саркому у крыс-rat sarcoma). Эти гены кодируют G-белки, которые находятся на внутренней поверхности плазматической мембраны и здесь связывают и гидролизуют GTP. Эти ras-белки, кодируемые вирусными ras-онкогенами, отличаются от нормальных ras-белков (кодируемых протоонкогенами) заменой аминокислоты в одном из двух положений. Этого, как правило, достаточно для нарушения GTP-азной активности, а вместе с ней и механизма собственной инактивации G-белка (разд. 12.3.4). Если в культивируемые клетки ввести антитела против продуктов ras-протоонкогенов, то эти клетки теряют способность делиться в ответ на воздействие ростовых факторов. На этом основании полагают, что ras-белки каким-то образом участвуют в сопряжении рецепторов для факторов роста с внутриклеточными белками-эффекторами. Природа эффекторных белков и механизм сопряжения остаются невыясненными, хотя накапливается все больше данных о том, что эффекторные белки могут регулировать фосфоинозитидный путь передачи сигнала - по крайней мере это одна из их функций. ras-Белки-одиночные полипептиды, поэтому предположение, что Gp-белок, сопрягающий рецепторы с фосфолипазой С, кодируется ras-протоонкогеном, весьма маловероятно: тогда Gp слишком отличался бы от всех остальных G-белков-гомологичных гетеротримеров, рассмотренных в этой главе (см. табл. 12-3). Гораздо более правдоподобно, что семейство ras-протоонкогенов, включающее как минимум три члена, кодирует особую группу G-белков с новыми функциями. Несмотря на ряд неясных моментов, изучение онкогенов открыло важный новый подход к выяснению нормальных механизмов передачи клеточного сигнала с участием G-белков, а также и других клеточных сигнальных механизмов.
12.3.12. Активаторы G-белков образуют большое семейство гомологичных гликопротеинов, семикратно пронизывающих мембрану [19]
Сигнальные системы, в которых используются G-белки, удивительно многообразны. Мы видели, что некоторые G-белки (Gs и Gi) сопрягают рецепторы с аденилатциклазой, а другие (Gp) с фосфолипазой С. В глазу позвоночных G-белок, называемый трансдуцином, сопрягает поглощение фотона молекулой родопсина с активацией фермента фосфодиэстеразы, который гидролизует cGMP (разд. 12.4.5); падение концентрации этого внутриклеточного посредника приводит к электрическим изменениям в клетке-фоторецепторе. Все эти G-белки могут опосредованно, тем или иным способом изменять состояние ионных каналов, однако некоторые G-белки могут взаимодействовать с ними непосредственно. Например, присоединение ацетилхолина к рецепторам на клетках сердечной мышцы активирует Gi-подобный белок, который прямо активирует калиевый канал в плазматической мембране. (Эти рецепторы, чувствительные к алкалоиду мухомора мускарину, называют мускаринивыми рецепторами ацетилхолина в отличие от других - никотиновых рецепторов ацетилхолина, которые являются каналообразующими рецепторами скелетных мышц-см. разд. 6.4.17.)
Все до сих пор охарактеризованные G-белки, которые работают в этих столь различных системах, эволюционно родственны. Они имеют сходную субъединичную структуру и аминокислотную последовательность: у а-субъединицы трансдуцина и Gi, например, последовательности на 65% идентичны. Не удивительно, что многие, если не все, взаимодействующие с этими G-белками рецепторы тоже гомологичны между собой, что стало ясно после секвенирования их кДНК. Обобщение первичных структур рецепторов этого быстро растущего класса дало общую структуру, состоящую из одной полипептидной цепи, которая пронизывает липидный бислой семь раз. Это семейство семикратно трансмембранных белков-рецепторов включает ß-адренэргические рецепторы (рис. 12-24), мускариновые рецепторы для ацетилхолина, несколько рецепторов для нейропептидов и даже родопсин. Похоже, что все эти гликопротеины входят в очень большое семейство эволюционно родственных рецепторов. Общий структурный «мотив», вероятно, возник в эволюции рано, так как он свойствен уже бактериородопсину (светочувствительному протонному насосу, который, правда, действует не через G-белок - см. разд. 6.27) и рецепторным белкам, участвующим в регуляции созревания дрожжей (разд. 10.3.2). Однако не все рецепторы клеточной поверхности несколько раз пронизывают мембрану, и сейчас мы переходим к другому классу рецепторов - к семейству тирозин-специфических протеинкиназ.
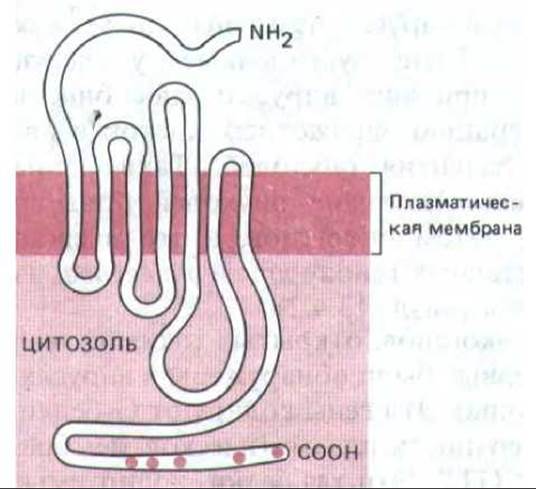
Рис. 12-24. Схема предполагаемого расположения ß-адренэргического рецептора в плазматической мембране. Выделенные красным цветом участки цитоплазматического «хвоста» указывают положение остатков серина-потенциальных мишеней для фосфорилирования при десенсибилизации рецептора (разд. 15.5.2). Установлено, что у других рецепторов, сопряженных с G-белками, полипептидная цепь тоже семикратно пронизывает мембрану. (По данным R. A. Dixon et al., Nature 321: 75-79, 1986.)
12.3.13. Многие каталитические рецепторы - гликопротеины с тирозин-специфической протеинкиназной активностью, однократно пронизывающие мембрану [20]
Обширная группа поверхностных рецепторов трансформирует внешний сигнал во внутриклеточный с помощью G-белков, но есть и такие рецепторы, которые действуют более коротким путем. Это каталитические белки-рецепторы, и наиболее изученные среди них - однократно пронизывающие мембрану тирозин-специфические протеинкиназы, каталитический домен которых находится с внутренней стороны плазматической мембраны. При связывании лиганда они активируются и переносят терминальную фосфатную группу от АТР на гидроксильную группу тирозинового остатка в определенных белках клетки-мишени. К этому семейству протеинкиназ относятся рецепторы инсулина, многих ростовых факторов, включая тромбоцитарный фактор роста (ТФР, или PDGF - platelet-derived growth factor, см. разд. 13.3.4) и фактор роста эпидермиса (ФРЭ, или EGP - epidermal growth factor), который стимулирует деление эпидермальных и многих других клеток (см. рис. 12-25). Большинство других протеинкиназ фосфорилирует сериновые или, реже, треониновые остатки в белках, так что фосфотирозин содержится менее чем в 0,1% фосфорилированных белков клетки. Во всех изученных случаях белок-рецептор с тирозинкиназной активностью фосфорилирует и сам себя, когда активирован. В случае рецептора инсулина это самофосфорилирование повышает активность киназы по типу положительной обратной связи.
Каким образом связывание лиганда с внеклеточным доменом рецептора активирует каталитический домен на другой стороне плазматической мембраны? Трудно представить себе, как конформационные изменения могли бы передаваться через липидный бислой по одиночной трансмембранной а-спирали. В случае рецептора для EGF связывание лиганда вызывает конформационные изменения наружного домена, что приводит к димеризации рецептора. Возможно, что в результате взаимодействия двух соседних цитоплазматических доменов димер приобретает каталитическую активность.
Имеется достаточно данных о том, что важную роль в сигнальном процессе играет киназная функция рецепторов. Например, клетки, содержащие мутантный рецептор инсулина с единственной аминокислотной заменой, избирательно подавляющей киназную активность, на инсулин не реагируют. Однако идентифицировать ключевые субстраты, которые фосфорилируются наряду с самим рецептором, чрезвычайно трудно, и поэтому конкретная роль фосфорилирования тирозина в передаче сигнала остается неясной. В случае рецептора для PDGF одним из субстратов, по-видимому, является киназа, фосфорилирующая фосфатидилинозитол (PI-киназа, см. рис. 12-21). Возможно, этим объясняется тот парадоксальный факт, что PDGF вызывает медленную активацию фосфоинозитидного сигнального пути, хотя его рецептор не сопряжен с Gp1.
После связывания лиганда многие каталитические рецепторы переходят внутрь клетки путем эндоцитоза в окаймленных пузырьках, содержащих комплексы рецептор-лиганд (разд. 6.5.7). В некоторых случаях такой эндоцитоз, по-видимому, определяется самофосфорилированием рецептора. Этот процесс может играть важную роль и в расщеплении сигнальных молекул, и в регуляции плотности рецепторов на поверхности клетки-мишени (разд. 12.5). Кроме того, происходящий при этом перенос домена с тирозинкиназной активностью в новый участок клетки тоже может быть существенным для сигнального процесса, хотя это пока еще не доказано.
1 В последнее время появились данные, что рецепторы по крайней мере некоторых факторов роста после связывания лиганда могут фосфорилировать и фосфолипазу С, усиливая гидролиз Р1В2. - Прим. перев.
12.3.14. Продукты некоторых онкогенов - это аномальные каталитические рецепторы с нерегулируемой киназной активностью [21]
Первая тирозиновая протеинкиназа была открыта в 1979 г. Это был не поверхностный клеточный рецептор, а внутриклеточный продукт вирусного онкогена - белок, названный рр60 v-src (разд. 13.4.2). Первым рецептором, у которого обнаружили тирозинкиназную активность (в 1982 г.), был рецептор для EGF. Несколькими годами позже выяснилось, что вирусный онкоген erbB кодирует урезанный вариант рецептора для EGF. Этот урезанный белок потерял EGF-связывающий наружный домен, но сохранил внутриклеточный домен с тирозинкиназной активностью, и поэтому клетки с такими дефектными рецепторами ведут себя так, как будто на них постоянно действует сигнал к пролиферации. Позднее выяснилось, что онкоген пеи, активный в некоторых химически индуцированных опухолях нервной системы у крыс, кодирует аномальный рецептор, являющийся тирозиновой киназой, хотя природа лиганда (предположительно это ростовой фактор) для нормального рецептора не установлена. В этом случае аномальный и нормальный рецепторы различаются только по одному аминокислотному остатку в единственном трансмембранном сегменте белка. Такого изменения оказалось достаточно, чтобы сделать тирозиновую киназу постоянно активной. Эти исследования подчеркивают важную роль тирозиновых киназ в контроле клеточной пролиферации.
Между онкогенами и нормальными путями передачи сигнала к пролиферации было обнаружено немало и других связей. Онкоген sis, например, кодирует функционально активную субъединицу PDGF, а онкоген erbA - измененную форму рецептора тиреоидного гормона. Как мы будем более подробно обсуждать в гл. 13, исследование онкогенов открывает перспективный путь к выявлению и пониманию целого спектра механизмов, с помощью которых пролиферативные сигналы достигают своей цели.
Продукты примерно половины всех открытых до сих пор онкогенов - это протеинкиназы, фосфорилирующие белки-мишени по остаткам тирозина, серина или треонина. Это не удивительно, так как фосфорилирование играет важную роль в процессах передачи сигнала, запускаемых как каталитическими рецепторами, так и рецепторами, сопряженными с G-белками, и для его осуществления имеется весьма обширное семейство протеинкиназ. Уже известно более 70 протеинкиназ, и все они, видимо, происходят от общего предшественника, так как их каталитические домены гомологичны (рис. 12-25). Фактически сейчас уже возможно предсказать, будет ли белок киназой и если да, то какие остатки - серина, треонина или тирозина - он будет фосфорилировать, просто исходя из данных о его аминокислотной последовательности. В следующем разделе мы увидим, что два главных внутриклеточных посредника - сАМР и Са2+-реализуют многие свои эффекты, активируя протеинкиназы, специфичные в отношении серина и треонина.
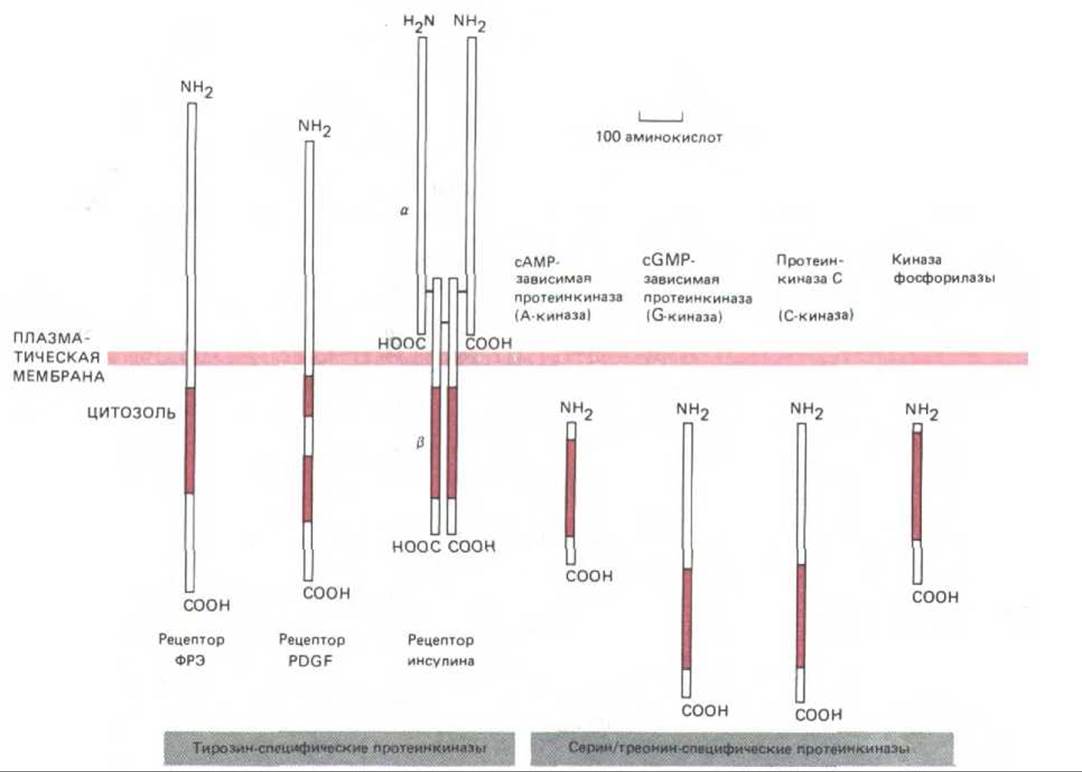
Рис. 12-25. Размеры и локализация каталитических доменов некоторых протеинкиназ, рассмотренных в этой главе. Во всех случаях каталитический домен (выделен цветом) состоит примерно из 250 аминокислотных остатков и имеет сходную аминокислотную последовательность; это позволяет предполагать происхождение их всех от общего предшественника. Три представленные здесь тирозинспецифические киназы-трансмембранные белки-рецепторы, которые при связывании специфического внеклеточного лиганда активируются и фосфорилируют ряд белков внутри клетки (в том числе и самих себя) по остаткам тирозина. Обе цепи рецептора инсулина кодируются одним геном, продукт которого - белок-предшественник - расщепляется на две цепи, связанные дисульфидными мостиками. Внеклеточная часть рецептора PDGF, по-видимому, сложена в пять иммуноглобулиноподобных доменов - возможно, этот белок относится к суперсемейству иммуноглобулинов (разд. 18.6.20). Регуляторные субъединицы А-киназы (см. рис. 12-27) и киназы фосфорилазы (см. рис. 12-31), в норме ассоциированные с этими киназами, на схеме не показаны.
Заключение
Известны три основных семейства поверхностных клеточных рецепторов, передающих внеклеточные сигналы различными способами. Рецепторы, образующие канал, - это чувствительные к нейромедиатору ионные каналы, которые быстро открываются или закрываются в ответ на связывание нейромедиатора и изменяют электрическую возбудимость клетки. Каталитические рецепторы являются в основном тирозин-специфическими киназами, которые прямо фосфорилируют определенные белки клеток-мишеней по остаткам тирозина. Рецепторы, сопряженные с G-белками, опосредованно активируют или инактивируют ферменты или ионные каналы, связанные с плазматической мембраной, через регуляторные GTP-связывающие белки (G-белки). Эти G-белки «выключают» сами себя, медленно гидролизу я связанный GTP. Некоторые из таких рецепторов активируют или ингибируют аденилатциклазу, изменяя этим концентрацию внутриклеточного посредника сАМР. Другие активируют фосфоинозитид-специфичную фосфолипазу С, которая гидролизует фосфатидилинозитол-бисфосфат (Р1Р2), образуя из него два внутриклеточных посредника: 1) инозитолтрисфосфат (InsP3), освобождающий ионы Са2+ из их внутриклеточных хранилищ и повышающий их концентрацию в цитозоле; и 2) диацилглицерол, остающийся в плазматической мембране и активирующий протеинкиназу С, которая фосфорилирует различные клеточные белки. Разнообразные ответы, вызываемые активацией рецепторов, сопряженных с G-белками, быстро прекращаются после удаления внеклеточного сигнального лиганда. При этом G-белки инактивируются сами, InsP3 быстро дефосфорилируется фосфатазой, диацилглицерол превращается в фосфатидную кислоту или расщепляется с образованием арахидоновой кислоты, сАМР гидролизуется фосфодиэстеразой, а ионы Са2+ быстро откачиваются из цитозоля.