Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Межклеточная сигнализация
Адаптация клеток-мишеней
Реагируя на стимулы почти любого типа, клетки и целые организмы обычно могут воспринимать одинаковое относительное изменение внешнего сигнала в широком диапазоне его абсолютных величин. На клеточном уровне для этого необходимо, чтобы клетки-мишени, длительно подвергающиеся воздействию какого-то стимула, теряли способность реагировать на него с первоначальной чувствительностью. Это явление, называемое адаптацией или десенситизацией (десенсибилизацией), позволяет клеткам регулировать свою чувствительность к данному стимулу. В случае химических сигналов десенситизация дает клеткам возможность воспринимать именно изменения в концентрации сигнального лиганда (а не его абсолютную концентрацию).
Десенситизация к химическим сигналам достигается разными способами. Иногда она бывает результатом уменьшения числа поверхностных рецепторов или же их инактивации; в других случаях это следствие изменения белков, участвующих в передаче сигнала уже после активации рецептора.
12-28
12.5.1. Некоторые формы десенситизации - результат эндоцитоза поверхностных рецепторов [31]
Белковые гормоны и факторы роста, присоединившиеся к поверхностным рецепторам клеток-мишеней, нередко захватываются клеткой путем эндоцитоза, опосредованного рецептором (разд. 6.5.7). Эндоцитозные пузырьки (эндосомы) впоследствии переносят свое содержимое в лизосомы, где лиганды, а иногда и их рецепторы подвергаются расщеплению гидролитическими ферментами. Этот процесс не только представляет собой важный путь разрушения некоторых сигнальных лигандов, но может играть существенную роль и в регулировании концентрации определенных рецепторных белков на поверхности клеток-мишеней. Хотя распад рецепторов и замена их новыми происходит непрерывно, в отсутствие лиганда время полужизни рецептора составляет около суток. Некоторые лиганды заметно повышают скорость расщепления рецепторов, вызывая эндоцитоз: например, у фибробластов человека, растущих в культуре без EGF, время полужизни рецепторов EGF около 10 ч, а при добавлении избытка EGF рецепторы расщепляются со временем полужизни 1 ч. При высоких концентрациях таких лигандов число поверхностных рецепторов постепенно уменьшается; в результате снижается и чувствительность клетки к данному лиганду.
Большинство типов эндоцитируемых рецепторов, однако, «не доходят» до лизосом: они освобождаются в эндосомах от своих лигандов и затем возвращаются в плазматическую мембрану для дальнейшего использования (разд. 6.5.10). Но и в этом случае при повышении концентрации лиганда большая доля циркулирующих таким образом рецепторов оказывается внутри клетки и становится недосягаемой для внеклеточного лиганда. Эту форму десенситизации называют секвестрацией рецепторов.
12-29
12-30
12.5.2. Десенситизация часто бывает связана с фосфорилированием рецепторов [32]
Для десенситизации многих рецепторов клеточной поверхности используется их обратимое фосфорилирование. Как уже говорилось ранее, эндоцитоз некоторых каталитических рецепторов (т.е. их удаление с поверхности или разрушение) зависит от их самофосфорилирования по тирозиновым остаткам (разд. 12.3.14). Другой пример - десенситизация эритроцитов лягушки при длительном воздействии адреналина. Их ß-адренэргические рецепторы постепенно модифицируются так, что через несколько часов они уже не способны активировать аденилатциклазу; инактивированные рецепторы удаляются с поверхности, по-видимому в эндосомы. Эта модификация состоит в фосфорилировании нескольких остатков серина в рецепторном белке (см. рис. 12-24), и ее осуществляет специальная протеинкиназа, которая может фосфорилировать только активированную форму рецептора. Судя по некоторым данным, фосфорилирование косвенно выключает функцию ß-рецепторов, позволяя им связываться с ингибиторным белком, что делает их неспособными активировать Cs-белки. Родопсин, структурно родственный ß-адренэргическим рецепторам (разд. 12.3.12), инактивируется после фотоактивации с помощью сходного механизма: специфическая родопсинкиназа фосфорилирует его активированные молекулы, позволяя им связаться с ингибиторным белком аррестином, который не дает им возможности активировать G-белок трансдуцин. Это, однако, лишь один из механизмов, используемый фоторецепторами для адаптации к свету (разд. 19.6.8).
12.5.3. Некоторые формы десенситизации связаны с изменениями не в рецепторах, а в G-белках [33]
Хотя большинство известных механизмов десенситизации обусловлено модификацией рецепторов, в принципе десенситизация может быть следствием изменений в любом из компонентов сигнального пути. Показано, что в некоторых случаях она связана с изменениями в G-белке. Например, если культуру фибробластов инкубировать с простагландином PGE1, который в норме активирует аденилатциклазу через Gs-белок, клетки вскоре станут нечувствительными не только к PGE1, но и к другим лигандам, рецепторы которых действуют через Gs-аденилат - циклазный путь (это называется гетерологичной десенситизацией в отличие от гомологичной, при которой рецепторы эндоцитируются или инактивируются, так что клетки теряют чувствительность только к одному лиганду - тому, который связывается с этими рецепторами). Когда Gs-белки из десенситизированных фибробластов добавляли к мембранам мутантных клеток, лишенных собственного С8-белка, они оказывались неэффективными (по сравнению с нормальными Gs-белками) активаторами аденилатциклазы. Природа изменений в Gs-белке у десенситизированных к PGE1 фибробластов еще не известна, но если и здесь причиной окажется фосфорилирование, это не вызовет удивления.
Изменения в G-белках позволили бы также объяснить некоторые аспекты наркомании. У морфинистов клетки-мишени в мозгу десенситизированы к морфину (рис. 12-39), поэтому для достижения того же эффекта обезболивания или эйфории требуется значительно большая доза наркотика, чем нормальным людям. Десенситизированные клетки, однако, имеют нормальный уровень функциональных поверхностных рецепторов морфина (опиатных рецепторов). Механизм десенситизации изучали с помощью морфин-чувствительных линий нервных клеток. Морфиновые рецепторы на поверхности этих клеток вызывают активацию Gi-белков (разд. 12.3.6), которые ингибируют аденилатциклазу и снижают таким образом уровень сАМР. Клетки, культивируемые в присутствии постоянных концентраций морфина, десенситизируются, так что аденилатциклазная активность и уровень внутриклеточного сАМР у них возвращаются к норме, хотя морфин по-прежнему связывается поверхностными рецепторами. Если теперь удалить морфин из культуральной среды, произойдет заметное повышение активности аденилатциклазы и концентрация сАМР внутри клетки необычно возрастет. Возможно, именно избыток сАМР вызывает те крайне неприятные симптомы, которые возникают при резком прекращении употребления наркотика (беспокойство, потливость, дрожь и т.д.). Действительные механизмы привыкания к морфину достоверно не известны, но предполагают, что они связаны с изменениями Gi-белков.
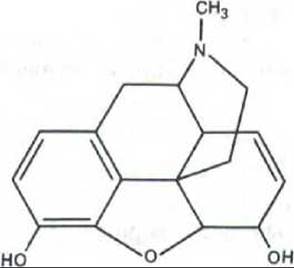
Рис. 12-39. Структура морфина, получаемого из маковых зерен. Почему некоторые из наших клеток имеют рецепторы для препаратов, подобных морфину? Фармакологи давно предполагали, что морфин имитирует какие-то эндогенные сигнальные молекулы, регулирующие восприятие боли и настроение. В 1975 г. из мозга свиньи были выделены два пептида с морфиноподобным действием, названные энкефалинамн.
Вскоре из гипофиза и других тканей удалось выделить более длинные пептиды, получившие название эндорфинов. Все эти так называемые эндогенные опиаты содержат общую последовательность из 4 аминокислот и связываются с теми же поверхностными рецепторами, что и морфин (и родственные наркотики). Однако в отличие от морфина они быстро разрушаются в организме и поэтому не накапливаются в количествах, достаточных для развития привыкания, наблюдаемого у морфинистов.
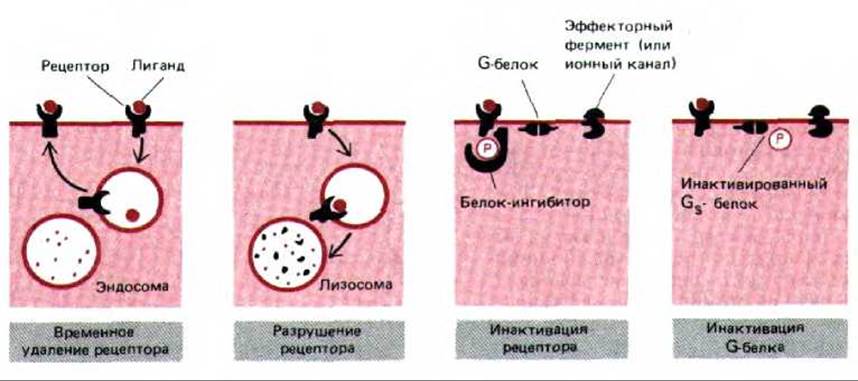
Рис. 12-40. Четыре возможных способа десенситизации клеток-мишеней при длительном воздействии сигнальной молекулы. Изображен рецептор, в норме активирующий или ингибирующий эффекторный фермент (или ионный канал) через G-белок. Хотя механизмы инактивации, показанные здесь для рецептора и для G-белка, включают фосфорилирование, возможны и другие виды модификаций (они описаны при обсуждении бактериального хемотаксиса, разд. 12.5.4). Кроме того, в инактивации рецептора путем фосфорилирования не всегда участвует белок-ингибитор.

Рис. 12-41. Фотографии бактерий Salmonella typhimurium, собирающихся у кончика стеклянного капилляра с аминокислотой серином (А) и избегающих капилляра с фенолом (Б). Снимки сделаны через 5 мин после внесения капилляров в чашки с бактериями. Такой тест-простой способ демонстрации хемотаксиса. (В. A. Rubik, D.E. Koshland, Proc. Natl. Acad. Sci. USA 75: 2820-2824, 1978.)
Различные механизмы десенсибилизации клеток-мишеней, которые мы рассмотрели, суммированы на рис. 12-40.
12.5.4. Адаптация играет центральную роль в бактериальном хемотаксисе [34]
Многие виды химической сигнализации между клетками многоклеточных животных могли возникнуть из тех приспособлений, с помощью которых одноклеточные организмы реагируют на химические изменения в окружающей среде. В самом деле, как уже говорилось, некоторые внутриклеточные посредники используются организмами того и другого типа. К наиболее изученным реакциям одноклеточных на внешние сигналы относятся явления хемотаксиса, при которых движение клетки направляется к источнику определенного вещества или от него. Хемотаксис эукариотических клеток рассмотрен в разд. 14.3.2 на примере клеточной стадии слизевика Dictyostelium discoideum и в разд. 11.6.4 на примере нейтрофилов человека. Мы закончим эту главу описанием бактериального хемотаксиса, который в основном благодаря успехам генетического анализа - особенно четко и элегантно иллюстрирует центральную роль адаптации в ответах на химические сигналы.
Подвижные бактерии плывут в сторону более высоких концентраций питательных субстратов (аттрактантов), например Сахаров и аминокислот, и «убегают» от высоких концентраций вредных веществ (репеллентов) (рис. 12-41). Это сравнительно простое, но весьма целесообразное поведение - хемотаксис - наиболее интенсивно изучалось на бактериях E.coli и Salmonella typhimurium. Мы будем говорить здесь в основном о хемотаксисе по направлению к аттрактантам; движение прочь от репеллентов обеспечивается теми же механизмами, но действующими «наоборот».
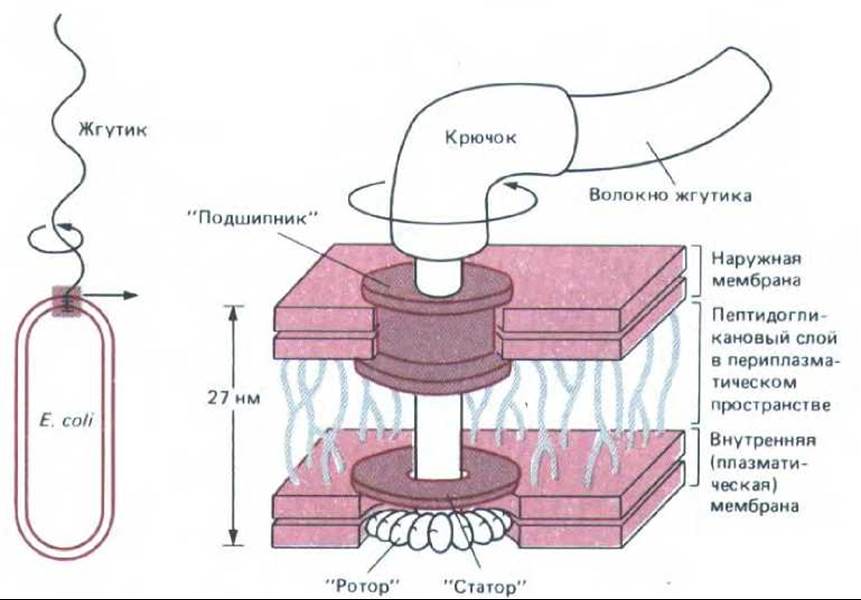
Рис. 12-42. Схема «мотора», вращающего жгутик Е. coli. «Ротором» служит белковый диск, расположенный в плазматической мембране. Под действием трансмембранного протонного градиента он быстро вращается (около 100 об/с) в липидном бислое относительно другого белкового диска («статора»). «Ротор» расположен на одной оси с крючком и жгутиком и заставляет их вращаться. Белковый «подшипник» служит для герметизации наружной мембраны в месте прохождения через нее вращающегося стержня. На рисунке неподвижные детали окрашены, а вращающиеся оставлены белыми (По М. L. de Pamphilis, J. Adler, J. Bacteriol. 105: 384-395; 396-407, 1971, с изменениями.)
Бактерии плавают с помощью жгутиков, устроенных значительно проще, чем жгутики эукариотических клеток (разд. 11.3.2). Бактериальный жгутик - это спиральная трубочка из одинаковых субъединиц белка флагеллина. Основание каждого жгутика прикреплено с помощью короткого гибкого крючка к маленькому белковому диску, погруженному в бактериальную мембрану. Этот диск составляет часть микроскопического «мотора», который приводит в быстрое вращение спиральный жгутик, используя энергию трансмембранного протонного градиента (рис. 12-42).
Поскольку жгутики на поверхности бактерии закручены в спираль в одну определенную сторону, направление их вращения не безразлично для движения. Вращение против часовой стрелки позволяет всем жгутикам собраться в общий пучок, так что бактерия равномерно плывет в одном направлении. Но при вращении по часовой стрелке пучок рассыпается на отдельные жгутики и бактерия начинает беспорядочно кувыркаться на месте (рис. 12-43). В отсутствие внешних стимулов вращение дисков изменяется на противоположное каждые несколько секунд, что приводит к характерной картине: прямолинейное движение прерывается резкими изменениями направления в периоды кувыркания (рис. 12-44, А)
Аттрактанты и репелленты видоизменяют обычное движение бактерий. Они присоединяются к специфическим белковым рецепторам и влияют на частоту кувырканий, увеличивая или уменьшая интервал между двумя последовательными сменами направления, в котором вращаются жгутики. Когда бактерии плывут в сторону большей концентрации аттрактанта, они кувыркаются реже, чем тогда, когда плывут в противоположную сторону (или когда вообще нет градиента). Поскольку периоды прямолинейного движения длиннее при перемещении «вверх» по градиенту концентрации, бактерии будут постепенно приближаться к источнику аттрактанта (рис. 12-44, A). И наоборот, встретив возрастающую концентрацию репеллента, бактерии будут кувыркаться чаще обычного и в результате постепенно удаляться от его источника.
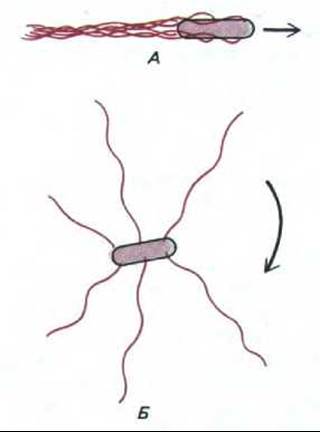
Рис. 12-43. Схема расположения жгутиков Е. coli при движении клетки. Если жгутики вращаются против часовой стрелки (А), то они собираются в единый пучок, который действует как пропеллер и обеспечивает прямолинейное движение. При вращении жгутика по часовой стрелке (Б) пучок рассыпается, и бактерия начинает кувыркаться.
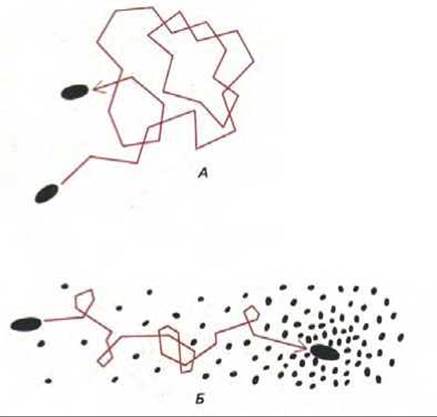
Рис. 12-44. Траектории плывущих бактерий. В отсутствие хемотаксического сигнала (А) периоды прямолинейного движения прерываются короткими периодами кувыркания, которые случайным образом изменяют направление движения. В присутствии аттрактанта (Б) кувыркание частично подавляется, когда бактерия случайно движется в сторону большей его концентрации. Это ведет к постепенному приближению бактерии к источнику аттрактанта.
В естественных условиях бактерии улавливают пространственные градиенты различных веществ, замечая изменения их концентрации во времени при своем равномерном передвижении с места на место (из-за малых собственных размеров бактериям было бы чрезвычайно трудно выявлять пространственные градиенты путем сравнения концентраций на разных концах клетки). В лабораторных условиях изменения концентраций во времени можно моделировать быстрым добавлением или удалением какого-либо вещества. Если добавить в культуральную среду аттрактант, кувыркание, как и следовало ожидать, быстро (за десятые доли секунды) подавляется, однако через некоторое время, несмотря на присутствие аттрактанта, частота кувыркания возвращается к норме. Бактерии остаются в этом адаптированном состоянии до тех пор, пока концентрация аттрактанта не изменится снова: добавление аттрактанта быстро подавляет кувыркания, а его удаление - усиливает, пока бактерия не приспособится к новому уровню. Адаптация играет в хемотаксисе важнейшую роль, так как позволяет бактериям реагировать не на постоянную абсолютную величину, а на изменение концентрации аттрактанта и продолжать движение, когда оно происходит в нужном направлении.
12-31
12.5.5. В бактериальном хемотаксисе участвуют четыре гомологичных трансмембранных рецептора [35]
Раскрытие молекулярных механизмов бактериального хемотаксиса стало возможным в основном благодаря выделению и анализу мутантов с различными нарушениями этого процесса. Таким путем было показано, что хемотаксические реакции на ряд веществ зависят от небольшого семейства близко родственных трансмембранных белков-рецепторов, ответственных за передачу сигналов через плазматическую мембрану. Эти хемотаксические рецепторы метилируются во время адаптации (см. ниже), и поэтому их часто называют метил-акцептирующими белками хемотаксиса (рис. 12-45).
В плазматической мембране есть четыре типа рецепторов хемотаксиса и каждый из них обусловливает ответ на узкую группу химических соединений. Два опосредуют реакцию на серии и на аспартат соответственно, прямо связывая эти аминокислоты и преобразуя это событие во внутриклеточный сигнал. Два других передают ответ на сахара и дипептиды, но они активируются косвенно через периплазматические субстрат-связывающие белки, которые участвуют также в транспорте Сахаров и дипептидов через плазматическую мембрану (разд. 6.4.13). Эти белки, «плавающие» в периплазматическом пространстве (между внешней мембраной бактерии и плазматической мембраной), специфически связывают сахара и дипептиды и затем образуют комплексы с подходящими рецепторами хемотаксиса в плазматической мембране, активируя их (рис. 12-46). Хотя в системах транспорта этих Сахаров и дипептидов и в соответствующих системах хемотаксиса используются одни и те же первичные рецепторы (субстрат-связывающие белки), в остальном их механизмы различны. На это указывают мутации, инактивирующие транспорт, но не влияющие на хемотаксис, и наоборот.
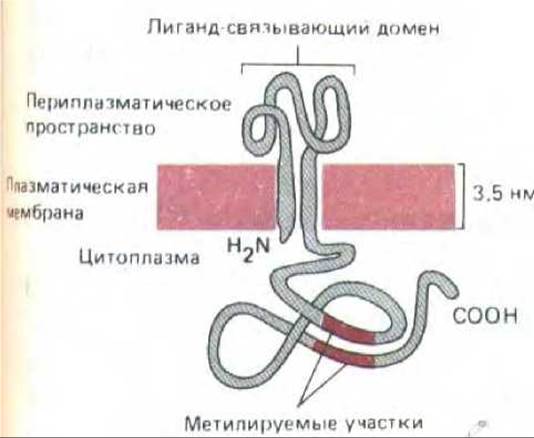
Рис. 12-45. Структура хемотаксического рецептора. Два участка полипептидной цепи, подвергающиеся метилированию, содержат весьма консервативную последовательность из 13 аминокислот.
Этот рисунок отражает структуру рецептора для аспартата, однако сходное строение имеют хемотаксические рецепторы всех четырех типов. (По A. F. Russo, D. Е. Koshland, Jr., Science 220: 1016-1020, 1983. Copyright 1983 by the A A AS.)
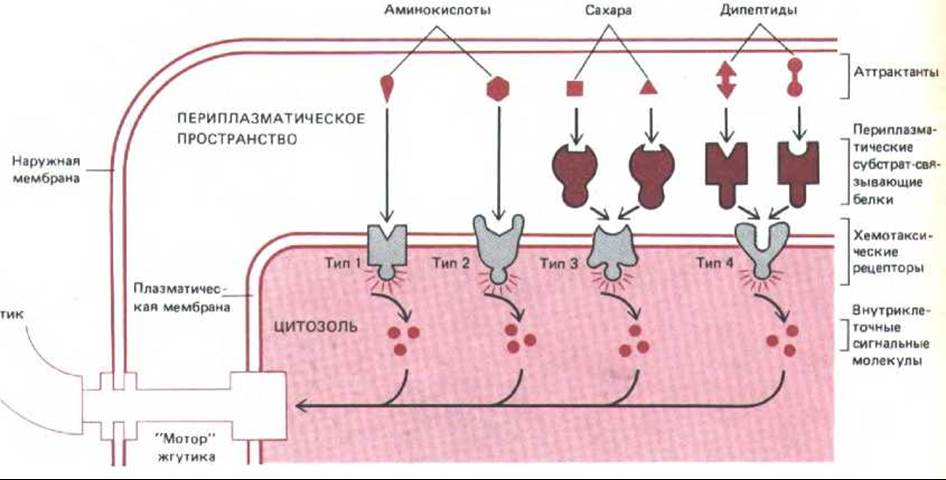
Рис. 12-46. Этапы преобразования сигнала при хемотаксисе у бактерий. Химические аттрактанты связываются с хемотаксическими рецепторами типа 1 или 2 в плазматической мембране или с периплазматическими субстрат-связывающими белками, которые затем присоединяются к хемотаксическим рецепторам типа 3 или 4. Это приводит к активации рецепторов, и они передают внутрь клетки сигнал, заставляющий «мотор» жгутика вращаться против часовой стрелки; в результате кувыркание подавляется и периоды прямолинейного движения становятся более длительными. Аттрактанты проникают в периплазматическое пространство снаружи через широкие каналы во внешней мембране (не показано).
12.5.6. Адаптация обусловлена метилированием белков [35]
Имеются убедительные данные в пользу того, что адаптацию при хемотаксисе бактерий обеспечивает ковалентное присоединение метальной группы к белковым рецепторам хемотаксиса. Если метилирование блокировано мутацией, адаптации не происходит, и тогда присутствие аттрактанта подавляет кувыркание в течение нескольких дней, а не минут. Таким образом, активация рецепторов хемотаксиса имеет два различных (и раздельных) следствия: 1) быстро развивается возбуждение, так как активированный рецептор создает внутриклеточный сигнал, заставляющий мотор жгутика продолжать вращение против часовой стрелки, и в результате клетка продвигается вперед без кувырканий; 2) происходит медленная адаптация, обусловленная тем, что активированный рецептор становится доступным для метилирования цитоплазмати-ческими ферментами, и за несколько минут его активация сходит на нет (рис. 12-47).
Метилирование рецептора катализируется растворимым ферментом (метилтрансферазой), который переносит метильную группу на свободный карбоксил остатка глутаминовой кислоты в активированном рецепторе (рис. 12-48). На один рецептор может быть перенесено до четырех метильных групп; степень метилирования повышается с ростом концентрации аттрактанта, когда каждый рецептор в течение большей доли всего времени находится в комплексе с лигандом. При удалении аттрактанта рецептор деметилируется растворимым ферментом (рис. 12-48). Хотя уровень метилирования во время хемотаксических реакций изменяется, у адаптированных бактерий он остается постоянным, так как при этом достигается точное равновесие между скоростями метилирования и деметилирования.
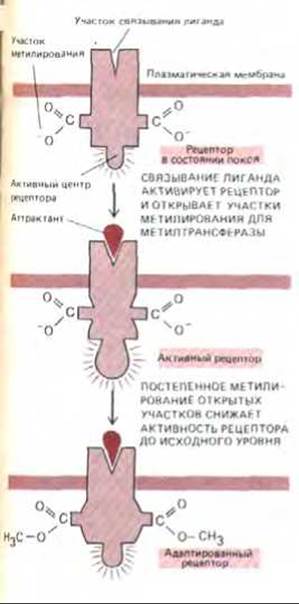
Рис. 12-47. Последовательные процессы активации и адаптации (в результате метилирования) хемотаксического рецептора. Обратите внимание, что активность рецептора (а значит, и частота кувырканий бактерии) в исходном и в адаптированном состоянии одинакова. Для простоты рецептор показан с двумя участками метилирования, в действительности же у каждого рецептора их четыре. При повышении концентрации лиганда доля времени, когда рецептор занят лигандом, увеличивается. Более высокая концентрация лиганда вызывает большее конформационное изменение рецептора, чем низкая, и приближает его состояние к предельно измененному. Однако медленное усиление метилирования через несколько минут восстанавливает исходную конформацию, причем большей концентрации аттрактанта соответствует большее число метильных групп на рецепторе. Рецептор теперь адаптирован. Хотя на схеме показано прямое присоединение лиганда к рецептору, в некоторых случаях он сначала присоединяется к периплазматическому субстрат-связывающему белку, который затем взаимодействует с рецептором.
12.5.7. Активация рецептора и изменения во вращении жгутиков сопряжены через каскад фосфорилирования белков [36]
Активация рецептора хемотаксиса аттрактантами и репеллентами должна создавать внутриклеточный сигнал, влияющий на направление вращения жгутика. Генетические исследования показали, что в передаче этого сигнала участвуют четыре цитоплазматических белка - CheA, CheW, CheY я CheZ. CheY и CheZ действуют в конце зффекторного пути и контролируют направление вращения жгутика, видимо, связываясь с его «мотором». CheY дает сигнал вращаться по часовой стрелке, и бактерия начинает кувыркаться. Мутанты, у которых функциональный CheY утрачен, плавают совсем без кувыркания. CheZ оказывает действие, противоположное CheY, заставляя «мотор» вращаться против часовой стрелки, что ведет к прямолинейному движению клеток. Белки CheA и, возможно, CheW передают сигнал от рецептора хемотаксиса белкам CheY и CheZ с помощью механизма, включающего фосфорилирование и дефосфорилирование белков.
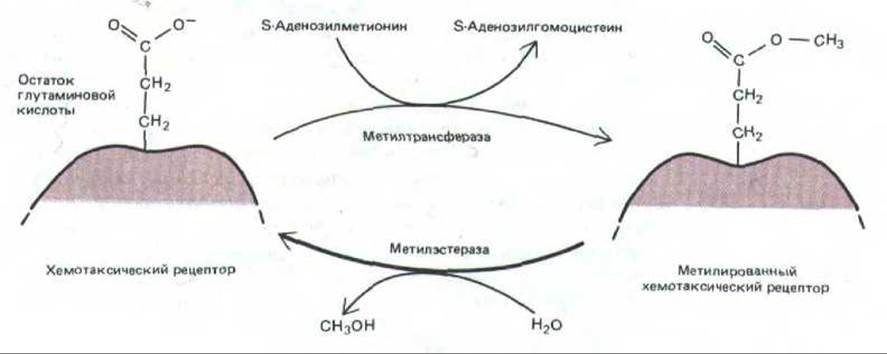
Рис. 12-48. Реакции метилирования и деметилирования белковых хемотаксических рецепторов. С помощью эфирных связей к каждому рецептору может присоединиться до четырех метильных групп.
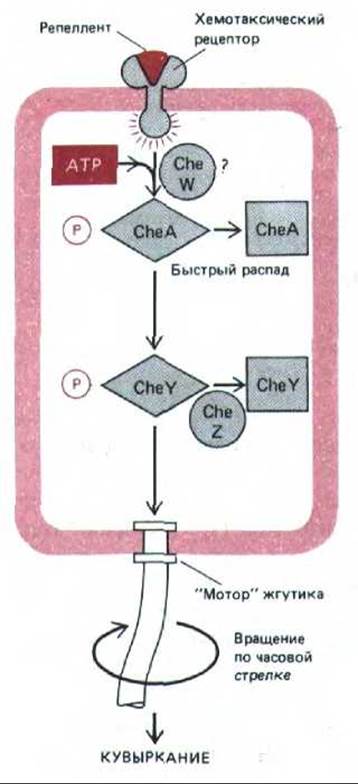
Рис. 12-49. Система фосфорилирования, с помощью которой, как полагают, хемотаксические рецепторы способны контролировать «мотор» жгутика. Связывание репеллента активирует рецептор, что приводит к кратковременному фосфорилированию CheA. CheA быстро переносит свой ковалентне связанный высокоэнергетический фосфат прямо на CheY. CheY-фосфат связывается с «мотором» жгутика и заставляет его вращаться по часовой стрелке, вызывая кувыркание. Связывание аттрактанта дает противоположный эффект, снижая фосфорилирование CheA и CheY, и вращение жгутика против часовой стрелки приводит к прямолинейному движению. CheZ ускоряет дефосфорилирование CheY-фосфата, действуя как антагонист CheY. Каждый из этих фосфорилированных интермедиатов живет около 10 с, что позволяет бактерии быстро реагировать на изменение среды (см. рис. 12-34). Как хемотаксический рецептор взаимодействует с CheA и какую роль в процессе играет CheW, пока не известно.
Опыты in vitro с очищенными белками показали, что CheA-это протеинкиназа, которая в присутствии АТР фосфорилирует сама себя, а затем быстро переносит фосфатную группу на CheY. Фосфорилированный CheY дефосфорилируется с участием CheZ, который, как уже говорилось, является антагонистом CheY in vivo. По-видимому, CheY активируется (и вызывает кувыркание), будучи фосфорилирован киназой CheA, а инактивируется (что позволяет бактерии плыть прямо), когда его дефосфорилирует CheZ. Как полагают, при связывании хемотаксическими рецепторами аттрактанта фосфорилирование CheA и CheY снижается, CheY инактивируется и бактерия меньше кувыркается и дольше плывет по прямой линии; репелленты же, напротив, активируют CheA-зависимое фосфорилирование CheY, что приводит к активации CheY и стимулирует кувыркание (рис. 12-49).
Этот же набор белков осуществляет адаптацию. CheA фосфорилирует фермент, деметилирующий рецепторы хемотаксиса (см. рис. 1248), повышая его активность и обеспечивая тем самым регуляцию хемотаксических рецепторов по принципу обратной связи.
По-видимому, все гены и белки, участвующие в бактериальном хемотаксисе, уже идентифицированы, а большинство белков секвенировано и выделено в больших количествах. Похоже, что мы быстро приближаемся к выяснению практически полной молекулярной картины этой формы адаптивного поведения.
Заключение
Временно и обратимо адаптируясь к высоким концентрациям сигнального лиганда, клетки могут регулировать свою чувствительность к величине стимула, отвечая, таким образом, на изменение концентрации лиганда, а не на ее абсолютную величину. Адаптация достигается разными способами: 1) связанный лиганд может вызывать переход рецепторов внутрь клетки, где они некоторое время остаются в «скрытом» состоянии или же разрушаются в лизосомах; 2) активированные рецепторы могут обратимо инактивироваться путем фосфорилирования или метилирования; 3) нерецепторные белки сигнального пути (типа G-белков) тоже могут обратимо инактивироваться с помощью неясных пока механизмов. Пример адаптации, лучше всего изученный на молекулярном уровне, - это бактериальный хемотаксис: обратимое метилирование ключевого мембранного белка в цепи передачи сигнала позволяет клеткам передвигаться в оптимальном направлении.
Литература
Цитированная
1. Smith E.L. et al. Principles of Biochemistry: Mammalian Biochemistry, 7th ed, pp. 355 619. New York, McGraw-Hill, 1983.
Snyder S. H. The molecular basis of communication between cells. Sci. Am., 253 (4), 132-140, 1985.
2. Norman A. W., Litwach G. Hormones. San Diego, CA, Academic, 1987.
Wilson J. D., Foster D. W. Williams' Textbook of Endocrinology, 7th ed. Philadelphia, Saunders, 1985.
3. Simpson I. A., Cushman S. W. Hormonal regulation of mammalian glucose transport. Annu. Rev. Biochem., 55, 1059-1089, 1986.
4. Beer D. J., Matloff S. M., Rocklin R. E. The influence of histamine in immune and inflammatory responses. Adv. Immunol., 35, 209-268, 1984.
Gospodarowicz D., Cheng J., Lui G. M., Baird A., Bohlen P. Isolation of brain fibroblast growth factor by heparin sepharose affinity chromatography: identity with pituitary fibroblast growth factor. Proc. Natl. Acad. Sci. USA, 81, 6963-6967, 1984.
5. Smith W. L., Borgeat P. The eicosanoids: prostaglandins, thromboxanes, leukotrienes, and hydroxyeicosaenoic acids. In: Biochemistry of Lipids and Membranes (D. E. Vance, J. E. Vance, eds.), pp. 325-360. Menlo Park, CA, Benjamin-Cummings, 1985.
6. Evans R. M. The steroid and thyroid hormone receptor superfamily. Science, 240, 889-895, 1988.
Gehring U. Steroid hormone receptors: biochemistry, genetics, and molecular biology. Trends Biochem. Sci., 12, 399-402, 1987.
Ivarie R. D., O'Farrell P. H. The glucocorticoid domain: steroid-mediated changes in the rate of synthesis of rat hepatoma proteins. Cell, 13, 41-55, 1978.
Yamamoto K. R. Steroid receptor regulated transcription of specific genes and genenetworks. Annu. Rev. Genet., 19, 209-252, 1985.
7. Ashburner M., Chihara C., Meltzer P., Richards G. Temporal control of puffing activity in polytene chromosomes. Cold Spring Harbor Symp.
Quant. Biol., 38, 655-662, 1974.
8. Attardi В., Ohno S. Physical properties of androgen receptors in brain cytosol from normal and testicular feminized (Tfrn/y) mice.
Endocrinology, 103, 760-770, 1978.
9. BerridgeM. The molecular basis of communication within the cell. Sci. Am., 253 (4), 142-152, 1985.
Kahn C. R. Membrane receptors for hormones and neurotransmitters. J. Cell Biol., 70, 261-286, 1976.
Levitski A. Receptors: A Quantitative Approach. Menlo Park, Ca. Benjamin-Cummings, 1984.
Rees Smith В., BucklandP. R. Structure-function relations of the thyrotroprin receptor. In: Receptors, Antibodies and Disease. Ciba Foundation Symposium 90 (D. Evered, J. Whelan, eds.), pp. 114-132. London, Pitman, 1982.
Snyder S. H. The molecular basis of communication between cells. Sci. Am., 253 (4), 132-140, 1985.
10. Pastan I. Cyclic AMP. Sci. Am., 227(2), 97-105, 1972.
SutherlandE. W. Studies on the mechanism of hormone action. Science, 177, 401-408, 1972.
11. Schramm M., Selinger Z. Message transmission: receptor controlled adenylate cyclase system. Science, 225, 1350-1356, 1984.
12. Casperson G.F., Bourne H. R. Biochemical and molecular genetic analysis of hormone-sensitive adenylate cyclase. Annu. Rev. Pharmacol. Toxicol., 27, 371-384, 1987.
Feder D. et al. Resonstruction of beta1-adrenoceptor-dependent adenylate cyclase from purified components. EMBO J. 5, 1509-1514, 1986. Rodbell M. The role of hormone receptors and GTP-regulatory proteins in membrane transduction. Nature, 284, 17-22, 1980.
13. Oilman A.G. G proteins and dual control of afenylate cyclase. Cell, 36, 577-579, 1984.
Gilman A. G. G proteins: transducers of receptor-generated signals. Annu. Rev.
Biochem., 56, 615 649, 1987. Lai C.-Y. The chemistry and biology of cholera toxin. CRC Crit. Rev. Biochem., 9, 171-206, 1980.
Levitzki A. From epinephrine to cyclic AMP. Science, 241, 800-806, 1988. Stryer L., Bourne H. R. G proteins: a family of signal transducers. Annu. Rev. Cell Biol., 2, 391-419, 1986.
14. Carafoli E. Intracellular calcium homeostasis. Annu. Rev. Biochem., 56, 395-433, 1987.
CarafoliE., Penninston J.T. The calcium signal. Sci. Am., 253(5), 70-78, 1985.
Evered D., Whelan J., eds. Calcium and the Cell. Ciba Foundation Symposium 122. Chichester, U.K., Wiley, 1986.
Volpe P. et al. "Calciosome", a cytoplasmic organelle: the inositol 1,4,5-trisphosphate-sensitive Ca2+ store of nonmuscle cells? Proc. Natl. Acad. Sci. Usa, 85, 1091-1095, 1988.
15. Augustine G.J., Charlton M.P., Smith S.J. Calcium action in synaptic transmitter release. Annu. Rev. Neurosci., 10, 633-639, 1987.
Heilbrunn L. V., Wiercenski F. J. The action of various cations on muscle protoplasm. J. Cell. Comp. Physiol., 29, 15-32, 1947.
16. Berridge M.J. Inositol lipids and calcium signalling. Pro. R. Soc. Lond. (Biol.), 234, 359-378, 1988.
Cockcroft S. Polyphosphoinositide phosphodiesterase: regulation by a novel guanine nucleotide binding protein, Gp. Trends Biochem. Sci., 12, 75-78, 1987.
Majerus P. W. et al. The metabolism of phosphoinositide-derived messenger molecules. Science, 234, 1519-1526, 1986.
Michell R. H., Putney J. W., eds. Inositol Lipids in Cellular Signaling. Current Communications in Molecular Biology. Cold Spring Harbor, NY. Cold Spring Harbor Laboratory, 1987.
Sekar M. C., Hokin L. L. 1 he role of phosphoinositides in signal transduction. J. Membr. Biol., 89, 193-210, 1986.
Woods N. M., Cuthbertson K. S. R., Cobbold P. H. Repetitive transient rises incytoplasmatic free calcium in hormone-stimulated hepatocytes. Nature, 319, 600-602, 1986.
17. Angel P. et al. Phorbol ester-inducible genes contain a common cis element recognized by a TPA-modulated /raws-acting factor. Cell, 49, 729-739, 1987.
Bell R. M. Protein kinase C activation by diacylglycerol second messengers. Cell, 45, 631-632, 1986.
Lee W., Mitchell P., Tijan R. Purified transcription factor AP-1 interacts with TPA-inducible enhancer elements. Cell, 49, 741-752, 1987. Nishizuka Y. Studies and perspectives of protein kinase C. Science, 233, 305-312, 1986.
Parker P. J. et al. The complete primary structure of protein kinase C - the major phorbol ester receptor. Science, 233, 853-859, 1986.
18. Barbacid M. ras genes. Annu. Rev. Biochem., 56, 779-827, 1987.
19. Dohlman H.G., Caron M.G., Lefkowitz R.J. A family of receptors coupled to guanine nucleotide regulatory proteins. Biochemistry, 26, 26572664, 1987.
Dunlap K., Holz G. G., Rane S. G. G proteins as regulators of ion channel function. Trends Neurosci., 10, 241-244, 1987.
Kubo T. et al. Cloning, sequencing and expression of complementary DNA encoding the muscarinic acetylcholine receptor. Nature, 323, 411416, 1986.
Masu Y. et al. cDNA cloning of bovine substance-K receptor through oocyte expression system. Nature, 329, 836-838, 1987.
StryerL. The molecules of visual excitation. Sci. Am., 257(1), 42-50, 1987.
20. Carpenter G. Receptors for epidermal growth factor and other polypeptide mitogens. Annu. Rev. Biochem., 56, 881-914, 1987.
Kaplan D. R. et al. Common elements in growth factor stimulation and oncogenic transformation: 85 kd phosphoprotein and phosphatidylinositol kinase activity. Cell, 50, 1021-1029, 1987.
Rosen O.M. After insulin binds. Science, 237, 1452-1458, 1987. Schlessinger J. Allosteric regulation of the epidermal growth factor receptor kinase. J. Cell Biol., 103, 2067-2072, 1986.
Yarden Y, Ullrich A. Growth factor receptor tyrosine kinases. Annu. Rev. Biochem., 57, 443-478, 1988.
21. Deuel T.F. Polypeptide growth factors: roles in normal and abnormal cell growth. Annu. Rev. Cell Biol., 3, 443-492, 1987.
Hanks S. K., Quinn A. M., Hunter T. The protein kinase family: conserved features and deduced phylogeny of the catalytic domains. Science, 241, 42-52, 1988. Hunter T. A thousand and one protein kinases. Cell, 50, 823-829, 1987.
Ullrich A. et al. Human insulin receptor and its relationship to the tyrosine kinase family of oncogenes. Nature, 313, 756-761, 1985.
22. Cohen P. Control of Enzyme Activity, 2nd ed. London. Chapman and Hall, 1983. Edelman A.M., Blumenthal D.K., Krebs E. G. Protein serine/threonine kinases. Annu. Rev. Biochem, 56, 567-613, 1987.
23. Cohen P. Protein phosphorylation and the control of glycogen metabolism in skeletal muscle. Philos. Trans. R. Soc. Lond. (Biol.), 302, 13-25, 1983.
Montminy M. R., Bilezikjian L. M. Binding of a nuclear protein to the cyclic-AMP response of the somatostatin gene. Nature, 328, 175-178, 1987.
Pilkis S. J., El-Maghrabi M. R., Claus Т. Н. Hormonal regulation of hepatic gluconeogenesis and glycolysis. Annu. Rev. Biochem, 57, 755784, 1988.
Smith S. В., White H. D.. Siegel J. В., Krebs E. G. Cyclic AMP-dependent protein kinase I: cyclic nucleotide binding, structural changes, and release of the catalytic subunits. Proc. Natl. Acad. Sci. USA, 78, 1591-1595, 1981.
24. Alemany S., Pelech S., Brier ley С. Н., Cohen P. The protein phosphatases involved in cellular regulation. Evidence that dephosphorylation of glycogen phosphorylase and glycogen synthase in the glycogen and microsomal fractions of rat liver are catalysed by the same enzyme: protein phosphatase-1. Eur. J. Biochem., 156, 101-110, 1986.
Ingebritsen T.S., Cohen P. Protein phosphatases: properties and role in cellular regulation. Science, 221, 331 338, 1983.
25. Baku Y.S. et al. Three-dimensional structure of calmodulin. Nature, 315, 37-40, 1985.
Cheung W.Y. Calmodulin. Sci. Am., 246(6), 48-56, 1982.
Gerday C., Gilles R., Bolis L., eds. Calcium and Calcium Binding Proteins. Berlin, Springer-Verlag, 1988.
Klee C.B., Crouch Т.Н., Richman P.O. Calmodulin. Annu. Rev. Biochem., 49, 489-515, 1980.
26. Cohen P. Protein phosphorylation and hormone action. Proc. R. Soc. Lond. (Biol.), 234 115-144, 1988.
27. Golberg N. D., Haddox M. K. Cyclic GMP metabolism and involvement in biological regulation. Annu. Rev. Biochem., 46, 823 896, 1977. Nakamura Т., Gold G. H. A cyclic nucleotide-gated conductance in olfactory receptor cilia. Nature, 325, 442-444, 1987.
Schnapf J.L., Bay lor D.A. How photoreceptor cells respond to light. Sci. Am., 256, (4), 40-47, 1987.
Stryer L. Cyclic GMP cascade of vision. Annu. Rev. Neurosci., 9, 87-119, 1986.
28. Cohen P. Protein phosphorylation and hormone action. Proc. R. Soc, Lond. (Biol.), 234, 115-144, 1988.
29. Schimke R. T. On the roles of synthesis and degradation in regulation of enzyme levels in mammalian tissues. Curr. Top. Cell. Regul., 1, 77-124, 1969.
30. Lewis J., Slack J., Wolpert L. Thresholds in development. J. Theor. Biol., 65, 579-590, 1977.
Miller S. G., Kennedy M. B. Regulation of brain type II Ca2+/calmodulin-dependent protein kinase by autophosphorylation: a Ca2+-triggered molecular switch. Cell, 44, 861-870, 1986.
Mulvihill E. R., Palmiter R. D. Relationship of nuclear estrogen receptor levels to induction of ovalbumin and conalbumin mRNA in chick oviduct. J. Biol. Chem., 252, 2060-2068, 1977.
31. Lefkowitz R.J., ed. Receptor regulation. Receptors and Recognition. Series B, Vol. 13. London, Chapman and Hall, 1981.
Soderquist A.M., Carpenter G. Biosynthesis and metabolic degradation of receptors for epidermal growth factor. J. Memb. Biol., 90, 97-105, 1986.
32. Sibley D. R., Benovic J. L., Caron M. G., Lefkowitz R. J. Regulation of transmembrane signaling by receptor phosphorylation. Cell, 48, 913-922, 1987.
33. Kassis S., Fishman P. H. Different mechanisms of desensitization of adenylate cyclase by isoproterenol and prostaglandin Et in human fibroblasts: role of regulatory components in desensitization. J. Biol. Chem., 257, 5312-5318, 1982.
Klee W.A., Sharma S.K., Nirenberg M. Opiate receptors as regulators of adenylate cyclase. Life Sci., 16, 1869-1874, 1975.
Snyder S.H. Opiate receptors and internal opiates. Sci. Am., 236(3), 44-56, 1977.
34. Adler J. The sensing of chemicals by bacteria. Sci. Am., 234(4), 40-47, 1976. Berg H. How bacteria swim. Sci. Am., 233(2), 36-44, 1975.
35. Koshlad D. E., Jr. Biochemistry of sensing adaptation in a simple bacterial system. Annu. Rev. Biochem., 50, 765-782, 1981.
Russo A.F., Koshland D.E. Receptor modification and absolute adaptation in bacterial sensing. In: Sensing and Response in Microorganisms (M. Eisenbach, M. Balaban, eds.), pp. 27-41. Amsterdam, Elsevier, 1985.
Springer M.S., Goy M.F., Adler J. Protein methylation in behavioral control mechanisms and in signal transduction. Nature, 280, 279-284, 1979.
36. Hess J. F., Oosawa K., Kaplan N., Simon M. I. Phosphorylation of three proteins in the signaling pathway of bacterial chemotaxis. Cell, 53, 79-87, 1988.
Oosawa K., Hess J. F., Simon M. L Mutants defective in bacterial chemotaxis show modified protein phosphorylation. Cell, 53, 89-96, 1988.