Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Клеточная адгезия, соединения между клетками и внеклеточный матрикс
Межклеточные соединения
Специализированные межклеточные соединения особенно многочисленны и важны в эпителиях, но во многих местах контакта между клетками и между клетками и матриксом они встречаются во всех тканях. В большинстве своем они слишком малы для того, чтобы их можно было увидеть в световой микроскоп; однако их можно выявить с помощью электронной микроскопии в обычных препаратах или же в препаратах, полученных методом замораживания-скалывания. В обоих случаях видно, что взаимодействующие плазматические мембраны (а нередко и подстилающие их участки цитоплазмы и межклеточное пространство) имеют в этих местах высокоспециализированную структуру. Клеточные соединения могут быть разделены на три функциональные группы: 1) запирающие соединения, которые так тесно сцепляют клетки в эпителиальном пласте, что делают невозможным прохождение даже небольших молекул с одной стороны пласта на другую; 2) прикрепительные контакты, которые механически связывают клетки (и их цитоскелеты) с соседними клетками или внеклеточным матриксом; и 3) коммуникационные контакты, по которым передаются химические или электрические сигналы между взаимодействующими клетками.
Основные типы межклеточных соединений внутри каждой из этих групп перечислены в табл. 14-1. Основным типом замыкающих контактов являются плотные соединения; адгезионные соединения и десмосомы составляют основной тип прикрепительных контактов; а щелевые контакты, химические синапсы нервных клеток и, наконец, плазмоде с мы, образующиеся между растительными клетками, - это главные виды коммуникационных контактов. Так как химические синапсы и плазмодесми будут детально рассматриваться в гл. 19 и 20 соответственно, мы не будем обсуждать их в этой главе.
Таблица 14-1. Функциональная классификация клеточных соединений
|
I. Замыкающие (плотные) соединения II. Прикрепительные соединения 1. Места прикрепления актиновых филаментов (адгезионные контакты) а) между клетками (например, адгезионные пояса) б) между клетками и матриксом (например, фокальные контакты) 2. Места прикрепления промежуточных филаментов а) между клетками (десмосомы) б) между клетками и матриксом (полудесмосомы) III. Коммуникационные соединения 1. Щелевые контакты 2. Химические синапсы 3. Плазмодесмы (только у растений)1 |
1) Это единственный род соединений между растительными клетками.
14-4
14-5
14.1.1. Плотные соединения создают в эпителиальных клеточных пластах барьер проницаемости [2]
Несмотря на существенные структурные и биохимические различия между разными типами эпителиев, эти ткани обладают по меньшей мере одной общей функцией: они служат барьерами с избирательной проницаемостью, разделяющими жидкости разного химического состава по обе стороны пласта. Плотные соединения играют вдвойне важную роль в поддержании такой барьерной функции. Это хорошо иллюстрируется на примере кишечного эпителия млекопитающих.
Эпителиальные клетки, выстилающие тонкий кишечник, удерживают большую часть содержимого кишки в ее внутренней полости (просвете). Однако в то же время они должны перекачивать определенные питательные вещества через клеточный пласт во внеклеточную жидкость соединительной ткани по другую сторону пласта (см. рис. 14-1), откуда эти вещества диффундируют в кровеносные сосуды. Такой трансэпителиальный перенос осуществляют две группы транспортных белков, связанных с мембраной. Одна группа расположена на апикальной поверхности (обращенной в просвет кишки) и активно переносит избранные молекулы из просвета в эпителиальные клетки; другая группа расположена на базолатеральных (базальных и латеральных) поверхностях клеток и позволяет тем же молекулам выходить из клеток, облегчая диффузию во внеклеточную жидкость по другую сторону эпителия (рис. 14-2). Для поддержания такого направленного транспорта нужно, чтобы апикальные транспортные белки не могли переходить на базолатеральную поверхность клетки, а базолатеральные - на апикальную поверхность. Кроме того, щели между эпителиальными клетками должны быть так закупорены, чтобы транспортируемые молекулы не могли диффундировать обратно в полость кишки через межклеточные пространства «вниз» по градиентам концентрации, создающимся в результате трансэпителиального переноса.
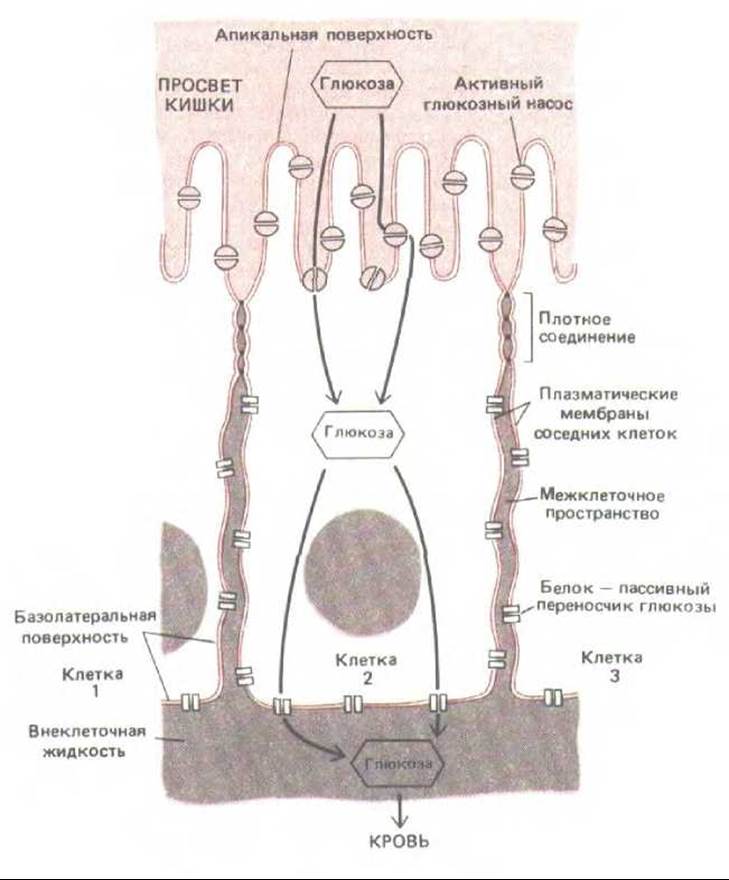
Рис. 14-2. Схема эпителиальной клетки из тонкой кишки: показано, как плотные контакты разграничивают области плазматической мембраны, в которых могут находиться различные транспортные белки. Такое разграничение обеспечивает перенос питательных веществ из просвета кишки через эпителиальный слой в кровь. В представленном здесь примере глюкоза активно транспортируется в клетку глюкозними насосами апикальной поверхности, а затем выходит из клетки путем облегченной диффузии при участии белков - пассивных переносчиков глюкозы, находящихся в базолатеральной области мембраны. Плотные соединения, по-видимому, ограничивают перемещение белков определенными участками плазматической мембраны, действуя как диффузионные барьеры внутри ее липидного бислоя; эти соединения блокируют также диффузию липидных молекул в наружном (но не во внутренном) листке липидного бислоя.
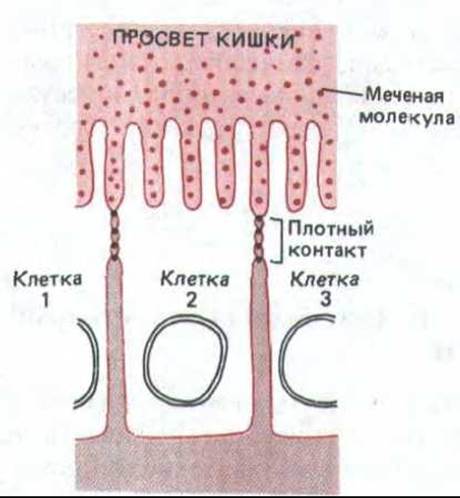
Рис. 14-3. Растворимая меченая молекула, введенная по одну сторону эпителиального слоя, не может пройти через плотные соединения, скрепляющие соседние клетки. Но это препятствие не абсолютно, и есть данные о том, что клетки могут изменять свойства своих плотных соединений для регулирования потока растворенных веществ и воды через эпителий.
По-видимому, плотные соединения между эпителиальными клетками препятствуют обоим этим видам диффузии. Во-первых, они действуют как барьеры для диффузии мембранных белков между апикальной и базолатеральной поверхностями плазматической мембраны (рис. 14-2). Такая нежелательная диффузия компонентов мембраны происходит при разрушении плотных соединений, например при удалении внеклеточных ионов Са2+, необходимых для сохранения целостности плотного соединения. Во-вторых, соседние клетки оказываются так плотно сомкнутыми, что даже и водорастворимые молекулы не проходят между ними: если с одной сторони эпителиального клеточного пласта ввести электроноплотный маркер из малых молекул, то обычно он не проникает через плотное соединение (рис. 14-3).
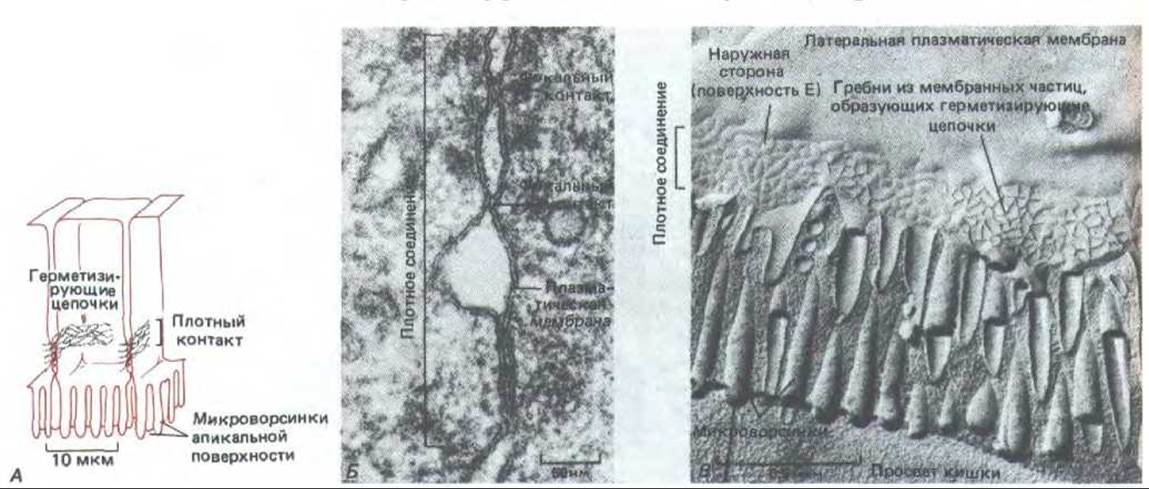
Рис. 14-4. Структура плотного соединения между эпителиальными клетками тонкой кишки. А, Схема. Б. Электронная микрофотография препарата, полученного методом замораживания-скалывания. В. Обычная электронная микрофотография. Обратите внимание, что клетки ориентированы апикальными концами вниз. На фото Б плоскость микрофотографии параллельна плоскости мембраны; видно, что плотное соединение образовано сетью из герметизирующих цепочек, опоясывающей каждую клетку в пласте. Эти герметизирующие цепочки видны как гребни из внутримембранных частиц на внутренней (цитоплазматической) поверхности скола (В) или как комплементарные им бороздки на наружной поверхности мембраны (Н). На обычном препарате (В) соединение выглядит как серия фокальных контактов между наружными липидными слоями двух смежных мембран; каждый такой контакт соответствует герметизирующей цепочке в поперечном разрезе. [Б и В из N. В. Giluda. Tn: Cell Communication (R.P, Cox, ed.), pp. 1-29. New York, Wiley, 1974. Reprinted by permission of John Wiley a. Sons, Inc.]
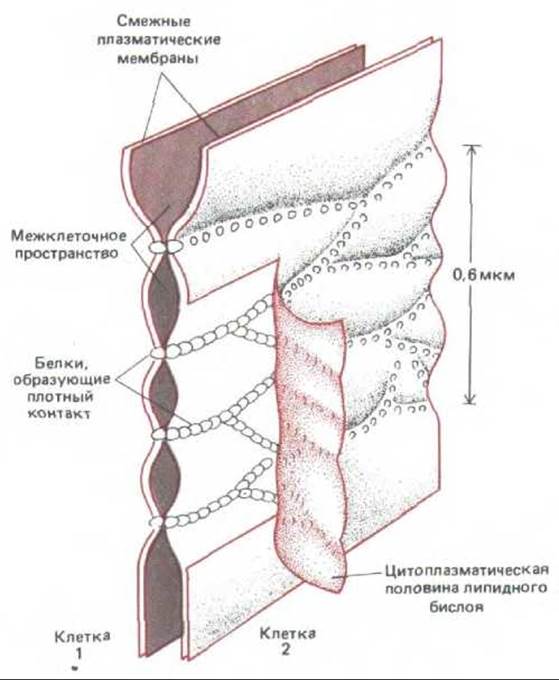
Рис. 14-5. Современная модель строения плотного соединения. Предполагается, что смежные плазматические мембраны скреплены непрерывными цепочками из особых трансмембранных белков, осуществляющих контакт через межклеточное пространство и образующих герметичное соединение. Чтобы показать эти белковые цепочки, внутренний липидный монослой одной из мембран на этой схеме отогнут. На препаратах, приготовленных методом замораживания -скалывания, белки плотного соединения остаются не на наружном монослое мембраны, как показано здесь, а на внутреннем, где создают узор внутримебранных частиц, показанный на рис. 14-4, Б.
Молекулярная структура плотного соединения еще не ясна, но электронная микроскопия с применением метода замораживания - скалывания показывает, что оно состоит из сети анастомозирующих волокон, которая оплетает апикальный конец каждой клетки по всей его окружности (рис. 14-4, А и Б). На обычных электронных микрофотографиях они видны как серии локальных соединений между наружными поверхностями двух смежных плазматических мембран (рис. 14-4, В). Хотя все плотные соединения непроницаемы для макромолекул, их проницаемость для малых молекул сильно различается у разных эпителиев. Например, в эпителии, выстилающем тонкий кишечник, плотные соединения в 10000 раз более проницаемы для ионов, чем в эпителии мочевого пузыря. Способность соединения препятствовать переходу ионов через межклеточные пространства увеличивается в логарифмической зависимости от числа волокон в сети, как если бы каждое волокно действовало как независимый барьер. Как полагают, волокна состоят из длинных рядов специфических трансмембранных белков каждой из двух контактирующих мембран, которые (белки) непосредственно соединяются друг с другом, замыкая межклеточное пространство (рис. 14-5).
14.1.2. Прикрепительные контакты связывают цитоскелет клетки с цитоскелетом соседней клетки или с внеклеточным матриксом
Прикрепительные контакты встречаются во многих тканях. Они позволяют группам клеток, например эпителиальных, функционировать в виде прочных структурных единиц, скрепляя цитоскелетные элементы разных клеток между собой или с внеклеточным матриксом (рис. 14-6). Их больше всего в тканях, подверженных большим механическим нагрузкам, таких как сердечная мышца, эпидермис или шейка матки. Они встречаются в двух структурно и функционально различных формах: 1) адгезионные соединения и 2) десмосомы и полудесмосомы. Адгезионные контакты служат местами соединения актиновых филаментов, а десмосомы и полудесмосомы - местами соединения промежуточных филаментов.
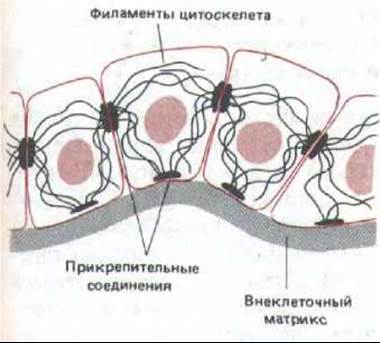
Рис. 14-6. На этой схеме показано, как соединены филаменты цитоскелета с такими же филаментами соседних клеток и с внеклеточным матриксом.
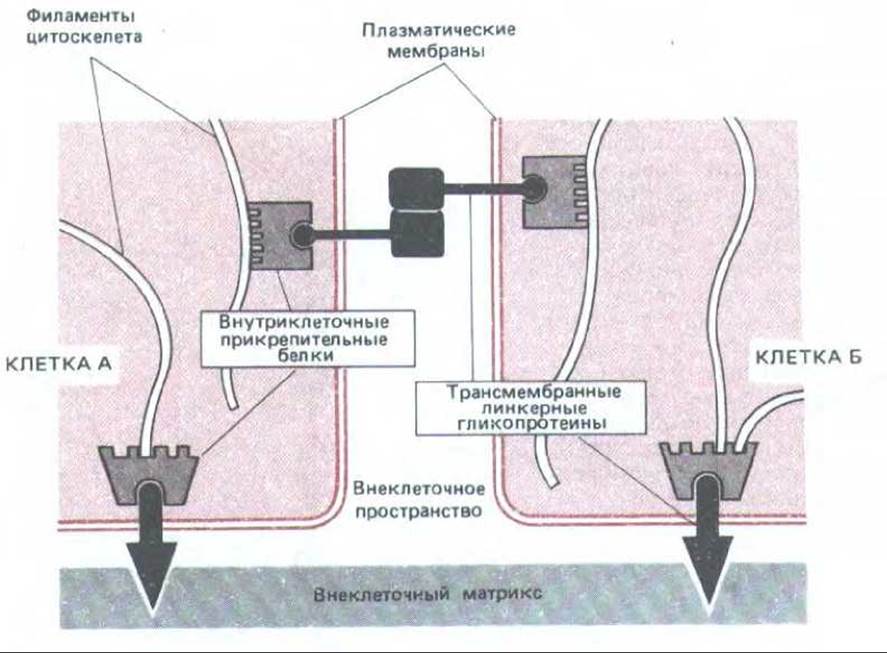
Рис. 14-7. Схема функциональной роли двух групп белков, образующих прикрепительные контакты: внутриклеточных прикрепительных белков и трансмембранных линкерных гликопротеинов. В данном примере внеклеточные домены трансмембранных линкерных гликопротеинов, скрепляющих клетки, взаимодействуют непосредственно. В других случаях они могут быть соединены дополнительными белками, находящимися во внеклеточном пространстве. Комплексы внутриклеточных прикрепительных белков связывают линкерные гликопротеины с цитоскелетом.
Прежде чем рассматривать различные классы прикрепительных контактов, следует вкратце охарактеризовать общие принципы их структуры. Как показано на рис. 14-7, все эти соединения состоят из белков двух типов: 1) внутриклеточных прикрепительных белков, которые связывают соединительный комплекс со специфическими элементами цитоскелета (актиновыми или промежуточными филаментами), и 2) трансмембранных линкерных гликопротеинов, внутриклеточные домены которых связаны с одним или несколькими внутриклеточными прикрепительными белками, а внеклеточные домены взаимодействуют либо с внеклеточным матриксом, либо с внеклеточными доменами трансмембранных линкерных гликопротеинов другой клетки.
14.1.3. Адгезионные соединения связывают внутриклеточные пучки актиновых филаментов с такими же пучками других клеток или с внеклеточным матриксом [3]
Межклеточные адгезионные соединения весьма многообразны. Во многих неэпителиальных тканях они принимают форму точечных или линейных контактов, связывающих актиновые филаменты в кортикальной цитоплазме смежных клеток. В эпителиальных пластах они часто образуют непрерывный адгeзионный пояс (zonula adherens) вокруг каждой из контактирующих клеток, расположенных около апикального конца клетки чуть ниже плотного соединения. У соседних клеток адгезионные пояса находятся прямо друг против друга и удерживаются вместе с помощью Са2+-зависимого механизма. Трансмембранные линкерные гликопротеины, участвующие в таком соединении, по-видимому, относятся к семейству Са2+-зависимых молекул межклеточной адгезии, называемых кадгеринами (cadherins) (разд. 14.3.7). Адгезионный пояс называют также опоясывающей десмосомой, однако следует учитывать, что он в химическом отношении существенно отличается от настоящей десмосомы (см. ниже).
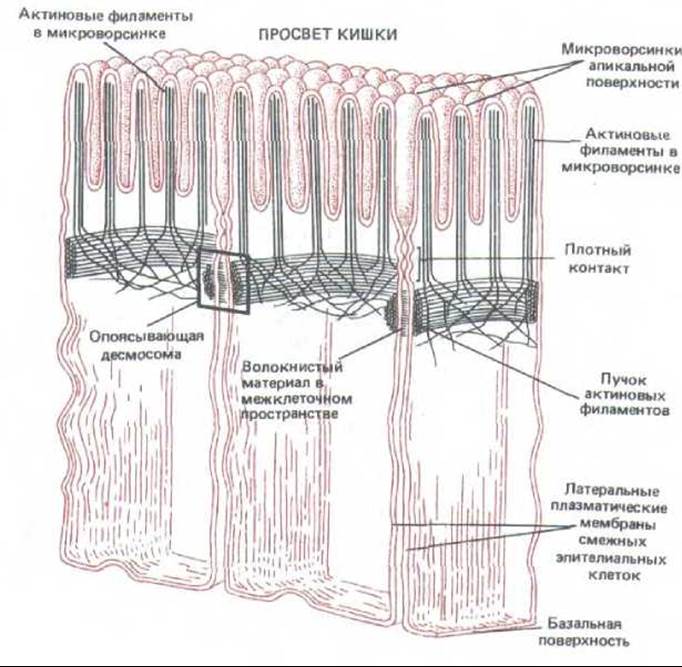
Рис. 14-8. Адгезионные пояса (опоясывающие десмосомы) между эпителиальными клетками тонкой кишки. Такое соединение опоясывает каждую из контактирующих клеток; его характерная особенность-наличие сократимого пучка актиновых филаментов, лежащих под цитоплазматической поверхностью мембраны в зоне соединения.
Внутри каждой клетки под адгезионным поясом лежит сократимый пучок актиновых филаментов, расположенных параллельно плазматической мембране; к адгеэионному поясу этот пучок прикреплен с помощью комплекса внутриклеточных белков, содержащего винкулин (разд. 11.2.8). Таким образом, актиновые пучки посредством трансмембранных гликопротеинов организуются в плотную межклеточную сеть (рис. 14-8), которая, как полагают, участвует в одном из фундаментальных процессов морфогенеза животных-в сворачивании эпителиальных пластов в трубки и другие подобные структуры (рис. 14-9).
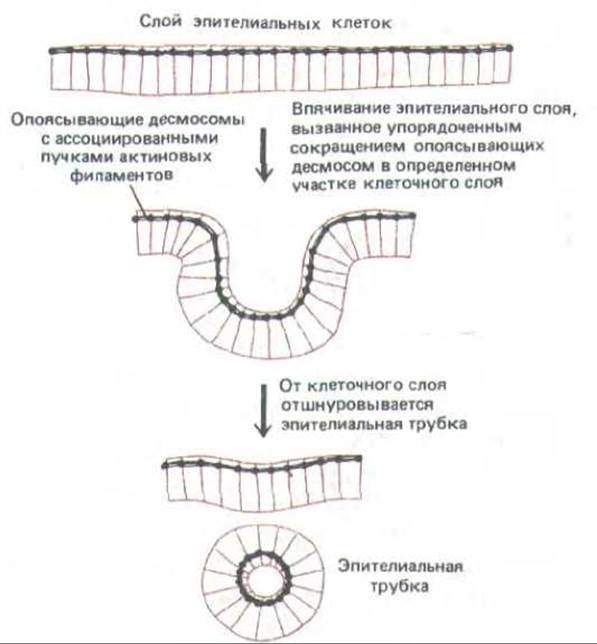
Рис. 14-9. Сворачиванис эпителиального слоя в трубку (например, при образовании нервной трубки). Как полагают, координированное сокращение пучков актиновых филаментов, лежащих вдоль опоясывающих десмосом, приводит к сужению апикальных концов клеток в определенных участках клеточного слоя, и в результате этот слой свертывается в трубку, которая затем отделяется от образовавшего ее эпителия.
Например, согласованное сокращение таких пучков в нервной пластинке приводит к сужению апикального конца каждой эпителиальной клетки, и в результате этого пластинка свертывается в нервную трубку на ранней стадии развития позвоночного (разд. 16.1.10).
Адгезионные соединения между клетками и матриксом связывают клетки и их актиновые филаменты с внеклеточным матриксом. Например, фибробласты при росте на искусственном субстрате, покрытом молекулами внеклеточного матрикса, плотно прикрепляются к нему в специализированных участках плазматической мембраны, называемых локальными контактами или адгезионными пластинками, как раз там, где кончаются пучки актиновых филаментов (разд. 11.2.8). Многие клетки в тканях устанавливают сходные локальные контакты с окружающим их внеклеточным матриксом. Крупный трансмембранный линкерный гликопротеин (который служит на клеточной поверхности рецептором для гликопротеина внеклеточного матрикса - фибронектина, см. разд. 14.2.13) в таких пластинках образует одно из связующих звеньев между матриксом и пучками актиновых филаментов. Внеклеточный домен такого рецептора для фибронектина связывается с молекулами фибронектина на поверхности культуральной чашки, а его внутриклеточный домен связывается с одним из прикрепительных белков-талином, который в свою очередь присоединяется к винкулину; винкулин же присоединен к одному или двум другим белкам, которые связываются с актином (см. рис. 1138).
Рецептор фибронектина - это только один представитель обширного семейства трансмембранных линкерных гликопротеинов, называемых интегринами (разд. 14.2.17), которые, по-видимому, связывают пучки актиновых филаментов с внеклеточным матриксом. Некоторые интегрины хорошо изучены, и на их примере видно, как трансмембранные линкерные гликопротеины, участвующие в межклеточной адгезии (кадгерины и др.), могут соединять пучки кортикальных актиновых филаментов соседних эпителиальных клеток; однако в адгезионных поясах винкулин присутствует без талина.
14.1.4. Десмосомы связывают промежуточные филаменты соседних клеток; полудесмосомы связывают эти филаменты с базальной мембраной [4]
Десмосомы представляют собой «точечные» структуры межклеточного контакта, которые, подобно заклепкам, скрепляют клетки в различных тканях, главным образом в эпителиальных (рис. 14-10). Они служат также местами прикрепления промежуточных филаментов (разд. 11.5), образующих структурный каркас цитоплазмы, который противодействует растяжению. Таким образом, промежуточные филаменты соседних клеток объединены при помощи десмосом в непрерывную сеть, пронизывающую всю ткань. Тип промежуточных филаментов, прикрепленных к десмосомам, зависит от типа клеток: в большинстве эпителиальных клеток это кератиновые филаменты, в волокнах сердечной мышцы-десминовые, а в некоторых клетках, покрывающих поверхность мозга-виментиновые (см. табл. 11-5).
Электронная микроскопия и биохимические исследования показывают, что десмосома состоит из (1) плотной цитоплазматической пластинки, образованной комплексом внутриклеточных белков, ответственных за прикрепления цитоскелета, и (2) трансмембранных линкерных гликопротеинов, которые связаны с пластинкой и взаимодействуют между собой своими внеклеточными доменами, удерживая вместе смежные плазматические мембраны (рис. 14-11). Роль десмосом в соединении клеток выявляется при некоторых формах потенциально смертельного кожного заболевания пемфигуса, при котором у больных образуются антитела к одному или нескольким десмосомным линкерным гликопротеинам собственного организма; это приводит к разрушению десмосом между клетками эпидермиса и появлению многочисленных волдырей в результате просачивания тканевых жидкостей в разрыхленный эпителий. Антитела разрушают десмосомы только в коже, из чего следует, что десмосомы в других тканях, возможно, имеют иную биохимическую природу.
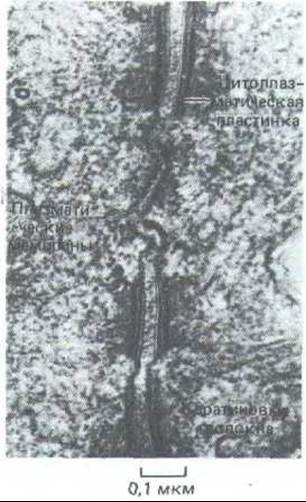
Рис. 14-10. Электронная микрофотография трех десмосом между двумя эпителиальными клетками в кишке крысы. [N. В. Gilula. In: Cell Communication (R.P. Cox, ed.), pp. 1-29. New York, Wiley, 1974. Reprinted by permission of John Wiley a. Sons, inc.]
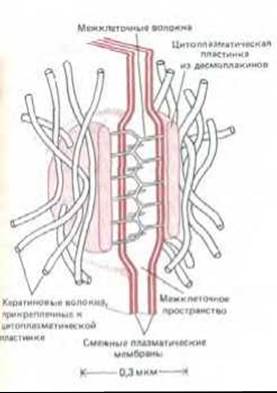
Рис. 14-11. Сильно схематизированное изображение десмосомы, С внутренней стороны каждой из смежных плазматических мембран находится электроноплотная пластинка, состоящая из смеси внутриклеточных прикрепительных белков, называемых десмоплакинами. Каждая пластинка связана с густой сетью кератиновых волокон, проходящих вдоль поверхности пластинки. Трансмембранные линкерные гликопротеины, называемые десмоглеинами, связываются с пластинками и своими внеклеточными доменами соединяют смежные мембраны при участии какого-то Са2+-зависимого механизма. Хотя десмосомы и адгезионные пояса различаются морфологически и химически, они содержат по меньшей мере один общий внутриклеточный белок, называемый плакоглобином.
Полудесмосомы морфологически сходны с десмосомами, но отличаются от них функциональными и химическими особенностями. Они скрепляют не плазматические мембраны соседних клеток между собой, а базальную поверхность этих клеток с подстилающей базальной мембраной - специализированной прослойкой внеклеточного матрикса на границе между эпителием и соединительной тканью (разд. 14.2.15). Кроме того, если кератиновые филаменты, связанные с десмосомами, прикрепляются к последним своей боковой поверхностью (рис. 14-11), то многие филаменты, прикрепленные к полудесмосомам, оканчиваются в десмосомных пластинках (рис. 14-12).
И десмосомы, и полудесмосомы действуют как заклепки, распределяя сжимающие и растягивающие усилия по эпителию и подлежащей соединительной ткани.
14-6
14.1.5. Щелевые контакты позволяют малым молекулам переходить непосредственно из клетки в клетку [5]
Вероятно, это самый удивительный тип межклеточных соединений. Щелевые контакты относятся к наиболее распространенным - они весьма многочисленны в большинстве тканей и имеются практически у всех животных. На электронных микрофотографиях они выглядят как участки, где мембраны двух смежных клеток разделены узкой щелью шириной около 3 мкм. Щелевые контакты участвуют в межклеточной коммуникации, позволяя неорганическим ионам и другим малым водорастворимым молекулам прямо переходить из цитоплазмы одной клетки в цитоплазму другой и обеспечивая таким образом электрическое и метаболическое сопряжение между клетками. Такое сопряжение имеет важный функциональный смысл, многие аспекты которого мы еще только начинаем понимать.
Межклеточные связи такого типа были впервые продемонстрированы в 1958 г. физиологическими методами, однако потребовалось больше 10 лет, чтобы показать, что это физиологическое сопряжение коррелирует с наличием щелевых контактов, видимых в электронный микроскоп. Первые данные о таком сопряжении были получены при электрофизиологическом исследовании определенных пар взаимодействующих нейронов в нервной цепочке речного рака. При подаче разности потенциалов на два микроэлектрода, введенных в две взаимодействующие клетки, через мембрану в месте их соединения протекал ток неожиданно большой величины. Это указывало на то, что неорганические ионы (которые переносят электрические заряды в живых тканях) могут свободно переходить из одной клетки в другую. Последующие опыты показали, что небольшие флуоресцирующие молекулы, введенные в одну из клеток, тоже легко переходят в соседние клетки, не просачиваясь в межклеточное пространство, если только их молекулярная масса не превышала 10001500. Из этого следовало, что эффективный диаметр соединительных каналов должен составлять около 1,5 нм (рис. 14-13) и что клетки обмениваются малыми молекулами (неорганическими ионами, сахарами, аминокислотами, нуклеотидами, витаминами и др.), но не макромолекулами (белками, нуклеиновыми кислотами и полисахаридами).
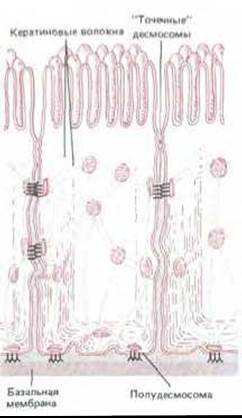
Рис. 14-12. Расположение десмосом и полудесмосом в эпителиальных клетках тонкого кишечника. Сети кератиновых волокон соседних клеток связаны друг с другом через десмосомы, а с базальной мембраной - через полудесмосомы. Если к плотным пластинкам десмосом кератиновые волокна прикрепляются своей боковой поверхностью, то в полудесмосомах они закреплены своими концами.
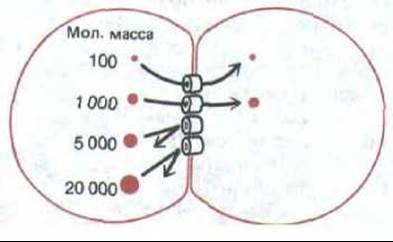
Рис. 14-13. Если в одну из двух клеток, соединенных щелевым контактом, ввести флуоресцирующие молекулы разной величины, то в другую клетку будут переходить лишь те из них, у которых мол. масса не превышает примерно 1000-1500 (в зависимости от типа клеток), а более крупные проходить не будут. Это соответствует эффективному диаметру межклеточного канала около 1,5 нм.
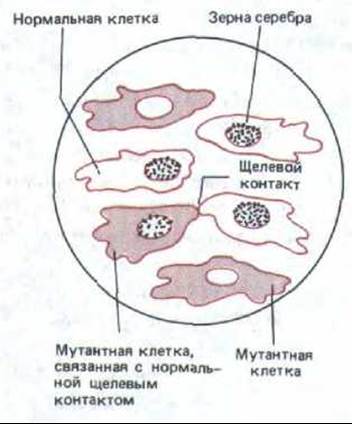
Рис. 14-14. Здесь схематически представлен радиоавтограф, демонстрирующий метаболическое сопряжение клеток, связанных щелевыми контактами, в культуре in vitro. Мутантные клетки лишены фермента тимидинкиназы и поэтому не могут включать в ДНК радиоактивный тимидин, добавленный в среду. Нормальные клетки способны включать тимидин в ДНК, и поэтому их ядра усеяны черными точками (зернами серебра в радиоавтографе). Как видно, в смешанной культуре нормальных и мутантных клеток радиоактивную метку включают также ядра тех мутантных клеток, которые соприкасаются с нормальными и устанавливают с ними щелевые контакты. Это обусловлено тем, что в нормальной клетке радиоактивный тимидин фосфорилируется тимидинкиназой с образованием тимидинтрифосфата; затем радиоактивный тимидинтрифосфат переходит через щелевые контакты в мутантную клетку и включается в ее ДНК.
Такой обмен малыми внутриклеточными метаболитами составляет основу метаболической кооперации, которая может быть продемонстрирована на клетках в культуре. Например, можно выращивать клетки мутантных линий, у которых нет фермента тимидинкиназы, вместе с нормальными (дикого типа) клетками, у которых этот фермент есть. Мутантные клетки сами по себе не способны включать тимидин в ДНК, так как они не могут осуществлять первый этап этого процесса-превращение тимидина в тимидинтрифосфат. Если, однако, выращивать такие клетки совместно с клетками дикого типа в присутствии радиоактивного тимидина, то метка будет включаться в ДНК мутантных клеток, находящихся в прямом контакте с клетками дикого типа. Это означает, что какой-то предшественник ДНК, содержащий радиоактивный тимидин (очевидно, это тимидинтрифосфат), прямо переходит из клеток дикого типа в контактирующие с ними мутантные клетки (рис. 14-14). Такой метаболической кооперации не наблюдается, когда подобный эксперимент проводят с клетками, не способными к образованию щелевых контактов.
Есть и другие данные в пользу того, что за электрическое и химическое сопряжение между соприкасающимися клетками ответственны щелевые контакты. Типичные для таких контактов структуры можно обнаружить почти везде, где удается выявить сопряжение по электрическим или химическим критериям. И наоборот, сопряжение не выявляется между теми клетками позвоночных, у которых нет щелевых контактов. Кроме того, прохождение тока и красителя можно блокировать, если в клетки, соединенные щелевыми контактами, путем микроиньекции ввести антитела к главному белку такого контакта (см. ниже). Наконец, если этот белок щелевого контакта включить в искусственный липидный бислой или же мРНК, кодирующую этот белок, инъецировать в ооциты лягушки, то электрофизиологически можно будет обнаружить в этих объектах каналы со многими свойствами, присущими каналам щелевых контактов.
14.1.6. Коннексоны щелевого контакта являются олигомерами трансмембранного белка, несколько раз пронизывающего мембрану [6]
Щелевые соединения построены из трансмембранных белков, формирующих структуры называемые котексонами. Когда коннексоны плазматической мембраны двух соседних клеток совмещаются, они образуют непрерывный водный канал, соединяющий внутренность двух клеток (рис. 14-15). Коннексоны соединены так, что между смежными плазматическими мембранами остается щель (отсюда и название «щелевой контакт»), и в этом состоит отличие от плотного соединения, где мембраны сближены теснее (ср. рис. 14-5 и 14-15). На электронных микрофотографиях препаратов, полученных методом замораживания-скалывания, каждый коннексон виден как внутримембранная частица, и каждый щелевой контакт может содержать сотни сгруппированных вместе коннексонов (рис. 14-16).
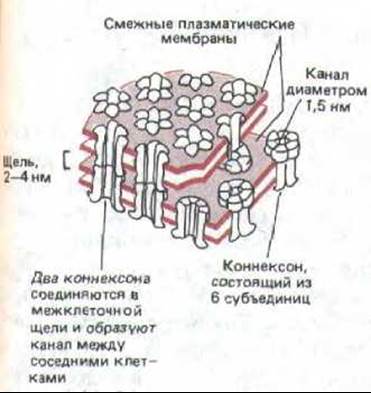
Рис. 14-15. Модель щелевого контакта по данным биохимических исследований, электронной микроскопии и рентгеноструктурного анализа. Показаны соединенные таким контактом плазматические мембраны двух соседних клеток. Через оба липидных бислоя проходят белковые структуры, называемые конпексонами; как полагают, каждый коннексон состоит из шести идентичных белковых субъединиц. В результате соединения двух коннексонов образуется непрерывный водный канал, соединяющий одну клетку с другой.
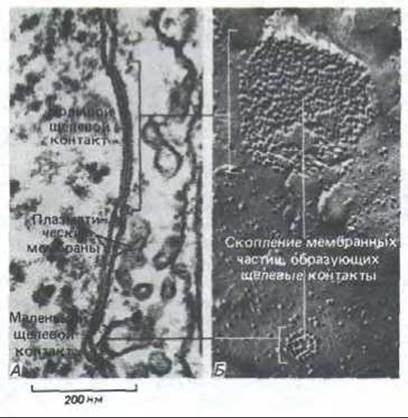
Рис. 14-16. Большой и маленький щелевые контакты между фибробластами в культуре. Электронные микрофотографии тонкого среза (А) и препарата, полученного методом замораживания -скалывания (Б). На сколе каждый щелевой контакт выглядит как скопление гомогенных межмембранных частиц, ассоциированных только с цитоплазматической стороной скола мембраны. Каждая межмембранная частица соответствует коннексону, показанному на рис. 14-15. [N.B. Gilula. In: Cell Communication (R.P. Cox, ed.), pp. 1-29. New York, Wiley, 1974. Reprinted by permission of John Wiley a. Sons, Inc.]

Рис. 14-17. Электронная микрофотография участка щелевого контакта, выделенного из печени крысы. Применен негативный контраст, чтобы показать коннексоны, организованные в гексагональную решетку. Электроноплотное центральное отверстие каждого коннексона имеет диаметр около 2 нм. [N. В. Gilula. In: Intercellular Junctions and Synapses (Receptors and Recognition, Series B, Vol. 2; J. Feldman, N.B. Gilula, and J.D. Pitts, eds.), pp. 3-22, London. Chapman a. Hall, 1978.]
Щелевые контакты благодаря их необычной устойчивости к протеолитическим ферментам и детергентам удается выделять из печени грызунов (рис. 14-17). Щелевой контакт состоит в основном из одного белка с мол. массой около 30000. Как показывает секвенирование ДНК, его полипептидная цепь (около 280 аминокислотных остатков) пересекает липидный бислой мембраны в виде четырех а-спиралей. Видимо, для образования каждого коннексона объединяются шесть таких белковых молекул, подобно тому как это, вероятно, происходит при построении канала рецептора ацетилхолина, где водную пору образуют шесть а-спиралей - по одной от каждой белковой субъединицы (см. рис. 6-64).
Антитела к белку с мол. массой 30000 реагируют со щелевыми контактами многих тканей и организмов; по-видимому, белки коннексона во всех случаях сходны (хотя биохимические и физиологические данные показывают, что они все же не идентичны). Это согласуется с тем фактом, что клетки различного типа в культуре обычно образуют щелевые контакты друг с другом, даже если они принадлежат разным видам.
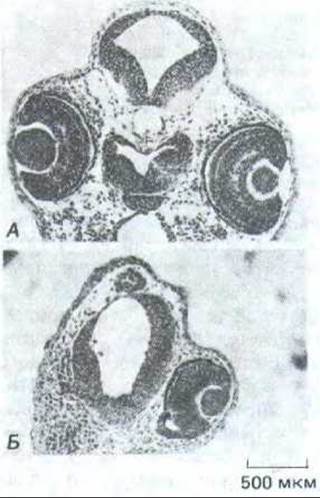
Рис. 14-18. Действие антител к главному белку щелевого контакта, инъецированных в одну из клеток раннего зародыша Xenopus. Поперечные срезы нормального эмбриона (А) и зародыша после инъекции антител на 8-клеточной стадии (Б). Обратите внимание, что у второго из них на стороне инъекции отсутствует глаз и недоразвит мозг. (A. Warner, S. Guthrie, N. В. Gilula, Nature 331: 126-131, 1985. Copyright 1985 Macmillan Journals Limited.)
14-7
14.1.7. Большинство клеток в ранних эмбрионах сообщается через щелевые контакты [7]
В некоторых тканях роль сопряжения клеток через щелевые контакты очевидна. Например, электрическое сопряжение синхронизирует сокращения клеток сердечной мышцы и клеток гладкой мускулатуры, ответственных за перистальтику кишечника. Точно так же электрическое сопряжение между нервными клетками позволяет потенциалам действия быстро распространяться от клетки к клетке без задержки, происходящей в химических синапсах; это дает преимущество в случаях, когда решающее значение имеют быстрота и надежность ответа, например при некоторых реакциях бегства у рыб и насекомых. Труднее понять, зачем нужны щелевые контакты в тканях, не проявляющих электрической активности. В принципе обмен метаболитами и ионами мог бы обеспечить координацию активности отдельных клеток в этих тканях. Например, через щелевые контакты могла бы координироваться такая активность клеток эпителиального слоя, как биение ресничек; а поскольку внутриклеточные посредники типа циклического AMP способны проходить через щелевые контакты, ответ сопряженных клеток на внеклеточные сигнальные молекулы мог бы распространяться и координироваться именно этим путем.
По-видимому, сопряжение клеток через щелевые контакты играет важную роль в эмбриогенезе. В ранних зародышах позвоночных (у мышиного - начиная с поздней стадии восьми бластомеров) большинство клеток электрически связано друг с другом. Однако по мере того, как специфические группы клеток приобретают явные различия и начинают дифференцироваться, они обычно утрачивают сопряжение с окружающими тканями. Например, при замыкании нервной трубки ее клетки теряют связь с покрывающей эктодермой (см. рис. 14-9). Тем временем клетки внутри каждой группы остаются сопряженными друг с другом и поэтому ведут себя как кооперативная система, согласованно следуя по определенному пути развития.
Одна из привлекательных гипотез состоит в том, что сопряжение эмбриональных клеток могло бы обеспечивать возможность дальнодействуюшей сигнализации в развивающемся эпителии. Например, малые молекулы могли бы переходить через щелевые контакты из тех участков ткани, где их концентрация поддерживается на высоком уровне, в участки, где она остается низкой, так что создавался бы плавный градиент. Локальный уровень концентрации мог бы доставлять клеткам «позиционную информацию» для управления их дифференцировкой в соответствии с их локализацией в зародыше. Но действительно ли щелевые контакты выполняют такую функцию, не известно.
На возможную роль межклеточной коммуникации через щелевые контакты в процессах развития указывают эксперименты, в которых в один из бластомеров 8-клеточного зародыша амфибии инъецировали антитела к главному белку щелевого контакта. Введенные антитела не только избирательно разрывали электрическое сопряжение и предотвращали перенос красителя между потомками обработанной клетки (что проверялось через два цикла деления - на 32-клеточной стадии), но и резко нарушали развитие зародыша (рис. 14-18). Остается неясным, каким образом разрыв клеточного сопряжения на ранней стадии приводит позже к дефектам в развитии, однако эксперименты такого рода - многообещающий первый шаг в изучении роли щелевых контактов в эмбриональном развитии.
14.1.8. Проницаемость щелевых контактов может регулироваться [8]
Экспериментальные воздействия, снижающие рН или повышающие концентрацию свободных ионов Са2+ в цитозоле, быстро (за несколько секунд) и обратимо уменьшают проницаемость щелевых контактов, а в некоторых тканях проницаемость их может регулироваться градиентом напряжения на контакте или внеклеточными химическими сигналами. Эти наблюдения показывают, что щелевые контакты - динамичные структуры, способные открываться или закрываться в ответ на изменения в клетках. Таким образом, в этом отношении они сходны с обычными ионными каналами (разд. 6.4.14), хотя переходы между открытым и закрытым состояниями происходят здесь значительно реже, чем у большинства ионных каналов.
Какую роль играет регуляция проницаемости щелевых контактов потенциалом или величиной рН в нормальном функционировании клеточных ансамблей, не известно. В одном случае однако, смысл контроля с участием ионов Са2+ кажется понятным. При гибели или повреждении клетки ее мембрана утрачивает барьерную функцию. Такие ионы, как Са2+ или Na+, входят в клетку, а важные метаболиты выходят из нее. Если бы такая клетка оставалась связанной со своими здоровыми соседями, то их внутренняя среда тоже подвергалась бы опасности. Однако повышение концентрации Са2+ в поврежденной клетке приводит к закрытию каналов щелевых контактов, что эффективно изолирует ее и таким образом предотвращает распространение повреждения.
Повышение проницаемости щелевых контактов под действием внеклеточных химических сигналов ведет к распространению реакции на соседние клетки, не находящиеся в прямом контакте с действующим агентом. Например, гормон глюкагон, побуждающий клетки печени к расщеплению гликогена и высвобождению глюкозы в кровяное русло, может также повышать проницаемость щелевых контактов между этими клетками у крысы. Это происходит за счет увеличения внутриклеточной концентрации циклического AMP (сАМР), который активирует сАМР-зависимую протеинкиназу (разд. 12.4.1), а та в свою очередь, по-видимому, фосфорилирует главный белок щелевого контакта. Расщепление гликогена клетками печени тоже обусловлено повышением концентрации сАМР, так что одновременное увеличение проницаемости щелевых контактов, облегчая диффузию сАМР из клетки в клетку, способствует вовлечению соседних групп клеток в процесс расщепления гликогена. На рис. 14-19 суммированы различные типы соединений, образующихся между клетками в эпителии. В апикальном конце клетки относительное положение клеточных соединений одинаково почти во всех эпителиях: плотные соединения занимают наиболее апикальную область клетки, за ними идет адгезионный пояс, а дальше - специальные параллельные ряды десмосом; все вместе они образуют «соединительный комплекс». Менее регулярно располагаются щелевые контакты и дополнительные десмосомы.
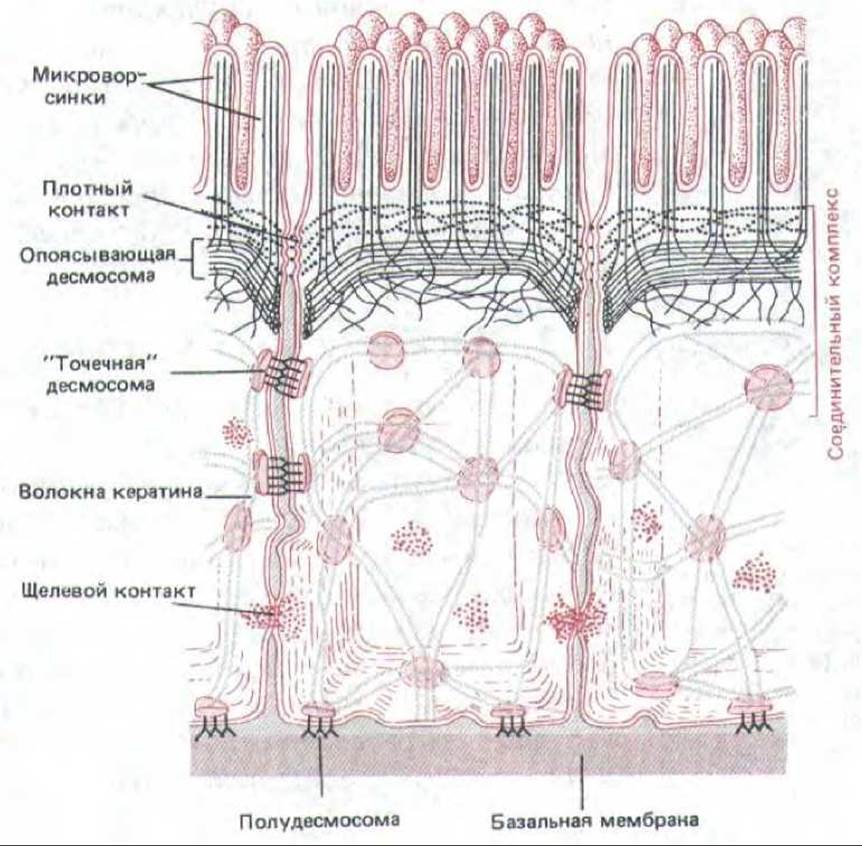
Рис. 14-19. Схема расположения различных соединений, образуемых эпителиальными клетками тонкой кишки.
Заключение
Большинство клеток в тканях связаны друг с другом и с внеклеточным матриксом в специализированных местах контакта, называемых клеточными соединениями. Клеточные соединения разделяют на три функциональных класса: запирающие, прикрепительные и коммуникационные. Плотные соединения составляют главную группу запирающих соединений и играют основную роль в поддержании разности концентраций малых гидрофильных молекул по разные стороны эпителиальных слоев; они, во-первых, плотно связывают мембраны соседних клеток и создают таким образом непрерывный барьер проницаемости между двумя сторонами эпителия и, во-вторых, образуют барьер в липидном бислое, предотвращающий диффузию мембранных транспортных белков между апикальной и базо латеральной областями плазматической мембраны каждой эпителиальной клетки.
Существуют два основных типа прикрепительных контактов: адгезионные соединения и десмосомы. Все они объединяют группы клеток в прочные структурные комплексы, связывая элементы их цитоскелетов. Адгезионные соединения связывают пучки актиновых филаментов, а десмосомы-промежуточные филаменты. Щелевые контакты служат для межклеточной коммуникации и состоят из групп канальных белков, позволяющих частицам с мол. массой менее 1500 непосредственно переходить из одной клетки в другую. Клетки, связанные такими контактами, обмениваются многими неорганическими ионами и другими малыми молекулами, т, е. они химически и электрически сопряжены. Щелевые контакты имеют большое значение для координации функций электрически активных клеток и, по-видимому, играют сходную роль также в других группах клеток.