Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Внутриклеточная сортировка макромолекул и сохранение клеточных компартментов
Транспорт белков в митохондрии и хлоропласти
Как мы уже хорошо знаем (гл. 7.), митохондрии и хлоропласты представляют собой окруженные двойной мембраной органеллы, специализирующиеся на синтезе АТР - путем транспорта электронов и окислительного фосфорилирования в митохондриях и фотосинтетического фосфорилирования в хлоропластах. Хотя обе органеллы имеют свою собственную ДНК и аппарат белкового синтеза, большинство их белков кодируется клеточной ДНК и поступает из цитозоля. Более того, каждый поступивший в органеллу белок должен достичь определенного субкомпартмента, в котором он функционирует. В митохондриях имеется четыре субкомпартмента: митохондриальный матрикс, внутренняя мембрана, межмембранное пространство и внешняя мембрана, обращенная к цитозолю (рис. 8-26, А). В хлоропластах, кроме этого, имеется тилакоидная мембрана и тилакоидное пространство (рис. 8-26, Б). Каждый из этих субкомпартментов содержит отличный от других набор белков. Рост митохондрий и хлоропластов возможен за счет импорта цитоплазматических белков, включающего последовательный избирательный перенос белков через одну, две или (в хлоропластах) даже три мембраны.
Те сравнительно немногие белки, которые кодируются собственными геномами этих органелл, расположены в основном во внутренней мембране в митохондриях и в тилакоидной мембране в хлоропластах. Полипептиды, кодируемые геномами этих органелл, обычно образуют субъединицы белковых комплексов, другие компоненты которых кодируются ядерными генами и поступают из цитозоля. Образование таких гибридных белковых агрегатов требует сбалансированности синтеза этих двух типов субъединиц; каким образом координируется синтез белка на рибосомах разных типов, разделенных двумя мембранами, остается загадкой.
8-16
8.4.1. Митохондриальные сигнальные пептиды представляют собой амфипатические аминокислотные последовательности [21]
В изучении биогенеза митохондрий оказалось чрезвычайно полезным использование в качестве объекта дрожжей. В их клетки можно эффективно вводить гибридные гены, кодирующие «смешанные» белки (полученные с помощью методов рекомбинантных ДНК). О механизмах переноса веществ в митохондрии известно гораздо больше, чем о механизмах переноса в хлоропласты. Скорее всего, эти механизмы идентичны, хотя хлоропласты и содержат еще один, самый внутренний мембранный компартмент - тилакоид.
Белки, импортируемые в митохондриальный матрикс, обычно поступают из цитозоля в течение одной-двух минут после их отделения от полирибосом. Эти белки почти всегда несут на N-конце сигнальный пептид длиной от 20 до 80 аминокислотных остатков. После поступления белка в митохондрию сигнальный пептид быстро удаляется при помощи специфической протеазы (сигнальной пептидазы) матрикса и затем, вероятно, деградирует в матриксе до аминокислот. Сигнальный пептид может быть исключительно простым. Молекулярно-генетические эксперименты, в которых сигнальную последовательность постепенно укорачивали, показали, что для обеспечения импорта одного митохондриального белка требуется всего 12 аминокислот. Эти 12 остатков можно присоединить к любому митохондриальному белку, и он окажется в митохондриальном матриксе. Физические исследования полных сигнальных пептидов подтверждают, что они могут образовывать амфипатические а-спиральные структуры (рис. 8-27), в которых все положительно заряженные остатки выстроены с одной стороны спирали, а незаряженные гидрофобные остатки уложены с противоположной стороны.
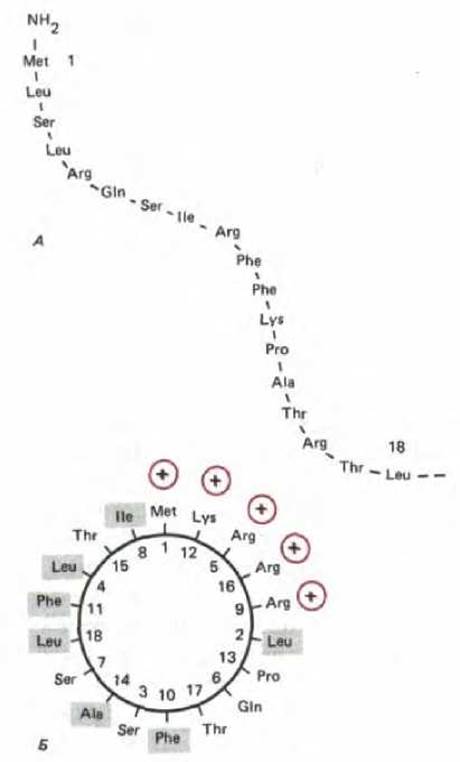
Рис. 8-27. Сигнальный пептид для импорта белков в митохондрии. Цитохромоксидаза - это большой, состоящий из многих белков комплекс, расположенный во внутренней митохондриальной мембране, где он функционирует как терминальный фермент в цепи переноса электронов. А. Первые 12 аминокислот предшественника субъединицы IV этого фермента служат сигнальным пептидом для импорта данной субъединицы в митохондрию. Б. Если на сигнальный пептид, свернутый по всей длине в а-спираль с 3,6 остатками на виток, смотреть сверху, то видно, что положительно заряженные остатки (выделены цветом) сгруппированы с одной стороны спирали, а незаряженные (отмечены прямоугольниками) собраны с противоположной стороны. Последовательности митохондриальных сигнальных пептидов почти всегда способны образовывать такую амфипатическую спираль. Полагают, что спирали данного типа играют важную роль в переносе белков через митохондриальные мембраны.
Считается, что внешняя мембрана митохондрий содержит белки-рецепторы, связывающие митохондриальные сигнальные пептиды и тем самым помогающие процессу переноса, однако до сих пор эти гипотетические рецепторы не были как следует охарактеризованы.
8.4.2. Перенос веществ в митохондриальный матрикс зависит как от электрохимического градиента на внутренней мембране, так и от гидролиза АТР [22]
Практически все сведения о молекулярном механизме переноса белков внутрь митохондрии были получены при анализе бесклеточных транспортных систем. Суть экспериментов заключается в следующем. Вначале из гомогенизированных клеток методом дифференциального центрифугирования выделяют митохондрии, а затем инкубируют их с радиоактивно меченными белками, предназначенными для этих органелл (митохондриальные белки-предшественники). Очищенные белки-предшественники очень быстро и эффективно включаются в такие митохондрии.
Все формы направленного движения и транспорта нуждаются в энергии. В большинстве случаев эта энергия используется в форме АТР. Однако для переноса белков в митохондрии требуется еще наличие электрохимического градиента на внутренней митохондриальной мембране. Этот градиент образуется в процессе транспорта электронов по мере того, как протоны откачиваются из матрикса в межмембранное пространство (см. разд. 7.1.7). Внешняя митохондриальная мембрана свободно проницаема для ионов, поэтому на ней не поддерживается никакой градиент. Электрохимический градиент на внутренней мембране используется как аккумулятор энергии для осуществления большей части синтеза АТР в клетке. Кроме того, энергия градиента расходуется для переноса внутрь митохондрии белков, несущих положительно заряженные митохондриальные сигнальные пептиды. Если добавить ионо-форы, сбрасывающие митохондриальный мембранный потенциал (см. разд. 7.2.10), этот перенос блокируется. Каким образом электрохимический градиент способствует переносу белков? Ответ на этот вопрос пока не получен.
8.4.3. Митохондриальные белки проникают в матрикс в зонах слипания, связывающих две мембраны [23]
Пересекает ли белок на пути к митохондриальному матриксу две мембраны поочередно, или он проникает через обе мембраны сразу? Чтобы ответить на этот вопрос, можно охладить бесклеточную систему до температуры льда, задержав таким образом белки на промежуточной стадии переноса. Оказалось, что их N-концы находятся при этом в матриксе (они могут быть удалены протеазой матрикса), а остальная часть молекул расположена вне митохондрии (поскольку чувствительна к добавленным извне протеолитическим ферментам). Этот результат показывает, что белок-предшественник, когда проникает в матрикс, проходит через обе митохондриальные мембраны сразу. Специалисты по электронной микроскопии заметили многочисленные зоны слипания, в которых, внешняя и внутренняя митохондриальные мембраны сливаются, и предположили, что это именно те участки, через которые происходит перенос белков в матрикс. Недавно эти точки контакта были идентифицированы биохимически (по их связыванию с частично перенесенными внутрь митохондрии белками-предшественниками) и очищены.
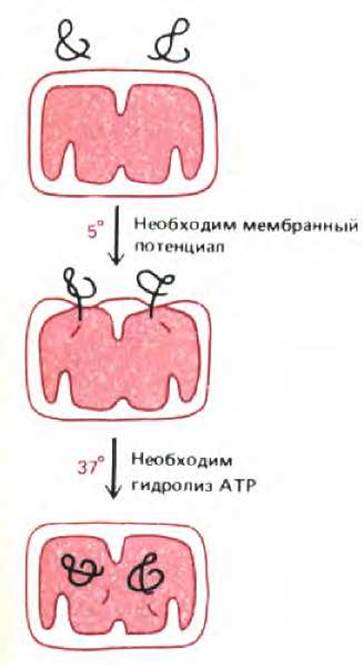
Рис. 8-28. При переносе белков в матрикс они в течение короткого времени соединяют внутреннюю и внешнюю митохондриальные мембраны. Если изолированные митохондрии инкубировать с белком-предшественником при 5°С, предшественник переносится лишь частично. В матриксе N-концевой сигнальный пептид отрезается; большая часть полипептидной цепи остается вне митохондрии (и доступна для протеолитических ферментов). При нагревании до 37°С перенос происходит полностью. Для изначального внедрения белка в митохондриальную мембрану при 5°С требуется разность потенциалов на внутренней мембране. Последующий перенос может происходить без этой разности потенциалов, но для него необходимо присутствие АТР с цитоплазматической стороны внутренней мембраны. Полагают, что гидролиз АТР необходим при разворачивании полипептидной цепи для того, чтобы белок мог пройти сквозь мембрану.
Если охлажденные митохондрии, содержащие частично перенесенные промежуточные продукты, опять нагреть, то перенос быстро завершается (рис. 8-28), даже если мембранный потенциал на внутренней мембране сброшен. По-видимому, мембранный потенциал необходим лишь для начальной стадии переноса белка через мембрану, которая происходит даже при низкой температуре. Дальнейшие события, однако, требуют наличия АТР. Эти факты означают, что в норме перенос проходит в два этапа: 1) управляемое электрически проникновение сигнального пептида и связанных с ним последовательностей сквозь обе митохондриальные мембраны и 2) продвижение остатка цепи в митохондриальный матрикс, требующее гидролиза АТР и физиологических температур (рис. 8-29).
8.4.4. Когда белки проникают в митохондриальный матрикс, они разворачиваются [24]
По всей вероятности, белки-предшественники разворачиваются перед тем, как пересечь две митохондриальные мембраны в точке контакта. Трудно представить себе, что свернутый водорастворимый белок мог бы «протаранить» два (или даже один) липидных бислоя, оставаясь в своей нативной трехмерной конформации. Точно также невозможно вообразить, что пора могла бы пропускать глобулярные белки, которые сильно варьируют по размерам и форме. Ведь при этом она становилась бы проницаемой для протонов, и в результате электрохимический градиент на внутренней мембране исчезал бы. Между тем, в развернутом состоянии все белки имеют сходную конформацию и могут быть перенесены с помощью общего механизма. Но поскольку белки в свернутом состоянии обладают меньшей свободной энергией, чем в развернутом (по этой причине полипептиды спонтанно сворачиваются), разворачивание молекулы белка требует затрат энергии. Предполагается, что эту энергию обеспечивает гидролиз АТР.
Чтобы проверить, разворачиваются ли белки-предшественники, когда они пересекают митохондриальную мембрану, был сконструирован гибридный ген, кодирующий «смешанный» белок. В этом как бы состыкованном белке митохондриальный сигнальный пептид присоединен к N- концу цитоплазматического фермента-дигидрофолатредуктазы (ДГФР). Такой гибридный белок обладал почти ненарушенной ферментативной активностью, а значит ДГФР была в нативной трехмерной конформации. При смешивании с препаратом митохондрий этот белок поступал в матрикс. Однако если его предварительно обрабатывали метатрексатом, который прочно связывается с активным центром фермента и мешает разворачиванию его молекулы, то перенос резко подавлялся. Генетические эксперименты на дрожжах подтверждают, что для АТР-зависимой реакции разворачивания белков необходимы некоторые гены семейства hsp 70. Если эти гены инактивировать, то и митохондриальные белки-предшественники, и белки, предназначенные для ЭР, не могут пересечь соответствующие мембраны и вместо этого накапливаются в цитозоле.
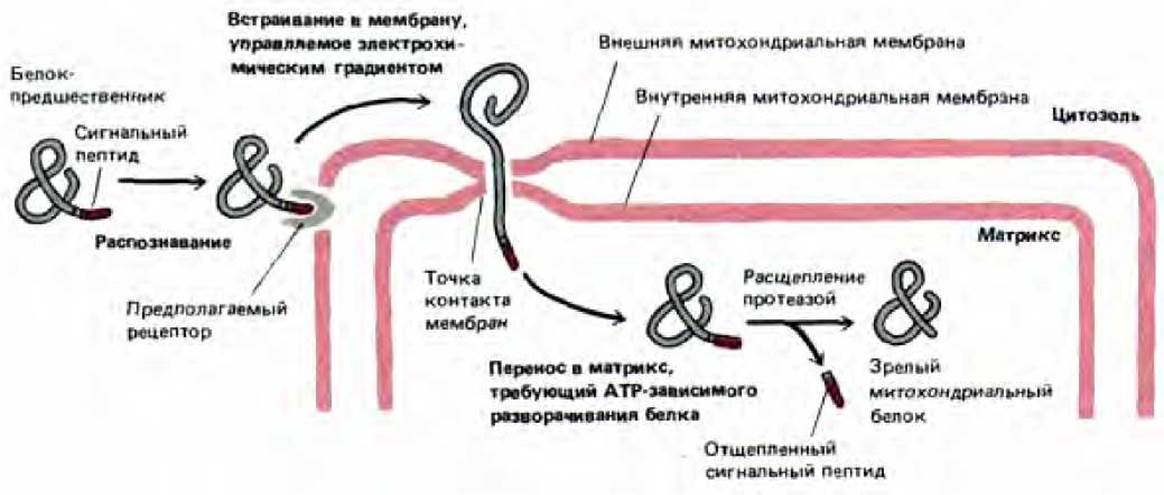
Рис. 8-29. Импорт белков в митохондрии. N-концевой сигнальный пептид белка-предшественника распознается рецептором, который, как полагают, расположен во внешней мембране. Белок переносится через обе митохондриальные мембраны в специальных точках контакта. Для начала этого процесса необходим электрохимический градиент по сторонам внутренней мембраны. В матриксе сигнальный пептид отрезается специфической протеазой, и образуется зрелый белок.
8-17
8.4.5. Для транспорта белков в межмембранное пространство митохондрий необходимы два сигнала [25]
Транспорт некоторых белков-предшественников в межмембранное пространство митохондрий начинается с их переноса в матрикс (рис. 8-29). Однако за N-концевым сигнальным пептидом, инициирующим этот перенос, расположена очень сильно гидрофобная аминокислотная последовательность. Как только сигнальный пептид отщепляется матриксной протеазой, эта гидрофобная последовательность начинает, в свою очередь, выполнять роль сигнального пептида для обратного встраивания данного белка во внутреннюю мембрану. Вероятно, этот перенос происходит с помощью механизма, сходного с механизмом встраивания белков в мембрану ЭР. Аналогичный способ используется и для встраивания во внутреннюю мембрану митохондрий белков, кодируемых митохондриальным геномом (рис. 8-30, А).
После того, как белки, предназначенные для межмембранного пространства, встроятся во внутреннюю мембрану, они отрезаются протеазой в межмембранном пространстве (рис. 8-30, Б). Многие из этих зрелых растворимых белков в конце концов присоединяются к «внешней» поверхности внутренней мембраны, где они образуют субъединицы комплексов, содержащих также и трансмембранные белки.
Для транспорта белков из цитозоля во внутреннюю мембрану митохондрий также требуется гидрофобный сигнальный пептид. Возможно, этот транспорт происходит по схеме, изображенной на рис. 8-30, А, но прямо это доказано не было. Такой двухстадийный путь трудно отличить в эксперименте от альтернативного пути, при котором транспорт в точке контакта прерывается по достижении гидрофобного сигнала, и белок остается заключенным в бислой внутренней мембраны.
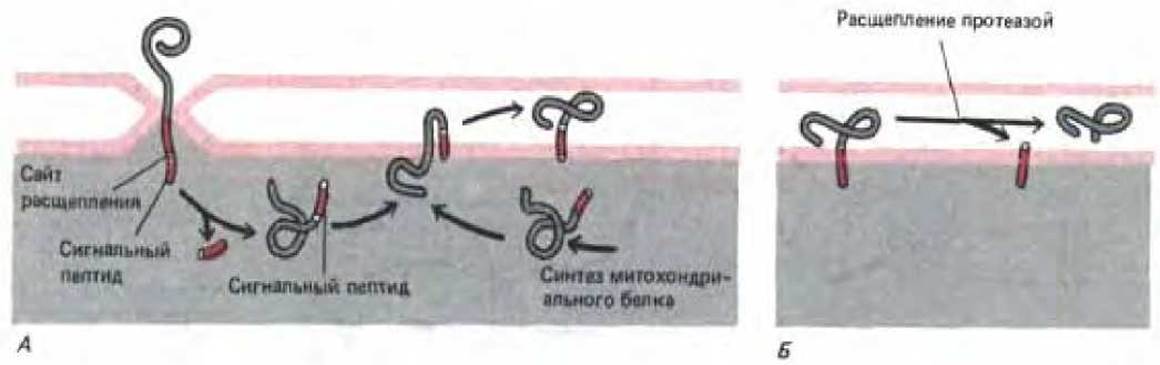
Рис. 8-30. Импорт белков из цитозоля в межмембранное пространство митохондрий или внутреннюю мембрану требует многих сигналов. Вначале белок переносится в пространство матрикса, как это показано на рис. 8-29. Однако при отрезании сигнального пептида, использованного для первичного переноса, обнажается смежный гидрофобный сигнальный пептид на новом N-конце. Этот сигнал вызывает встраивание белка во внутреннюю мембрану таким же образом, каким в нее встраиваются белки, кодируемые митохондриальным геномом (А.) Этот механизм предположительно сходен с тем, который бактериальные предки митохондрий использовали для встраивания белков в плазматическую мембрану, и, как полагают, напоминают механизм встраивания белков в ЭР. Для транспорта белков в межмембранное пространство требуется еще третья стадия, на которой протеаза с активным центром, обращенным в трансмембранное пространство, отрезает белок от его трансмембранного сигнального пептида, находящегося во внутренней мембране (Б). Путь, изображенный на рис. (А), может быть использован и для переноса белков из цитозоля во внутреннюю мембрану, который тоже требует гидрофобного пептида.
8.4.6. Для переноса белков из цитозоля во внешнюю митохондриальную мембрану также необходимо их разворачивание [26]
Во внешней мембране митохондрий имеется одна необычная структура (она напоминает внешнюю мембрану грамотрицательных бактерий), липидный слой которой содержит большие количества образующего поры белка-порина. По этой причине внешняя мембрана свободно проницаема для неорганических ионов и метаболитов и для молекул белков размером меньше 10 кДа. Но для больших по размеру белков внешняя мембрана является барьером и поэтому помогает удержать белки межмембранного пространства от утечки обратно в цитозоль.
Включение во внешнюю мембрану белков, кодируемых основным клеточным геномом - таких, как порин, - происходит по АТР- зависимому механизму, но не требует использования специальных пептидов, которые бы потом отрезались. Мембранный потенциал тоже не требуется. О том, как происходит подобное включение, известно очень мало. По крайней мере у одного белка внешней мембраны имеется нормальный матриксный транспортный сигнал, за которым следует последовательность, каким-то образом прерывающая перенос на внешней мембране.
8-18
8.4.7. Для того, чтобы направлять белки в тилакоидную мембрану хлоропластов, необходимы два сигнальных пептида [27]
Транспорт белков в хлоропласти во многих отношениях напоминает транспорт в митохондрии: и тот, и другой процесс происходят после трансляции, и тот, и другой нуждаются в энергии, и в том, и в другом случае используются гидрофильные N-концевые сигнальные пептиды, которые затем удаляются. Однако имеется по крайней мере одно важное отличие: в митохондриях для проведения этого транспорта используется еще электрохимический градиент на их внутренней мембране. В хлоропластах же, где электрохимический градиент имеется не на внутренней мембране, а на мембране тилакоида (см. гл. 7), по-видимому, для транспорта через внешнюю двумембранную оболочку в качестве источника энергии используется только гидролиз АТР.
Сигнальные пептиды для переноса белков в хлоропласты напоминают раннее описанные пептиды для импорта в митохондрии. Но в растительных клетках имеются и митохондрии, и хлоропласты, и соответственно, белки должны «выбирать» между ними. Например, в растительных клетках бактериальный фермент, присоединенный (методами генной инженерии) к N-концевой последовательности митохондриального белка, направляется в митохондрии. Тот же белок, связанный с N-концевой последовательностью белка хлоропластов, оказывается в хлоропластах.
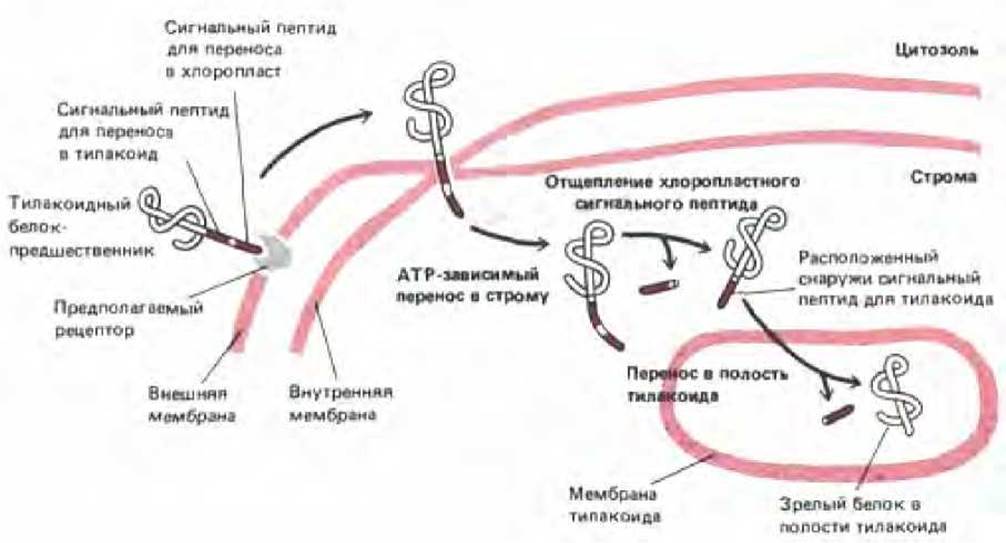
Рис. 8-31. Для переноса белков в полость (тилакоидное пространство) тилакоида в хлоропластах требуется два сигнальных пептида, такой перенос осуществляется в две стадии. Полипептид-предшественник содержит N-кондевой сигнальный пептид для переноса в хлоропласт, за которым непосредственно следует тилакоидный сигнальный пептид. Хлоропластный сигнальный пептид вызывает перенос белка в строму через точки контакта в мембране (см. рис. 7-73); механизм этого переноса сходен с механизмом переноса в митохондриаль-ный матрикс (рис. 8-29). Затем сигнальный пептид отрезается, открывая тилакоидный сигнальный пептид, который вызывает перенос через мембрану тилакоида. Этот процесс имеет много общего с перемещением белков в ЭР.
Хлоропласты содержат еще один окруженный мембраной компартмент - тилакоид Множество белков хлоропластов, включая белковые субъединицы фотосинтетической системы и АТР-синтетазы, импортируются в мембрану тилакоида из цитозоля. Подобно некоторым митохондриальным белкам-предшественникам, эти белки доставляются к месту назначения в два этапа. Сначала они проникают через двумембранную оболочку в матрикс хлоропласта (называемый стромой), а затем переносятся в мембрану тилакоида (или сквозь нее в тилакоидное пространство). Предшественники этих белков имеют кроме N-концевого сигнального пептида для хлоропластов еще гидрофобный тилакоидный сигнальный пептид. После того, как белок с помощью N-концевого сигнального пептида проникает в строму, этот пептид удаляется стро-мальной протеазой (аналогичной протеазе матрикса митохондрий). В результате открывается тилакоидный сигнальный пептид, который затем инициирует транспорт через мембрану тилакоида (рис. 8-31). Как и в митохондриях, этот второй этап служит для встраивания собственных белков хлоропласта в мембрану тилакоида; необходимый для этого белок-транслокатор, вероятно, происходит от бактериального предка хлоропластов.
Заключение
Большинство белков проникает в митохондрии и хлоропласты из цитозоля сходным образом. Этот механизм был наиболее хорошо изучен для митохондрий, особенно у дрожжей. Белок переносится в матрикс митохондрии через зоны слипания внешней и внутренней мембран. Для этого переноса требуется гидролиз АТР, а также электрохимический градиент на внутренней мембране. Транспортируемый белок разворачивается, когда пересекает мито хондриальные мембраны. В митохондрии или хлоропласты переносятся только те белки, которые содержат специфический сигнальный пептид. Этот сигнальный пептид обычно расположен на N-конце молекулы белка и отрезается после переноса ее внутрь органеллы. На втором этапе транспорта белок может переноситься во внутреннюю мембрану. Для этого он должен иметь еще гидрофобный сигнальный пептид; этот пептид открывается после удаления первого сигнала. В случае хлоропластов для переноса белков из стромы в тилакоид также требуется второй сигнальный пептид.