Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Внутриклеточная сортировка макромолекул и сохранение клеточных компартментов
Аппарат Гольджи
Аппарат Гольджи (называемый также комплексом Гольджи) обычно расположен около клеточного ядра, а в животных клетках он часто находится вблизи центросомы, или клеточного центра. Он состоит из набора окруженных мембраной уплощенных цистерн, напоминающих стопку тарелок. Каждая стопка Гольджи (у растений называемая диктиосомой) обычно содержит от четырех до шести цистерн, имеющих, как правило, диаметр около 1 мкм (рис. 8-59). Число стопок Гольджи в клетке в значительной степени зависит от ее типа: некоторые клетки содержат одну большую стопку, тогда как в других имеются сотни очень маленьких стопок.
Со стопками Гольджи всегда ассоциирована масса мелких (диаметром ~60 нм) ограниченных мембраной пузырьков. Они группируются на стороне, примыкающей к ЭР, а также по периферии стопки вблизи расширенных краев каждой цистерны (см. рис. 8-59). Полагают, что эта пузырьки (пузырьки Гольджи) переносят белки и липиды в аппарат Гольджи, транспортируют их из него и между остальными цистернами. Многие пузырьки являются окаймленными и покрыты клатрином или другим специфическим белком. Часто можно видеть, как такие окаймленные пузырьки отшнуровываются от цистерн Гольджи.
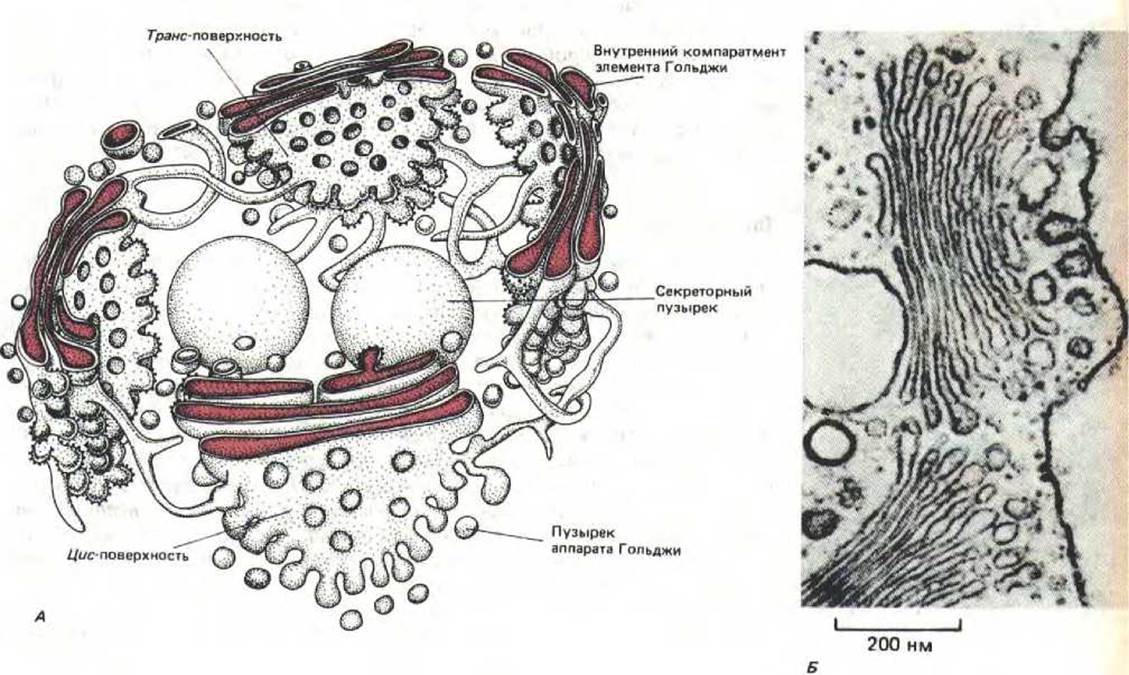
Рис. 8-59. А, Трехмерная структура аппарата Гольджи, реконструированная на основе электронных микрофотографий животной секреторной клетки. Стопки уплощенных цистерн Гольджи имеют расширенные края, от которых, видимо, отпочковываются мелкие пузырьки. Большие секреторные пузырьки образуются из транскомпартмента аппарата Гольджи. Б. Электронная микрофотография поперечного среза аппарата Гольджи в растительной клетке (зеленая водоросль Chlamydomonas). Аппарат Гольджи в растительных клетках обычно более выражен и более четко отделен от других внутриклеточных мембран, по сравнению с клетками животных. (А-по R. V. Krstic, Ultrastructure of the Mammalian Cell. New York; Springer-Verlag, 1979; Б-с любезного разрешения George Palade.)
Аппарат Гольджи имеет две разные стороны: формирующуюся, или цис-сторону и зрелую, или транс-сторону. Цис-сторона тесно связана с переходными элементами ЭР (см. разд. 8.1.3); транс-сторона расширяется, образуя трубчатый ретикулум, называемый транс-сетью Гольджи. Белки и липиды в составе небольших пузырьков попадают в стопку Гольджи с цис-стороны, а покидают ее, направляясь в различные компартменты, вместе с пузырьками, образующимися на транс-стороне. Переходя из одной стопки Гольджи в другую, эти молекулы претерпевают последовательные серии модификаций.
Аппарат Гольджи развит в секреторных клетках, таких, например, как бокаловидные клетки эпителия кишечника, которые выделяют большое количество слизи. На транс-стороне аппарата Гольджи, обращенной к той части плазматической мембраны, где происходит секреция, образуются необычно большие пузырьки (рис. 8-60).
8-33
8.7.1. В аппарате Гольджи происходит модификация олигосахаридных цепей [48]
Как отмечалось выше, в ЭР к белкам присоединяется N-связанный олигосахарид. Этот олигосахарид претерпевает модификации уже в ЭР (см. разд. 8.6.12). Дальнейшие изменения происходят с ним в аппарате Гольджи.
В зрелых гликопротеинах с остатком аспарагина связаны олигосахариды двух обширных классов: сложные олигосахариды и олигосахариды с высоким содержанием маннозы (рис. 8-61). Иногда к одной и той же полипептидной цепи присоединяются (в разных местах) олигосахариды обоих типов. К олигосахаридам с высоким содержанием маннозы в аппарате Гольджи новые сахара не добавляются. Они содержат два N-ацетилглюкозамина и много остатков маннозы, часто почти столько же, сколько их было у связанного с липидом олигосахарида- предшественника в ЭР. Сложные олигосахариды могут иметь больше, чем два N-ацетилглюкозамина, а также различное число остатков галактозы, сиаловой кислоты и (в некоторых случаях) фукозы. Сиаловая кислота представляет особый интерес, как единственный углеводный остаток в гликопротеинах, несущий отрицательный заряд (см. разд. 6.1.6). Сложные олигосахариды образуются в результате «доделки» олигосахаридов, присоединенных в ЭР, и добавления дополнительных Сахаров. Таким образом, каждый сложный олигосахарид состоит из сердцевины, или кора, сформированного из исходного N-связанного олигосахарида и (обычно он содержит два N-ацетилглюкозамина и три остатка маннозы) и концевой области, состоящей из варьирующего числа трисахаридов (N-ацетилглюкозамин-галактоза-сиаловая кислота), присоединенных к сердцевинным остаткам маннозы. Иногда концевая область как бы обрезана и содержит только N-ацетилглюкозамин и галактозу или даже один N-ацетилглюкозамин. В некоторых случаях необязательным оказалось и присутствие фукозы, присоединенной к коровому N-ацетилглюкозамину. Все эти сахара, составляющие концевой участок, добавляются в транс-части аппарата Гольджи целым рядом гликозилтрансфераз, которые работают в строго определенной последовательности (рис. 8-62). Субстратом для них служат специфические активированные нуклеотид-сахара. Они транспортируются в полости аппарата Гольджи при помощи набора связанных с мембраной носителей. Эти же носители выводят нуклеотидные побочные продукты гликозилирования. Одна из описанных гликозилтрансфераз (галактозилтрансфераза) обычно используется для того, чтобы маркировать во фракции мембранных пузырьков, очищенных методом дифференциального центрифугирования, те из них, которые происходят из аппарата Гольджи.
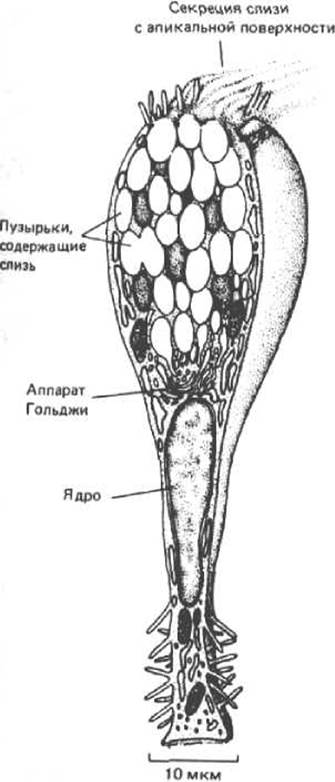
Рис. 8-60. Бокаловидная клетка тонкого кишечника. Эта клетка специализирована для секреции слизи, представляющей собой смесь гликопротеинов и протеогликанов, синтезированных в ЭР и аппарате Гольджи. Аппарат Гольджи сильно поляризован, что облегчает выделение слизи путем экзоцитоза с апикальной поверхности клетки. (По R. Krstic, Illustrated Encyclopedia of Human Histology. New York: Springer-Verlag, 1984.)
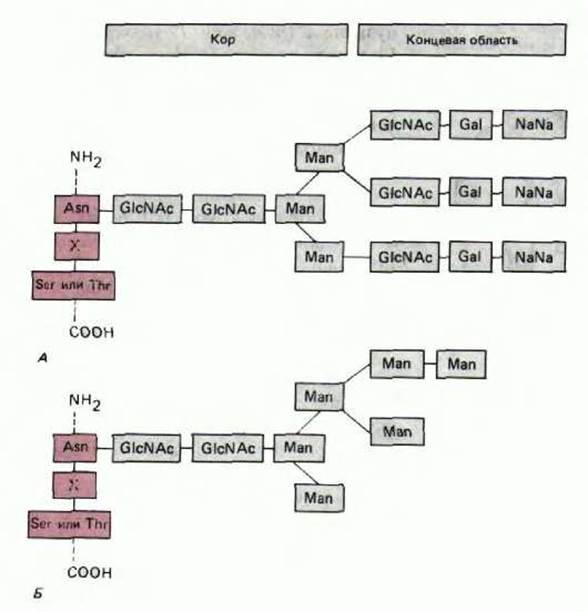
Рис. 8-61. Примеры двух основных классов связанных с аспарагином (N-связанных) олигосахаридов, обнаруженных в зрелых гликопротеинах: «сложные» олигосахариды (А) и «олигосахариды с высоким содержанием маннозы» (Б). Существует множество вариаций этих структур. Например, показанный здесь сложный олигосахарид имеет три концевых цепи, но часто встречаются также олигосахариды с двумя или четырьмя концевыми цепями, в зависимости от гликопротеина и от клетки, в которой он образуется. Встречаются также «гибридные» олигосахариды с одной маннозной концевой цепью и одной - с GlcNAc-Gal. Три аминокислоты, выделенные цветом, представляют собой последовательность, которую узнает фермент, добавляющий к белку исходный олигосахарид. Сокращения: Asn-аспарагин; Man-манноза; GlcNAc-N-ацетилглюкозамин; NANA-N-ацетилнейраминовая кислота (сиаловая кислота); Gal-галактоза; Х-любая аминокислота.
Реакции, в результате которых получаются сложные олигосахариды, происходят по строго упорядоченной схеме, показанной на рис. 8.63.
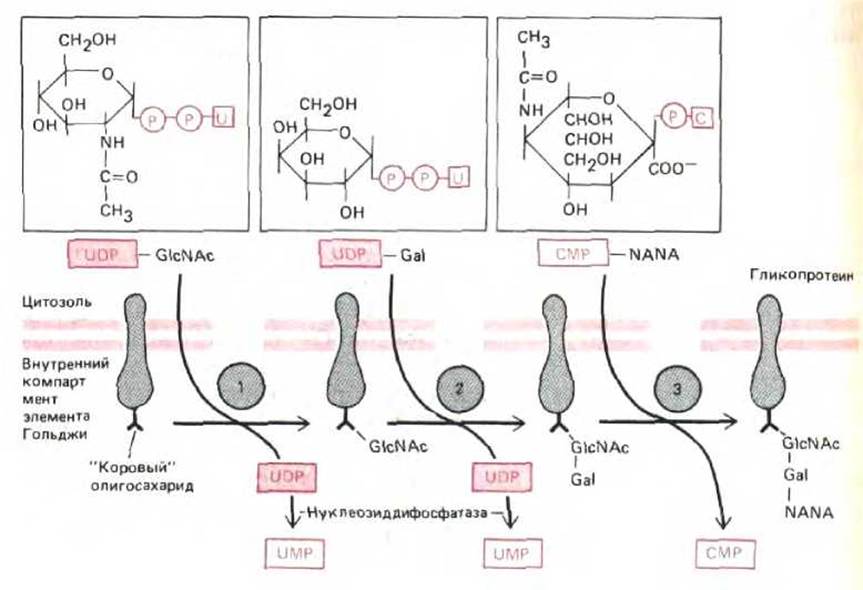
Рис. 8-62. Схема последовательного присоединения сахарных остатков. Эти реакции протекают в аппарате Гольджи и приводят к образованию сложных олигосахаридов. На каждом этапе действует одна из трех различных гликозилтрансфераз, использующих в качестве субстратов сахара, активированные за счет связывания их с нуклеотидами. Гликозилирование протекает на внутренней поверхности мембраны. Сверху показаны структуры нуклеотид-сахаров UDP-ацетилглюкоз-амина, UDP-галактозы и CMP-N-ацетилнейраминовой кислоты. Сокращения см. в подписи к рис. 8-61.
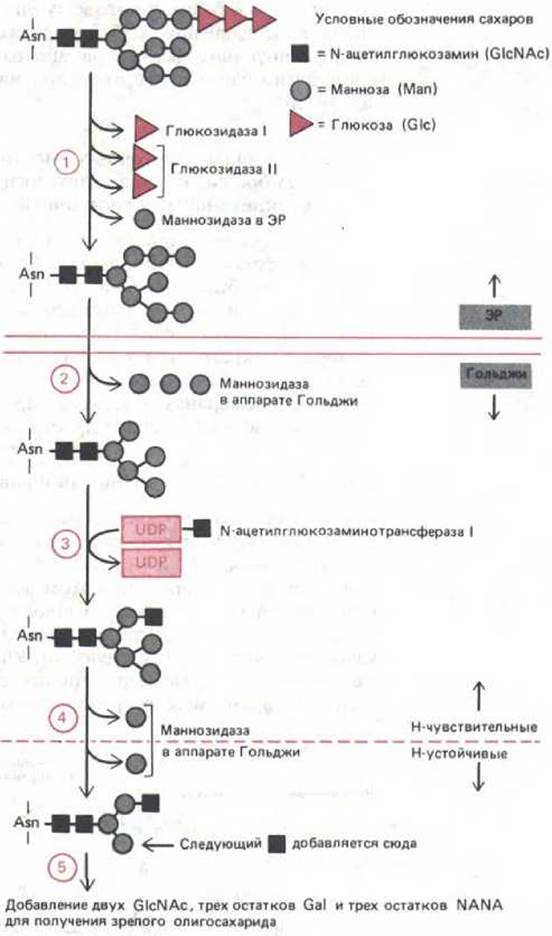
Рис. 8-63. Процессинг олигосахаридов, протекающий в ЭР и аппарате Гольджи. Процессинг высокоупорядочен, и каждая стадия, показанная здесь, зависит от предыдущей реакции в серии. Процессинг начинается в ЭР с удаления у олигосахарида, исходно перенесенного к белку, остатка глюкозы. Еще до завершения синтеза белка могут быть удалены все три остатка глюкозы. Затем маннозидаза в мембране ЭР удаляет определенный остаток маннозы. В стопке Гольджи маннозидаза I удаляет еще три остатка маннозы, а N-ацетилглюкозоаминотрансфераза I добавляет остаток GlcNAc, не дающий маннозидазе II удалить два дополнительных остатка маннозы. В конце концов это приводит к образованию кора из трех остатков маннозы, присутствующего в олигосахаридах «сложного» типа. На этом этапе связь между двумя остатками GlcNAc в коре становится устойчивой к атаке высокоспецифичной эндогликозидазы (EndoH). Так как все последующие стадии данного процесса тоже устойчивы к действию EndoH, обработка этим ферментом широко применяется для разделения сложных олигосахарядов и олигосахаридов с высоким содержанием маннозы. Наконец, добавляются дополнительные остатки GlcNAc, галактозы и сиаловой кислоты. Степень процессинга исходного олигосахарида зависит от типа белка и от положения остатка аспарагина в том белке, к которому присоединен олигосахарид. Процессинг некоторых олигосахаридов прерывается в аппарате Гольджи, другие же претерпевают в различной степени изображенные здесь модификации. Сокращения см. в подписи к рис. 8-61.
Детали этого процесса удалось выяснить, благодаря использованию разнообразных препаратов и антибиотиков, которые подавляют его специфические стадии (табл. 8-4). Останется ли данный олигосахарид богатым маннозой или будет модифицирован, определяется в основном конфигурацией белка, к которому он прикрепляется: если олигосахарид после присоединения к белку окажется стерически доступным для модифицирующих ферментов аппарата Гольджи, он, видимо, будет превращен в сложную форму; в противном случае он останется богатым маннозой.
Таблица 8-4. Препараты, подавляющие различные стадии N-гликозилирования
|
Препарат (ы) |
Подавляемая стадия |
|
Туникамицин |
Долихол-Р → dol-P-P-GlcNAc |
|
Кастаноспермин и N-метил-дезоксинодзиримицин |
Глюкозаз-Man9-GlcNAC2-Asn → глюкоза2-Маn9-GlсМАс2-Аsn |
|
Бромокондуритол |
Глюкоза2-Маn9-GlcNАс2-Аsn → Man9-GlcNAc2-Asn |
|
Цезоксиманнонодзиримицин |
Man8-GlcNAc2-Asn → Man5-GlcNAC2-Asn |
|
Свэнсонин |
GlcNAc-Man3-GlcNAc2-Asn → GlcNAc-Man3-GlcNAc2 -Asn |
8.7.2. Углеводы клеточных мембран обращены к той стороне мембраны, которая топологически эквивалентна внеклеточному пространству
Поскольку олигосахаридные цепи присоединяются со стороны внутреннего пространства ЭР и аппарата Гольджи, расположение углеводов на мембранных белках и липидах несимметрично. Как и асимметрия самого липидного бислоя, эта асимметричная ориентация гликозилированных молекул сохраняется в процессе транспорта к плазматической мембране, секреторным пузырькам или лизосомам. В результате олигосахариды всех гликопротеинов и гликолипидов в соответствующих клеточных мембранах обращены в просвет органелл, а в плазматической мембране - во внеклеточное пространство (рис. 8-64).
8.7.3. Зачем нужно N-гликозилирование? [49]
Существует важное различие между синтезом молекул олигосахаридов и других макромолекул, таких, как ДНК, РНК и белки. Нуклеиновые кислоты и белки копируются с матрицы путем многократного повторения одинаковых этапов, при этом используется один и тот же фермент (или ферменты). Сложные углеводы нуждаются в различных ферментах на разных этапах синтеза, и продукт каждой реакции узнается в качестве субстрата для следующей. Учитывая сложность биохимических механизмов, которые выработались в процессе эволюции для синтеза олигосахаридов, можно предположить, что эти соединения выполняют важные функции, однако большая часть этих функций пока неизвестна.
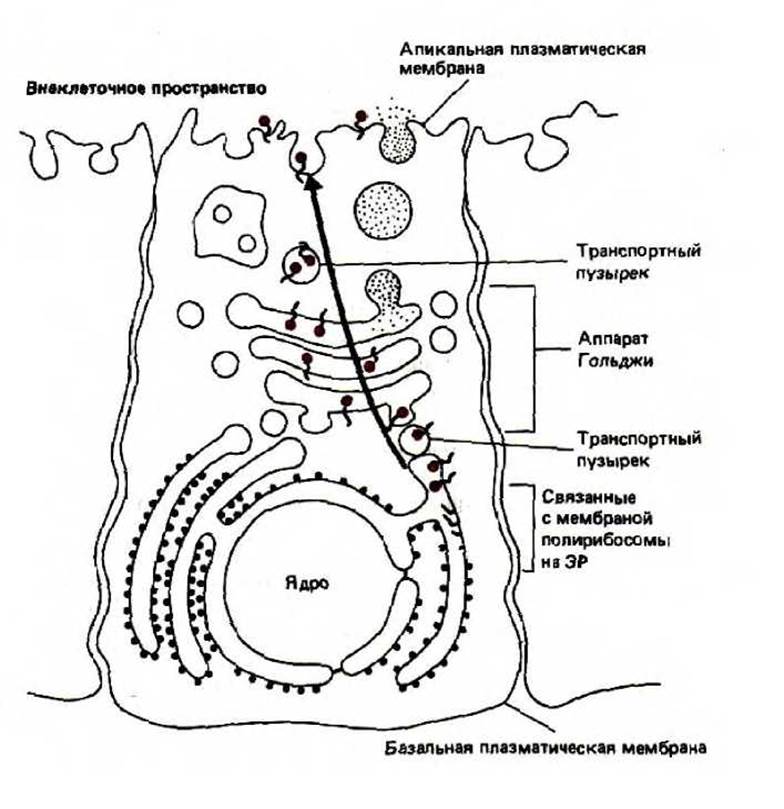
Рис. 8-64. Ориентация трансмембранного белка в мембране ЭР сохраняется при транспорте его к другим мембранам. Черные кружки на конце каждой молекулы гликопротеина обозначают N-связанный олигосахарид, который присоединяется к белкам в просвете (полости) ЭР. Обратите внимание, что эти остатки Сахаров находятся только в просвете внутренних органелл, а после того, как транспортный пузырек сольется с плазматической мембраной, они оказываются обращенными во внеклеточное пространство.
К примеру, N-гликозилирование преобладает у всех эукариот, включая дрожжи, но отсутствует у эубактерий. Поскольку у большинства белков, переносимых через ЭР и аппарат Гольджи, имеется один или более N-связанных олигосахаридов (а процесс переноса специфичен для клеток эукариот), было выдвинуто предположение, что эти олигосахариды участвуют в транспорте. Однако оказалось, что препараты, блокирующие некоторые стадии гликозилирования (табл. 8-4), в общем не влияют на транспорт (имеется, правда, одно важное исключение - транспорт в лизосомы, который мы обсудим ниже - см. разд. 8.8). Мутантные культивируемые клетки, у которых гликозилирование в аппарате Гольджи блокировано на разных стадиях, тем не менее жизнеспособны, и транспорт белков протекает у них нормально. Установлено, что некоторые белки без «своих» олигосахаридов не могут правильно свернуться, в результате они преципитируют в ЭР и становятся неспособными к транспорту, однако большинство белков сохраняет нормальную активность и без гликозилирования.
Поскольку цепочки сахаров имеют ограниченную гибкость, даже небольшой N-связанный олигосахарид выдается над поверхностью гликопротеина (рис. 8-65), и может, таким образом, ограничивать присоединение других макромолекул к поверхности этого гликопротеина. В результате присутствие олигосахарида в некоторых случаях обусловливает относительную устойчивость гликопротеина к действию протеаз. Возможно, олигосахариды обеспечивали предковой эукариотической клетке защитную оболочку, которая, в отличие от жесткой клеточной стенки бактерий, позволяла ей изменять форму и двигаться. С тех пор олигосахариды могли модифицироваться для выполнения и других функций.
8.7.4. В аппарате Гольджи происходит сборка протеогликанов [50]
В процессе переноса белков из ЭР к местам конечного назначения через аппарат Гольджи изменяются не только N-связанные олигосахариды; многие белки модифицируются и другими способами. Например, как отмечалось выше, у некоторых белков сахара присоединяются к боковым цепям определенных остатков серина или треонина. Такое О-связанное гликозилирование, как и наращивание цепей N-связанных олигосахаридов, катализируется гликозилтрансферазами. Эти ферменты добавляют к белку по одному сахару, используя в качестве субстрата нуклеотид-сахара, содержащиеся в полостях аппарата Гольджи. Обычно первым присоединяется N-ацетилгалактозамин, а за ним следует различное количество дополнительных остатков Сахаров, от нескольких до 10 и более.
Наиболее сильно гликолизируется протеогликановые коровые белки, которые в аппарате Гольджи модифицируются с образованием протеогликанов. Этот процесс включает полимеризацию одной или более цепей гликозаминогликанов (длинных неразветвленных полимеров, состоящих из повторяющихся дисахаридных единиц) с серинами корового белка. Судьба протеогликанов различна: одни из них секретируются в качестве компонентов внеклеточного матрикса, а другие остаются погруженными в плазматическую мембрану. Кроме того, протеогликаны составляют основу слизи, которая образует защитное покрытие множества эпителиев.
Сахара, входящие в состав гликозаминогликанов, сразу же после их полимеризации в аппарате Гольджи сильно сульфатируются, что придает протеогликанам отрицательный заряд. Сульфат переносится от активированного донора сульфатов 3'-фосфоаденозин-5'-фосфосульфата (PAPS), который поступает из цитозоля в аппарат Гольджи. Самая тонкая модификация, происходящая в этой органелле, - присоединение сульфата, взятого от PAPS, к гидроксильной группе определенных остатков тирозина в белках. Сульфатированные тирозины характерны для секретируемых белков, но иногда встречаются и у белков плазматической мембраны (в их обращенных во внеклеточное пространство доменах).
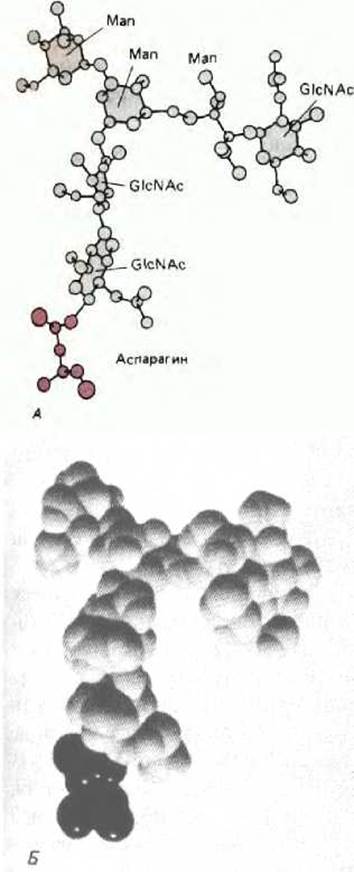
Рис. 8-65. Трехмерная структура небольшого N-связанного олигосахарида, определенная с помощью рентгеноструктурного анализа гликопротеина. Этот олигосахарид содержит всего 6 остатков Сахаров, тогда как в N-связанном олигосахариде, первоначально присоединенном к белку в ЭР, содержится 14 остатков сахаров (см. рис. 8-52). А. Шаростержневая модель, изображающая все атомы, кроме водородных; Б. пространственная модель, темные атомы - остаток аспарагина. (С любезного разрешения Richard Feldman.)
8.7.5. При образовании секреторных пузырьков белки часто подвергаются протеолизу [51]
Наиболее радикальная модификация, которой подвергаются белки перед секрецией, происходит в последнюю очередь. Многие полипептидные гормоны и нейропептиды синтезируются в форме неактивного белка-предшественника, из которого затем в результате протеолиза образуется активная молекула. Полагают, что это расщепление начинается в транс-сети Голъджи и продолжается в секреторных пузырьках. Сначала связанная с мембраной протеаза расщепляет белок по связям основных аминокислот (Lys-Arg, Lys-Lys, Arg-Lys, или Arg-Arg), после чего происходит окончательная «доделка» секретируемого продукта (рис. 8-66). В простейшем случае полипептид часто имеет только один N-концевой про-участок, который отщепляется с образованием зрелого белка незадолго до секреции. Следовательно, такие белки синтезируются в виде пре- про-белков, у которых пре-часть является сигнальным пептидом ЭР, удаляемым в шероховатом ЭР. В более сложном случае пептидные молекулы синтезируются в виде полипротеинов, содержащих множество копий одной и той же аминокислотной последовательности (см. рис. 8-66). И наконец, в клетке существуют пептиды, выступающие в роли предшественников для множества различных конечных продуктов. Эти конечные продукты по одному отщепляются от исходной полипептидной цепи. В разных типах клеток одни и те же полипротеины могут расщепляться, различным образом, увеличивая тем самым разнообразие молекул, участвующих в химической передаче сигнала между клетками.
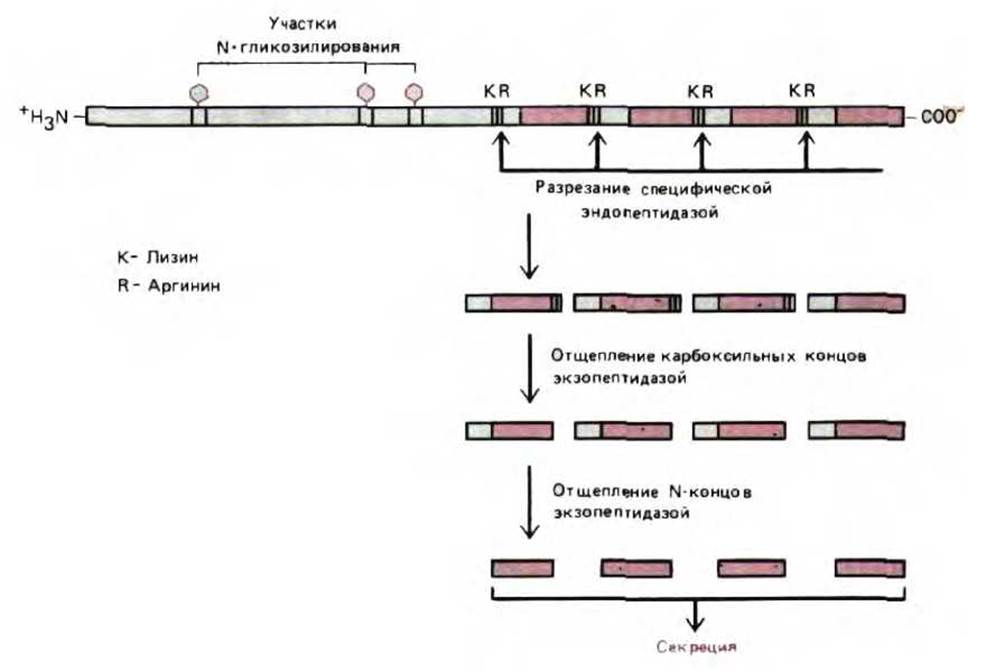
Рис. 8-66. Пример полипротеина, который разрезается с образованием множества копий одной и той же молекулы сигнального пептида. Обычно процессинг начинается с разрезания по парам основных аминокислот (здесь пары Lys-Arg), катализируемого специфической связанной с мембраной протеазой, расположенной в секреторных пузырьках или в транс-сети Гольджи. Здесь показан механизм процессинга, при котором образуется 13-аминокислотный пептид-а-фактор дрожжей Saccharomyces cerevisiae. Это секретируемый пептид, который регулирует у дрожжей половой процесс. (По R. Fuller, A. Brake, and J. Thorner, in Microbiology 1986 [L. Lieve, ed.], pp. 273-278. Washington, D. C: American Society for Microbiology, 1986.)
Почему для столь большого количества полипептидов характерен такой «задержанный» протеолиз? Возможно многие из них, например, энкефалины (нейропептиды, состоящие из пяти аминокислот), слишком коротки, чтобы их можно было эффективно синтезировать на рибосомах, ведь известно, что даже более длинные пептиды иногда утрачивают сигналы, необходимые для упаковки в секреторные пузырьки. Кроме того, задержка образования активного продукта до того момента, как он попадает в секреторный пузырек, может предотвращать действие данного продукта внутри клетки.
8.7.6. Цистерны Гольджи собраны в виде последовательных компартментов, в которых происходит процессинг продукта [52]
Процессинг в стопке Гольджи высоко упорядочен. Каждая цистерна представляет собой отдельный компартмент, со своим собственным набором ферментов, а вся стопка, таким образом, образует ячейку многостадийного процессинга. Белки модифицируются последовательно, по мере того, как они перемещаются из цистерны в цистерну.
Белки, поступившие из ЭР, попадают в первую цистерну Гольджи (цис-компартмент), затем переходят в следующий компартмент (промежуточный) и, наконец, оказываются в транс-компартменте (представленном последней цистерной стопки), где гликолизирование завершается. Из транс-компартмента белки попадают в транс-сеть Гольджи (ТСГ); в этом трубчатом ретикулуме они распределяются в различные транспортные пузырьки и отправляются к пунктам конечного назначения-плазматической мембране, лизосомам или секреторным пузырькам.
Функциональные различия между цис-, промежуточным и транс-компартментами стопки Гольджи были впервые обнаружены при изучении ферментов процессинга N-связанных олигосахаридов. В ходе экспериментов использовали как физическое фракционирование органеллы, так и иммуноэлектронную микроскопию. Благодаря этому, например, было показано, что удаление остатков маннозы и присоединение N- ацетилглюкозамина происходит в промежуточном компартменте, а присоединение галактозы и сиаловой кислоты-в транс-компартменте (рис. 8-67 и 8-68).
Белки, попадающие в аппарат Гольджи из ЭР (кроме тех из них, которые должны остаться в одной из цистерн Гольджи), «протекают» через стопку от цис- к промежуточному и затем к транс-компартменту, подвергаясь при этом ступенчатому процессингу. Механизм переноса белков и липидов от одной цистерны к другой точно не известен, однако полагают, что в нем участвуют окаймленные пузырьки, которые отшнуровываются от расширений цистерн. Поскольку было показано, что попавшие в аппарат Гольджи белки перемещаются от цис-компартмента через промежуточный к транс-компартменту не напрямую, и никогда не перескакивают, надо, чтобы каждый пузырек мог сливаться только с мембраной следующей цистерны. Хотя до сих пор были обнаружены только три функционально различных области аппарата Гольджи, каждая из них иногда представлена двумя или более последовательно расположенными цистернами, и, возможно, будут открыты более тонкие различия между ними. С другой стороны, может быть, существуют только три фундаментально различных компартмента, и некоторые цистерны внутри них представляют собой просто копии одной и той же функциональной ячейки.
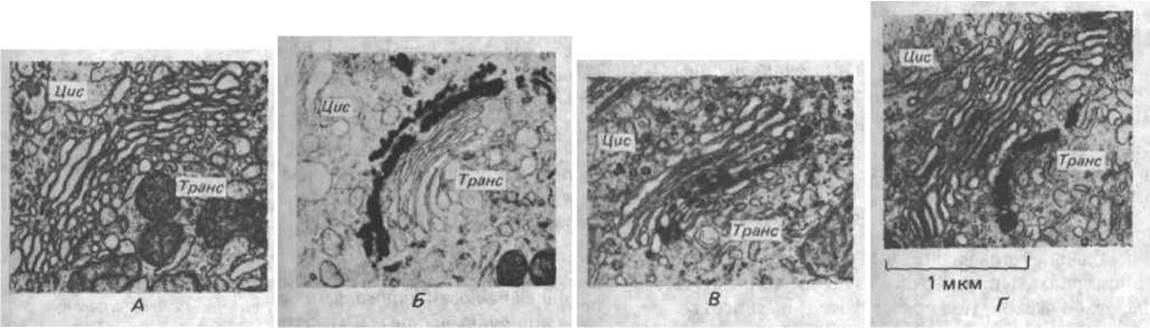
Рис. 8-67. Гистохимическое окрашивание показывает, что аппарат Гольджи биохимически поляризован. А. Неокрашенный препарат. Б. Осмий окрашивает в основном цистерны цис-компартмента. В. Фермент нуклеозиддифосфатаза (см. рис. 8-62) обнаруживается в транс-цистернах Гольджи; этот фермент раньше называли «тиаминпирофосфатазой». Г. Фермент кислая фосфатаза является маркером транс-сета Гольджи (С любезного разрешения Daniel S. Friend.)
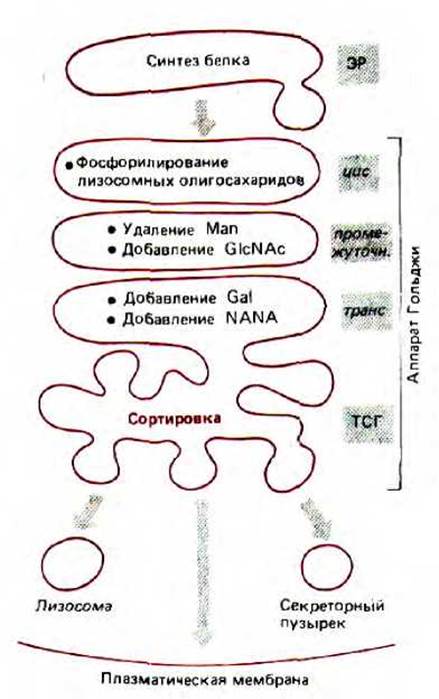
Рис. 8-68. Компартментация аппарата Гольджи. По мерс продвижения сквозь тесно сгруппированные цистерны стопки Гольджи белки претерпевают ковалентные модификации. Транс-сеть Гольджи (TGN) представляет собой трубчатый ретикулум, который работает прежде всего как ориентировочный пункт. Локализацию каждой изображенной здесь ступени процессинга удалось определить, сочетая различные методы, включая субфракционирование мембран аппарата Гольджи и электронную микроскопию после окраски антителами к некоторым ферментам процессинга.
Место протекания многих других реакций до сих пор не установлено.
Заключение
Белки поступают в аппарат Гольджи из ЭР и направляются затем к плазматической мембране, лизосомам и секреторным пузырькам. Аппарат Гольджи представляет собой поляризованную структуру, состоящую из одной или более стопок уплощенных цистерн, окруженных множеством мелких пузырьков. Эти цистерны объединены в по меньшей мере три различных компартмепта (цис-, промежуточный и транс-компартмент) аппарата Гольджи. Белки из полости и мембраны ЭР переносятся на цис-сторону стопки Гольджи при помощи транспортных пузырьков. Белки, предназначенные для секреторных пузырьков, плазматической мембраны и лизосом, движутся последовательно от одной цистерны к другой. Наконец, они достигают транс-сети Гольджи, откуда каждый белок в составе специальных пузырьков отправляется к положенному месту.
В отличие от ЭР, аппарат Гольджи содержит много нуклеотид-сахаров. Различные гликозилтрансферазы используют их в качестве субстратов в реакциях гликозилирования белков и липидов, проходящих через аппарат Гольджи. Например, от N-связанных олигосахаридов отщепляются остатки маннозы, и добавляются дополнительные сахара - такие, как остатки N-ацетилглюкозамина, галактозы и сиаловой кислоты. Кроме того, в аппарате Гольджи происходит О-гликозилирование и превращение протеогликановых коровых белков в протеогликаны. Сульфатирование Сахаров в протеогликанах и некоторых остатков тирозина в белках тоже происходит именно в аппарате Гольджи.