Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Поддержание нормальной организации тканей
Мягкие клетки и твердый матрикс: рост, обновление и репарация кости
Кость - это очень плотная специализированная соединительная ткань. Подобно железобетону, костный матрикс состоит из двух компонентов - прочных волокон (фибриллы коллагена типа II), противодействующих растяжению, и твердых частиц (фосфат кальция в виде кристалликов гидоксиапатита), устойчивых к сжатию. Объем пространства, занятого коллагеном, почти равен объему, занимаемому фосфатом кальция. В костях взрослого организма фибриллы расположены упорядоченными слоями, напоминая структуру фанеры: в каждом слое они лежат параллельно друг другу, но под прямым углом к фибриллам обоих смежных слоев.
Кость при всей ее твердости подвержена изменениям. Весь ее плотный внеклеточный матрикс пронизан каналами и полостями, заполненными живыми клетками, которые составляют около 15% веса компактной кости. Эти клетки участвуют в непрекращающемся процессе перестройки костной ткани. Клетки одного типа разрушают старый костный матрикс, а клетки другого типа образуют новый. Этот механизм обеспечивает обновление матрикса внутри кости.
Кость может расти только путем аппозиции, т. е. отложения дополнительного матрикса вместе с клетками на свободной поверхности твердой ткани. У эмбриона аппозиционный рост кости должен быть скоординирован с ростом других тканей так, чтобы организм мог увеличиваться в размерах без существенного искажения пропорций. Рост большей части скелета, особенно рост длинных костей конечностей и туловища, координируется с помощью сложной стратегии. У эмбриона сначала из хряща образуются миниатюрные «модели» будущих костей. Каждая такая модель растет, и по мере образования нового хряща более старый хрящ замещается костью. Рост и разрушение хряща и отложение кости в период развития так тонко скоординированы, что у взрослого животного кость, даже достигнув полуметра в длину, имеет почти такую же форму, как первоначальная хрящевая модель, длина которой не превышала нескольких миллиметров. Не углубляясь детально в геометрию этого процесса, мы остановимся на активности клеток, лежащей в основе роста костей и хряща у зародыша и обновления соответствующих тканей у взрослого организма; здесь особенно четко выявляется роль взаимодействий между клетками разного типа.
17.8.1. Хрящ способен к интерстициальному росту [39, 42]
«Сотрудничество» кости и хряща основано на их контрастных свойствах. Обе ткани образуются из мезенхимных клеток, секретирующих большие количества внеклеточного матрикса, который содержит коллаген. Но костный матрикс тверд, а хрящевой может деформироваться, так как состоит в основном из протеогликанов в высокой концентрации (разд. 14.2.4) и из коллагена типа II. Поэтому хрящ в отличие от кости способен к интерстициальному росту: он может увеличиваться в объеме за счет того, что клетки, уже окруженные матриксом, продолжают секретировать его.
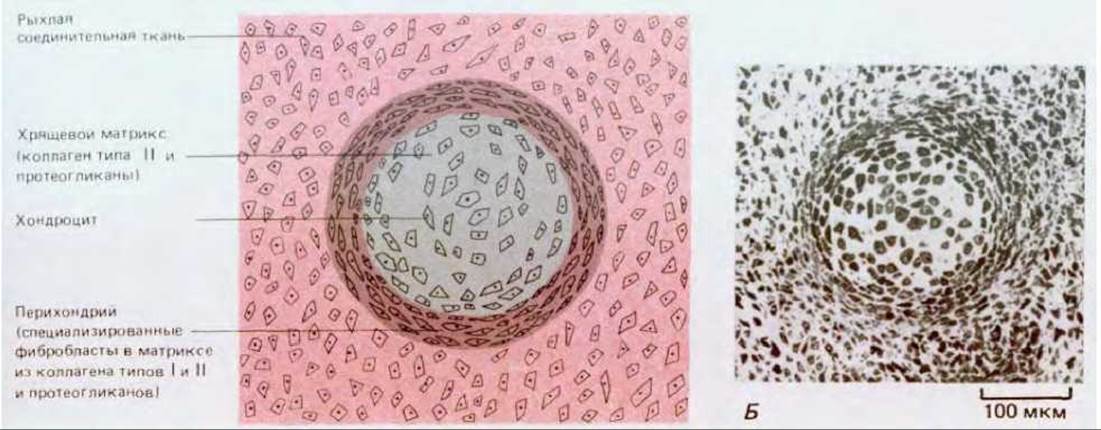
Рис. 17-43. А. Схематическое изображение среза, проходящего через хрящевой стержень в период его образования. Показан окружающий хрящевую ткань фиброзный перихондрий. Каждый хондроцит заполняет лакуну в хрящевом матриксе. Б. Поперечный срез через такой стержень у куриного эмбриона на ранней стадии развития. По мере роста ткани количество хрящевого матрикса, приходящегося на один хондроцит, будет сильно возрастать, и граница между хрящом и перихондрием обозначится более резко. (С любезного разрешения Peter Gould.)
Хрящевые клетки, или хондроциты, отделены друг от друга матриксом. Каждая клетка занимает в матриксе небольшую полость, или лакуну. Хрящ обычно не содержит кровеносных капилляров, и жизнедеятельность его клеток поддерживается благодаря диффузии питательных веществ и газов через матрикс от лежащих довольно далеко кровеносных сосудов и в обратном направлении. Большую часть хряща окружает перихондрий - плотный слой соединительной ткани, содержащей коллаген (рис. 17-43). Хрящ растет изнутри, по мере того как хондроциты секретируют новый матрикс, а волокнистый перихондрий выступает в роли корсета, ограничивающего изменения формы. В процессе роста хряща образуются и новые клетки: хондроцит, находящийся в своей лакуне, разделившись, даст две клетки, и каждая из них будет затем секретировать новый матрикс, который вскоре изолирует их друг от друга (рис. 17-44). Новые клетки могут также переходить в хрящ из перихондрия. Как полагают, перихондриальные клетки, напоминающие фибробласты, делятся и подвергаются превращению, в результате которого они начинают образовывать вокруг себя хрящевой матрикс и быстро становятся настоящими хондроцитами. По-видимому, этот процесс, происходящий in vivo, аналогичен описанной выше трансформации соединительнотканных клеток in vitro (разд. 17.7.2).
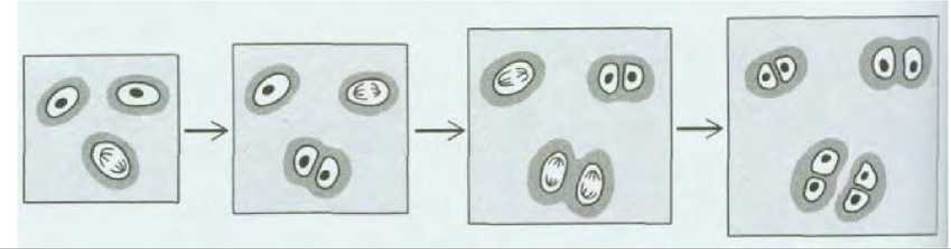
Рис. 17-44. Рост хряща. Ткань разрастается, по мере того как хондроциты делятся и производят больше матрикса. Новосинтезированный матрикс, непосредственно окружающий клетки, выделен более темным серым цветом. Хрящ может также расти благодаря поступлению фибробластов из перихондрия и их превращению в хондроциты (см. рис. 17-43).
17.8.2. Остеобласты секретируют костный матрикс, а остеокласты разрушают его [41, 43]
Кость - ткань более сложная, чем хрящ. Костный матрикс секретируют остеобласты, которые лежат на поверхности уже существующего матрикса и наслаивают на него новый костный материал. Некоторые остеобласты остаются свободными на поверхности, в то время как другие постепенно погружаются в продукт своей собственной секреции. Этот свежеизготовленный материал (состоящий главным образом из коллагена типа I) называется остеоидом. Он быстро превращается в плотный костный матрикс в результате отложения фосфата кальция. Оказавшись заключенной в твердый матрикс, исходная костеобразующая клетка, называемая теперь остеоцитом, уже не имеет возможности делиться, хотя и продолжает секретировать в небольших количествах матрикс. Подобно хондроциту, остеоцит занимает небольшую полость, или лакуну, в матриксе, но в отличие от хондроцитов он не изолирован от своих собратьев: от каждой лакуны отходят очень узкие канальцы, которые содержат отростки лежащего в лакуне остеоцита, позволяющие ему образовывать щелевые контакты с соседними остеоцитами (рис. 17-45). Хотя такие сети из остеоцитов сами не секретируют матрикс и не разрушают его, им, вероятно, принадлежит важная роль в регуляции активности тех клеток, которые это делают.
В то время как остеобласты откладывают костный матрикс, остеокласты разрушают его (рис. 17-46). Остеокласты - это крупные многоядерные клетки типа макрофагов. Подобно другим макрофагам, они развиваются из моноцитов, образующихся в кроветворной ткани костного мозга. Предшественники остеокластов - моноциты - выходят в кровяное русло и скапливаются в местах резорбции кости; там они сливаются друг с другом, образуя многоядерные остеокласты, которые внедряются в поверхностные слои костного матрикса и постепенно растворяют его.
Остеокласты способны проделывать глубокие ходы в материале компактной кости, образуя полости, в которые затем проникают другие клетки. По оси такого туннеля прорастают кровеносные капилляры, а стенки его покрываются слоем остеобластов (рис. 17-47). Остеобласты откладывают концентрическими слоями новую кость, которая постепенно заполняет полость, оставляя лишь узкий канал вокруг нового кровеносного сосуда. Многие остеобласты оказываются замурованными в костный матрикс и образуют там концентрические кольца остеоцитов. В то время как одни туннели заполняются костью, другие заново прокладываются остеокластами в более старых концентрических системах. Результаты этой непрерывной перестройки хорошо видны на гистологических препаратах компактной кости (рис. 17-48).
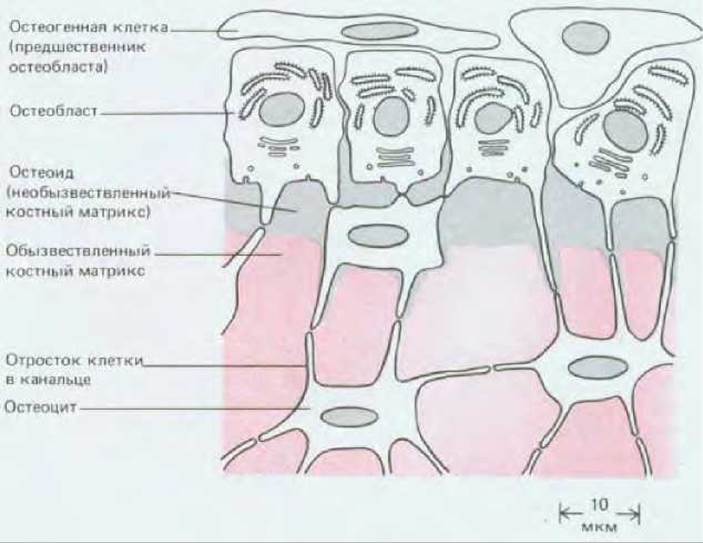
Рис. 17-45. Эта схема показывает, как остеобласты, выстилающие поверхность кости, секретируют органический матрикс кости (остеоид) и превращаются в остеоциты по мере погружения в этот матрикс. Образующийся матрикс вскоре обызвествляется. Полагают, что сами остеобласты ведут свое происхождение от остеогенных стволовых клеток - близких родственников фибробластов.
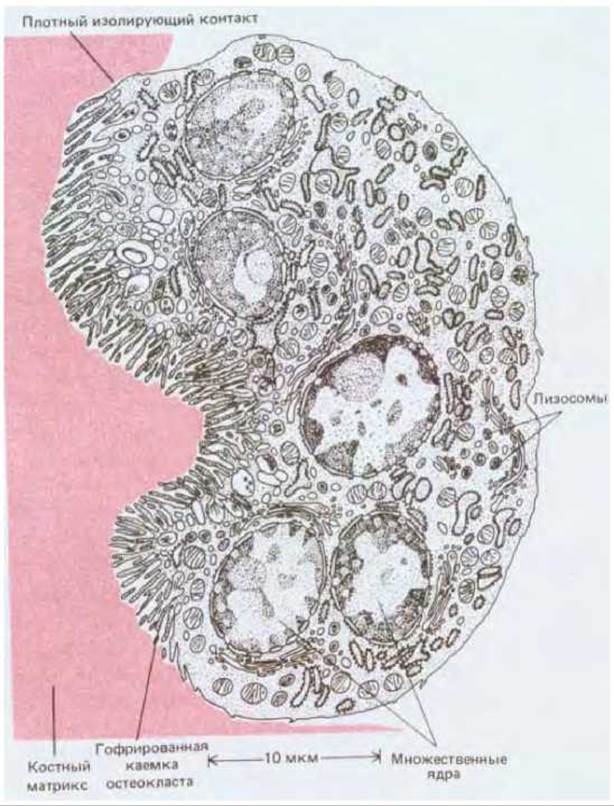
Рис. 17-46. Остеокласт - гигантская клетка, разрушающая костный матрикс. «Гофрированная каемка» - это место секреции кислот (для растворения минерального вещества кости) и гидролаз (для переваривания органических компонентов матрикса). Клетка показана в поперечном разрезе. Форма остеокластов изменчива, они подвижны и часто посылают отростки для резорбции кости сразу во многих участках. Остеокласты развиваются из моноцитов, их можно рассматривать как специализированные макрофаги. (R. V. Krstic: Ultrastucture of the Mammalian Cells An Atlas. Berlin: Springer, 1979.)
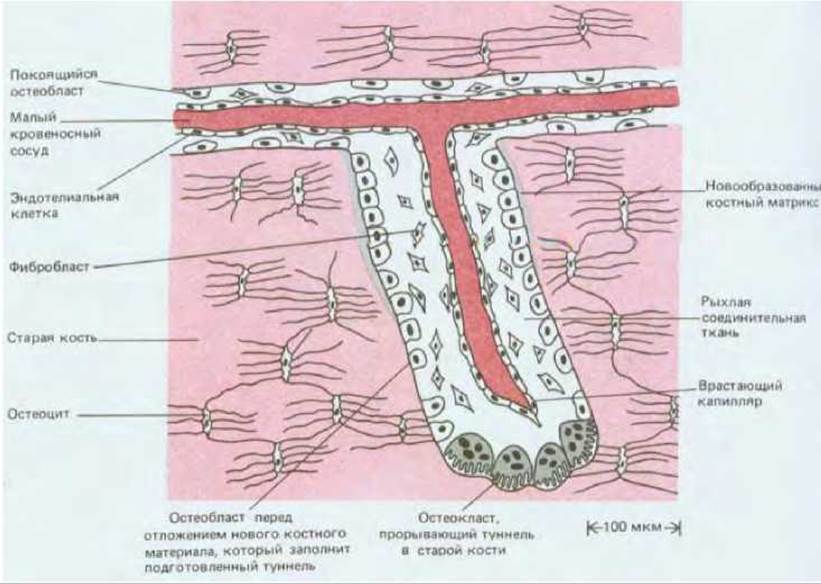
Рис. 17-47. Схема, иллюстрирующая процесс перестройки компактного вещества кости. Остеокласты, действуя небольшими группами, прокладывают тоннели в старой кости, продвигаясь ежедневно приблизительно на 50 мкм. Вслед за ними в тоннель входят остеобласты; они выстилают стенки тоннеля и начинают образовывать новую кость, откладывая матрикс со скоростью 1-2 мкм в сутки. Одновременно по оси тоннеля прорастают капилляры. В конце концов тоннель будет постепенно заполняться концентрическими слоями новой кости - останется свободным только узкий центральный канал. Каждый такой канал не только обеспечивает доступ остеобластам и остеокластам, но содержит также один или несколько кровеносных сосудов, доставляющих питательные вещества, необходимые для жизни костных клеток. Обычно за год у здорового взрослого млекопитающего таким способом заменяется 5-10% кости. (По Z. F. G. Jaworski, В. Duck, G. Sekaly, J. Anat., 133, 397-405, 1981.)

Рис. 17-48. Микрофотография поперечного среза компактного вещества длинной кости. Видны контуры тоннелей, проделанных остеокластами, а затем заполненных с помощью остеобластов. Срез приготовлен методом шлифования. Плотный матрикс сохранился, но клетки разрушены; однако отчетливо видны лакуны и канальцы, которые были заполнены остеоцитами и их отростками. Чередующиеся светлые и темные концентрические кольца соответствуют изменяющейся ориентации волокон коллагена в последовательных слоях костного матрикса, отложенного остеобластами, выстилавшими стенки в разные периоды жизни особи. (Такая картина получается при наблюдении образца между двумя частично скрещенными поляроидными фильтрами.) Обратите внимание на то, что часть более старой системы концентрических костных слоев (внизу справа, с узким центральным каналом) частично резорбирована и заменена более новой системой, в которой центральный канал все еще остается широким - по-видимому, потому, что он еще находится в процессе заполнения.
В этих процессах еще много непонятного. Кости, например, обладают удивительной способностью перестраивать свою структуру таким образом, чтобы приспособиться к испытываемым нагрузкам. Это означает, что накопление и разрушение матрикса каким-то образом регулируются локальными механическими напряжениями. Какие механизмы определяют, будет ли матрикс откладываться на поверхности данной кости остеобластами или разрушаться остеокластами, не известно. Вероятно, важную роль в этом играют факторы роста, выделяемые костными клетками, заключенными в толще матрикса (разд. 17.7.1). Эти факторы могли бы высвобождаться при разрушении матрикса или при воздействии соответствующих нагрузок.
17.8.3. В развивающемся организме остеокласты разрушают хрящ, чтобы проложить путь для роста кости [44]
Как полагают, замена хряща костью в процессе развития организма тоже зависит от активности остеокластов. По мере созревания хряща клетки в некоторых участках значительно увеличиваются в размерах за счет окружающего матрикса, а сам матрикс минерализуется, подобно кости, в результате отложения кристаллов фосфата кальция. В то же время хондроциты в таких участках набухают и гибнут, оставляя большие пустоты. В эти пустоты внедряются остеокласты и кровеносные сосуды, разрушающие остатки хрящевого матрикса, а следующие за ними по пятам остеобласты начинают откладывать костный матрикс. Единственное, что остается от хряща в длинных костях взрослого животного, - это тонкий слой, образующий гладкое покрытие в области суставов, где одна кость сочленяется с другой (рис. 17-49).
Однако в соединительной ткани, окружающей кость, сохраняются клетки, способные к образованию нового хряща. В случае перелома кости клетки из прилежащей области проведут починку, воспроизведя «на скорую руку» первоначальный эмбриональный процесс: сначала откладывается хрящ, чтобы заполнить брешь, а затем хрящ заменяется костью.
17.8.4. Структура тела стабилизируется его соединительнотканным каркасом, а также избирательным сцеплением клеток [45]
Отдельная кость, как и весь организм в целом - это динамическая система, поддерживающая свою структуру благодаря балансу между противоположными функциями различных специализированных клеток. Любая динамическая система ставит проблему стабильности, и это приводит к общему вопросу о поддержании структуры тела. Мы видели, каким образом клетки в тканях разного типа поддерживают свое дифференцированное состояние, как образуются новые клетки взамен утраченных, как перестраивается и обновляется внеклеточный матрикс. Но почему клетки различных типов постепенно не перемешиваются, почему не нарастает хаос? Почему структура в целом не искажается, не изменяет своих пропорций, по мере того как старые элементы заменяются новыми?
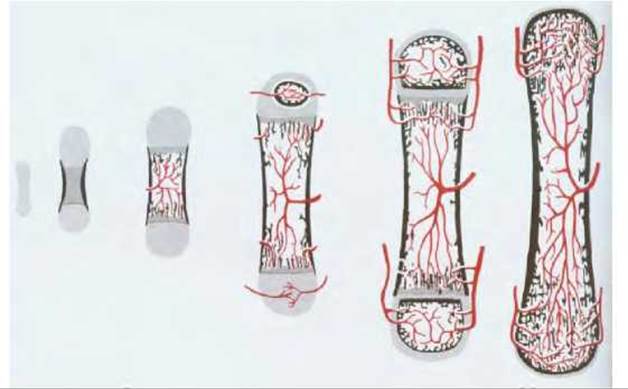
Рис. 17-49. Схема развития длинной кости (такой, как бедренная или плечевая) из миниатюрной хрящевой модели. Необызвествленный хрящ показан светло-серым цветом, обызвествленный - темно-серым, кость - черным, кровеносные сосуды - красным цветом. Хрящ не превращается в кость, а постепенно заменяется ею в результате деятельности остеокластов и остеобластов, которые внедряются в хрящ вместе с кровеносными сосудами. Остеокласты разрушают хрящевой и костный матрикс, в то время как остеобласты секретируют костный матрикс. Процесс окостенения начинается у эмбриона и заканчивается только к концу периода полового созревания. Образующаяся кость состоит из толстостенного полого цилиндра компактной кости, окружающей центральную полость, заполненную костным мозгом. Обратите внимание на то, что не все кости развиваются таким путем. Например, плоские кости черепа формируются сразу как костные пластинки, без предварительной стадии хрящевой модели. (D. W. Fawcett; A Textbook of Histology, 11 th ed. Philadelphia: Saunders, 1986, с изменениями.)
Конечно, с течением времени организм в какой-то степени все же деформируется: это одно из проявлений старения. Но поразительно то, что эти изменения так малы. Скелет, несмотря на постоянную перестройку, обеспечивает жесткую конструкцию, размеры которой почти не меняются. Это можно объяснить тем, что различные участки кости обновляются не все сразу, а мало-помалу, как при ремонте здания, в котором кирпичи заменяют по одному. Помимо консервативности способа обновления работают еще и механизмы активного гемеостаза. Например, небольшие отклонения кости от ее нормальной формы изменяют картину механических нагрузок, а эти нагрузки регулируют перестройку ткани так, чтобы вернуть кости ее нормальную форму (рис. 17-50).
Рост и обновление многих мягких частей тела гомеостатически контролируется таким образом, чтобы каждая деталь точно соответствовала предназначенному для нее месту. Эпидермис нарастает так, чтобы покрыть всю поверхность тела, и когда эта цель достигнута, миграция клеток прекращается в результате контактного торможения (разд. 11.6.8); соединительная ткань разрастается ровно настолько, чтобы заполнить образовавшийся при ранении дефект, и так далее. Но необходимо нечто большее, чем регулирование числа клеток. При обновлении дифференцированных клеток различного типа должны поддерживаться не только нужные численные соотношения между ними, но и их правильное относительное расположение. При обновлении тканей неизбежны перемещения клеток, и эти перемещения должны быть каким-то образом ограничены.
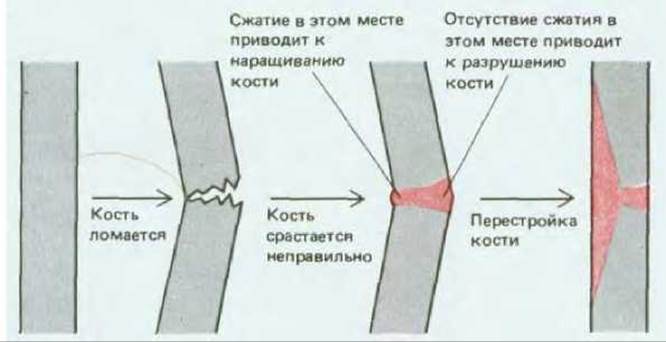
Рис. 17-50. Схема, иллюстрирующая процесс перестройки длинной кости ноги после неправильно сросшегося перелома. Деформации в недавно образовавшейся кости приводят к необычным напряжениям. В местах повышенного сжатия кости увеличивается скорость образования кости относительно скорости ее разрушения. Там же, где сжатие снижено, скорость роста кости уменьшается. Таким образом, кость постепенно перестраивается, приближаясь к своему нормальному состоянию.
Ограничивающие факторы могут быть разными. Например, железы и другие скопления специализированных клеток часто находятся в плотных капсулах из соединительной ткани. Клетки некоторых типов погибают, если оказываются вне своего обычного окружения и лишаются специфических факторов роста, необходимых, вероятно, для их выживания. Быть может, самый важный механизм, удерживающий различные клетки на своих местах, - это избирательная адгезия: клетки одного и того же типа имеют тенденцию «слипаться» друг с другом (разд. 14.3.5), образуя либо плотные массы (как, например, в случае гладкой мускулатуры), либо эпителиальные слои (выстилка кишечника и т. п.).
Как сказано в разд. 14.3.7, этот механизм позволяет диссоциированным клеткам эпидермиса, например, спонтанно объединяться в эпителий с правильной структурой. И в более общем случае: стойкие прокладки из эпителиальных клеток разграничивают отдельные области тела, т.е. поддерживают обособленность клеток и ограничивают их распределение надлежащими территориями.
Понятно, насколько сложными и тонкими должны быть механизмы контроля и координации, сохраняющие структуру тела и организацию его тканей при постоянно протекающих перестройках и обновлении. Важнейшая роль этих механизмов четко и в жестокой форме выявляется тогда, когда они разлаживаются, как мы это увидим в последней главе книги при обсуждении проблемы рака.
Заключение
Хрящ и кость состоят из клеток, погруженных в плотный матрикс. Хрящ с его податливым матриксом способен к интерстициальному росту, тогда как твердая кость может расти только в результате отложения нового материала на ее поверхности. Тем не менее кость подвергается непрерывной перестройке благодаря совместной деятельности остеокластов, разрушающих матрикс, и остеобластов, которые его создают. Некоторые остеобласты замуровываются в матрикс, становятся остеоцитами и участвуют в регуляции обновления костного матрикса. Большинство длинных костей развивается из миниатюрных хрящевых «моделей», которые по мере роста служат матрицами для отложения костного вещества в результате совместной активности остеобластов и остеокластов. Сходным образом происходит заживление костных переломов у взрослого организма: сначала разрыв заполняется хрящом, который позже замещается костью. Хотя костная ткань, как и большинство других тканей, непрерывно обновляется, этот динамический процесс регулируется так, что глобальная структура остается прежней. Таким образом, благодаря этому и другим механизмом (таким, например, как избирательная межклеточная адгезия) организация тела стойко сохраняется, несмотря на постоянное замещение почти всех его компонентов.
Приложение. Перечень клеток взрослого человеческого организма
Сколько различных типов клеток существует в организме взрослого человека? В большом руководстве по гистологии обычно упоминается около 200 типов, заслуживающих отдельного названия. Эти традиционные названия - в отличие, например, от названий спектральных цветов - не относятся к отдельным частям некоего условно подразделенного континуума: большинство из них соответствует дискретным, четко различающимся категориям. Внутри той или иной категории часто наблюдаются некоторые вариации: волокна скелетных мышц, приводящих в движение глазное яблоко, гораздо меньше, чем волокна крупных мышц ноги; слуховые волосковые клетки в разных участках ушной улитки могут быть настроены на разную частоту звука, и т.д. Однако нет непрерывных переходов между столь разными типами клеток взрослого организма, как, например, мышечное волокно и слуховая волосковая клетка.
Традиционная гистологическая классификация основана на форме и структуре клетки, видимых под микроскопом, и на ее химической природе, очень грубо оцениваемой по связыванию различных красителей. Более тонкие методы позволяют выделить новые подклассы в рамках традиционной классификации. Так, в современной иммунологии установлено, что к прежней категории «лимфоцитов» относится более десяти разных типов клеток (см. гл. 18). Точно так же фармакологические и физиологические исследования показали, что существует много различных разновидностей гладкомышечных клеток; например, в стенке матки эти клетки обладают высокой чувствительностью к эстрогену, а на последних стадиях беременности - к окситоцину, в то время как аналогичные клетки в стенке кишечника этими свойствами не обладают. Иного рода важные различия между клетками обнаружены в эмбриологических экспериментах вроде тех, которые обсуждались в гл. 16; они показали, что во многих случаях внешне сходные клетки из разных участков организма неэквивалентны - в том смысле, что в них есть внутренние различия в возможностях дальнейшего развития и в способности воздействовать на другие клетки. Например, соединительнотканные клетки из разных участков дермы должны быть неэквивалентными, так как под их влиянием лежащие над ними эпидермальные клетки ведут себя по-разному (разд. 16.6.4). Внутри таких категорий, как «фибробласт», вероятно тоже имеется много подтипов, химические различия между которыми пока не удается выявить непосредственно.
Ввиду сказанного выше любая классификация клеток будет в какой-то степени произвольной в отношении детальности подразделения. В наш перечень включены только те виды клеток взрослого человеческого организма, которые считаются различными во всяком большом современном руководстве по гистологии. Они сгруппированы в приблизительном соответствии со своей функцией. Мы не пытались как-либо подразделять класс нейронов центральной нервной системы. Когда отдельный вид клеток, например ороговевающая эпидермальная клетка (кератиноцит), последовательно получает различные названия по мере своего созревания, мы приводим только два из них - одно для дифференцирующейся клетки и одно для стволовой клетки. С учетом сделанных оговорок 210 наименований клеток, содержащихся в перечне, составляют более или менее исчерпывающий список различных вариантов экспрессии генома в виде фенотипов нормальных клеток взрослого человека.
Ороговевающие эпителиальные клетки
Кератиноцит эпидермиса (= дифференцирующаяся эпидермальная клетка)
Базальная клетка эпидермиса (стволовая) Кератиноцит ногтей Базальная клетка ногтевого ложа (стволовая) Клетки стержня волоса клетка мозгового вещества клетка коркового вещества
кутикулярная клетка Клетки корневого влагалища волоса
кутикулярная
слоя Гексли
слоя Генле
наружная Клетка волосяной матрицы (стволовая)
Клетки влажных многослойных барьерных эпителиев
Поверхностная эпителиальная клетка многослойного плоского эпителия роговицы, языка, ротовой полости, пищевода, анального отверстия, дистальной части уретры, влагалища
Базальная клетка тех же видов эпителия (стволовая)
Клетка эпителия мочевыводящих путей (выстилающего мочевой пузырь и мочевыводящие пути)
Эпителиальные клетки с экзокринной функцией
Клетки слюнной железы
слизистая клетка (секрет богат полисахаридами)
белковая клетка (секрет богат гликопротеиновыми ферментами)
Клетка железы фон Эбнера в языке (секрет служит для промывания вкусовых почек)
Клетка молочной железы, секретирующая молоко
Клетка слезной железы, секретирующая слезы
Клетка церуминозной железы уха, секретирующая ушную серу
Клетка эккринной потовой железы, секретирующая гликопротеины (темная клетка)
Клетка эккринной потовой железы, секретирующая малые молекулы (светлая клетка)
Клетка апокринной потовой железы (выделяет пахучий секрет, чувствительна к половым гормонам)
Клетка железы Молля в веке (специализированная потовая железа)
Клетка сальной железы, секретирующая богатое липидами кожное сало
Клетка боуменовой железы в носу (секретирует жидкость, промывающую обонятельный эпителий)
Клетка бруннеровой железы в двенадцатиперстной кишке, секретирующая щелочной раствор слизи и ферментов
Клетка семенного пузырька, секретирующая компоненты семенной жидкости, включая фруктозу (как источник энергии для движения спермиев)
Клетка предстательной железы, секретирующая другие компоненты семенной жидкости Клетка бульбоуретральной железы, секретирующая слизь
Клетка бартолиниевой железы, выделяющая жидкость для увлажнения влагалища
Клетка железы Литтре, секретирующая слизь
Клетка эндометрия, секретирующая главным образом углеводы
Изолированная бокаловидная клетка дыхательного и пищеварительного трактов, секретирующая слизь
Слизистая клетка выстилки
желудка
Зимогенная клетка слизистой желудка (секретирует пепсиноген)
Обкладочная клетка слизистой желудка (секретирует НСl)
Ацинозная клетка поджелудочной железы (секретирует пищеварительные ферменты и бикарбонат)
Клетка Панета в тонком кишечнике (секретирует лизоцим)
Пневмоциты типа II в легком (секретируют сурфактант)
Клетка
Клара в легком (функция неизвестна)
Клетки, выделяющие гормоны
Клетки передней доли гипофиза, выделяющие гормон роста
фолликулостимулирующий гормон лютеинизирующий гормон пролактин
адренокортикотропный гормон тиреотропный гормон
Клетка промежуточной доли гипофиза, выделяющая меланоцитстимулирующий гормон
Клетки задней доли гипофиза, выделяющие
окситоцин
вазопрессин
Клетки желудочно-кишечного тракта, секретирующие
серотонин
эндорфин
соматостатин
гастрин
секретин
холецистокинин
инсулин
глюкагон
бомбезин
Клетки щитовидной железы, секретирующие тиреоидный гормон кальцитонин
Клетки паращитовидной железы секретирующие паратгормон оксифильные (функция неизвестна)
Клетки надпочечников,
секретирующие
адреналин
норадреналин
стероидные гормоны
минералокортикоиды
глюкокортикоиды
Клетки половых желез, секретирующие
тестостерон (клетки Лейдига в семенниках)
эстроген (клетки theca interim яйцевого фолликула в яичниках)
Клетки юкстагломерулярного аппарата почки юкстагломерулярные клетки (секретируют ренин) клетка macula densa вероятно, близки по функции; периполярная клетка возможно, участвуют в секреции мезангиальная клетка эритропоэтина
Эпителиальные всасывающие клетки желудочно-кишечного тракта, экзокринных желез и мочеполовых путей
Клетка со щеточной каемкой из микроворсинок (в тонком кишечнике)
Исчерченная клетка протока экзокринной железы
Эпителиальная клетка желчного пузыря
Клетка со щеточной каемкой в проксимальном почечном канальце
Клетка дистального почечного канальца
Безресничная клетка семявыносящего протока
Клетки эпидидимиса главная клетка базальная клетка
Клетки, ответственные за процессы метаболизма и накопление резервных материалов
Гепатоцит (печеночная клетка)
Жировые клетки клетка белого жира клетка бурого жира липоцит печени
Эпителиальные клетки, выполняющие главным образом барьерную функцию, - выстилают легкие, кишечник, экзокринные железы и мочеполовой тракт
Пневмоциты типа I (выстилающие воздушную полость легкого)
Клетка протока поджелудочной железы (центроацинарная клетка)
Неисчерченная клетка протока потовой железы, слюнной железы, молочной железы и др.
Париетальная клетка почечного клубочка
Подоцит почечного клубочка
Клетка тонкой части петли Генле (в почках)
Клетка собирательной трубки (в почках)
Клетка протока семенного пузырька, предстательной железы и др.
Эпителиальные клетки, выстилающие замкнутые внутренние полости
Клетки эндотелия кровеносных и лимфатических сосудов
фенестрированная
непрерывная
селезеночная
Синовиальные клетки (выстилают суставные полости и секретируют главным образом гиалуроновую кислоту)
Серозные клетки (выстилают полости брюшины, плевры и перикарда)
Плоские клетки, выстилающие перилимфатическое пространство уха плоская клетка
столбчатая клетка эндолимфатического мешочка с микроворсинками без микроворсинок
«темная» клетка
клетка вестибулярной мембраны
базальная клетка сосудистой полоски
маргинальная клетка сосудистой полоски
клетка Клаудиуса
клетка Бётчера
Клетка сосудистого сплетения (секретирует цереброспинальную жидкость)
Плоская клетка мягкой и паутинной оболочек Клетки ресничного эпителия глаза
пигментированные
непигментированные
«Эндотелиальная» клетка роговицы
Ресничные клетки с проталкивающей функцией
Клетки дыхательных путей
Клетки яйцевода и эндометрия (у женщин)
Клетки rete testis и семявыносящего протока (у мужчин)
Эпендимные клетки, выстилающие полости мозга
Клетки, секретирующие внеклеточный матрикс
Эпителиальные
Амелобласт (секретирует зубную эмаль)
Клетка planum semilunatum вестибулярного аппарата (секретирует протеогликан)
Интердентальная клетка кортиевого органа (секретирует вещество текториальной мембраны, лежащей над волосковыми клетками этого органа)
Неэпителиальные (соединительнотканные)
Фибробласты (рыхлой соединительной ткани, роговицы, сухожилий, ретикулярной ткани костного мозга и др.)
Перицит кровеносного капилляра
Клетка nucleus pulposus межпозвоночного диска
Цементобласт/цементоцит (секретирует цемент корня зуба, сходный с веществом кости)
Одонтобласт/одонтоцит (секретирует дентин зуба)
Хондроциты гиалинового хряща волокнистого хряща эластического хряща Остеобласт/остеоцит
Первичная остеогенная клетка (стволовая клетка остеобластов)
Гиалоцит стекловидного тела глаза
Звездчатая клетка перилимфатического пространства уха
Сократимые клетки
Клетки скелетных мышц красные (медленные) белые (быстрые) промежуточные
мышечное веретено с ядерной сумкой
мышечное веретено с ядерной цепочкой
клетка-сателлит (стволовая)
Клетки сердечной мышцы обычные
узловые (пейсмейкерные)
волокна Пуркинье
Клетки гладкой мускулатуры (разные)
Миоэпителиальные клетки
радужной оболочки
экзокринных желез
Клетки крови и иммунной системы
Эритроцит
Мегакариоцит
Макрофаги и родственные клетки
моноцит
микрофаги соединительной ткани (разные)
клетка Лангерганса (в эпидермисе)
остеокласт (в кости)
дендритная клетка (в лимфоидных тканях)
микроглиальная клетка (в центральной нервной системе)
Нейтрофил Эозинофил Базофил Тучная клетка Т-лимфоциты
Т-хелпер
Т-супрессор
Т-киллер
В-лимфоциты,
продуцирующие
IgM
IgG
IgA
IgE
Клетка-киллер
Стволовые клетки и коммитированные предшественники для крови и иммунной системы (разные)
Сенсорные преобразователи
Фоторецепторы
палочки колбочки
чувствительные к синему
чувствительные к зеленому
чувствительные к красному
Слуховые рецепторные клетки
внутренние волосковые клетки кортиева органа
наружные волосковые клетки кортиева органа
Рецепторы ускорения и силы тяжести
волосковые клетки вестибулярного аппарата
тип I
тип II
Вкусовые рецепторные клетки клетка вкусовой луковицы,
тип II
Обонятельные рецепторные клетки обонятельный нейрон
базальная клетка обонятельного эпителия (стволовая для обонятельных нейронов)
Рецепторы рН крови клетки каротидного тельца
тип I
тип II
Осязательные рецепторные клетки
клетка Меркеля в эпидермисе
первичные осязательные нейроны (разные)
Терморецепторные клетки
первичные терморецепторные нейроны
чувствительные к холоду
чувствительные к теплу
Болевые рецепторы
первичные нейроны, чувствительные к боли (разные)
Рецепторы положения и напряжений в скелетно-мышечной системе первичные проприоцептивные нейроны (разные)
Вегетативные нейроны
Холинэргические (разные)
Адренэргические (разные)
Пептидэргические (разные)
Опорные клетки органов чувств и периферических нейронов
Опорные клетки кортиева органа
внутренняя столбчатая клетка
наружная столбчатая клетка
внутренняя фаланговая клетка
наружная фаланговая клетка
пограничная клетка
клетка Генсена
Опорная клетка вестибулярного аппарата
Опорная клетка вкусовой почки (клетка вкусовой почки, тип I)
Опорная клетка обонятельного эпителия
Шванновская клетка
Клетка-сателлит (инкапсулирующая тела периферических нейронов)
Глиальная клетка кишечника
Нейроны и глиальные клетки центральной нервной системы
Нейроны (огромное разнообразие типов, пока еще плохо классифицированных)
Глиальные клетки
астроциты (разные)
олигодендроцит
Клетки хрусталика
Эпителиальная клетка передней части хрусталика
Волокно хрусталика (клетка, содержащая кристаллины)
Пигментные клетки
Меланоцит
Эпителиальная клетка пигментного слоя сетчатки
Половые клетки
Оогония/ооцит
Сперматогония (стволовая клетка для сперматоцитов)
Сперматоцит
Питающие клетки
Клетка яйцевого фолликула
Клетка Сертоли (в семеннике)
Эпителиальная клетка тимуса
Литература
Общая
Clark W.E. Le Gros. The Tissues of the Body, 6th ed. Oxford, U.K., Clarendon Press, 1971.
Cormack D. Ham's Histology, 9th ed. Philadelphia: Lippincott, 1987.
Fawcett D. W. (Bloom and Fawcett) A Textbook of Histology, 11 th ed. Philadelphia, Saunders, 1986.
Goss R.J. The Physiology of Growth. New York: Academic Press, 1978.
Weiss L., ed. Histology: Cell and Tissue Biology, 5th ed. New York, Elsevier, 1983.
Wheater P.R., Burkitt H.G., Daniels V.G., Functional Histology, 2nd, ed. Edinburgh, Churchill Livingstone, 1987. Цитированная
1. Clark W.E. Le Gros. The Tissues of the Body, 6th ed. Oxford, U.K., Clarendon Press, 1971.
Montagna W. The skin. Sci. Am. 212(2), 56-66, 1965.
Wessels N. K. Tissue Interactions and Development. Menlo Park, CA, Benjamin Cummings, 1977.
2. Cahn R. D., Cahn, M. B. Heritability of cellular differentiation: clonal growth expression of differentiation in retinal pigment cells in vitro. Proc. Natl. Acad. Sci. USA, 55, 106-114, 1966.
Coon H. G. Clonal stability and phenotypic expression of chick cartilage cells in vitro. Proc. Natl. Acad. Sci. USA, 55, 66-73, 1966.
Itoh Y, Eguchi G. In vitro analysis of cellular metaplasia from pigmented epithelial cells to lens phenotypes: a unique model of studying cellular and molecular mechanisms of "transdifferentiation". Dev. Biol, 115, 353-362, 1986.
Yaffe D. Retention of differentiation potentialities during prolonged cultivation of myogenic cells. Proc. Natl. Acad. Sci. USA, 61, 477-483, 1968.
3. Anderson J. E. The effect of steroid hormones on gene transcription. In: Biological Regulation and Development (R. F. Goldberger, K. Yamamoto, eds.), Vol. 3B, pp. 169-212. New York, Plenum, 1983.
Okada T. S., Kondoh H., eds. Commitment and Instability in Cell Differentiation. Curr. Top. Dev. Biol., 20, 1986.
4. Hosley M. A., Hughes S. E., Oakley B. Neural induction of taste buds. J. Сотр. Neurol., 260, 224-232, 1987.
Kinnamon S. C. Taste transduction: a diversity of mechanisms. Trends Neurosci., 11, 491-496, 1988.
Zalewski A. A. Neuronal and tissue specifications involved in taste bud formation. Ann. N.Y. Acad. Sci., 228, 344-349, 1974.
5. Goss R.J. The Physiology of Growth. New York, Academic Press, 1978.
6. Clayton R. M. Divergence and convergence in lens cell differentiation: regulation of the formation and specific content of lens fibre cells. In
Stem Cells and Tissue Homeostasis (B. Lord, C. Potten, R. Cole, eds.), pp. 115-138. Cambridge University Press, 1978.
Goss R.J. The Physiology of Growth, pp. 210-225. New York, Academic Press, 1978.
Maisel H., ed. The Ocular Lens: Structure, Function, and Pathology. New York, Dekker, 1985.
Wistow G. J., Piatigorsky J. Lens crystallins: the evolution and expression of proteins for a highly specialized tissue. Annu. Rev. Biochem., 57, 479-504, 1988.
7. Fawcett D. W. (Bloom and Fawcett) A Textbook of Histology, 11 th ed. Philadelphia, Saunders, 1986.
Gevers W. Protein metabolism in the heart. J. Mol. Cell. Cardiol., 16, 3-32, 1984.
Young R. W. Visual cells. Sci. Am. 223(4), 80-91, 1970.
8. Aherne W.A., Camplejohn R.S., Wright N. A. In Introduction to Cell Population Kinetics. London, Edward Arnold, 1977.
Wright N.A., Alison M.R. Biology of Epithelial Cell Populations, Vol. 1-3. Oxford, U.K., Oxford University Press, 1984.
9. FawcettD. W. (Bloom and Fawcett). A Textbook of Histology, 11th ed. pp. 679-715. Philadelphia, Saunders, 1986.
Moog F. The lining of the small intestine. Sci. Am. 245(5), 154-176, 1981.
10. Fausto N. New perspectives on liver regeneration. Hepatol., 6, 326-327, 1986.
Gohda E., et al. Purification and partial characterization of hepatocyte growth factor from plasma of a patient with fulminant hepatic failure. J. Clin. Invest., 81, 414-419, 1988.
Goss K. J. The Physiology of Growth, pp. 251-266. New York, Academic Press, 1978.
Holder N. Regeneration and compensatory growth. Br. Med. Bull., 37, 227-232, 1981.
11. Anderson J. R., ed. Muir's Textbook of Pathology, 12th ed. London, Edward Arnold, 1985.
Robbins S. L., Cotran R. S., Kumar V. Pathologic Basis of Disease, 3rd ed. Philadelphia, Saunders, 1984.
12. Campbell J. H., Campbell G. R. Endothelial ceil influences on vascular smooth muscle phenotype. Annu. Rev. Physiol., 48, 295-306, 1986. Development of the Vascular System. Ciba Symp. 100. London, Pitman, 1983.
Fawcett D. W. (Bloom and Fawcett) A Textbook of Histology, 11th ed., pp. 367-405. Philadelphia, Saunders, 1986.
Ryan U.S., ed. Endothelial Cells, Vols. 1-3. Boca Raton, FL, CRS Press, 1988.
13. Goss R.J. The Physiology of Gowth. pp. 120-137. New York, Academic Press, 1978.
Hobson В., Denekamp J. Endothelial proliferation in tumours and normal tissues: continuous labelling studies. Br. J. Cancer, 49, 405-413, 1984.
14. Folkman J. The vascularization of tumors. Sci. Am. 234(5), 58-73, 1976.
Folkman J., Haudenschild C. Angiogenesis in vitro. Nature., 288, 551-556, 1980.
Madri J. A., Pratt В. М. Endothelial cell-matrix interactions: in vitro models of angiogenesis. J. Histochem. Cytochem., 34, 85-91, 1986.
15. Folkman J., Klasbrun M. Angiogenic factors. Science, 235, 442-447, 1987.
Kalebic Т., Garbisa S., Glaser В., Liotta L. A. Basement membrane collagen: degradation by migrating endothelial cells. Science, 221, 281-283, 1983.
Knighton D. R., et al. Oxygen tension regulates the expression of angiogenesis factor by macrophages. Science, 221, 1283-1285, 1983.
Leibovich S.J., et al. Macrophage-induced angiogenesis is mediated by tumour necrosis factor-alpha. Nature, 329, 630-632, 1987.
Schweigerer L., et al. Capillary endothelial cells express basic fibroblast growth factor, a mitogen that promotes their own growth. Nature, 325, 257-259, 1987.
16. Cairnie А. В., Lala P.K., Osmond D. G., eds. Stem Cells of Renewing Cell Populations. New York, Academic Press, 1976.
Cheng H., Leblond C. P. Origin, differentiation, and renewal of the four main epithelial cell types in the mouse small intestine. V. Unitarian theory of the origin of the four epithelial cell types. Am. J. Anat., 141, 537-562, 1974.
17. Graziadei P.P. C., Monti Graziadei G. A. Continuous nerve cell renewal in the olfactory system. In Handbook of Sensory Physiology, Vol. IX, Development of Sensory Systems (M. Jacobson, ed.). pp. 55-82. New York, Springer-Verlag, 1978.
18. Alien Т.О., Potten C.S. Fine-structural identification and organization of the epidermal proliferative unit. J. Cell. Sci, 15, 291-319, 1974. Bereiter-Hahn, J. Matolsy A. G. Richards K. S., eds. Biology of the Integument, Vol. 2, Vertebrates. New York, Springer, 1986. MacKenzie I. C.
Ordered structure of the stratum corneum of mammalian skin. Nature, 222, 881-882, 1969.
Sengel P. Morphogenesis of skin. Cambridge, U. K., Cambridge University Press, 1976.
Stenn K. S. The skin. In Histology: Cell and Tissue Biology L. Weiss, ed.), 5th ed pp. 569-606. New York, Elsevier, 1983.
19. Fuchs E., Green H. Changes in keratin gene expression during terminal differentiation of the keratinocyte. Cell, 19, 1033-1042, 1980.
Green H. The keratinocyte as differentiated cell type. Harvey Lectures, 74, 101-139, 1979.
Sawyer R. H., ed. The Molecular and Developmental Biology of Keratins. Curr. Top. Dev. Biol., 22, 1987.
20. Barrandon Y, Green H. Three clonal types of keratinocyte with different capacities for multiplication. Proc. Nat). Acad. Sci. USA, 84, 23022306, 1987.
Green H. Terminal differentiation of cultured human epidermal cells. Cell, 11, 405-415, 1977.
Watt F. M. Selective migration of terminally differentiating cells from the basal layer of cultured human epidermis. J. Cell. Biol., 98, 16-21, 1984.
21. Barrandon Y., Green H. Cell migration is essential for sustained growth of keratinocyte colonies: the roles of transforming growth factor-alpha and eidermal growth factor. Cell, 50, 1131-1137, 1987.
Read J., Watt F. M. A model for in vitro studies of epidermal homeostasis: proliferation and involucrin synthesis by cultured human keratinocytes during recovery after stripping off the suprabasal layers. J. Invest. Dermatol., 90, 739-743, 1988.
22. Fawcett D. W. (Bloom and Fawcett). A Textbook of Histology, 11th ed. pp. 568-576, 901-912. Philadelphia, Saunders, 1986. Neville M. C., Neifert M. R. Lactation: Psysiology, Nutrition, and Breast-Feeding. New York, Plenum, 1983.
Patton S. Milk. Sci Am. 221(1), 58-68, 1969.
Richards R. C., Benson G. K. Ultrastructural changes accompanying involution of the mammary gland in the albino rat. J. Endocrinol., 51, 127135, 1971.
Vonderhaar B. K., Topper Y. J. A role of the cell cycle in hormone-dependent differentiation. J. Cell. Biol, 63, 702-712, 1974.
23. Dexter T. M., Spooncer E. Growth and differentiation in the hemopoietic system. Annu. Rev. Cell Biol., 3, 423-441, 1987.
Weiss L., ed. Histology: Cell and Tissue Biology, 5th ed., pp. 447-509. New York, Elsevier, 1983.
Wintrobe M.M. Blood, Pure and Eloquent. New York, McGraw-Hill, 1980.
24. Stossel T. P. The molecular biology of phagocytes and the molecular basis of nonneoplastic phagocytic disorders. In The Molecular Basis of Blood Diseases (G. Stamatoyannopoulos, A. W. Nienhuis, P. Leder, P. W. Majerus, eds.), pp. 499-533. Philadelphia, Saunders, 1987.
Zucker M.B. The functioning of blood platelets. Sci. Am. 242(6), 86-103, 1980.
25. Robbins S. L., Cotran R. S., Kumar V. Pathological Basis of Disease, 3rd ed. Philadelphia, Saunders, 1984.
Taussig M.J. Processes in Pathology and Microbiology, 2nd ed. Oxford, U. K, Blackwell, 1984.
26. Magli M. C., Iscove N. N., Odartchenko N. Transient nature of haemopoietic spleen colonies. Nature, 295, 527-529, 1982.
Till J. E., McCulloch E. A. A direct measurement of the radiation sensitivity of normal mouse bone marrow cells. Radiat. Res., 14, 213-222, 1961.
27. Lemischka I. R., Raulet D. H., Mulligan R. C. Developmental potential and dynamic behavior of hematopoietic-stem cells. Cell, 45, 917-927, 1986.
Wu A. M., Till J. E., Siminoitch L., McCulloch E. A. Cytological evidence for relationship between normal hematopoietic colony-forming cells and cells of the lymphoid system. J. Exp. Med., 127, 455-462, 1968.
28. Till J.E., McCulloch E. A. Hemopoietic stem cell differentiation. Biochem. Biophys. Acta, 605, 431-459, 1980.
29. Dexter T. M., Heyworth C., Whetton A. D. The role of growth factors in haemopoiesis. Bioessays, 2, 154-158, 1985.
Metcalf D. Clonal analysis of proliferation and differentiation of paired daughter cells: action of granulocyte-macrophage colony-stimulating factor on granulocytemacrophage precursors. Proc. Natl. Acad. Sci. USA, 77, 5327-5330, 1980.
Metcalf D. The Hemopoietic Colony-Stimulating Factors. Amsterdam, Elsevier, 1984.
30. Goldwasser E. Erythropoietin and the differentiation of red blood cells. Fed. Proc., 34, 2285-2292, 1975.
Heath D. S., Axelrad A.A., McLeod D.L., Shreeve M.M. Separation of the erythropoietin-responsive progenitors BFU-E and CFU-E in mouse bone marrow by unit gravity sedimentation. Blood. 47, 777-792, 1976.
Ihle J. N., et al. Biological properties of homogeneous interleukin 3. J. Immunol., 131, 282-287, 1983.
Suda J., et al. Purified interleukin-3 and erythropoietin support the terminal differentiation of hemopoietic progenitors in serum-free culture. Blood, 67, 1002-1006, 1986.
31. Metcalf D. The Wellcome Foundation Lecture, 1986. The molecular control of normal and leukaemic granulocytes and macrophages. Proc. R. Soc. Lond. (Biol.), 230, 389-423, 1987.
Roberts R., et al. Heparan sulphate-bound growth factors: a mechanism for stromal cell-mediated haemopoiesis. Nature, 332, 376-378, 1988.
32. Spangrude G. J., Heimfeld S., Weissman I. L. Purification and characterization of mouse hematopoietic stem cells. Science, 241, 58-62, 1988. Suda Т., Suda J., Ogawa M. Disparate differentiation in mouse hemopoietic colonies derived from paired progenitors. Proc. Natl. Acad. Sci. USA, 81, 2520-2524, 1984.
33. Cormack D. Ham's Histology, 9th ed., pp. 388-420. Philadelphia, Lippincott, 1987. Pearson M. L, Epstein H. F., eds. Muscle Development: Molecular and Cellular Control. Cold Spring Harbor, N. Y., Cold Spring Harbor Laboratory, 1982.
34. Clegg C, H., Linkhart T. A., Olwin В. В., Hauschka S. D. Growth factor control of sceletal muscle differentiation: commitment to terminal differentiation occurs in Gl phase and is repressed by fibroblast growth factor. J. Cell Biol., 105, 949-956, 1987.
Davis R. L., Weintraub H., Lassar A. B. Expression of single transfected cDNA converts fibroblasts to myoblasts. Cell, 51, 987-1000, 1987.
Devlin R. В., Emerson C. P., Jr. Coordinate regulation of contractile protein synthesis during myoblast differentiation. Cell, 13, 599-611, 1978. Konigsberg I. R. Diffusion-mediated control of myoblast fusion. Dev. Biol., 26, 133-152, 1971.
Menko A. S., Boettiger D. Occupation of the extracellular matrix receptor, integrin, is a control point for myogenic differentiation, Cell, 51, 51-57, 1987.
Pinney D.F., Pear son-White S.H., Konieczny S.F., Latham K.E., Emerson C. P. Myogenic lineage determination and differentiation: evidence for a regulatory gene pathway. Cell, 53, 781-793, 1988.
35. Buckingham M., et al. Actin and myosin multigene families: their expression during the formation and maturation of striated muscle. Am. J. Med. Genet., 25, 623-634, 1986.
Lomo Т., Westgaard R. H., Dahl H. A. Contractile properties of muscle: control by pattern of muscle activity in the rat. Proc. R. Soc. Lond. (Biol.), 1987, 99-103, 1974.
Miller J. A, Stockdale F. E. What muscle cells know that nerves don't tell them. Trends Neurosci., 10, 325-329, 1987.
Sanes J. R. Cell lineage and the origin of muscle fibre types. Trends Neurosci., 10, 219-221, 1987.
36. Bischoff R. Proliferation of muscle satellite cells on intact myofibers in culture. Dev. Biol., 115, 129-139, 1986.
Goldspink G. Development of muscle. In Differentiation and Growth of Cells in Vertebrate Tissues (G. Goldspink, ed.), pp. 69-99. London, Chapman and Hall,
1974. Moss F. P., Leblond C. P. Satellite cells as a source of nuclei in muscles of growing rats. Anat. Rec., 170, 421-435, 1971.
37. Gabbiani G., Rungger-Brandle E. The fibroblast. In Tissue Repair and Regeneration (L. E. Glynn, ed.), pp. 1-50. Handbook of inflammation, Vol. 3. Amsterdam, Elsevier, 1981.
Fawcett D. W. (Bloom and Fawcett). A Textbook of Histology, 11th ed., pp. 136-187. Philadelphia, Saunders, 1986.
38. Conrad G. W., Hart G. W., Chen Y. Differences in vitro between fibroblast-like cells from cornea, heart, and skin of embryonic chicks. J. Cell Sci., 26, 119-137, 1977.
Hauschka P. V., Mavrakos A. E., lafrati M. D., Doleman S. E., Klagsbrun M. Growth factors in bone matrix: isolation of multiple types by affinity chromatography on heparin-Sepharose. J. Biol. Chem., 261, 12665-12674, 1986.
Reddi A. H., Gay R., Gay S., Miller I. J. Transitions in collagen types during matrix-induced cartilage, bone and bone marrow formation. Proc. Natl. Acad. Sci. USA, 74, 5589-5592, 1977.
Schor S. L., Schor A. M. Clonal heterogeneity in fibroblast phenotype: implications for the control of epithelial-mesenchymal interactions. Bioessays, 7, 200-204,
1987. Seyedin S. M., et al. Cartilage-inducing factor-A: apparent identity to transforming growth factor-beta. J. Biol. Chem., 261, 5693-5695, 1986.
39. Benya P. D., Schaffer J. D. Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels. Cell, 30, 215-224, 1982.
Caplan A.I. Cartilage. Sci. Am. 251(4), 84-94, 1984. von der Mark K., Gauss V., von der Mark H., Muller P. Relationship between cell shape and type of collagen synthesized as chondrocytes lose their cartilage phenotype in culture. Nature, 267, 531-532, 1977.
Zanetti N. C., Solursh M. Induction of chondrogenesis in limb mesenchymal cultures by disruption of the actin cytoskeleton. J. Cell Biol., 99, 115123, 1984.
40. Spiegelman B. M., Ginty C. A. Fibronectin modulation of cell shape and lipogenic gene expression in 3T3 adipocytes. Cell, 35, 657-666, 1983. Sugihara H., Yonemitzu N., Miyabara S., Yun K. Primary cultures of unilocular fat cells: characteristics of growth in vitro and changes in differentiation properties. Differentiation, 31, 42-49, 1986.
Zezulak K.M., Green H. The generation of insulin-like growth factor-1-sensitive cells by growth hormone action. Science, 233, 551-553, 1986.
41. Cormack, Hanvs Histology, 9th ed., pp. 264-323. Philadelphia, Lippincott, 1987.
Fawcett D. W. (Bloom and Fawsett). A Textbook of Histology, 11th ed., pp. 188 238. Philadelphia, Saunders, 1986.
Jee W. S. S. The skeletal system. In Histology: Cell and Tissue Biology (L. Weiss, ed.), 5th. ed., pp. 200 255. New York, Elsevier, 1983.
42. Hall B.K. Cartilage, Vols. 1-3. New York, Academic Press, 1983.
43. Marcus R. Normal and abnormal bone remodeling in man. Ann. Rev. Med., 38, 129-141, 1987.
Osdoby P., Krukowski M., Oursler M. J., Salino-Hugg T. The origin, development, and regulation of osteoclasts. Bioessays, 7, 30 34, 1987.
Vaughan J. The Phisiology of Bone, 3rd ed. Oxford, U.K., Clarendon Press, 1981.
44. Cormack D. Ham's Histology, 9th ed. pp. 312-320. Philadelphia, Lippincott, 1987.
45. Currey J. The Mechanical Adaptations of Bone. Princeton, NJ, Princeton University Press, 1984.
Goss R.J. The Phisiology of Growth. New York, Academic Press, 1978.
Rogers S.L. The Aging Skeleton. Springfield, IL, Thomas, 1982.
Sinclair D. Human Growth After Birth, 4th ed. Oxford, U. K., Oxford University Press, 1985.