Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Иммунная система
Тонкая структура антител
Поскольку антитела существуют в столь огромном числе вариантов, в неиммунизированном организме любой из видов антител будет составлять менее миллионной доли всех молекул Ig, имеющихся в крови. Этот факт поставил иммунохимиков перед чрезвычайно сложной проблемой белковой химии: каким образом можно получить достаточное количество какого-либо антитела для определения его аминокислотной последовательности и трехмерной структуры?
Проблема была решена благодаря специфическому свойству опухолевых клеток, образующихся при множественной миеломе - злокачественном заболевании, при котором в костном мозге («миелогенной» ткани) развиваются множественные опухоли. Эти клетки секретируют в кровь большие количества антител одного вида. Такие антитела гомогенны, или моноклональны, поскольку рак обычно начинается с неконтролируемого роста одной-единственной клетки (см. разд. 21.1.2); в данном случае это плазматическая клетка, вырабатывающая антитела. Антитело, накапливающееся в крови, называют миеломным белком.
Еще с прошлого столетия известно, что моча больных, страдающих этим заболеванием, часто содержит необычные белки, названные белками Бенс-Джонса по имени английского врача, который их впервые описал. Однако только в 1950-х годах выяснилось, что эти белки представляют собой свободные L-цепи иммуноглобулина. Первоначально детальная структура антитела была определена путем изучения миеломных белков из мочи или крови больных или же белков от мышей, у которых были целенаправленно индуцированы аналогичные формы рака. Впоследствии появилась возможность делать В-клетки, секретирующие антитела, бессмертными путем их слияния с клетками миеломы, не секретирующими антитела. Образующиеся гибридомы стали удобным источником моноклональных антител, которые можно получить против любого желаемого антигена в неограниченном количестве (разд. 4.5.4).
18.3.1. L- и Н-цепи состоят из константной и вариабелыюй областей [11, 14]
При сравнении аминокислотных последовательностей множества миеломных белков выявилась поразительная особенность, имеющая важный и неожиданный генетический подтекст. N-концевая часть последовательности как L-, так и Н-цепей изменчива, а С-концевая-постоянна.
Например, если сравнить последовательности большого числа различных миеломных ϰ -цепей (каждая длиной около 220 аминокислот), то окажется, что С-концевые половины у них одинаковы или различаются лишь незначительно, тогда как N-концевые половины все разные. Таким образом, L-цепи содержат константную область примерно из 110 аминокислот и вариабельную область такой же длины. N-концевая вариабельная область Н-цепей тоже состоит приблизительно из 110 аминокислот, константная же, в зависимости от класса антител, - из 330 или 440 аминокислот (рис. 18-24).
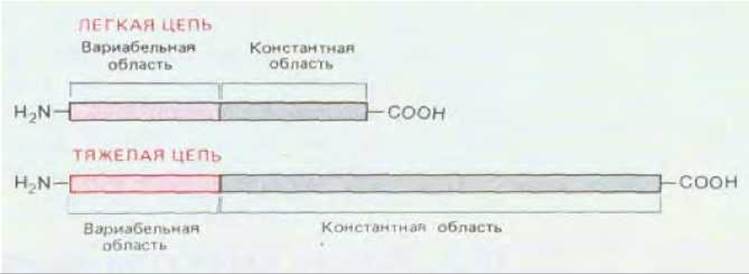
Рис. 18-24. Как легкие, так и тяжелые цепи молекул состоят из константной и вариабельной областей. У всех легких цепей данного типа (æ или λ) вся С-концевая половина имеет одинаковую последовательность аминокислот (иногда с небольшими различиями), тогда как N-концевые половины различны. N-концевые вариабельные области тяжелых и легких цепей сходны по длине (около 110 аминокислотных остатков), тогда как константная область у тяжелых цепей в три-четыре раза (в зависимости от класса антител) длиннее, чем у легких цепей.
Именно N-концевые части L- и Н-цепей совместно образуют антиген-связывающий участок, и изменчивость их аминокислотных последовательностей служит структурной основой разнообразия таких участков, В связи с существованием вариабельной и константной областей возникают важные вопросы относительно генетических механизмов образования антител; их мы обсудим позже. Но еще до того как стало возможным прямое изучение этих вопросов, в результате исследования миеломных белков выяснились другие важные черты структуры антител.
18.3.2. Каждая L- и Н-цепь содержит по три гипервариабельные области, которые совместно формируют антиген- связывающий участок [17]
Только часть вариабельной области непосредственно участвует в связывании антигена. Этот вывод вначале был сделан в результате оценки максимальных размеров антиген-связывающего участка. Первые измерения, в которых «молекулярными линейками» служили олигомеры разной величины, были проведены на антителах к декстрану - полимеру D-глюкозы. Когда для того, чтобы подавить связывание декстрана с антителами к нему, использовали дисахариды, трисахариды и олигосахариды большей длины, состоящие из остатков глюкозы, то их действие возрастало по мере удлинения цепи приблизительно до шести мономеров; с олигосахаридами большей длины эффект не увеличивался, Это позволяло предполагать, что наиболее крупные антиген-связывающие участки могут контактировать самое большее с пятью или шестью сахарными остатками антигена. Поэтому казалось крайне маловероятным, что все 220 аминокислот вариабельных областей L- и Н-цепей вносят прямой вклад в построение антиген-связывающего участка.
И действительно, теперь ясно, что связывающий участок антитела формируют всего лишь около 20-30 аминокислотных остатков вариабельной области каждой из цепей. Первым свидетельством в пользу этого явились данные об аминокислотных последовательностях, показавшие, что различия между вариабельными областями как в L-, так и в Н-цепях в основном ограничены тремя небольшими гипервариабельиыми областями в каждой цепи. Остальные части, известные под названием структурных областей, относительно постоянны. Эти данные позволили предсказать, что антиген-связывающий участок образуют всего лишь 5-10 аминокислот каждой гипервариабельной области (рис. 18-25), и это было впоследствии подтверждено рентгеноструктурным анализом антител (см. ниже).
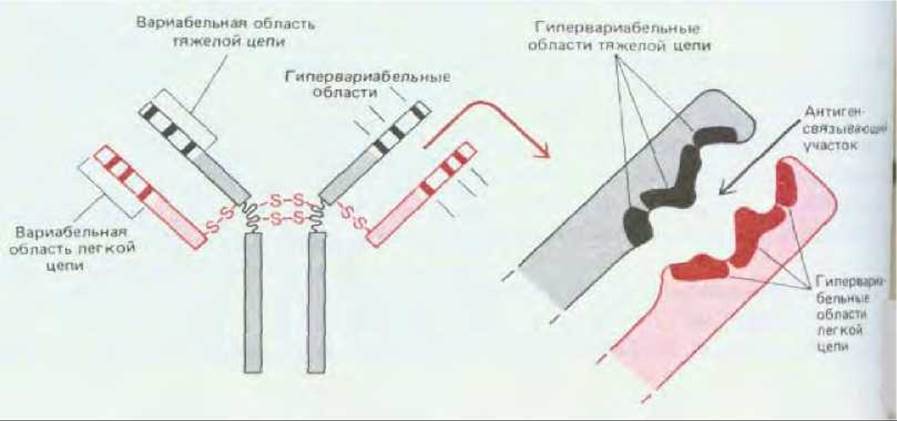
Рис. 18-25. На этой сильно упрощенной схеме показано, как три гипервариабельные области каждой легкой и тяжелой цепи совместно образуют антиген-связывающий участок молекулы антитела. Гипервариабельные области иногда называют областями, определяющими комплементарность.
18.3.3. L- и Н-цепи свернуты в ряд повторяющихся гомологичных доменов [11, 16, 18]
Когда к концу 60-х годов была впервые определена полная последовательность аминокислот в одной из Н-цепей, стала очевидной другая важная особенность структуры Ig. Оказалось, что константная область, которая в большинстве Н-цепей примерно в три раза длиннее, чем в L- цепях, состоит из трех гомологичных сегментов, причем каждый из них, длиной около ПО аминокислот, содержит по одной внутрицепочечной дисульфидной связи. Эти три сегмента гомологичны не только друг другу, но также и константной области L-цепей. Единственные вариабельные домены в L- и Н-цепях тоже сходны между собой, а в меньшей степени - и с константными доменами.
Эти данные позволили предсказать, что как L-, так и Н-цепи построены из повторяющихся сегментов, или доменов, каждый из которых сворачивается независимо, образуя компактную функциональную единицу. И действительно (рис. 18-26), L-цепь состоит из одного вариабельного домена (VL) и одного константного (CL), а большинство Н-цепей - из вариабельного домена (VH) и трех константных доменов (CN1, CN2 и CN3). (Каждаяμ- и s-цепь содержит один вариабельный и четыре константных домена.) Вариабельные домены ответственны за связывание антигена, а константные домены Н-цепей (за исключением CN1) образуют Fc-область, определяющую другие биологические свойства антител.
Гомология между доменами позволяет предположить, что цепи Ig возникли в ходе эволюции в результате ряда последовательных дупликаций одного исходного гена, который кодировал один-единственный домен с неизвестной функцией, состоявший из 110 аминокислот (разд. 18.6.20). Эту гипотезу подкрепляют данные о том, что каждый домен константной области Н-цепи кодируется отдельной последовательностью ДНК (экзоном) (рис. 18-27).
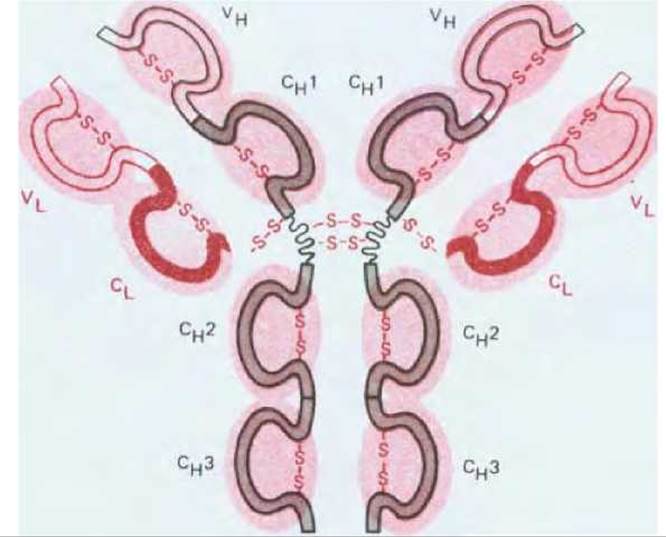
Рис. 18-26. Каждая из легких и тяжелых цепей в молекуле Ig свернута в повторяющиеся домены, сходные друг с другом. Вариабельные домены тех и других цепей (VL и VH) образуют антиген-связывающие участки (см. рис. 18-25), тогда как константные домены тяжелых цепей (главным образом СH2 и СH3) определяют другие биологические свойства молекулы. Тяжелые цепи антител IgM и IgE имеют дополнительный константный домен CH4.
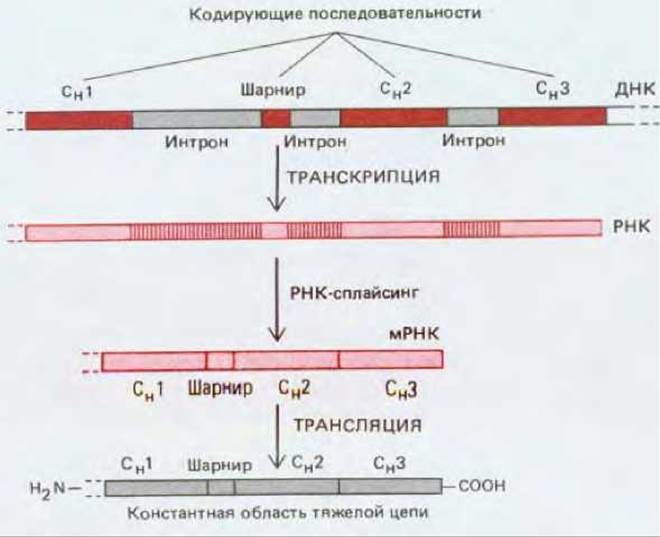
Рис. 18-27. Организация последовательностей ДНК, кодирующих константную область тяжелой цепи. Последовательности, кодирующие каждый из доменов и шарнирный участок (экзоны), разделены некодирующими последовательностями (нитронами). Интроны удаляются путем сплайсинга первичных РНК-транскриптов при образовании мРНК. ДНК, кодирующая вариабельную область тяжелой цепи, не показана. Возможно, что наличие интронов в последовательности ДНК облегчало возникновение случайных дупликаций в ДНК, приведших к появлению генов антител в процессе эволюции (разд. 9.4.12 и 10.5.3).
18.3.4. Рентгеноструктурные исследования выявили трехмерное строение доменов и антиген-связывающих участков иммуноглобулинов [19]
Даже тогда, когда известна полная аминокислотная последовательность белка, из нее невозможно вывести его трехмерную структуру - для этого необходим рентгеноструктурный анализ кристаллов данного белка (разд. 4.1.14). В кристаллическом виде уже получены несколько фрагментов миеломных белков и один интактный IgG. Данные рентгеноструктурного анализа этих белков подтвердили предсказания иммунохимиков. Еще важнее то, что эти исследования позволили понять, как на основе одной и той же структурной схемы конструируются миллионы различных антигенсвязывающих участков.
Как показано на рис. 18-28, все домены Ig имеют очень сходную пространственную структуру, в основе которой лежит так называемая иммуноглобулиновая укладка. Каждый домен представляет собой, грубо говоря, цилиндр размером 4 х 2,5 х 2,5 нм, построенный как «сэндвич» из двух белковых слоев, где один слой образован тремя, а другой - четырьмя отрезками полипептидной цепи. В каждом слое прилегающие друг к другу отрезки антипараллельны и образуют ß-слой (разд. 3.3.2). Два таких слоя расположены приблизительно параллельно и соединены одной внутрицепочечной дисульфидной связью.
Вариабельные домены уникальны в том отношении, что каждый из них имеет свой особенный набор из трех гипервариабельных областей, уложенных в три гипервариабельные петли (см. рис. 18-28). Гипервариабельные петли L- и Н-вариабельных доменов собраны в группу и образуют антиген-связывающий участок, как это и было предсказано. Важный принцип, раскрытый в результате проведенных исследований, состоит в том, что вариабельная область молекулы антитела состоит из весьма консервативной жесткой структуры, к одному из концов которой прикреплены гипервариабельные петли. Поэтому огромное разнообразие антиген-связывающих участков может создаваться путем изменения одних только гипервариабельных петель - их длины и аминокислотной последовательности - без нарушения общей пространственной структуры, необходимой для функционирования антитела.
Рентгеноструктурный анализ фрагментов антител, связанных с антигеном или антигенной детерминантой (гаптеном), позволил установить, как именно (в ряде конкретных случаев) гипервариабельные петли L- и Н-вариабельных доменов совместно образуют одну антиген-связывающую поверхность. Размеры и форма каждой такой поверхности варьируют в зависимости от конформации полипептидной цепи в гипервариабельных петлях, которая в свою очередь определяется последовательностью боковых цепей аминокислот в этих петлях. Таким образом, сейчас уже понятны общие принципы структуры антител.
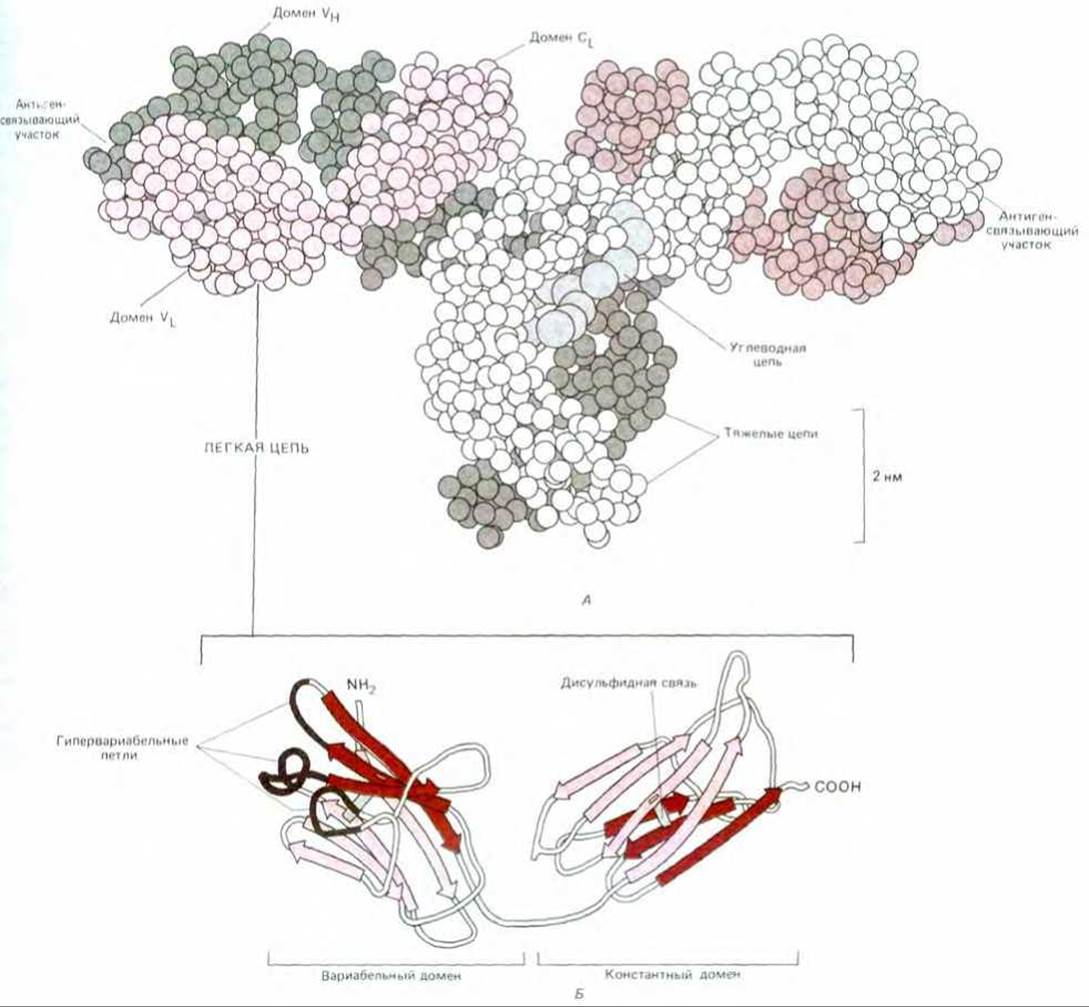
Рис. 18-28. Пространственная структура молекулы антитела IgG (по данным рентгеноструктурного анализа). А. Каждый аминокислотный остаток молекулы белка изображен здесь в виде маленького шарика. Одна из тяжелых цепей показана белым цветом, другая - темно-серым. Домены легких цепей показаны цветными. Молекула антитела гликозилирована: олигосахаридная цепь, прикрепленная иомену СH2, изображена светлосерой. Б. Пространственная укладка всей легкой цепи. Как вариабельный, так и константный домены состоят из двух ß-слоев (один из них составлен из трех отрезков цени, а другой из четырех). Полипептидные цепи в этих двух слоях показаны разными цветами; слои соединены между собой дисульфидной связью. Обратите внимание, что все гипервариабельные области образуют петли на дальнем конце вариабельного домена, где они сближаются и формируют часть антиген-связывающего участка (А - по Е. W. Silverton et al., Proc. Natl. Acad. Sci. USA 74, 5140, 1977; Б - пo M. Schiffer at al., Biochemistry, 12.4620, 1973. Copyright 1973 Amer. Chem. Soc.)
Заключение
Каждая L- и Н-цепь иммуноглобулина состоит из вариабельной области длиной примерно в ПО аминокислотных остатков на N-конце и следующей за нею константной области, которая имеет такую же длину в L-цепи и в три или четыре раза длиннее в Н-цепи. Каждая цепь составлена из повторяющихся, сходным образом свернутых доменов: у L-цепи имеется один домен в вариабельной области (VL) и один в константной области(CL), а у Н-цепи - один домен в вариабельной области (VH) и три или четыре в константной области (СH). Изменчивость аминокислотной последовательности в вариабельных областях L- и Н-цепей ограничена в основном несколькими небольшими гипервариабельными областями, которые пространственно сближены друг с другом и образуют антиген-связывающий участок. Этот участок имеет размеры, достаточные для того, чтобы контактировать с антигенной детерминантой, соответствующей по величине пяти или шести остаткам сахара.
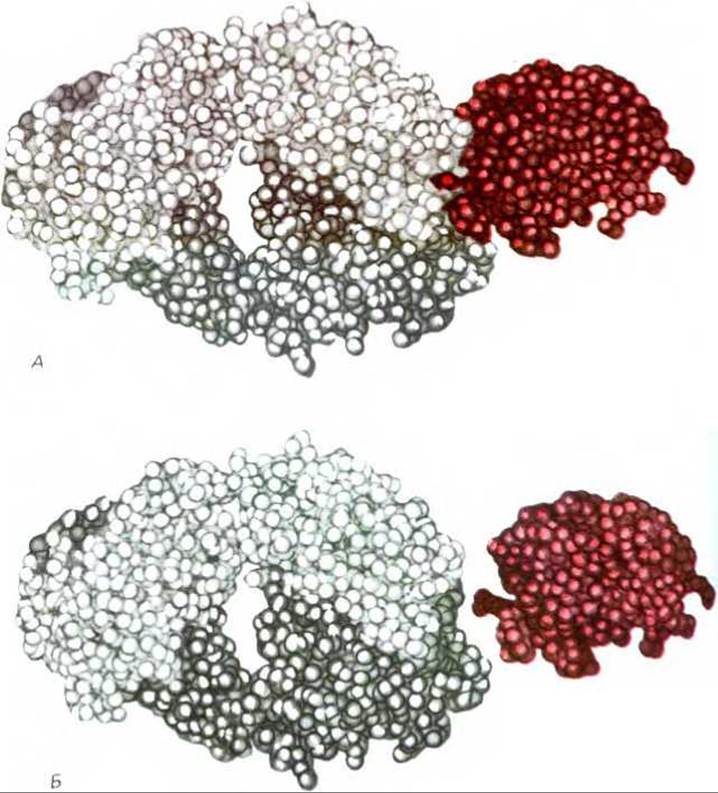
Рис. 18-29. Трехмерная структура комплекса антиген-антитело (по данным рентгеноструктурного анализа). Антиген - в данном случае это фермент лизоцим выделен цветом. Антиген-связывающий участок Fab-фрагмента антитела образуют совместно две цепи - легкая и тяжелая (на рисунке светло-серая и темно-серая соответственно). Б. Здесь модели антигена и антитела разделены, чтобы показать их комплементарные контактирующие поверхности. Выступ на комплементарной поверхности антигена представляет собой остаток глутамина. В ряде других антител, исследованных тем же методом, антиген-связывающий участок (для небольшого гаптена) образует гораздо более глубокую щель. (A. Amit et al., Science, 233, 747-753, 1986. Copyright 186 by the AAAS.)