Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Нервная система
Образование и уничтожение синапсов
Встреча конуса роста с клеткой-мишенью - один из ключевых моментов в развитии нейронов: и конус роста, и клетка-мишень подвергаются трансформации, в результате которой устанавливается синаптическая связь. Но на этом процесс развития не заканчивается - многие из синапсов, образовавшихся вначале, позднее уничтожаются, а где-то на этой же клетке-мишени образуются новые. Такие локальные изменения схемы синаптических связей дают возможность исправлять ошибки в образовании связей и осуществлять «тонкую настройку»: первоначальная схема связей и осуществлять «тонкую настройку»: первоначальная схема связей приблизительно намечается с помощью факторов, направляющих миграцию конусов роста по специфическим путям к клеткам-мишеням; затем образуются предварительные синаптические соединения, позволяющие пре- и постсинаптическим клеткам взаимодействовать; и наконец, первоначальные соединения пересматриваются и уточняются с помощью механизмов, использующих как нейротропные факторы, так и электрические сигналы в виде потенциалов действия и синаптических потенциалов. Поэтому внешние стимулы, способные возбуждать электрическую активность в нервной системе, могут влиять на развитие схемы нервных связей.
В этом разделе мы рассмотрим образование синапсов на молекулярном уровне, а также правила, определяющие, будет ли синапс образован или уничтожен, и роль электрической активности в регуляции этих процессов. Мы начнем с синапсов между мотонейронами и клетками скелетной мышцы, поскольку они лучше изучены.
19.8.1. Синаптический контакт приводит к специализации данных участков растущего аксона и клетки-мишени для функции передачи сигналов [62]
Ранние этапы образования нервно-мышечного синапса проще всего наблюдать в культуре. Здесь можно видеть, что значительная часть молекулярного механизма синаптической передачи существует еще до того, как конус роста достигнет мышечной клетки. По мере того как конус роста продвигается вперед, он при электрическом возбуждении тела нейрона выделяет небольшие количества ацетилхолина (рис. 19-75). Мембрана конуса роста уже содержит потенциал-зависимые кальциевые каналы для сопряжения электрического возбуждения с секрецией; эти каналы служат также для распространения нервных импульсов по эмбриональному нейриту (в котором поначалу нет натриевых каналов). Еще до того, как мышечная клетка иннервируется, она уже имеет ацетилхолиновые рецепторы (эмбрионального типа) и может реагировать на ацетилхолин деполяризацией и сокращением.
Относительно мало эффективную синаптическую передачу можно наблюдать уже через несколько минут после первого контакта конуса роста с мышечной клеткой. Однако для образования зрелого синапса и у конуса роста, и у клетки-мишени должна развиться структурная и биохимическая специализация - процесс, который обычно продолжается несколько дней. Конус роста прекращает движение, в нем накапливаются синаптические пузырьки, а в определенном участке образуются «активные зоны» для быстрого и узколокального высвобождения ацетилхолина (разд. 19.3.3). Ацетилхолиновые рецепторы на поверхности мышечной клетки концентрируются на синаптическом участке, а в других областях плазматической мембраны их становится мало. Как достигается такое перераспределение рецепторов для нейромедиатора? Этот вопрос касается не только мышечных клеток, но и нейронов: для успешной передачи сигналов и обработки информации нейроны тоже должны концентрировать определенные виды рецепторов и ионных каналов в определенных областях плазматической мембраны.
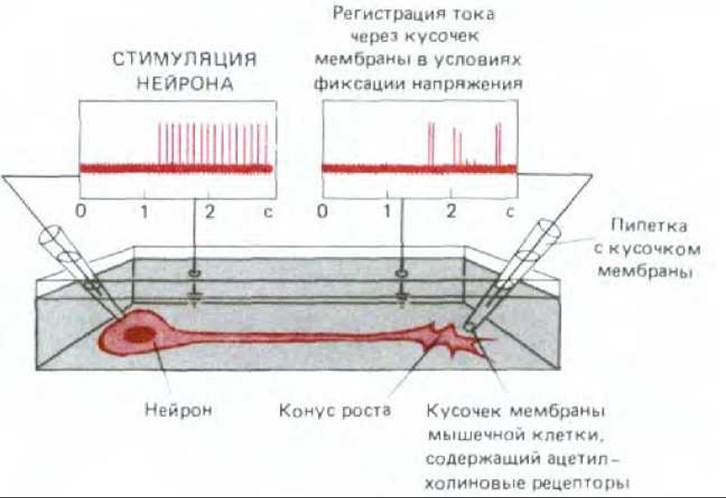
Рис. 19-75. Схема эксперимента, показывающего, что из конуса роста мотонейрона в ответ настимуляцию тела клетки высвобождаются порции ацетилхолина. Ничтожные количества выделяемого медиатора обнаруживают, измеряя его влияние на силу тока, протекающего через кусочек мембраны мышечного волокна, которая закрывает отверстие микропипетки и содержит множество рецепторов ацетилхолина. Из конуса роста ацетилхолин выделяется в гораздо меньших количествах и с меньшей регулярностью, чем из зрелого синаптического окончания.
19.8.2. Рецепторы ацетилхолина диффундируют в мембране мышечной клетки и собираются в месте формирования синапса [63]
В зрелой мышечной клетке концентрация ацетилхолиновых рецепторов в области синапса в тысячу с лишним раз выше, чем на других участках мембраны. Эксперименты с гашением флуоресценции (разд. 6.2.9) показывают, что рецепторы в области синапса «привязаны» и не могут свободно передвигаться в плоскости мембраны. В отличие от этого в неиннервированной мышечной клетке зародыша рецепторы распределены по всей ее поверхности и способны диффундировать более свободно. Когда с мышечной клеткой образует контакт аксон мотонейрона, рецепторы ацетилхолина начинают скапливаться на участке мембраны, лежащем под окончанием аксона; а вновь синтезируемые рецепторы тоже включаются теперь в мембрану главным образом в области развивающегося синапса (рис. 19-76). Рецепторы становятся закрепленными на месте - возможно, в результате взаимной адгезии, а может быть, благодаря связыванию с цитоскелетом или с внеклеточным матриксом. Некоторые важные сведения относительно того, каким образом аксон «выбирает» место будущего синапса, получены при изучении регенерации нервно-мышечного соединения.
19.8.3. Место нервно-мышечного контакта отличается устойчивой специализацией базальной мембраны [64]
Каждую мышечную клетку окружает базальная мембрана (см. рис. 19-16 и 19-18, А). В случае сильного повреждения мышечное волокно дегенерирует и отмирает, а его остатки уничтожаются макрофагами. Однако базальная мембрана при этом сохраняется и служит как бы «формой», в которой из оставшихся стволовых клеток может образоваться новое мышечное волокно (разд. 17.6.3). Даже тогда, когда разрушено не только мышечное волокно, но и нервное окончание, место прежнего нервно-мышечного контакта все еще можно определить по неровной поверхности базальной мембраны в этом участке. Эта синоптическая базальная мембрана обладает особыми химическими свойствами, и можно получить антитела, которые будут избирательно связываться с ее поверхностью. Интересно то, что именно синаптическая базальная мембрана определяет локализацию остальных компонентов синапса. Значение базальной мембраны для образования нервно-мышечного соединения было продемонстрировано в серии экспериментов на амфибиях. После одновременного разрушения нерва и мышечной клетки когда остается лишь пустая оболочка из базальной мембраны, можно легко убедиться, что синаптический участок базальной мембраны специфически удерживает молекулы ацетилхолинэстеразы, которая в нормальном синапсе гидролизует выделяемый нервными окончаниями ацетилхолин. К тому же базальная мембрана удерживает в месте синапса и окончание аксона; если разрушить только мышечную клетку, оно остается связанным с базальной мембраной на протяжении многих дней. С другой стороны, удаление базальной мембраны с помощью коллагеназы приводит к тому, что окончание аксона отделяется даже при сохранности мышечной клетки.
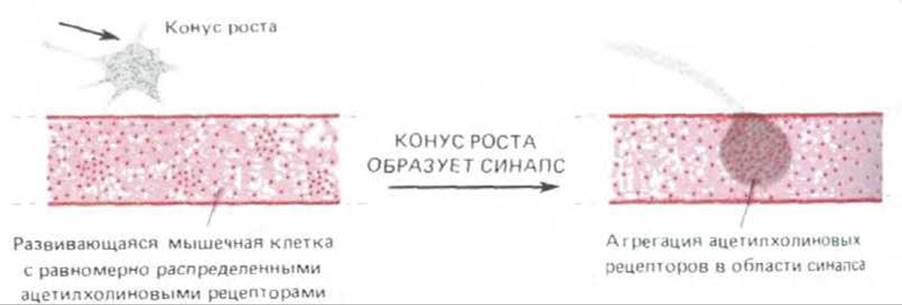
Рис. 19-76. Скопление ацетилхолиновых рецепторов в том участке мембраны развивающегося мышечного волокна, где образуется синапс между окончанием двигательного аксона и клеткой. Это скопление отчасти обусловлено диффузией рецепторов из соседних участков мембраны мышечного волокна, а отчасти тем, что здесь в мембрану включаются вновь синтезируемые рецепторы. По-видимому, эти процессы не зависят от выделения из нервного окончания нейромедиатора, так как происходят и в присутствии веществ, блокирующих потенциалы действия в нервной клетке, и даже при наличии во внеклеточной среде высоких концентраций а-бунгаротоксина (компонент змеиного яда, который, связываясь с ацетилхолиновыми рецепторами, блокирует их взаимодействие с ацетилхолином). Рецепторы, скопившиеся в месте образования синапса, находятся как бы в ловушке-скорость обновления этих рецепторов здесь гораздо ниже, чем в других участках мембраны, и время жизни достигает пяти дней и более.
В самом деле, по-видимому, базальная мембрана сама по себе способна направлять процесс регенерации окончания аксона. Это было продемонстрировано в следующем опыте: нерв и мышечную клетку разрушают, а затем дают возможность нерву регенерировать, и хотя чехол из базальной мембраны остается пустым, регенерирующий аксон отыскивает место первоначального синапса и образует здесь синаптическое окончание. Кроме того, базальная мембрана контролирует локализацию ацетилхолиновых рецепторов в месте синаптического соединения. Если разрушить нерв и мышечное волокно и дать возможность регенерировать мышце, а регенерацию нерва блокировать, то рецепторы ацетилхолина, синтезируемые регенерировавшей мышцей, локализуются преимущественно в области прежнего соединения, несмотря на отсутствие нерва (рис. 19-77). Как и следовало ожидать, экстракты, приготовленные из базальной мембраны нервно-мышечного соединения, содержат белок, называемый агрином, который способствует агрегации рецепторов в культуре мышечных клеток.
Очевидно, когда аксон контактирует с мышечной клеткой, он откладывает (или заставляет откладывать мышечную клетку) такие макромолекулы, как агрин, стабилизирующие синаптическое соединение. Однако базальной мембраны недостаточно для образования нервномышечного синапса: далеко не все встречи аксона с мышечной клеткой приводят к образованию синапса, и не все вновь образуемые синапсы абсолютно стабильны.
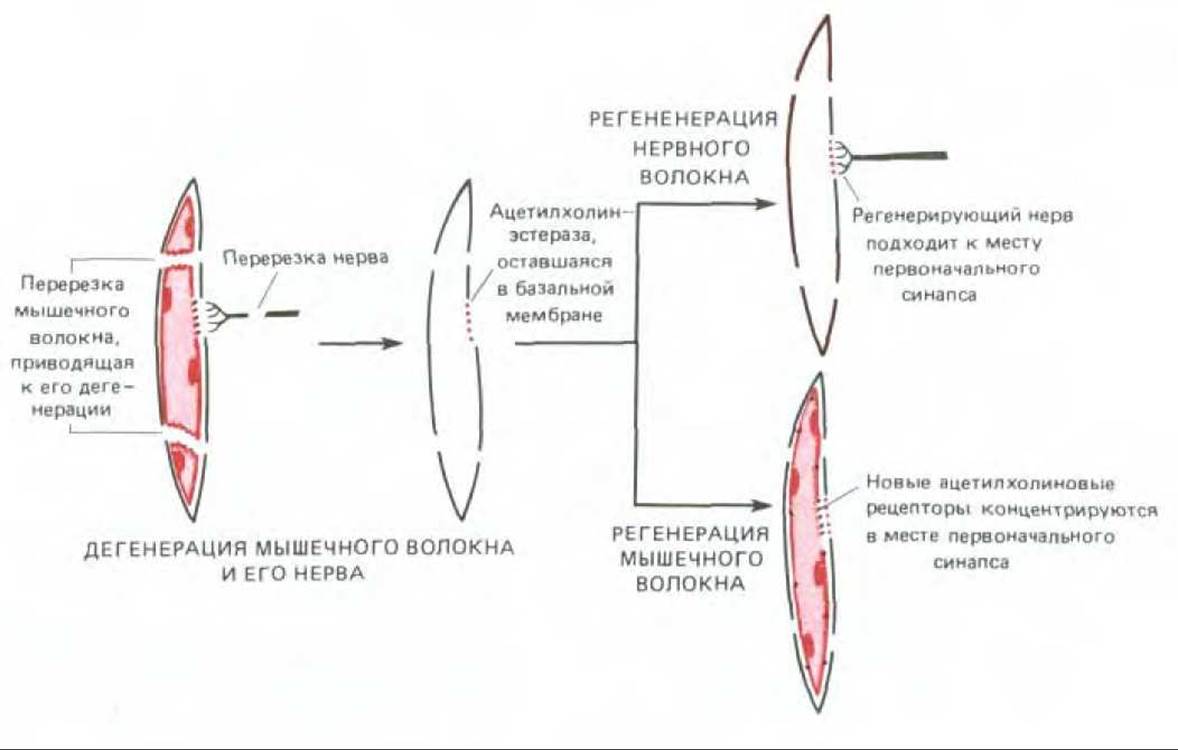
Рис. 19-77. Эксперимент, показывающий, что специфические свойства базальной мембраны нервно-мышечного соединения регулируют локализацию других компонентов синапса.
19.8.4. Восприимчивость мышечной клетки к образованию синапсов регулируется ее электрической активностью [63, 65]
Если у крысы перерезать нерв и передвинуть его конец так, чтобы он оказался над соседней нормальной мышцей, то перерезанные аксоны будут регенерировать и расти по поверхности этой мышцы; но до тех пор, пока нормальная иннервация этой мышцы не нарушена, чужеродные аксоны не будут вступать в контакт с отдельными клетками этой мышцы и образовывать на них синапсы. Если же перерезать нерв, в норме иннервирующий эту мышцу, то будут наблюдаться поразительные изменения. За несколько дней изменятся метаболизм и свойства мембраны мышечных клеток - в частности, будет синтезироваться и включаться в мембрану большое количество новых ацетилхолиновых рецепторов, что сделает клетку сверхчувствительной к ацетилхолину. В то же время мышечные клетки станут восприимчивыми к образованию новых синапсов с «чужими» аксонами, растущими на поверхности мышцы. Хотя эти аксоны предпочитают участки, где раньше находились синапсы, они смогут образовывать синапсы и на новых участках мышечных клеток. Как только синапсы будут сформированы, равномерное распределение ацетилхолиновых рецепторов исчезнет (как и в процессе эмбрионального развития) -они сохранятся в высоких концентрациях лишь в местах образования синапсов (рис. 19-78).
При денервации мышцы прекращается нормальная стимуляция этой мышцы со стороны нерва: к описанным выше изменениям приводит главным образом отсутствие электрической активности в мышечных клетках; оно же приводит и к выделению фактора, стимулирующего ветвление аксонов, о котором упоминалось раньше (разд. 19.8.4). Все эти эффекты денервации, в результате которых мышца становится более восприимчивой к образованию синапсов, можно воспроизвести с помощью местной анестезии интактного нерва, блокирующей проведение импульсов к мышце. И наоборот, если лишенную иннервации мышцу искусственно стимулировать через вживленные электроды, то чувствительность внесинаптических участков мембраны к ацетилхолину будет подавлена, так же как и образование новых синапсов. В норме электрическая активность, вызываемая нейроном, уже образовавшим синапс, «оберегает» клетку от нежелательной дополнительной иннервации.
Примерно таким же образом электрическая активность регулирует элиминацию синапсов во время развития. У зародыша позвоночных к неиннервированной мышце практически одновременно приходит много нервных окончаний, и вначале образуется немало лишних синапсов. Свойственная зрелой мышце иннервация, при которой на каждой мышечной клетке имеется только по одному синапсу, создается в результате двух разных процессов, разделенных во времени. Первый из них - это гибель избыточных мотонейронов, а второй - удаление лишних ветвей аксона (элиминация синапсов).
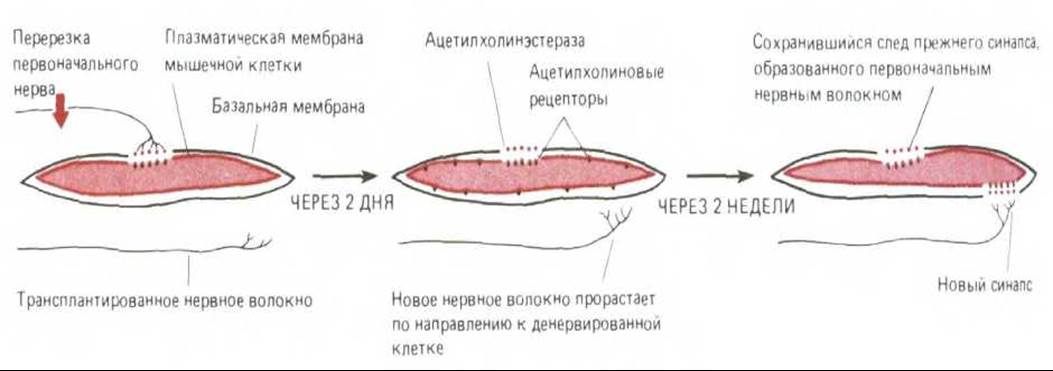
Рис. 19-78. Эксперимент на камбаловидной мышце крысы, который показывает, что денервированная мышечная клетка способна к образованию синапса после пересадки чужеродного нервного волокна. Обратите внимание, что в результате денервации распределение ацетилхолиновых рецепторов в мембране мышечной клетки изменяется: вновь синтезируемые рецепторы распределяются по всей клеточной поверхности, хотя в месте прежнего нервно-мышечного соединения концентрация рецепторов остается особенно высокой. После денервации изменяется и электрическая возбудимость мембраны, так как в мембране появляется новый класс потенциал-зависимых каналов, которые относительно устойчивы к действию тетродотоксина.
19.8.5. Электрическая активность мышцы влияет на выживание эмбриональных мотонейронов [59, 66]
Как уже отмечалось, примерно 50% мотонейронов зародыша погибает вскоре после образования синаптических контактов с мышечными клетками. Такую гибель лишних нейронов можно предотвратить, блокировав нервно-мышечную передачу (например, а-бунгаротоксином), или, наоборот, усилить, подвергнув мышцу прямой электрической стимуляции. Это позволяет предполагать, что электрическая активность мышцы регулирует образование в мышце нейротропного фактора, необходимого для выживания эмбриональных мотонейронов. Этот фактор, возможно, идентичен тому фактору, который, как полагают, вызывает рост аксонных окончаний по направлению к денервированной мышце. Когда мышца бездействует в результате блокирования синаптической передачи или из-за отсутствия иннервирующих аксонов, этот фактор образуется в больших количествах как сигнал о том, что клетка нуждается в иннервации. Электрическая активация мышцы под действием искусственных стимулов или в результате спонтанного возбуждения иннервирующих ее мотонейронов подавляет образование фактора, и часть незрелых мотонейронов зародыша гибнет в конкуренции за его оставшиеся малые количества.
19.8.6. Электрическая активность регулирует конкурентную элиминацию синапсов в соответствии с «правилом возбуждения» [61, 67]
Даже после гибели половицы эмбриональных мотонейронов на развивающейся мышце остается большой избыток синапсов. Каждый мотонейрон сильно ветвится, образуя синапсы на нескольких мышечных клетках, и каждая клетка чаще всего иннервируется отростками нескольких нейронов. Для того чтобы создалась система связей, присущая взрослому организму, необходима элиминация всех синапсов, кроме одного, на каждой мышечной клетке. Процесс элиминации синапсов во время развития был хорошо изучен на камбаловидной мышце (m. soleus) крысы, где к моменту рождения отдельная мышечная клетка иннервируется в среднем тремя мотонейронами. В последующие две-три недели каждый нейрон втягивает значительную часть своих терминальных ветвей, пока каждая клетка не будет иннервироваться одной-единственной ветвью одного мотонейрона (рис. 19-79). Если бы излишние ветви аксонов уничтожались случайным образом, то некоторые мышечные волокна могли бы совсем лишиться иннервации, тогда как на других сохранилось бы несколько синапсов. Тот факт, что на каждой клетке остается только один синапс, означает, что процесс элиминации синапсов носит конкурентный характер. Действительно, конкурентное устранение лишних синапсов во всех отделах нервной системы представляет собой один из важнейших механизмов, регулирующих развитие нервных связей и, как мы увидим позже, последующую модификацию этих связей под действием внешних стимулов. Хотя молекулярные механизмы конкурентной элиминации синапсов остаются непонятными, видимо, конкуренция в большинстве случаев подчиняется нескольким простым общим правилам, применимым как для нервно-мышечных, так и для межнейронных синапсов.
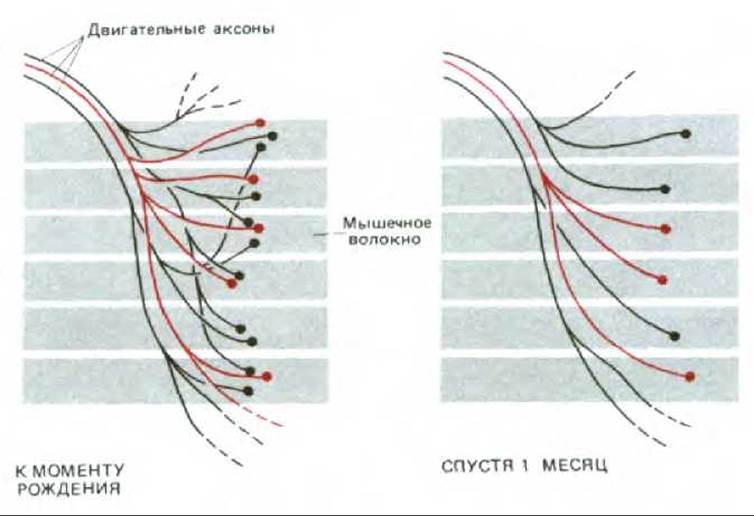
Рис. 19-79. Устранение лишних синапсов в скелетной мышце млекопитающего после рождения. Для ясности показаны далеко не все концевые ветви двигательных аксонов; на самом деле один аксон в зрелой мышце иннервирует своими разветвлениями несколько сотен мышечных волокон. Все аксонные ветви, иннервирующие одно незрелое мышечное волокно, обычно образуют синапсы на одном и том же небольшом участке мышечной клетки и конкурируют до тех пор, пока не останется лишь один синапс.
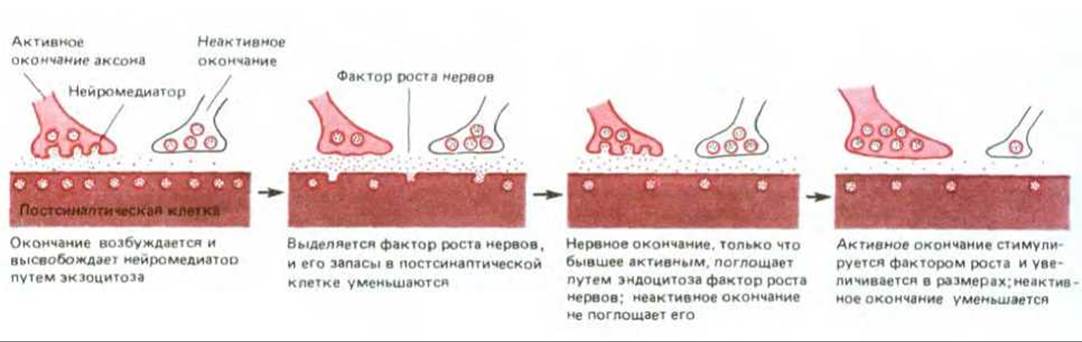
Рис. 19-80. Один из нескольких молекулярных механизмов, которые могли бы лежать в основе «правила возбуждения». Согласно представленной здесь гипотезе, сохранение синапса зависит от фактора роста нервов, выделяемого постсинаптической клеткой. Секрецию этого фактора вызывает локальная электрическая стимуляция, когда к синапсу приходит потенциал действия; в остальное время медиатор выделяется спонтанно, но с меньшей скоростью. Фактор роста поглощается окончанием аксона, которое только что было активировано, путем эндоцитоза вместе с мембранным материалом сразу после выделения медиатора (разд. 19.3.4). Окончания, поглощающие фактор роста, увеличиваются в размерах и накапливают вещества, укрепляющие синаптическую связь. Чем чаще осуществляется стимуляция мышцы, тем скорее истощаются внутриклеточные запасы фактора и тем реже происходит его спонтанное высвобождение без стимуляции. Поэтому неактивные нервные окончания, конкурирующие с активными, не могут получить необходимого количества фактора роста, постепенно сжимаются и в конце концов отмирают. Два окончания, активные в разное время, конкурируют за ограниченное количество фактора роста, содержащегося в постсинаптической клетке. Так как крупные окончания поглощают больше фактора роста и в результате становятся еще крупнее, конечный исход такой конкуренции может зависеть от незначительной разницы в первоначальных размерах окончаний. Согласно другой гипотезе, в результате стимуляции постсинаптической клетки происходит локальное выделение или активация протеазы, которая разрушает неактивные синапсы, в то время как активные синапсы каким-то образом защищены от действия этой протеазы.
Во-первых, хотя сначала конкуренция и включает элемент случайности, но окончательный результат совершенно однозначен - нейрон либо выживает, либо полностью уничтожается. Во-вторых, обычно конкуренция происходит только между синапсами, находящимися относительно близко друг к другу на одной клетке-мишени. Таким образом, при нормальном развитии типичного волокна скелетной мышцы млекопитающего приходящие нервные окончания образуют синапсы на одном и том же небольшом участке и конкурируют между собой, пока не останется только один синапс. Если же искусственно вызвать образование нескольких синапсов на одном и том же волокне, но на расстоянии 1 мм и более друг от друга, то множественная иннервация сохранится.
В-третьих, и это самое важное, конкурентная элиминация синапсов зависит от электрической активности как в аксонах, так и в иннервируемых ими клетках. Например, она замедлится, если блокировать возбуждение развивающейся мышцы, воздействуя местноанестезирующим препаратом на нерв или а-бунгаротоксином - на нервно-мышечные соединения. В большинстве изученных до сих пор систем инактивация части иннервирующих аксонов приводит к тому, что оставшиеся активными аксоны начинают контролировать большее число клеток-мишеней. Это выглядит так, как будто в районе активного синапса стимулируемая клетка-мишень выделяет какой-то фактор, способствующий разрушению близлежащих синапсов, или, наоборот, перестает синтезировать вещество, необходимое для поддержания синапсов.
Но здесь есть один загадочный момент. Если в результате синаптической стимуляции клетки-мишени синапсы разрушаются, то почему тогда остаются и укрепляются те синапсы, через которые клетка получает стимуляцию? По-видимому, ответ можно найти в следующем правиле: всякое возбуждение клетки-мишени укрепляет те синапсы, где пресинаптическое окончание аксона было перед этим активно, и способствует гибели тех синапсов, где оно находилось в состоянии покоя.
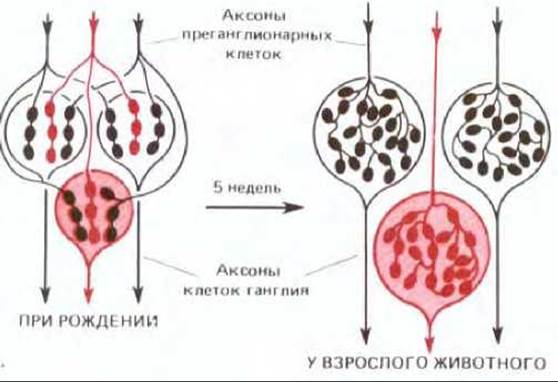
Рис. 19-81. Изменения в расположении синапсов на нейронах подчелюстного ганглия крысы, происходящие вскоре после рождения. Вначале каждая клетка иннервируется несколькими аксонами. Эти аксоны конкурируют до тех пор, пока в результате элиминации синапсов не останется лишь один аксон. Этот единственный аксон образует на клетке множество синапсов, которые уже не конкурируют между собой. (По D. Purves, J.W. Lichtman, Physiol. Rev., 58, 821-862, 1978.)
Поэтому решающую роль играют временные отношения между активацией аксона и клетки-мишени; когда несколько независимо активируемых нейронов образуют контакты с одной и той же клеткой, каждый из этих нейронов стремится укрепить свой синапс и содействовать элиминации синапсов, образованных другими нейронами.
Молекулярный механизм, лежащий в основе сформулированного выше «правила возбуждения», не ясен. На рис. 19-80 представлена одна из возможных гипотез, а в подписи к рисунку упоминается еще одно объяснение. Как бы то ни было, есть данные о том, что это правило справедливо для многих различных систем, и теперь мы рассмотрим его применительно к межнейронным синапсам.
19.8.7. Синхронно активные окончания аксонов образуют поддерживающие друг друга синапсы [68]
Одно из последствий «правила возбуждения» можно наблюдать в подчелюстном ганглии крысы, где каждый нейрон к моменту рождения иннервируется аксонами примерно от пяти пресинаптических нейронов, находящихся в стволе головного мозга. К концу первого месяца постнатальной жизни благодаря конкурентной элиминации синапсов каждый нейрон ганглия будет иннервирован уже только одним таким аксоном. Но к этому времени оставшийся аксон образует много новых концевых веточек, формирующих синапсы на других участках той же клетки, поэтому общее число синапсов будет больше, чем вначале (рис. 19-81). Очевидно, что ветви одного аксона должны обладать одним общим свойством, отличающим их от ветвей другого аксона такого же типа: все они будут возбуждаться одновременно. Но в соответствии с «правилом возбуждения» близкие друг к другу окончания, которые активируются одновременно, взаимно поддерживают образованные ими синапсы, в то время как окончания, возбуждающиеся независимо, конкурируют между собой.
19.8.8. Число сохраняющихся синапсов зависит от числа дендритов у постсинаптического нейрона [69]
Так как конкуренция синапсов за выживание отчасти определяется расстоянием между ними, окончательный результат зависит от строения постсинаптической клетки. Нейроны подчелюстного ганглия в структурном отношении атипичны - у них нет дендритов, поэтому синаптическая конкуренция происходит на близких друг к другу участках тела клетки и в результате остаются синапсы, образуемые только одним аксоном. У большинства других нейронов имеется много дендритов, так что они и у взрослых особей продолжают получать сигналы из разнообразных источников, что существенно для выполнения ими интегрирующей функции. Роль дендритов в регулировании элиминации синапсов хорошо видна на примере ресничного ганглия кролика, где у некоторых нейронов много дендритов, а у других очень мало или нет совсем (рис. 19-82). При рождении все нейроны иннервированы одинаковым числом пресинаптических аксонов - примерно четырьмя или пятью. Но во взрослом организме клетки без дендритов получают сигналы только от одного аксона, тогда как число аксонов, иннервирующих другие клетки, возрастает прямо пропорционально числу дендритов. Однако синапсы на одном дендрите обычно образованы окончаниями одного и того же аксона. Поэтому, вероятно, каждый дендрит представляет собой отдельную и независимую территорию, так что синапсы на одном дендрите не конкурируют с синапсами на других дендритах. Так же как и в скелетной мышце, конкуренция носит локальный характер и зависит от асинхронности возбуждения.
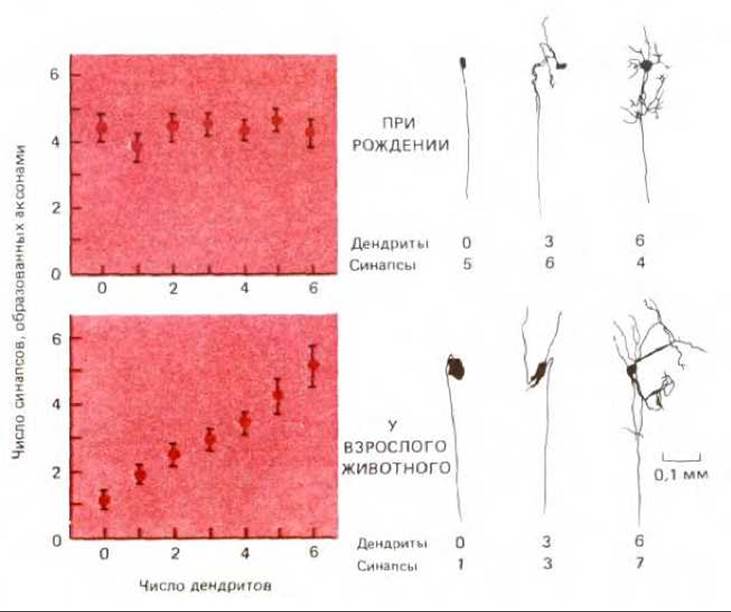
Рис. 19-82. Взаимосвязь между числом первичных дендритов и числом аксонов, образовавших синапсы на отдельных клетках, в ресничном ганглии кролика в процессе развития. При рождении среднее число входных синапсов не зависит от числа дендритов. У взрослых особей среднее число синапсов, «переживших» период конкурентной элиминации, пропорционально числу дендритов. Справа - отдельные клетки ганглия, на примере которых иллюстрируется эта взаимосвязь. (По D. Purves, R. I. Hume, J. Neurosci. 1: 441 -452, 1981, и R.I. Hume, D. Purves, Nature, 293, 469-471, 1981.)
Возможно, что наиболее глубокий смысл зависимости конкуренции синапсов от возбуждения раскрывается в тех случаях, когда стимулы от внешнего мира контролируют «настройку» анатомических связей между нейронами. Это особенно четко выявляется при изучении развития зрительной системы у позвоночных. Ниже будут рассмотрены соответствующие данные о млекопитающих.
19.8.9. У детенышей млекопитающих связи в зрительной системе подвержены влиянию сенсорного опыта [70]
В момент рождения зрительная система млекопитающего остается еще незрелой. Первые годы (у человека) или первые месяцы (у кошек или обезьян) представляют собой особый чувствительный (критический) период, когда система нервных связей подвергается настройке, и отсутствие нормального зрительного опыта в этот период может привести к серьезным и необратимым последствиям. Типичный пример этого - так называемый «ленивый» глаз как результат детского косоглазия. Дети, страдающие косоглазием, часто привыкают пользоваться только одним глазом, так как другой постоянно косит и на его сетчатке редко получается точно сфокусированное изображение. Если косоглазие вовремя исправить и ребенок научится пользоваться обоими глазами, то в дальнейшем глаза будут функционировать нормально. Но если не скорректировать косоглазие в детстве, то неиспользуемый глаз почти полностью и навсегда утратит способность видеть, и уже никакие линзы не помогут - состояние, называемое амблиопией. При этом сам глаз остается нормальным: дефект находится в мозгу. Прежде чем перейти к объяснению природы этого дефекта, нужно рассмотреть некоторые анатомические особенности зрительной системы взрослых млекопитающих.
19.8.10. В зрительной системе млекопитающих активные синапсы стремятся занять место неактивных [71]
У таких млекопитающих, как человек или кошка, поля зрения двух глаз почти совпадают, и зрительные сигналы от них комбинируются в мозгу, что обеспечивает бинокулярное стереоскопическое зрение. Это возможно благодаря тому, что аксоны, передающие сигналы от эквивалентных областей двух сетчаток, образуют синапсы в одних и тех же участках мозга (рис. 19-83). В первичной зрительной зоне коры каждого из полушарий головного мозга имеются две упорядоченные «карты» (проекции) противоположной половины зрительного поля - одна от левого глаза, а другая от правого. Однако эти две проекции накладываются не совсем точно: входы от двух глаз разделены - они представлены узкими чередующимися полосками, так называемыми колонками глазодоминантности. Эта картина схематично представлена на рис. 19-83 и может быть продемонстрирована путем введения в один глаз радиоактивных аминокислот. Меченые молекулы поглощаются нейронами сетчатки и транспортируются по аксонам нервных клеток в кору мозга, каким-то образом проходя через синапсы в «передаточных станциях» - латеральных коленчатых телах. Например, на радиоавтографах срезов зрительной коры взрослой обезьяны ясно видно, что меченые полоски шириной около 0,5 мм, получающие информацию от «меченого» глаза, перемежаются немечеными полосками такой же ширины, получающими входные сигналы от «немеченого» глаза (рис. 19-84).
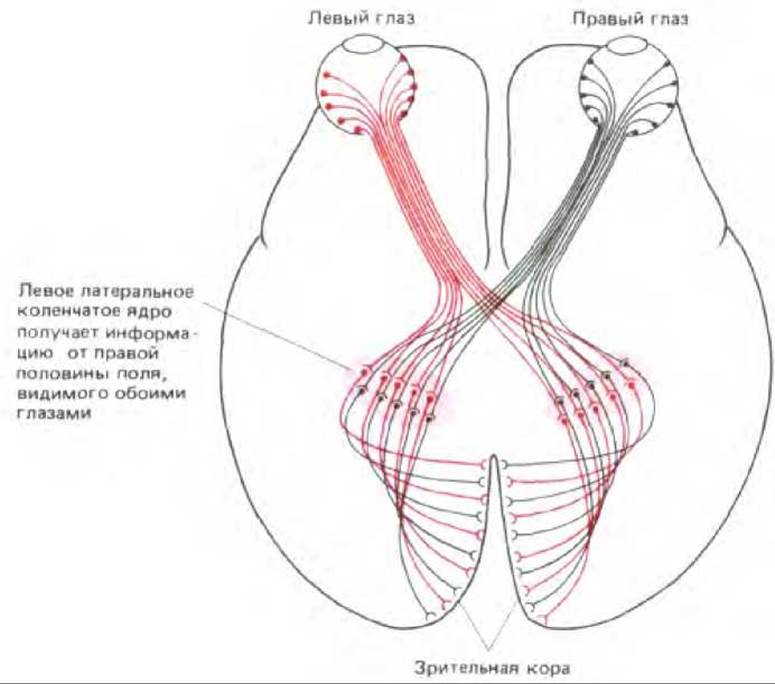
Рис. 19-83. Схема главных зрительных путей человека. Входные сигналы от правого и от левого глаза распределяются таким образом, что информация об одних и тех же участках поля зрения попадает в одни и те же области мозга. Обратите внимание, что вся информация от левой половины каждой сетчатки (т. е. от правой половины зрительного поля) поступает в левое полушарие мозга, а от правой половины обеих сетчаток - в правое полушарие.
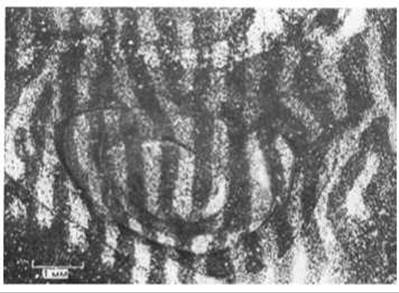
Рис. 19-84. Колонки глазодоминантности в зрительной коре мозга нормальной обезьяны. В один глаз вводили радиоактивный пролин, и животное жило еще 10 дней, в течение которых радиоактивная метка транспортировалась к участкам коры, получающим информацию от этого глаза. Затем приготовляли срезы коры, параллельные ее поверхности, и получали радиоавтограф. При исследовании радиоавтографа в темном поле зёрна, лежащие над радиоактивным участком, выглядят светлыми на темном фоне. Приводимое здесь изображение смонтировано из микрофотографий нескольких серийных срезов, проходивших через кору мозга на разной глубине. Колонки глазодоминантности, связанные с меченым глазом (светлые полосы), имеют ту же ширину, что и колонки, связанные с немеченым глазом (темные полосы). [D. H. Hubel, Т. N. Wiesel, S. Le Vay, Philos. Trans. R. Soc. (Biol.), 278, 377-409, 1977.]
Однако в период развития, когда зрительные связи только начинают устанавливаться, никаких колонок глазодоминантности различить не удается: проекции двух сетчаток совпадают полностью. Лишь позднее (обычно в первые недели жизни) эти проекции разделяются на присущие взрослому организму чередующиеся полоски в результате конкурентной элиминации окончаний аксонов. По-видимому, процесс образования системы связей подчиняется «правилу возбуждения»: аксоны, передающие сигналы от соседних точек сетчатки одного глаза, обычно возбуждаются синхронно друг с другом, но асинхронно с аксонами, несущими сигналы от другого глаза. Аксоны, возбуждающиеся синхронно, взаимно поддерживают и укрепляют синапсы, образованные ими на данной корковой клетке, но вытесняют синапсы от других аксонов. Процесс разделения проекций на чередующиеся полосы можно остановить искусственной стимуляцией обоих зрительных нервов, заставляя аксоны, несущие информацию от левого глаза, возбуждаться строго одновременно с аксонами от правого глаза; с тем же результатом можно вместо этого подавлять электрическую активность путем инъекции тетродотоксина (блокирующего потенциал-зависимые натриевые каналы) в оба глаза.
Наиболее поразительные функциональные последствия наблюдаются тогда, когда в чувствительный период один глаз специально оставляют закрытым и тем самым лишают зрительной стимуляции. Когда позже глаз открывают, животное ведет себя так, как если бы этот глаз полностью или частично ослеп. На радиоавтографах видно, что колонки глазодоминантности, связанные с закрытым глазом, резко сузились, а колонки, связанные с нормальным глазом, расширились и заняли освободившееся место (рис. 19-85). Опять-таки в соответствии с общим правилом, синапсы, образованные неактивными аксонами, исчезли, тогда как активные аксоны укрепили и умножили свои синапсы. Благодаря такому процессу территория коры мозга предоставляется аксонам, несущим информацию, и не растрачивается на бесполезные аксоны. После того как чувствительный период закончился, этот эффект уже необратим. Таким образом, объем и сложность кортикального аппарата - число нейронов и синапсов, с помощью которых взрослый организм будет обрабатывать сенсорную информацию,-зависят от сенсорной стимуляции, получаемой на раннем этапе жизни.
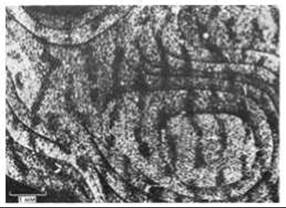
Рис. 19-85. Колонки глазодоминантности в коре обезьяны, один глаз которой был закрыт во время чувствительного периода. В другой глаз ввели радиоактивный пролин и затем приготовили радиоавтограф (см. подпись к рис. 19-84). Колонки глазодоминантности, связанные с глазом, лишенным зрительной информации (темные полосы), оказались суженными, а связанные с другим глазом-расширенными. Если ввести метку в глаз, который был закрыт, получится обратная картина: узкие светлые полосы будут чередоваться с широкими темными. [D. H Hubel, Т. N. Wiesel, S. Le Vay, Philos. Trans. R. Soc. (Biol.), 278, 377-409, 1977.]
19.8.11. Для образования конвергирующих связей от обоих глаз необходима синхронная бинокулярная стимуляция [70, 71, 72]
Ранний зрительный опыт очень важен также для установления нервных связей, обеспечивающих бинокулярное зрение. Например, некоторые дети с неисправленным косоглазием все-таки используют оба глаза, но не вместе, а попеременно. В этом случае оба глаза сохраняют способность видеть, но восприятие глубины (стереоскопическое зрение) уже не развивается. Как показывает регистрация электрических ответов отдельных клеток мозга, это тоже можно объяснить влиянием возбуждения на судьбу синаптических связей.
Стереоскопическое зрение зависит от бинокулярно активируемых нейронов, т. е. нейронов, которые реагируют на конвергентные синаптические сигналы от обоих глаз. Такие нейроны можно выявить у подопытных животных, вводя микроэлектрод в зрительную кору мозга и наблюдая ответы отдельных клеток на стимуляцию того и другого глаза. Такие клетки обнаружены в определенных слоях зрительной коры, расположенных выше и ниже слоя, содержащего «монокулярные» нейроны, образующие четко выраженные колонки глазодоминантности. В норме у животного очень много «бинокулярных» нейронов. Но у животного, которое во время чувствительного периода было лишено синхронной бинокулярной стимуляции (из-за сильного косоглазия или потому, что ему поочередно закрывали на целый день то один глаз, то другой), таких нейронов почти не оказывается. Очевидно, входные связи от обоих глаз сохраняются у бинокулярных нейронов только в том случае, если стимуляция обоих глаз происходит синхронно. Если же синхронности нет, то аксоны, несущие информацию от одного глаза, будут конкурировать с аксонами, передающими сигнал тому же нейрону, но от другого глаза; в результате у каждого нейрона в конце концов останутся входы только от одного глаза и возможность стереоскопического зрения будет утрачена.
19.8.12. Роль «правила возбуждения» в организации нервных связей с учетом индивидуального опыта [73]
Развитие бинокулярного зрения иллюстрирует общий организационный принцип: в результате синхронного возбуждения устанавливаются конвергентные связи. Это принцип, следующий из «правила возбуждения», помогает объяснить, каким образом в мозгу появляются нейроны, специфически реагирующие на определенные сложные комбинации ощущений, вызываемые объектами окружающего нас мира. Например, в мозгу приматов есть нейроны, которые, видимо, специфически возбуждаются при виде определенного лица. Иными словами, становится понятным, как мозг может в результате индивидуального опыта «настраиваться» таким образом, что его структура и функция отражают реально существующую взаимосвязь между отдельными феноменами внешнего мира. В этом смысле правило, по которому образуются и уничтожаются синапсы в ранний период жизни, представляет собой основу раннего обучения и памяти.
В этой главе уже высказывалось предположение, что в основе памяти лежит модуляция синаптической передачи в результате стойких химических изменений, происходящих в синапсах при связывании нейромедиаторов с рецепторами определенного типа. Имеет ли этот механизм какое-то отношение к описанным выше изменениям в системе синаптических связей в период развития? Видимо, по крайней мере в некоторых случаях химические и структурные изменения в синапсах тесно связаны между собой. Например, когда у аплизии вызывают долговременное привыкание или сенситизацию (разд. 19.5.3), повторяя определенные стимулы в течение нескольких дней, к химическим изменениям в синапсах добавляются еще изменения в размерах пресинаптических структур. Интересно также отметить, что у лягушек колонки глазодоминантности изменяются при введении агонистов или антагонистов NMDA-рецепторов, которые, как полагают, участвуют и в формировании следов памяти в гиппокампе (разд. 19.5.6).
Обо всем остальном, кроме приведенных выше данных, можно только строить гипотезы; память и механизмы образования и уничтожения синапсов еще во многом непонятны. Очевидно, однако, что эти проблемы относятся к ключевым вопросам биологии нервных клеток, и разрешение их, вероятно, позволит нам расширить и объединить наши представления о работе мозга на различных уровнях.
Заключение
Синапсы впервые образуются уже на ранних этапах развития, но первоначальная схема соединений подвергается длительной перестройке путем уничтожения старых синапсов и создания новых. При образовании синапса между мотонейроном и мышечным волокном происходят изменения в обеих клетках, а в разделяющей их базальной мембране накапливаются специфические вещества. Специализированная базальная мембрана нервно-мышечного соединения сохраняется после разрушения как двигательного аксона, так и мышечной клетки и регулирует восстановление компонентов синапса как в мышечном волокне, так и в окончании аксона при регенерации того и другого.
У млекопитающего при рождении на каждой мышечной клетке, как правило, имеется несколько синапсов, из которых все, крове одного, впоследствии уничтожаются в результате конкуренции. Активация мышечного волокна в области одного синоптического соединения способствует уничтожению других синапсов, находящихся поблизости, но в данный момент неактивных. Когда пре- и постсинаптическая активность совпадает во времени, происходит укрепление синапса. Это так называемое «правило возбуждения», молекулярный механизм которого не ясен, позволяет, по-видимому, объяснить процессы образования и уничтожения синапсов во многих частях развивающейся нервной системы. В частности, это правило помогает понять, как происходит «настройка» системы синоптических связей в мозгу в соответствии с индивидуальным опытом животного.
Литература
Общая
The Brain, Sci. Am., 241(3), 1979.
Cooke I., Lopkin M., eds. Cellular Neurophysiology: A Source Book. New York: Holt, Rinehart and Winston, 1972.
Hille B. Ionic Channels of Excitable Membranes. Sunderland, MA: Sinauer, 1984.
Kandel E. R., Schwartz J. H. Principles of Neural Science, 2nd ed. New York: Elsevier, 1985.
Ktffler S. W., Nicholls J. G., Martin A. R. From Neuron to Brain, 2nd ed. Sunderland, MA: Sinauer, 1984.
Molecular Neurobiology. Cold Spring Harbor Symp. Quant. Biol., 48, 1983.
Patterson P. H., Purves D. Readings in Developmental Neurobiology. Cold Spring Harbor, NY: Cold pring Harbor Laboratory, 1982.
Purves J., Lchtman J. M. Principles of Neural Development. Sunderland, MA: Sinauer, 1985.
Rаmоn у Cajal S. Histologie du Systeme Neryeux de 1'Homme et des Vertebres. Paris: Maloine, 1909-1911. (Reprinted, Madrid: Consejo Superior de Investigationes Cientificas, Institute Ramon у Cajal, 1972.)
Цитированная
1. Bullock Т.Н., Orkand R., Grinnel A. Introduction to Nervous Systems, pp. 6 and 393-496. San Francisco: Freeman, 1977.
Nauta W. J. H., Feirtag M. Fundamental Neuroanatomy. New York: Freeman / Scientific American Library, 1986.
2. Ramon у Cajal S. Recollections of My Life (E. H. Craigie, trans.). In: Memoirs of the American Philosophical Society. Vol. 8. Philadelphia, 1937. Reprinted, New York: Carland, 1988.
Stevens C.F. The neuron. Sci. Am., 241(3), 48-59, 1979.
3. Hodgkin A. L., The Conduction of the Nervous Impulse. Liverpool, U. K.: Liverpool University Press, 1964.
4. Katz B. Nerve, Muscle and Synapse. New York: McGraw-Hill, 1966.
5. Bunge M. B. The axonal cytoskeleton: its role in generating and maintaining cell form. Trends Neurosci., 9, 477-482, 1986.
Grafstein В., Forman D. S. Intracellular transport in neurons. Physiol. Rev., 60, 1167-1283, 1980.
Peters A., Palay S.L., Webster H., de F. The Fine Structure of the Nervous System. Philadelphia: Saunders, 1976.
Schwartz J.H. The transport of substances in nerve cells. Sci. Am., 242(4), 152-171, 1980.
6. Jones E.G. Pathways to progress-the rise of modern neuroanatomical techniques. Trends Neurosci., 9, 502-505, 1986.
LaVail J. H., LaVail M. M. Retrograde axonal transport in the central nervous system. Science, 176, 1416-1417, 1972.
Schnapp B. J., Vale R, D., Sheetz M. P., Reese T. S. Single microtubules from squid axoplasm support bidirectional movement of organelles. Cell, 40, 455-462, 1985.
Vale R. D. Intracellular transport using microtubule-based motors. Annu. Rev. Cell Biol., 3, 347-378, 1987.
7. Goldstein G.W., Betz A.L. The blood-brain barrier. Sci. Am., 255(3), 74-83, 1986.
KufflerS.W., Nicholls J.G., Martin A. R. From Neuron to Brain, 2nd ed., pp. 323-375. Sunderland, MA: Sinauer, 1984.
Perry V. H., Gordon S. Macrophages and microglia in the nervous system. Trends Neurosci., 11, 273-277, 1988.
8. Hille B. Ionic Channels of Excitable Membranes, pp. 21-75. Sunderland, MA: Sinauer, 1984.
Kandel E. R., Schwartz J. H. Principles of Neural Science, 2nd ed., pp. 49 - 86. New York: Elsevier, 1985.
Kuffler S.W., Nicholls J.G., Martin A. R. From Neuron to Brain, 2nd ed, pp. 97-206. Sunderland, MA: Sinauer, 1984.
9. Hodgkin A. L., Rushton W. A. H. The electrical constants of a crustacean nerve fibre. Proc. R. Soc. Lond. (Biol.)., 133, 444-479, 1946.
Roberts A., Bush В. М. H., eds. Neurones Without Impulses. Cambridge, U.K.: Cambridge University Press, 1981.
10. Baker P.P., Hodgkin A. L., Shaw T. The effects of changes in internal ionic concentrations on the electrical properties of perfused giant axons. J. Physiol., 164, 355-374, 1962.
Chiu S. Y., Ritchie J. M., Rogart R. В., Stagg D. A quantitative desciption of membrane currents in rabbit myelinated nerve. J. Physiol., 292, 149-166, 1979.
Hodgkin A. L. Chance and design in electrophysiology: an informal account of certain experiments on nerve carried out between 1934 and 1952. Hodgkin A. L., Huxley A. F. Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo. J. Physiol., 116, 449-472, 1952.
Hodgkin A.L., Huxley A. P., Katz B. Measurement of currnet-voltage relations in the membrane of the giant axon of Loligo. J. Physiol., 116, 424448, 1952.
Hodgkin A.L., Katz B. The cfflect of sodium ions on the electrical activity of the giant axon of the squid. J. Physiol., 108, 37-77, 1949.
11. Hodgkin A. L., Huxley A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. J. Physiol., 117, 500 544, 1952.
12. Bray G.M., Rasminsky M., Aquayo A.J. Interactions between axons and their sheath cells. Annu, Rev. Neurosci., 4, 127-162, 1981. French-Constant C., Raff M. C. The oligodendrocyte-type 2 astrocyte cell lineage is specialized for myelination. Nature, 323, 335-338, 1986, Morell P., Norton W.T. Myelin. Sci. Am., 242(5), 88-118, 1980.
13. Brown D.A. Synaptic mechanisms. Trends Neuroci., 9, 468-470, 1986.
Katz B. Nerve, Muscle and Synapse, pp. 97-158. New York: McGraw-Hill, 1966.
Kuffler S. W., Nicholls J. G., Martin A. R. From Neuron to Brain, 2nd ed., pp. 207-320. Sunderland, MA: Sinauer, 1984.
14. Dale H. H., Feldberg W., Vogt M. Release of acetylcholine at voluntary motor nerve endings. J. Physiol., 86, 353-380, 1936.
Fatt P., Katz B. An analysis of the end-plate potential recorded with an intracellular electrode. J. Physiol., 115, 320-370, 1951.
Feldberg W. The early history of synaptic and neuromuscular transmission by acetylcholine: reminiscences of an eyewitness. In The Pursuit of Nature (A. L. Hodgkin, et al.), pp- 65-83. Cambridge, U.K.: Cambridge University Press, 1977.
15. Hill B. Ionic Channels of Excitable Membranes, pp. 76-98. Sunderland, MA: Sinauer, 1984.
Katz В., Miledi R. The timing of calcium action during neuromuscular transmission. J. Physiol., 189, 535-544, 1967.
Llinas R. Calcium in synaptic transmission. Sci. Am., 247(4), 56-65, 1982.
Miller R.J. Calcium signalling in neurons. Trends Neurosci., 11, 415-419, 1988.
16. Couteaux R., Pecot-Dechavassine M. Vesicules synaptiques et poches au niveau des zones actives de la jonction neuromusculaire. Comptes Rendus Acad. Sci. (Paris) D, 271, 2346-2349, 1970.
Heuser J. E., et al. Synaptic vesicle exocytosis captured by quick freezing and correlated with quantal transmitter release. J. Cell Biol. 81:275-300, 1979.
Hauser J. E., Reese T. S. Structural changes after transmitter release. Trends Neurosci., 11, 458-464, 1988.
17. Del Castillo J., Katz B. Quantal components of the endplate potential. J. Physiol, 124, 560 573, 1954.
Fatt P., Katz B. Spontaneous subthreshold activity at motor nerve endings. J. Physiol., 117, 109-128, 1952.
18. Hille B. Ionic Channels of Excitable Membranes, pp. 117-147. Sunderland, MA: Sinauer, 1984.
19. Lester H. A. The response to acetylcholine. Sci. Am., 236(2), 106-118, 1977.
Sakmann В., Bormann J., Hamill O. P. Ion transport by single receptor channels. Cold Spring Harbor Symp. Quant. Biol., 48, 247-257, 1983.
20. Massoulie J.. Bon S. The molecular forms of cholinesterase and acetylcholinesterase in vertebrates. Annu. Rev. Neurosci., 5, 57-106, 1982. Taylor P., Schumacher M., MacPhee-Quigley K., Friedmann T, Taylor S. The structure of acetylcholinesterase: relationship to its function and cellular disposition. Trends Neurosci., 10, 93-95, 1987.
21. Barnard E. A., Darlison M.G., Seeburg P. Molecular biology of the GABA-A receptor: the receptor/channel superfamily. Trends Neurosci., 10, 502-509, 1987.
Grenningloh G., et al. The strychnine-binding subunit of the glycine receptor shows homology with nicotinic acetylcholine receptors. Nature, 328, 215-220, 1987.
Hille B. Ionic Channels of Excitable Membranes, pp. 371-383. Sunderland, MA: Sinauer, 1984. (Evolution of channels.)
22. Gottlieb D.I. GABAergic neurons. Sci. Am., 285(2), 38-45, 1988.
Mayer M. L., Westbrook G. L. The physiology of excitatory amino acids in the vertebrate central nervous system. Prog. Neurobiol., 28, 197-276, 1987.
Sneddon P., Westfall D. P. Pharmacological evidence that adenosine triphosphate and noradrenaline are cotransmitters in the quinea pig vas deferens. J. Physiol., 347, 561-580, 1984.
23. Snyder S.H. Drug and neurotransmitter receptors in the brain. Science, 224, 22-31, 1984.
Nathanson N. M. Molecular properties of the muscarinic acetylcholine receptor. Annu. Rev. Neurosci., 10, 195-236, 1987.
24. Bormann J. Electrophysiology of GABA-A and GABA-B receptor subtypes. Trend Neurosci., 11, 112-116, 1988.
Snyder S.H. Drug and the Brain. New York: W. H. Freeman/Scientific American Books, 1987.
Tollman J. F., Gallager D. W. The GABAergic system: a locus of benzodiazepine action. Annu. Rev. Neurosci., 8, 21-44, 1985.
25. Kuffler S. W., Nicholls J. G., Martin А. Я From Neuron to Brain, 2nd ed., pp. 407-430. Sunderland, MA: Sinauer, 1984.
26. Barren J. N. Motoneuron dendrites: role in synaptic integration. Fed. Proc., 34, 1398-1407, 1975.
27. Coombs J. S., Curtis D. R., Eccles J. C. The generation of impulses in motoneurones. J. Physiol., 139, 232-249, 1957.
Fuortes M. G. F., Frank K., Becker M. C. Steps in the production of motoneuron spikes. J. Gen. Physiol., 40, 735-752, 1957.
28. Connor J. A., Stevens C. F. Prediction of repetitive firing behaviour from voltage clamp data on an isolated neurone soma. J. Physiol., 213, 3153, 1971.
Hille B. Ionic Channels of Excitable Membranes, pp. 99-116. Sunderland, MA: Sinauer, 1984.
Rogawski M. A. The A-current: how ubiquitous a feature of excitable cells is it? Trends Neurosci., 8, 214-219, 1985.
29. Meech R. W. Calcium-dependent potassium activation in nervous tissues. Annu. Rev. Biophys. Bioeng., 7, 1-18, 1978.
Tsien R. W., Lipscombe D., Madison D. V., Bley K.R., Fox A. P. Multiple types of neuronal calcium channels and their selective modulation.
Trends Neurosci., 11, 431-438, 1988.
30. Bullock T. H., Horridge G. A. Structure and Function in the Nervous System of Invertebrates, pp. 38-124. San Franciso: Freeman, 1965.
Llinas R., Sugimori M. Electrophysiological properties of in vitro Purkinje cell dendrites in mammalian cerebellar slices. J. Physiol., 305, 197-213, 1980.
Shepherd G.M. Microcircuits in the nervous system. Sci. Am., 238(2), 92-103, 1978.
31. Breitwieser G. E., Szabo G. Uncoupling of cardiac muscarinic and betaadrenergic receptors from ion channels by a guanine nucleotide analogue. Nature, 317, 538-540, 1985.
Levitan I. B. Modulation of ion channels in neurons and other cells. Annu. Rev. Neurosci., 11, 119-136, 1988.
Nairn A. C., Hemmings H. C., Greengard P. Protein kinases in the brain. Annu. Rev. Biochem., 54, 931 -976, 1985.
Pfaffinger P. J., Martin J. M., Hunter D. D., Nathanson N. M., Hille B. GTP-binding proteins couple cardiac muscarinic receptors to а К channel. Nature, 317, 536-538, 1985.
32. Iversen L.L. The chemistry of the brain. Sci. Am., 241(3), 118-129, 1979.
Snyder S.H. Drugs and the Erain. New York: W. H. Freeman/Scientific American Library, 1988.
33. Bloom F.E., Neuropeptides. Sci. Am., 245(4), 148-168, 1981.
Hokfelt Т., Johanson O., Goldstein M. Chemical anatomy of the brain. Science, 225, 1326-1334, 1984.
Jan V. N., Bowers C. W., Branton D., Evans L., L. Y. Peptides in neuronal function: studies using frog autonomic ganglia. Cold Spring Harbor Symp. Quant. Biol., 48, 363-374, 1983.
Scheller R. H., Axel R. How genes control an innate behavior. Sci. Am., 250(3), 44- 52, 1984. (Neuropeptides in Aplysia).
34. Parley J., Alkon D. Cellular mechanisms of learning, memory, and information storage. Annu. Rev. Psychol., 36, 419 494, 1985.
Kandel E.R. Small systems of neurons. Sci. Am., 241(3), 60-70, 1979.
Morris R. G. M., Kandel E. R., Squire L. R., eds. Learing and Memory. Trends Neurosci., 11, 125-181, 1988.
35. Greenberg S. M., Castellucci V. F., Bayley H., Schwartz J. H. A molecular mechanism for long-term sensitization in Aplysia. Nature, 329, 6265, 1987.
Montarolo P. G., el al. A critical period for macromolecular synthesis in long-term heterosynaptic facilitation in Aplysia. Science, 234, 1249-1254, 1986.
Schwartz J. H., Greenberg S. M. Molecular mechanisms for memory: second-messenger induced modifications of protein kinases in nerve cells. Annu. Rev. Neurosci., 10, 459-476, 1987.
Siegelbaum S. A., Camardo J. S., Kandel E. R. Serotonin and cyclie AMP close single K+ channels in Aplysia sensory neurons. Nature, 299, 413417, 1982.
36. Dudai Y. Neurogenetic dissection of learning and short-term memory in Drosophila. Annu. Rev. Neurosci., 11, 537-563, 1988.
Kandel E. R., et al. Classical conditioning and sensitization share aspects of the same molecular cascade in Aplysia. Cold Spring Harbor Symp. Quant. Biol., 48, 821-830, 1983.
37. Biss T. V. P., Lomo T. Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path. J. Physiol., 232, 331 356, 1973.
Collingridge G. L., Bliss T.V.P. NMDA receptors their role in long-term potentiation. Trends Neurosci., 10, 288-293, 1987
Cotman C. W., Monaghan D. Т., Ganong A.H. Excitatory amino acid neurotransmission: NMDA receptors and Hebb-type synaptic plasticity. Annu. Rev. Neurosci, 11, 61-80, 1988.
Lisman J.E., Goldring M.A. Feasibility of long-term storage of graded information by the Ca2+ /calmodulin-dependent protein kinase molecules of the postsynaptic density. Proc. Natl. Acad. Sci. USA, 85, 5320-5324, 1988.
Mishkin M., Appenzeller T. The anatomy of memory. Sci. Am., 256(6), 80-89, 1987.
Morris R. G., Anderson E., Lynch G., Baudry M. Selective impairment of learning and blockade of long-term potentiation by an N-methyl-D- aspartate receptor antagonist, AP5. Nature, 319, 774-776, 1986.
38. Barlow H. В., Mollon J. D., eds. The Senses. Cambridge, U. K.: Cambridge University Press, 1982.
Schmidt R. F., ed. Fundamentals of Sensory Physiology. New York: Springer, 1978.
Shepherd G. Neurobiology, 2nd ed., pp. 205-353. New York: Oxford University Press, 1988.
39. Katz B. Depolarization of sensory terminals and the initiation of impulses in the muscle spindle. J. Physiol., 111, 261-282, 1950.
40. Hudspeth A. J. The cellular basis of hearing: the biophysics of hair cells. Science, 230, 745-752, 1985.
Roberts W. M., Howard J., Hudspeth A. J. Hair cells: transduction, tuning, and transmission in the inner ear. Annu. Rev. Cell Biol., 4, 63-92, 1988.
Von Bekesy G. The ear. Sci. Am., 197(2), 66—78, 1957.
41. Corey D.P., Hudspeth A.J. Compliance of the hair bundle associated with medianoelectrical transduction channels in the bullfrog's saccular hair cell. Neuron, 1, 189-199, 1988.
Pickles J. О. Recent advances in cochlear physiology. Prog. Neurobiol., 24, 1 -42, 1985.
42. Barlow H.B., Mollon J.D., eds. The Senses, pp. 102-164. Cambridge, U.K.: Cambridge University Press, 1982.
43. Baylor D.A., Lamb T.D., Yau K. W. Responses of retinal rods to single photons. J. Physiol., 288, 613-634, 1979.
Schnapf J.L., Baylor D. A. How photoreceptor cells respond to light. Sci. Am, 256(4), 40-47, 1987.
44. Stryer L. The molecules of visual excitation. Sci. Am., 257(1), 32-40, 1987.
45. Fesenko E. E., Kolesnikov S.S., Lyubarsky A. L. Induction by cyclic GMP of cationic conductance in plasma membrane of retinal rod outer segment. Nature, 313, 310-313, 1985.
Stryer L. The cyclic GMP cascade of vision. Annu. Rev. Neurosci., 9, 87-119, 1986.
46. Koch K. W., Stryer L. Highly cooperative feedback control of retinal rod guanylate cyclase by calcium ions. Nature, 334, 64-66, 1988.
Matthews H. R., Murphy R.L.W., FainG.L., Lamb T.D. Photoreceptor hight adaptation is mediated by cytoplasmic calcium concentration. Nature, 334, 67-69, 1988.
Nakatani K., Yau K. W. Calcium and light adaptation in retinal rods and cones, Nature, 334, 67-71, 1988.
47. Hubel D.H. Eye, Brain, and Vision. New York: W. H. Freeman / Scientific American Library, 1988.
Kuffler S. W., Nicholls J. G., Martin A. R. From Neuron to Brain, 2nd ed., pp. 19-96. Sunderland, MA: Sinauer, 1984.
Masland R. H. The functional architecture of the retina. Sci. Am., 255(6), 102-111, 1986.
48. Cowan W.M. The development of the brain. Sci. Am., 241(3), 106-117, 1979.
Hopkins W. G., Brown M. C. Development of Nerve Cells and their Connections. Cambridge, U.K.: Cambridge University Press, 1984.
Parnavelas J. G., Stern C. D., Stirling R. V., eds. The Making of the Nervous System. Oxford, U.K.: Oxford University Press, 1988.
Purves D., Lichtman J. W. Principles of Neural Development. Sunderland, MA: Sinauer, 1985.
49. Alvarez-Buylla A., Nottebohm F. Migration of young neurons in aduit avian brain. Nature, 335, 353-354, 1988.
Le Douarin N. M., Smith J. Development of the peripheral nervous system from the neural crest. Annu. Rev. Cell Biol., 4, 375-404, 1988.
Stent G. S., Weisblat D. A. Cell lineage in the development of invertebrate nervous system. Annu. Rev. Neurosci., 8, 45-70, 1985.
Williams R. W., Herrup K. The control of neuron number. Annu. Rev. Neurosci., 11, 423-453, 1988.
50. Hollyday M., Hamburger V. An autoradiographic study of the formation of the lateral motor column in the chick embryo. Brain Res., 132, 197208, 1977.
Rakic P., Mode of cell migration to the superficial layers of the fetal monkey neocortex. J. Сотр. Neurol., 145, 61-84, 1972.
51. Caviness V.S. Neocortical histogenesis in normal and reeler mice: a developmental study based on [3H] thymidine autoradiography. Dev. Brain Res., 4, 293-302, 1982.
McConnell S. K. Development and decision-making in the mammalian cerebral cortex. Brain Res. Rev., 13, 1-23, 1988.
Rakic P. Specification of cerebral cortical areas. Science, 241, 170-176, 1988.
52. Bray D., Hollenbeck P. J. Growth cone motility and guidance. Annu. Rev. Cell Biol., 4, 43-61, 1988. Harrison R.G. The outgrowth of the nerve fiber as a mode of protoplasmic movement. J. Exp. Zool., 9, 787-846, 1910.
Yamada K. M., Spooner B. S., Wessells N. K. Ultrastructure and function of growth cones and axons of cultured nerve cells. J. Cell Biol., 49, 614635, 1971.
53. Bamburg J. B. The axonal cytoskeleton: stationary or moving matrix? Thrends Neurosci., 11, 248-249, 1988.
Bamburg J. R., Bray D., Chapman K. Assembly of microtubules at the tip of growing axons. Nature, 321, 788-790, 1986.
Bray D. Surface movements during the growth of single explanted neurons. Proc. Natl. Acad. Sci. USA 65: 905-910, 1970.
Letourneau P. C., Ressler A. N. Inhibition of neurite initiation and growth by taxol. J. Cell Biol., 98, 1355-1362, 1984.
54. Davies A. M. Molecular and cellular aspects of patterning sensory neurone connections in the vertebrate nervous system. Development, 101, 185-208, 1987.
Kater S. В., Mattson M. P., Cohan C., Connor J. Calcium regulation of the neuronal growth cone. Trends Neurosci., 11, 315-321, 1988.
Letourneau P. C. Cell-to-substratum adhesion and guidance of axonal elongation. Dev. Biol., 44, 92-101, 1975.
Lumsden A. G.S., Davies A. M. Earliest sensory nerve fibres are guided to peripheral targets by attractants other than Nerve Growth Factor. Nature, 306, 786-788, 1983.
Patel N., Poo M. M. Orientation of neurite growth by extracellular electric fields. J. Neurosci., 2, 483-496, 1984.
55. Bentley D., Caudy M. Navigational substrates for peripheral pioneer growth cones: limb-axis polarity cues, limb-segment boundaries, and guidepost neurons. Cold Spring Harbor Symp. Quant. Biol., 48, 573-585, 1983.
Berlot J., Goodman C. S. Guidance of peripheral pioneer neurons in the grasshopper: adhesive hierarchy of epithelial and neuronal surfaces. Science, 223, 493-496, 1984.
Goodman C. S., Bastiani M. J. How embryonic nerve cells recognize one another. Sci. Am., 251(6), 58-66, 1984.
56. Bixby J. L., Pratt R. S., Lilien J., Reichardt L. F. Neurite outgrowth on muscle cell surfaces involves extracellular matrix receptors as well as Ca2+-dependent and independent cell adhesion molecules. Proc. Natl. Acad. Sci. USA, 84, 2555-2559, 1987.
Chang S., Rathjen F. G., Raper J. A. Extension of neurites on axons is impaired by antibodies against specific neural cell adhesion molecules. J. Cell Biol., 104, 355-362, 1987.
Jessell T. M. Adhesion molecules and the hierarchy of neural development. Neuron, 1, 3 13, 1988.
Sanes J. R., Schaehner M., Covault J. Expression of several adhesive macromolecules (N-CAM, L1, Jl, NILE, uvomorulin, laminin, fibronectin, and a heparan sulfate protcoglycan) in embryonic, adult, and denervated adult skeletal muscle. J. Cell Biol., 102, 420 431, 1986.
Tomaselli K.J., el al. N-cadherin and integrins: two receptor systems that mediate neuronal process outgrowth on astrocyte surfaces. Neuron, 1; 3343, 1988.
57. Lance-Jones C., Landmesser L. Motoneurone projection patterns in the chick hindlimb following early partial reversals of the spinal cord. J. Physiol., 302, 581-602, 1980. Landmesser L. The development of specific motor pathways in the chick embryo. Trends Neurosci., 7, 336-339, 1984.
Sperrv R. W. Chemoaffinity in the orderly growth of nerve fiber patterns and connections. Proc. Natl. Acad. Sci. USA, 50, 703-710, 1963.
Udin S. В., Fawcett J. W. Formation of topographic maps. Annu. Rev. Neurosci., 11, 289-327, 1988.
58. Campenot R. B. Local control of neurite development by nerve growth factor. Proc. Natl. Acad. Sci. USA, 74, 4516-4519, 1977.
Davies A., Lumsden A. Relation of target encounter and neuronal death to nerve growth factor responsiveness in the developing mouse trigeminal ganglion. J. Сотр. Neurol., 223, 124-137, 1984.
Greene L. A. The importance of both early and delayed responses in the biologien actions of nerve growth factor. Trends Neurosci., 7, 91 94, 1984.
Levi-Montalcini R., Calissano P. The nerve growth factor. Sci. Am., 240(6), 68-77, 1979.
59. Cowan W.M., Fawcett J. W., O'Leary D.D.M., Stanfield В. В. Regressive events in neurogenesis. Science, 225, 1258 1265, 1984.
Davies A.M. Role of neurotrophic factors in development. Trends Genet., 4, 139-144, 1988.
Hamburger V., Levi-Montalcini R. Proliferation, differentiation and degeneration in the spinal ganglia of the chick embryo under normal and experimental conditons. J. Exp. Zool., 162, 133-160, 1949.
Hamburger V., Vip J. W. Reduction of experimentally induced neuronal death in spinal ganglia of the chick embryo by nerve growth factor. J. Neurosci., 4, 767-774, 1984.
Williams R. W., Herrup K. The control of neuron number. Annu. Rev. Neurosci., 11, 423-453, 1988.
60. Brown M. C., Holland R. L., Hopkins W. G. Motor nerve sprouting. Annu. Rev. Neurosci., 4, 17-42, 1981.
Davies A.M. The survival and growth of embryonic proprioceptive neurons is promoted by a factor present in skeletal muscle. Dev. Biol., 115, 5667, 1986.
Ebendal Т.. Olson L., Seiger A., Hedlund К. О. Nerve growth factors in the rat iris. Nature, 286, 25-28, 1980.
Purves D., Voyvodic J. T. Imaging mammalian nerve cells and their connections over time in living animals. Trends Neurosci., 10, 398 404, 1987.
61. Purves D., Lichtman J.W. Principles of Neural Development. Sunderland, MA: Sinaucr, 1985.
62. Hume R. I., Role L. W., Fischbach G. D. Acetylcholine release from growth cones detected with patches of acetylcholine receptor-rich membranes. Nature, 305, 632-634, 1983.
Jarmillo F., Vtcini S.. Schuetze S. M. Embryonic acetylcholine receptors guarantee spontaneous contractions in rat developing muscle. Nature, 335, 66 68, 1988.
Spitzer N. C. Ion channels in development. Annu. Rev. Neurosci., 2, 363-397, 1979.
Young S. H., Poo M. M. Spontaneous release of transmitter from growth cones of embryonic neurones. Nature, 305, 634-637, 1983.
63. Poo M.M. Mobility and localization of proteins in excitable membranes. Annu. Rev. Neurosci., 8, 369-406, 1985.
Schuetze S. M., Role L. M. Development regulation of nicotinic acetylcholine receptors. Annu. Rev. Neurosci., 10, 403-457, 1987.
64. Burden S. J., Sargent P. В., McMagan U.J. Acetylcholine receptors in regenerating muscle accumulate at original synaptic sites in the absence of the nerve. J. Cell Biol., 82, 412-425, 1979.
Nitkin R. M., el al. Identification of agrin, a synaptic organizing protein from Torpedo electric organ. J. Cell Biol., 105, 2471-2478, 1987.
Sanes J. R., Hall Z. W. Antibodies that bind specifically to synaptic sites on muscle fiber basal lamina. J. Cell Biol., 83, 357 370, 1979.
65. Frank E., Jansen J. K. S., Lomo Т., Westgaard R. H. The interaction between foreign and original motor nerves innervating the soleus muscle of rats. J. Physiol., 247, 725-742, 1975.
Jones R., Vrbova G. Two factors responsible for denervation hypersensitivity. J. Physiol., 236, 517-538, 1974.
Lomo Т., Jansen J. K. S. Requirement for the formation and maintenance of neuromuscular connections. Curr. Top. Dev. Biol., 16, 253-281, 1980. Lomo Т., Rosenthal J. Control of ACh sensitivity by muscle activity in the rat. J. Physiol., 221, 493-513, 1972.
66. Oppenheim R. W. Cell death during neural development. In: Handbook of Physiology, Vol. 1: Neuronal Development, (W. M. Cowan, ed.). Washington, DC: American Physiological Society, 1988.
Pittman R., Oppenheim R. W. Cell death of motoneurons in the chick embryo spinal cord. IV. Evidence that a functional neuromuscular interaction is involved in the regulation of naturally occurring cell death and the stabilization of synapses. J. Сотр. Neurol, 187, 425-446, 1979.
67. Brown M. C., Jansen J. K. S. Van Essen D. Polyneuronal innervation of skeletal muscle in new-born rats and its elimination during maturation. J. Physiol., 261, 387-422, 1976.
Callaway E. M., Soha J. M., Van Essen D. Competition favouring inactive over active motor neurons during synapse elimination. Nature, 328, 422—426, 1987.
O'Brien R.A.D., Ostberg A.J.C., Vrbova G. Protease inhibitors reduce the lose of nerve terminals induced by activity and calcium in developing rat soleus muscles in vitro. Neurosci., 12, 637-646, 1984.
Ribshester R. R., Taxt T. Motor unit size and synaptic competiton in ral lumbrical muscles reinnervated by active and inactive motor axons. J. Physiol., 344, 89 111, 1983.
68. Lichtman J. W. The reorganization of synaptic connexions in the rat submandibular ganglion during post-natal development. J. Physiol., 273, 155-177, 1977.
Purves D., Lichtman J.W. Principles of Neural Development, pp. 271-328. Sunderland, MA: Sinauer, 1985.
69. Purves D. Modulation of neuronal competiton by postsynaptic geometry in autonomic ganglia. Trends Neurosci., 6, 10-16, 1983.
70. Barlow H. Visual experience and cortical development. Nature, 258, 199-204, 1975. Wiesel T.N. Postnatal development of the visual cortex and the influence of environment. Nature, 299, 583-591, 1982.
71. Fawcett J. W. Retinotopic maps, cell death, and electrical activity in the retinotectal and retinocollicular projections. In: The Making of the Nervous System (J.G. Parnavelas; C.D. Stern; R.V. Stirling, eds.), pp. 395-416. Oxford, U.K.: Oxford University Press, 1988.
Hubel D. H., Wiesel T.N. Ferrier lecture: functional architecture of macaque monkey visual cortex. Proc. R. Soc. Lond. Biol., 198, 1 59, 1977. Hubel D. H., Wiesel T.N., Le Vay S. Plasticity of ocular dominance columns in monkey striate cortex. Philos. Trans. R. Soc. Lond. Biol., 278, 377409, 1977.
Rakic P. Prenatal genesis of connections subserving ocular dominance in the rhesus monkey. Nature, 261, 467-471, 1976.
Stryker M.P., Harris W.A. Binocular impulse blockade prevents the formation of ocular dominance columns in cat visual cortex. J. Neurosci., 6, 2117-2133, 1986.
72. Hubel D. H., Wiesel T.N. Binocular interaction in striate cortex of kittens reared with artificial squint. J. Neurophysiol., 28, 1041-1059, 1965.
Le Vay S.. Wiesel T. N., Hubel D. H. The development of ocular dominance columns in normal and visually deprived monkeys. J. Сотр. Neurol, 191, 1 51, 1980.
73. Baylis G. C., Rolls E. Т., Leonard С. М. Selectivity between faces in the responses of a population of neurons in the cortex in the superior temporal sulcus of the monkey. Brain Res., 342, 91-102, 1985.
Cline H. Т., Debski E.A., Constantine-Paton M. N-methyl-D-aspartate receptor antagonist desegregates eye-specific stripes. Proc. Natl. Acad. Sci. USA, 84, 4342-4345, 1987,
Greenough W. Т.. Bailey С. Н. The anatomy of a memory: convergence of results across a diversity of tests. Trends Neurosci., 11, 142-147, 1988. Perrett D.I., Mistlin A.J., Chitty A.J. Visual neurones responsive to faces. Trends Neurosci., 10, 358-364, 1987.