Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Особенности растительных клеток
Центральная роль клеточной стенки
Клеточная стенка в растительных тканях представляет собой сложный внеклеточный матрикс, окружающий каждую клетку. По сравнению с клетками животных, у большинства из которых на поверхности также имеется внеклеточный матрикс (см. разд. 14.2), стенка растительной клетки обычно гораздо толще, прочнее и, что самое главное, более жесткая. Большинство различий между растениями и животными в питании, переваривании, осморегуляции, росте, размножении, межклеточных связях, защитных механизмах, а также морфологии связаны со свойствами клеточной стенки. Например, приобретение стенкой растительной клетки такого свойства, как жесткость, обусловило потерю способности к передвижению. Неподвижный образ жизни сохранился у многоклеточных растений. Именно толстые клеточные стенки, хорошо различимые под микроскопом, позволили Роберту Гуку в 1663 г. впервые рассмотреть клетки и дать им то название, которым мы пользуемся до сих пор.
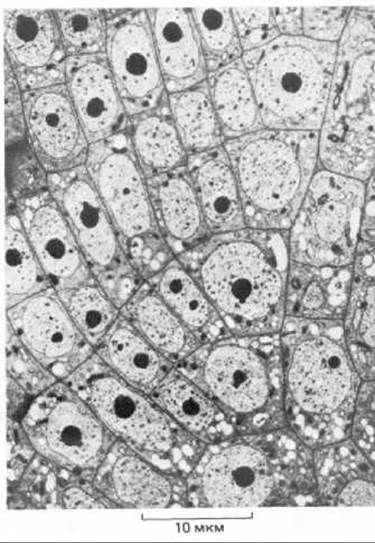
Рис. 20.1. Электронная микрофотография клеток кончика корня у камыша. Видна регулярная структура, обусловленная строгой последовательностью деления клеток с жесткими стенками. (С любезного разрешения В. Gunning.)
Клеточная стенка растения прежде всего защищает животное содержимое его клетки. Каждая такая стенка служит связующим звеном между своей и соседними клетками, обеспечивая единство и целостность всего растительного организма (рис. 20-1). Хотя при этом каждая клетка растения заключена в свою собственную «деревянную коробочку», возможность прямых контактов между клетками не утрачивается и они поддерживаются через плазмодесмы. Тысячи этих цитоплазматических канальцев, полость которых выстлана плазмалеммой, пронизывают клеточную стенку, соединяя соседние клетки и обеспечивая передвижение небольших молекул из клетки в клетку. Кроме того, вдоль клеточной стенки и сквозь нее циркулируют жидкости. Таким образом, у растений клеточная стенка осуществляет не только защитные и опорные, но и транспортные функции.
При специализации клетки растений образуют такие стенки, которые особенно хорошо приспособлены для выполнения конкретной функции. В данном разделе мы рассмотрим вопрос о том, какую роль в жизни растительной клетки играет окружающая ее клеточная стенка. Начнем с описания строения стенки.
20.1.1. Клеточная стенка образована волокнами целлюлозы, погруженными в полисахаридно-белковый матрикс [1]
Большинство вновь образуемых клеток в многоклеточном растении возникают в особых участках, которые называются меристемами (см. разд. 20.5.1). Эти новые клетки обычно малы по сравнению с уже дифференцированными. Увеличение их размеров возможно потому, что стенки таких клеток (первичные клеточные стенки, рис. 20-2) весьма тонки и представляют собой полужесткие структуры. После прекращения клеточного роста стенке не надо больше расширяться. У зрелых (нерастущих) клеток может сохраняться первичная клеточная стенка, но гораздо чаще клетка наращивает дополнительно вторичную клеточную стенку. Это происходит либо путем утолщения первичной стенки, либо за счет откладывания на внутренней стороне этой стенки новых прочных слоев разного состава (см. разд. 20.1.7).
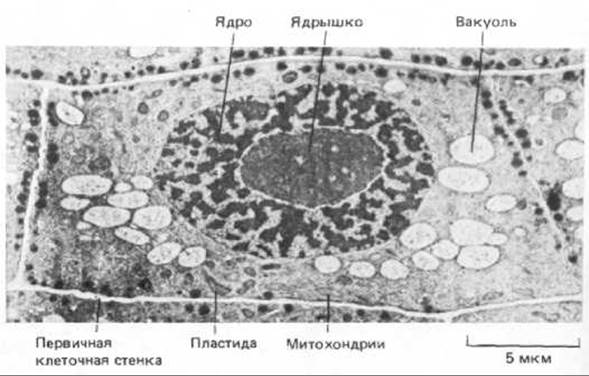
Рис. 20-2. Электронная микрофотография клетки из кончика молодого корешка лука. Видны основные органеллы и тонкая первичная клеточная стенка. (С любезного разрешения В. Wells.)
Хотя первичные клеточные стенки высших растений сильно различаются по составу и в деталях своей организации, все они построены по единому принципу, общему для внеклеточных матриксов: длинные волокна, обусловливающие прочность при растяжении, удерживаются вместе сетью из белка и полисахаридов, придающей устойчивость к сжатию. Тот же инженерный принцип (прочные волокна, устойчивые к натяжению, окруженные аморфным матриксом, устойчивым к сжатию) используется в конструкции костей животных (см. разд. 17.8); характерен он и для таких широко применяемых строительных материалов, как стеклопластики и железобетон. Фибриллы, входящие в состав клеточной стенки растений, обычно состоят из полисахарида целлюлозы - самого распространенного на Земле вида органических макромолекул. Матрикс же состоит в основном из двух других типов полисахаридов — гемицеллюлоз и пектинов, а также структурных гликопротеинов (рис. 203). Молекулы фибрилл и поперечного матрикса сшиты друг с другом с помощью ковалентных связей и нековалентных взаимодействий; при этом образуется необычно сложная структура, состав которой обычно специфичен для каждого из типов клеток (рис. 20-4). Известно строение основных молекул, образующих клеточные стенки у многих типов клеток, однако остается невыясненным, все ли эти виды молекул представлены в стенках клеток разных типов; не установлен и способ соединения молекул в трехмерной структуре.
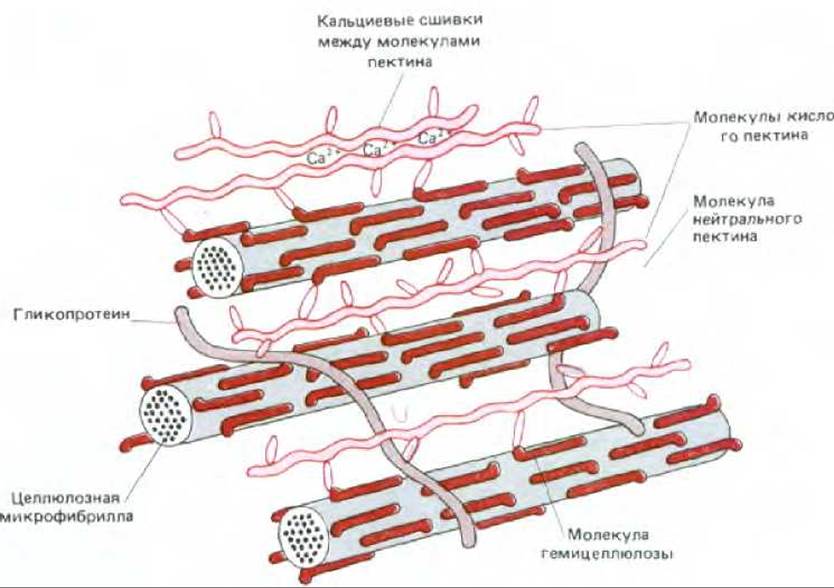
Рис. 20-3. Схема возможного соединения двух главных компонентов первичной клеточной стенки-целлюлозных микрофибрилл и матрикса. Молекулы гемицеллюлоз (например, ксилоглюканов) прикреплены к поверхности целлюлозных микрофибрилл водородными связями. Некоторые из этих молекул соединены поперечными сшивками, образованными короткими молекулами нейтральных пектинов (например, арабиногалактанов) и кислых пектинов (например, рамногалактуронанов). Гликопротеины плотно вплетены в ткань клеточной стенки.
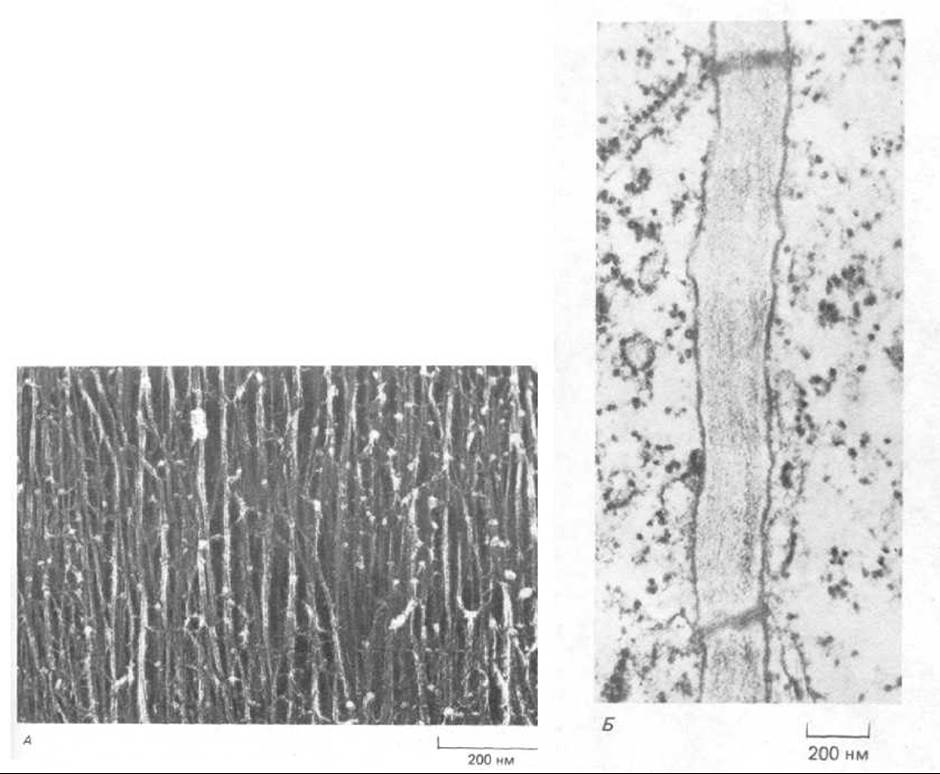
Рис. 20-4. А. Электронная микрофотография первичной клеточной стенки у моркови (препарат получен методом замораживания-скалывания и глубокого травления, см. разд. 4.1.11). Целлюлозные микрофибриллы соединены друг с другом сложной сетью из молекул матрикса. Сравните эту фотографию со схемой, приведенной на рис. 20-3. Б. Тонкий срез типичной первичной клеточной стенки. (А-с любезного разрешения В. Wells и К. Roberts; Б с любезного разрешения J. Burgess.)
20.1.2. Микрофибриллы целлюлозы соединены поперечными сшивками с молекулами гемицеллюлозы, пектина и гликопротеина, в результате чего образуется сложная сеть [1,2]
Молекула целлюлозы представляет собой неразветвленную цепь, содержащую не менее 500 остатков глюкозы, которые ковалентно соединены друг с другом ß1 → 4-глюкозидными связями, в результате чего вся молекула приобретает лентовидную структуру, стабилизированную внутримолекулярными водородными связями. Межмолекулярные водородные связи, соединяя смежные молекулы целлюлозы, содействуют скреплению этих молекул в параллельно лежащие тяжи, которые перекрываются и образуют пучок из 60-70 цепей, обладающих одинаковой полярностью. Такие кристаллические агрегаты с упорядоченной структурой и длиной во много микрометров, называются микрофибриллами целлюлозы (рис. 20-5).
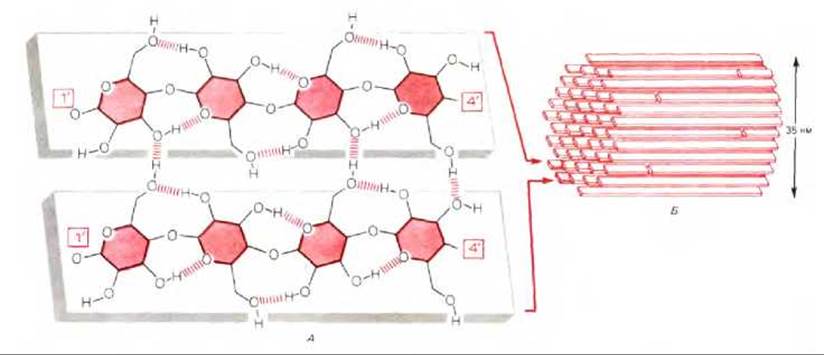
Рис. 20-5. Строение целлюлозы. А. Небольшой фрагмент двух молекул целлюлозы, каждая из которых состоит из длинной плоской цепи, составленной из остатков глюкозы, соединенных ß1 → 4-связями; эти цепи достигают в длину многих микрометров. Внутримолекулярные водородные связи стабилизируют каждую цепь, межмолекулярные водородные связи прочно сшивают между собой соседние цепи. Не указанные на рисунке водородные связи соединяют каждую цепь с цепями, лежащими над и под ней. Б. Целлюлозные микрофибриллы, состоящие из множества параллельно расположенных молекул целлюлозы, соединенных водородными связями. У большинства высших растений диаметр микрофибрилл составляет примерно 3,5 нм, однако у некоторых водорослей он может быть в 10 раз больше. Каждая молекула целлюлозы полярна (у молекулы есть 1'- и 4'-концы), все молекулы в каждой микрофибрилле имеют одинаковую полярность.
Гемицеллюлозы - это гетерогенная группа разветвленных полисахаридов, которые прочно связываются с поверхностью каждой целлюлозной микрофибриллы и друг с другом, покрывая таким образом эти микрофибриллы и способствуя объединению их в сложную сеть посредством водородных связей (см. рис. 20-3). Существует много различных гемицеллюлоз, однако любая из них имеет в основе длинный линейный остов, состоящий из молекул одного и того же моносахарида, соединенных связью ß1 → 4; от этого остова отходят короткие боковые цепи из остатков Сахаров другого типа (рис. 20-6). Моносахариды как оси, так и боковых цепей специфичны для вида растения и стадии его развития Еще один важный полисахаридный компонент клеточной стенки - это пектины. Пектины представляют собой гетерогенную группу разветвленных полимеров, содержащих много отрицательно заряженных остатков галактуроновой кислоты (рис. 20-7). Благодаря своему отрицательному заряду пектины сильно гидратированы и активно связывают катионы. При добавлении ионов Са2+ к раствору пектинов происходит сшивание последних с образованием полутвердого геля (поэтому-то пектин добавляют к фруктовым сокам, чтобы получить желе). Такое сшивание ионами Са2+, как полагают, играет определенную роль в объединении компонентов клеточной стенки. Особенно богата пектинами срединная пластинка - специализированная центральная область, обеспечивающая сцепление клеточных стенок соседних клеток (см. рис. 20-17). Этот слой в некоторых местах прерывается, образуя межклеточные воздушные полости, характерные для многих растительных тканей (рис. 20-8).
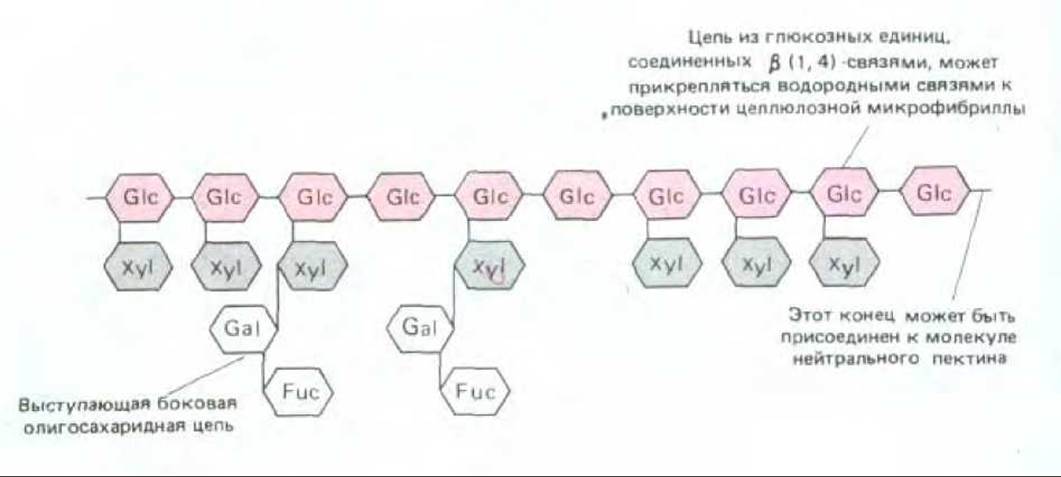
Рис. 20-6. Схема строения молекулы гемицеллюлозы из клеточной стенки типичного цветкового растения. Целлюлозоподобный остов молекулы состоит из остатков глюкозы и присоединен в клеточной стенке водородными связями к поверхности целлюлозной микрофибриллы. В данном случае изображен ксилоглюкан, в котором к глюкозным единицам осевой цепи присоединены остатки ксилозы; компонентами боковых олигосахаридных цепей могут быть и другие сахара, например, галактоза и фукоза.
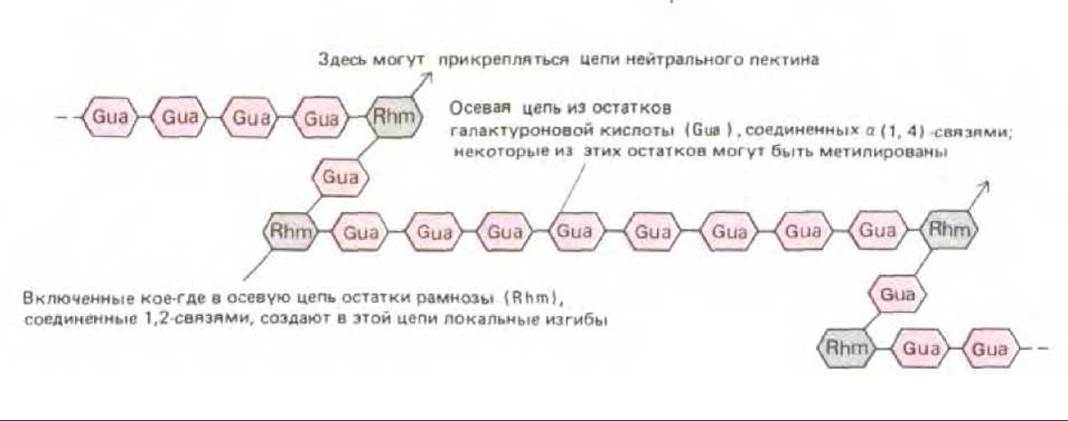
Рис. 20-7. Схема строения кислого пектина (рамногалактуронана) из клеточной стенки высшего растения. Показаны изломы линейной осевой цепи из отрицательно заряженных остатков галактуроновой кислоты. Эти изломы обусловлены присутствием остатков рамнозы, которые служат местами прикрепления нейтральных пектинов, связывающих кислые пектины с молекулами гемицеллюлозы (см. рис. 20-3).
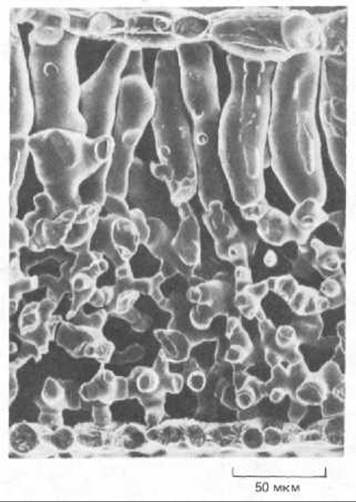
Рис. 20-8. Микрофотография листа бобового растения, полученная с помощью сканирующего электронного микроскопа методом замораживания-скалывания. Отчетливо видны верхний и нижний эпидермис. Между ними находятся многочисленные клетки мезофилла листа. По мере роста этих фотосинтезирующих клеток, их стенки отделяются друг от друга в определенных участках вдоль срединной пластинки, в результате чего образуется открытая сеть клеток, каждая из которых имеет неограниченный доступ к ресурсам двуокиси углерода в окружающем их достаточно большом воздушном пространстве. (С. Е. Jeffree, N. D. Read, V.A. Smith, J. E. Dale, Planta, 172, 20-37, 1987.)
Кроме описанных нами трех типов полисахаридов, первичная клеточная стенка содержит гликопротеины, которые могут составлять до 10% всей ее массы. Удалось осуществить клонирование ДНК, кодирующей основные гликопротеины, и определить последовательность ее нуклеотидов. Гликопротеины клеточной стенки необычны в том отношении, что они содержат много повторяющихся последовательностей аминокислот. До 30% их аминокислотных остатков представлены гидроксипролином, который образуется при пострансляционном гидроксилировании пролина (как и в коллагене, см. разд. 14.2.7). К боковым цепям гидроксипролина и серина присоединяются короткие олигосахаридные цепи; таким образом больше половины массы каждого гликопротеина приходится на углеводную часть. Выделить гликопротеины, не повредив всю структуру клеточной стенки, весьма трудно, следовательно, они прочно встроены в сложную трехмерную сеть полисахаридов, составляющих эту стенку. Считается, что гликопротеины действуют подобно клею, повышая прочность клеточной оболочки. Существенно, что содержание некоторых мРНК, кодирующих эти гликопротеины, резко возрастает в ответ на инфекцию или ранение.
Чтобы клетка растения могла увеличиваться в размерах или изменять свою форму, клеточная стенка должна растягиваться или деформироваться. Из-за своей кристаллоподобной структуры отдельные целлюлозные микрофибриллы неспособны растягиваться, следовательно, при подобных изменениях должно происходить скольжение микрофибрилл относительно друг друга и/или разделение соседних микрофибрилл. Как будет обсуждаться ниже, направление растяжения растущей клетки зависит от того, как расположены микрофибриллы целлюлозы, устойчивые к растяжению в первичной клеточной стенке (см. разд. 20.4.7).
20.1.3. Малые размеры пор в стенке растительной клетки ограничивают обмен макромолекулами между клеткой и окружающей средой [3]
Все клетки поглощают питательные вещества и выводят продукты своего метаболизма через плазматическую мембрану. У растительных клеток соответствующие молекулы должны проходить также и сквозь клеточную стенку. Поскольку матрикс клеточной стенки представляет собой сильно гидратированный полисахаридный гель (первичная стенка содержит по массе до 60% воды), вода, газы и небольшие водорастворимые молекулы быстро диффундируют через нее. (Даже в тех случаях, когда толщина клеточной стенки достигает 15 мкм, на ее долю приходится только 10% того сопротивления, которое испытывают молекулы воды, циркулирующие между цитоплазмой и окружающей клетку средой; за остальные 90% ответственна плазматическая мембрана.) Средний диаметр отверстий между «сшитыми» друг с другом макромолекулами, образующими большинство клеточных стенок, составляет около 5 нм. Этого достаточно, чтобы сильно замедлить продвижение любой глобулярной макромолекулы с молекулярной массой, превышающей 20000. Следовательно, растения вынуждены использовать в качестве питательных веществ небольшие молекулы. Маленькими и водорастворимыми должны быть и молекулы, опосредующие межклеточные сигналы. И действительно, у растений большинство известных сигнальных молекул, таких как регуляторы роста - ауксины, цитокинины и гиббереллины (см. разд. 20.5.8) - имеют молекулярную массу менее 500.
20.1.4. Высокая прочность клеточной стенки позволяет клеткам поддерживать избыточное внутреннее гидростатическое давление, называемое тургором [4]
Механическая прочность клеточной стенки позволяет клеткам растений выжить в окружающей среде, которая гипотонична по отношению к содержимому клетки. Внеклеточная жидкая среда высших растений включает водную фазу во всех клеточных стенках и в дополнение к ней жидкость в длинных трубочках, образуемых клеточными стенками отмерших клеток ксилемы (см. разд. 20.2.5). Эти трубочки несут воду (транспирационный ток) от корней к местам испарения, находящимся главным образом в листьях. Хотя внеклеточная жидкость содержит больше растворенных веществ, чем менее концентрированный раствор в окружающей растение среде (например, в почве), она все равно остается гипотоничной по отношению к внутриклеточной жидкости. Это легко продемонстрировать, разрушив клеточную стенку с помощью целлюлаз и других ферментов и наблюдая за поведением такой, лишенной стенок, клетки, называемой протопластом (см. рис. 20-71). Если этот округлый протопласт некоторое время находится в гипотонических условиях, он осмотическим путем набирает воду и лопается (рис. 20-9). Клетка, сохранившая свою оболочку, в такой же ситуации лишь немного разбухнет. Дело в том, что клетка создает свое внутреннее гидростатическое давление, которое поддерживает клеточную стенку подобно тому, как внутренняя камера, наполненная воздухом, подпирает покрышку велосипедной шины. Такое гидростатическое давление приводит к осмотическому равновесию и препятствует дальнейшему проникновению воды (подробное изображение осмоса см. на схеме 6-1).
Возникающее вследствие осмотического дисбаланса этих двух сред избыточное гидростатическое давление внутри растительной клетки, называемое тургорным давлением (или просто тургором), имеет для растений жизненноважное значение. Тургор - главная сила, растягивающая клетку в период ее роста; он в значительной мере ответствен также за жесткость живых растительных тканей (сравните увядший лист обезвоженного растения с упругими листьями растения, получающего достаточно воды).
20.1.5. Рост растительной клетки определяется как тургорным давлением, так и контролируемым образованием клеточной стенки [5]
Тургорное давление важно не только для создания упругости растительных тканей. Всякий раз, когда клеточная стенка уступает внутреннему тургорному давлению и растягивается, происходит необратимое увеличение объема клетки, иными словами клетка растет. Рост клетки происходит лишь тогда, когда тургорное давление внутри клетки превышает локальный предел прочности стенки. В принципе, в этом случае растение может использовать две стратегии для своего роста: либо повышать тургорное давление, либо ослаблять клеточную стенку в отдельных местах. Имеется надежное доказательство того, что растительная клетка выбирает вторую возможность и разнообразными способами ослабляет клеточную стенку (перемещая, например, в стенку ионы Н+ с помощью АТРазы, локализованной в плазматической мембране и накачивающей протоны). Хотя детали этого механизма не изучены, полагают, что локальное снижение рН приводит к уменьшению числа слабых связей, скрепляющих компоненты стенки; при этом макромолекулы, входящие в состав стенки, под влиянием тургорного давления скользят относительно друг друга. Чтобы еще больше облегчить рост стенки, осуществляются и другие более сложные изменения, включая активацию ферментов, которые катализируют гидролиз гликозидных и других ковалентных связей.
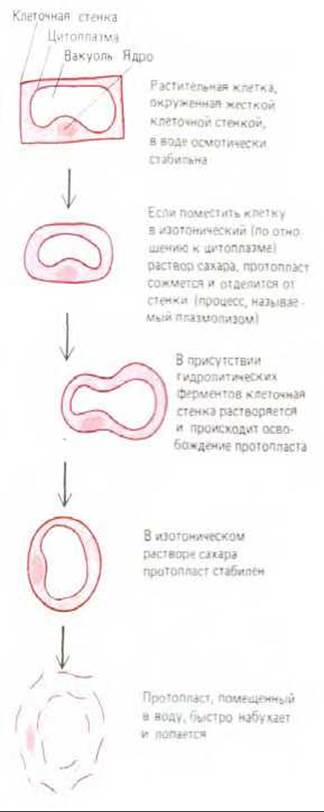
Рис. 20-9. Растительная клетка, лишенная стенки, т. е. протопласт, осмотически нестабильна, и при помещении в воду или гипотоническую внеклеточную жидкость, омывающую растительные клетки, набухает и лопается. Если же клетка окружена жесткой стенкой, она может набухать лишь в ограниченной степени. Давление, которое оказывает клетка на клеточную стенку, делает ее тургесцентной и обусловливает осмотическое равновесие; при этом вода больше не поступает в клетку (см. схему 6-1).
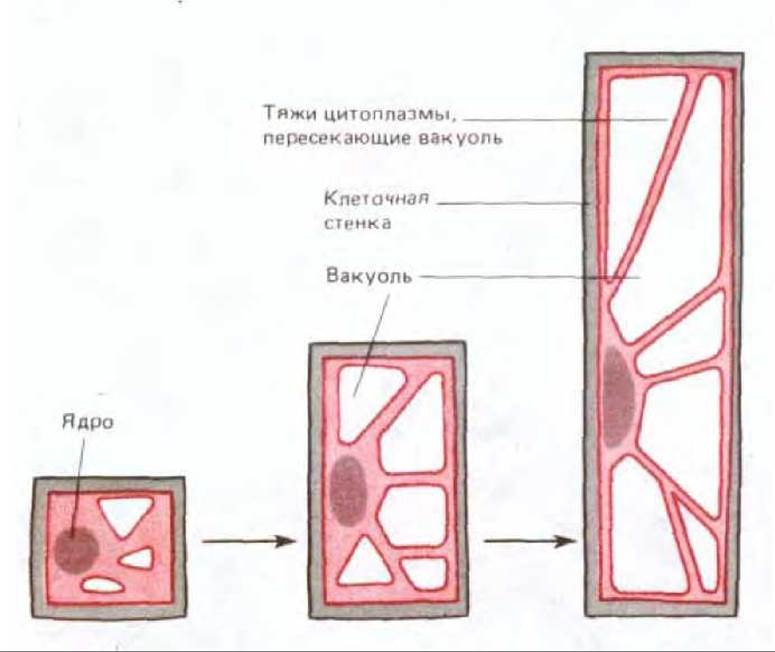
Рис. 20-10. Значительное увеличение размеров клетки может быть достигнуто и без увеличения объема цитоплазмы. Ослабление стенки обеспечивает растягивание клетки под действием тургора в определенном направлении, что сопровождается поглощением воды разбухающей вакуолью. В итоге цитоплазма превращается в тонкий периферический слой, соединенный с областью ядра тяжами, которые проходят через всю вакуоль и содержат пучки актиновых фила-ментов (см. рис. 20-53).
В большинстве случаев увеличение объема клетки происходит неравномерно, в основном за счет увеличения объема вакуоли, а не цитоплазмы. Сохранение почти постоянного количества цитоплазмы, обогащенной азотом, снижает метаболические затраты на образование больших клеток (рис. 20-10). Это дает дополнительные преимущества растениям, для которых азот является лимитирующим питательным веществом. Для поддержания тургорного давления, необходимого для постоянного роста клетки, растущая вакуоль должна активно поглощать растворенные вещества, которые накапливаются в ней, поддерживая осмотическое давление.
Однако рост клетки растения - это гораздо более сложный процесс, нежели простое ее раздувание подобно воздушному шару: ведь клетка должна иметь соответствующую форму. Клеточный рост в действительности определяется двумя сложными процессами. Один из них, контролируемый по принципу обратной связи, заключается во взаимодействии двух событий - растяжения клеточной стенки и восстановления тургора. Другой подразумевает приобретение клеткой определенной формы за счет того, что некоторые области стенки остаются жесткими, тогда как другие ее участки размягчаются и растягиваются. Подобный контроль за формой клетки осуществляется благодаря некоторым событиям, происходящим в цитоплазме, что будет описано ниже (см. разд. 20.4.8).
20.1.6. Тургор регулируется по принципу обратной связи путем изменения концентраций внутриклеточных растворенных веществ [6]
Поскольку тургорное давление играет важнейшую роль в жизни растений, неудивительно, что у растительной клетки выработались тонкие механизмы, регулирующие его величину. Эта величина сильно варьирует в зависимости от вида растения и типа клетки, составляя всего пол-атмосферы у некоторых водорослей с крупными клетками и достигая 50 атмосфер в замыкающих клетках устьиц. Клетки способны повышать тургорное давление, увеличивая концентрации осмотически активных молекул в цитозоле - либо за счет накачивания их внутрь из внеклеточной жидкости через плазматическую мембрану, либо за счет расщепления осмотически неактивных полимеров, находящихся обычно в вакуолях. В обоих случаях изменение тургорного давления регулируется по принципу обратной связи.
Как же работают такие системы с обратной связью? Эксперименты указывают на то, что «детектор тургорного давления» в плазматической мембране индуцирует транспорт ионов (чаще всего это активное накачивание в клетку ионов К+) в ответ на внезапное падение тургорного давления, тогда как резкое повышение тургора приводит к выводу ионов К+. Эти процессы протекают очень быстро и, по-видимому, связаны с какими-то изменениями в специфических транспортных белках плазматической мембраны.
Связанные с мембраной «детекторы», вероятно, также способны изменять скорость синтеза осмотически активных веществ в цитоплазме и вакуоли, но эти изменения происходят гораздо медленнее. Системы, регулирующие величину клеточного тургора, особенно важны для растений, обитающих в среде с экстремальными или непостоянными осмотическими свойствами. Например, растения, произрастающие на засоленных почвах, для поддержания тургора должны накапливать в своих жидкостях очень высокие концентрации растворенных веществ. Поскольку накопление ионов, например К+, в таких больших количествах, вероятно, повлияло бы на активность жизненно важных ферментов, клетки этих растений накапливают специальные органические вещества-полигидроксилированные соединения, такие как глицерол или маннитол, аминокислоты, например пролин, или же N-метилированные производные аминокислот, такие как глицинбетаин. Концентрация этих веществ в цитозоле может достигать очень высоких уровней (0,5 М), не влияя на метаболизм клетки. Вакуоль и ее содержимое самым непосредственным образом участвуют в регуляции тургорного давления в ответ на изменения окружающей среды (см. разд. 20.4.2).
В основе ограниченных движений растений также лежат регулируемые изменения тургора. Например, замыкающие клетки устьиц контролируют скорость газообмена между листьями и окружающим их воздухом, открывая или закрывая устьичные отверстия (рис. 20-11). В течение дня, когда устьица открыты, свет активирует насос, перекачивающий ионы К+ в плазматической мембране замыкающих клеток; в результате притока ионов К+ тургорное давление повышается, и замыкающие клетки набухают, открывая устьичное отверстие. Очень быстрые изменения тургора в клетках, расположенных на ключевых позициях, вызывают более заметные движения, к которым относятся, например, закрывание ловушек у насекомоядных растений и быстрое движение частей некоторых цветков при опылении. Изменения тургора, вызывающие эти движения, происходят в результате резкого повышения проницаемости мембран в клетках, расположенных в ключевых местах. Эти клетки действуют как «шарнир», регулируемый тургором. Каким образом слабое прикосновение к чувствительной поверхности приводит к тургорному взрыву в этих клетках пока неясно. Возможно, здесь задействованы ионные каналы с возникающим в них потенциалом действия.
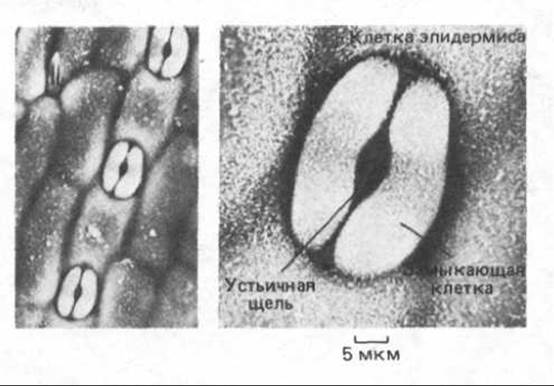
Рис. 20-11. Микрофотографии устьиц в эпидермисе листа тропического растения, полученные с помощью сканирующего электронного микроскопа при разном увеличении. Устьица - это поры, образуемые на поверхности листа двумя замыкающими клетками. Их движения, регулируемые тургором, определяют размер устьичной щели и, следовательно, интенсивности газообмена между листом и окружающей средой. У большинства растений устьица днем открыты, через них поступает двуокись углерода и через них же удаляются продукты фотодыхания. Ночью устьица обычно закрыты. Клетки эпидермиса снаружи покрыты водонепроницаемой восковой кутикулой (см. также рис. 20-18). (С любезного разрешения Н. W. Woolhouse, GJ. Hills.)
20.1.7. При образовании специализированных клеток происходит модификация клеточной стенки [7]
Наземные растения сильно отличаются друг от друга по своему строению и способам размножения (рис. 20-12). Тем не менее все они построены на одинаковых принципах из небольшого числа типов клеток и тканей. План строения почти всех растений имеет в основе продольные модульные линии, причем типичный модуль состоит из стебля, листа и почки (см. рис. 20-58). Более того, все они содержат одни и те же специализированные типы клеток, которые всегда организованы в три основных типа тканей: покровные (обеспечивающие покрытие), основные (обеспечивающие опору и питание) и проводящие (обеспечивающие транспорт жидкостей) (рис. 20-13).
Основные типы клеток представлены на схеме 20-1. Все они формируются из клеток с первичной клеточной стенкой в результате их роста и последующей дифференцировки. По мере дифференцировки клеток первичная стенка усложняется, образуя вторичную клеточную стенку. В ряде случаев этот процесс сводится лишь к простому добавлению целлюлозных слоев, но иногда происходит откладывание новых слоев разного состава. Молекулы целлюлозы, откладываемые во вторичную стенку, как правило, намного длиннее (~15 000 остатков глюкозы), чем молекулы, входящие в состав первичной стенки (от 500 до 5000 остатков глюкозы). Более того, сильно гидратированные пектиновые компоненты, характерные для первичной клеточной стенки, в значительной мере замещаются другими полимерами, в результате чего вторичная стенка оказывается более плотной и не столь гидратированной как первичная.
Вторичная клеточная стенка несет основную механическую нагрузку, приходящуюся на растение. Она также представляет собой существенный компонент питания многих животных и основу таких материалов, как древесина и бумага. Форма и состав образовавшейся в итоге клеточной стенки, тесно связаны с функцией определенных специализированных типов клеток: каждый тип клеток отличается от другого по морфологии, например по устройству клеточной стенки зрелого пыльцевого зерна, которая специфична для каждого определенного вида растения (рис. 20-14).
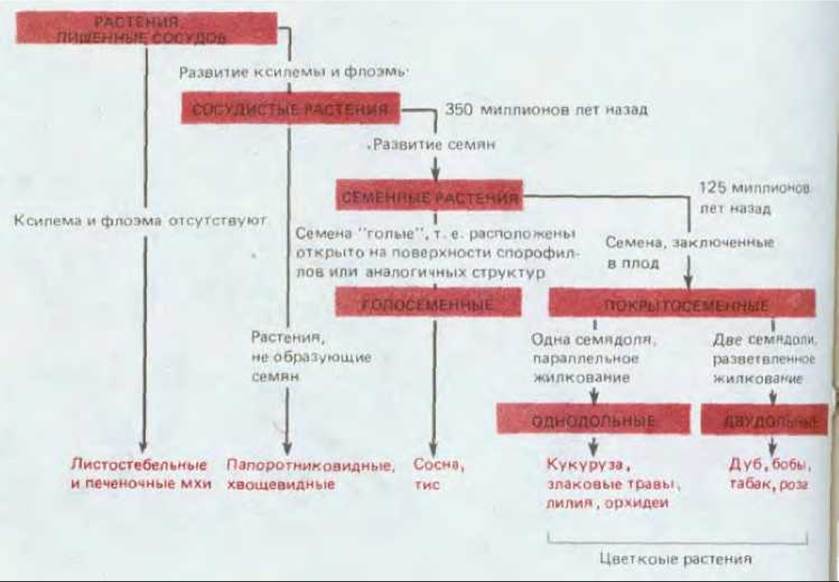
Рис. 20-12. Эволюция наземных растении. Все растения (за исключением водорослей) можно разделить на сосудистые, у которых транспорт осуществляется по проводящим тканям (ксилеме и флоэме), и несосудистые (например, мхи), которые невелики по размеру и устроены относительно просто. Как уже отмечалось, сосудистые растения появились на Земле примерно 350 млн. лет назад, когда возникли семена. Семя обеспечивает защиту развивающегося зародыша, который может оставаться в состоянии покоя, пока не будут обеспечены условия, необходимые для его дальнейшего развития. В связи с тем, что на Земле распространены в основном семенные сосудистые растения, в данной главе речь идет главным образом о них.
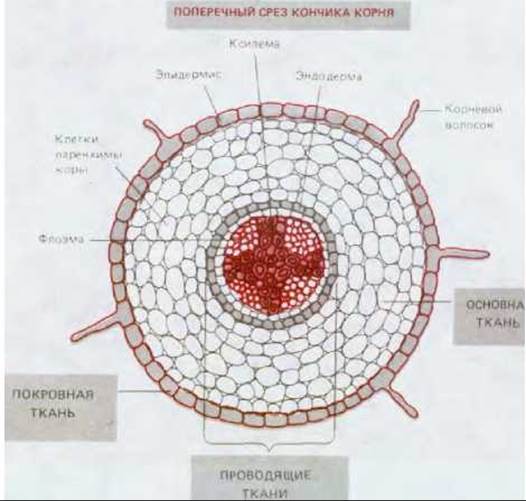
Рис. 20-13. В различных органах высших растений (листьях, стеблях и корнях) можно выделить три системы тканей: проводящую, основную (опорную) и покровную. Как видно на схематическом поперечном срезе кончика корня, проводящие ткани погружены в основную ткань, которую в свою очередь окружает покровная ткань. С некоторыми вариациями в расположении эти три системы формируют все части высшего растения. Каждая из них состоит из относительно небольшого числа основных типов клеток, часть из которых представлена на схеме 20-1.
Все значительные изменения как в составе, так и в строении первичной и вторичной клеточных стенок, отражают процессы, происходящие в цитоплазме; это лучше всего можно проиллюстрировать на примере развития сосудов ксилемы. В процессе дифференцировки клеток в молодых растущих тканях на стенках сосудистых элементов ксилемы образуются утолщения, в составе которых много целлюлозы. Их расположение определяется пучками цитоплазматических микротрубочек, которые лежат в кортикальном слое непосредственно под плазматической мембраной. Эти пучки микротрубочек обычно имеют вид спиралей или колец (рис. 20-15) и возникают при перегруппировке микротрубочек кортикального слоя цитоплазмы, в норме расположенных довольно равномерно (см. разд. 20.4.8). Это частный пример более общего правила, которое обсуждается ниже (см. тот же раздел), и согласно которому целлюлозные микрофибриллы, откладываемые вне клетки, располагаются параллельно микротрубочкам, лежащим в кортикальном слое цитоплазмы.
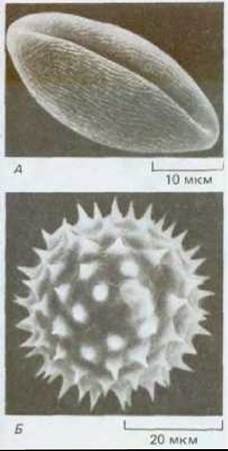
Рис. 20-14. Полученная с помощью сканирующего электронного микроскопа микрофотография пыльцевых зерен петунии (А) и подсолнечника (Б). Стенка образована спорополленином, сложным и очень прочным углеводородным полимером, который определяет характерную форму пыльцевых зерен. В стенке имеются поры, через которые при прорастании пыльцы пройдет пыльцевая трубка. (С любезного разрешения С. MacFarlane и С. Jeffree.)
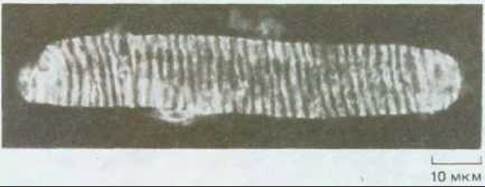
Рис. 20-15. Микротрубочки в кортикальном слое клетки из развивающейся ксилемы побега гороха. Обработка флуоресцирующими антителами выявляет спиральное расположение микротрубочек, которые определяют участок клеточной стенки, подлежащей утолщению сначала за счет отложений целлюлозы, а затем и лигнина (см. схему 20-1). Клетка крупная, поэтому глубина фокусного расстояния позволяет увидеть лишь одну сторону спирального рисунка. (С любезного разрешения I. Roberts.)
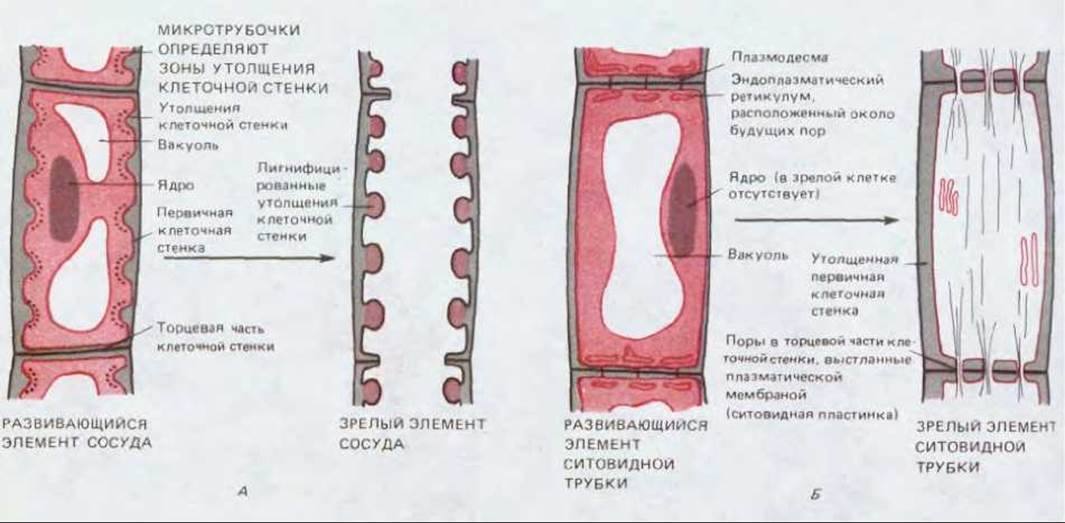
Рис. 20-16. Два примера возможных модификаций клеточной стенки при формировании специализированных клеток. А. Схематический продольный разрез развивающегося элемента малого сосуда ксилемы. В этой клетке образуются кольцевые утолщения, однако обнаруживаются и другие типы отложений. В конце концов протопласт и торцевая клеточная стенка исчезают и появляется сквозная трубка. Зрелый элемент, потеряв свой протопласт, отмирает. Б. Схематический продольный разрез через развивающийся элемент ситовидной трубки флоэмы. Первичная клеточная стенка утолщается и в торцевых ее участках появляются отверстия, т.е. образуется ситовидная пластинка, соединяющая соседние элементы трубки. Зрелые клетки сохраняют свою плазматическую мембрану, однако ядро и большая часть цитоплазмы утрачиваются.
Утолщенные целлюлозные участки клеточной стенки развивающихся ксилемных клеток впоследствии укрепляются путем отложения лигнина, нерастворимого полимера, состоящего из ароматических фенольных единиц, которые образуют внутри клеточной стенки разветвленную сеть с поперечными сшивками и составляют основу древесины. В результате локального удаления материала из торцевой части клеточной стенки образуются жесткие сосуды с низким сопротивлением, которые используются для транспорта воды в ксилеме (рис. 20-16). Аналогичная значительная перестройка первичной клеточной стенки происходит при развитии ситовидных трубок флоэмы в сосудистых тканях растения (см. рис. 20-16 и схему 20-1).
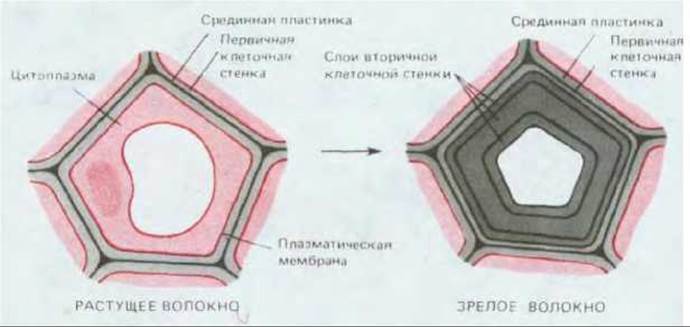
Рис. 20-17. Формирование вторичной клеточной стенки волокна (схематический поперечный разрез). В данном случае три новых слоя материала клеточной стенки откладывались в первичной стенке. Поскольку ориентация целлюлозных микрофибрилл в каждом слое различна, клеточная стенка в конструктивном отношении напоминает многослойную фанеру. У многих волокон образование вторичной клеточной стенки завершается гибелью клетки.
Вторичная клеточная стенка обычно откладывается между плазматической мембраной и первичной клеточной стенкой, иногда слои откладываются последовательно один за другим (рис. 20-17). Однако в определенных случаях особые макромолекулы откладываются либо внутри первичной стенки (как, например, лигнин в клетках ксилемы), либо на наружной ее поверхности. Например, эпидермальные клетки, покрывающие наружную поверхность растения, обычно имеют утолщенную первичную клеточную стенку, внешняя часть которой покрыта толстой водонепроницаемой кутикулой, защищающей растения от инфекции, механического повреждения, потери воды и вредоносного ультрафиолетового излучения (см. схему 20-1). Кутикула секретируется по мере дифференцировки эпидермальных клеток. Она состоит преимущественно из кутина (в коре из родственного ему вещества суберина), представлявшего собой полимер из жирных кислот с длинной цепью, который образует на поверхности растения обширную сеть с многочисленными поперечными сшивками. Слой кутина часто пропитывается смесью восков, которые, кроме того, и наслаиваются на него; воски являются эфирами спиртов с длинной цепью и жирных кислот (рис. 20-18). Кутикула растительной клетки по составу сильно отличается от кутикулы насекомых и ракообразных, построенной из белков и полисахаридов.
20.1.8. Даже зрелая клеточная стенка представляет собой динамичную структуру [8]
Состав и строение клеточной стенки взрослого растения не являются чем-то неизменным: составляющие части могут добавляться и удаляться, а связи между компонентами меняться. Локальное удаление материала стенки при развитии торцевых стенок в сосудах ксилемы и ситовидных трубок флоэмы представляют собой поразительный пример таких изменений (рис. 20-16).
Изменение клеточных стенок в уже зрелых клетках можно также проиллюстрировать на примере процессов, происходящих при потере части растения, например отмершего листа. При отмирании листа клеточные полимеры распадаются, а сахара, аминокислоты и ионы вновь используются растением. Кроме того, стареющий лист выделяет небольшие количества газа этилена. В зоне, расположенной между основанием черешка листа и стеблем (отделительный слой), клетки реагируют на сложные и еще плохо изученные комбинации этилена и других эндогенных регуляторов роста растений (см. рис. 20-67) образованием и секрецией ферментов, разрушающих клеточную стенку (пектиназа и целлюлоза). Эти ферменты действуют локально на определенный участок и частично растворяют клеточные стенки в отделительном слое (рис. 20-19). Одновременно с этим в слое клеток со стороны стебля откладывается водоустойчивый суберин, который защищает «рану», образующуюся после отделения листа в результате ферментативного переваривания.
Подобная локальная реакция клеток происходит и при созревании плодов. В этом случае низкие концентрации этилена (одна часть на миллион) стимулируют в клетках-мишенях плода (например, апельсина или банана) секрецию ферментов, расщепляющих белок и ослабляющих сцепление между соседними клетками. Это приводит к размягчению, т. е. «созреванию» плода.
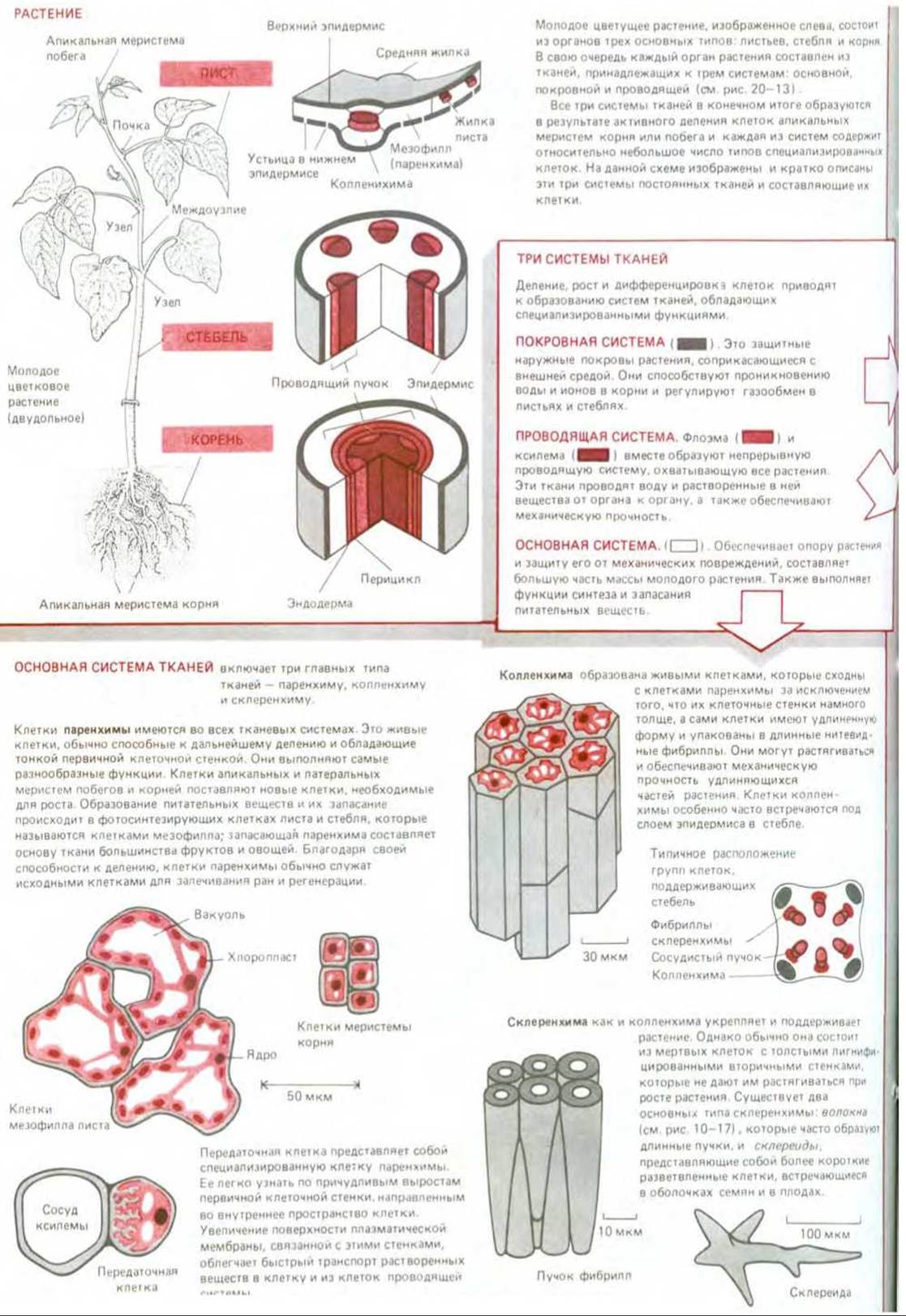
Схема 20-1. Типы клеток у высших растении.
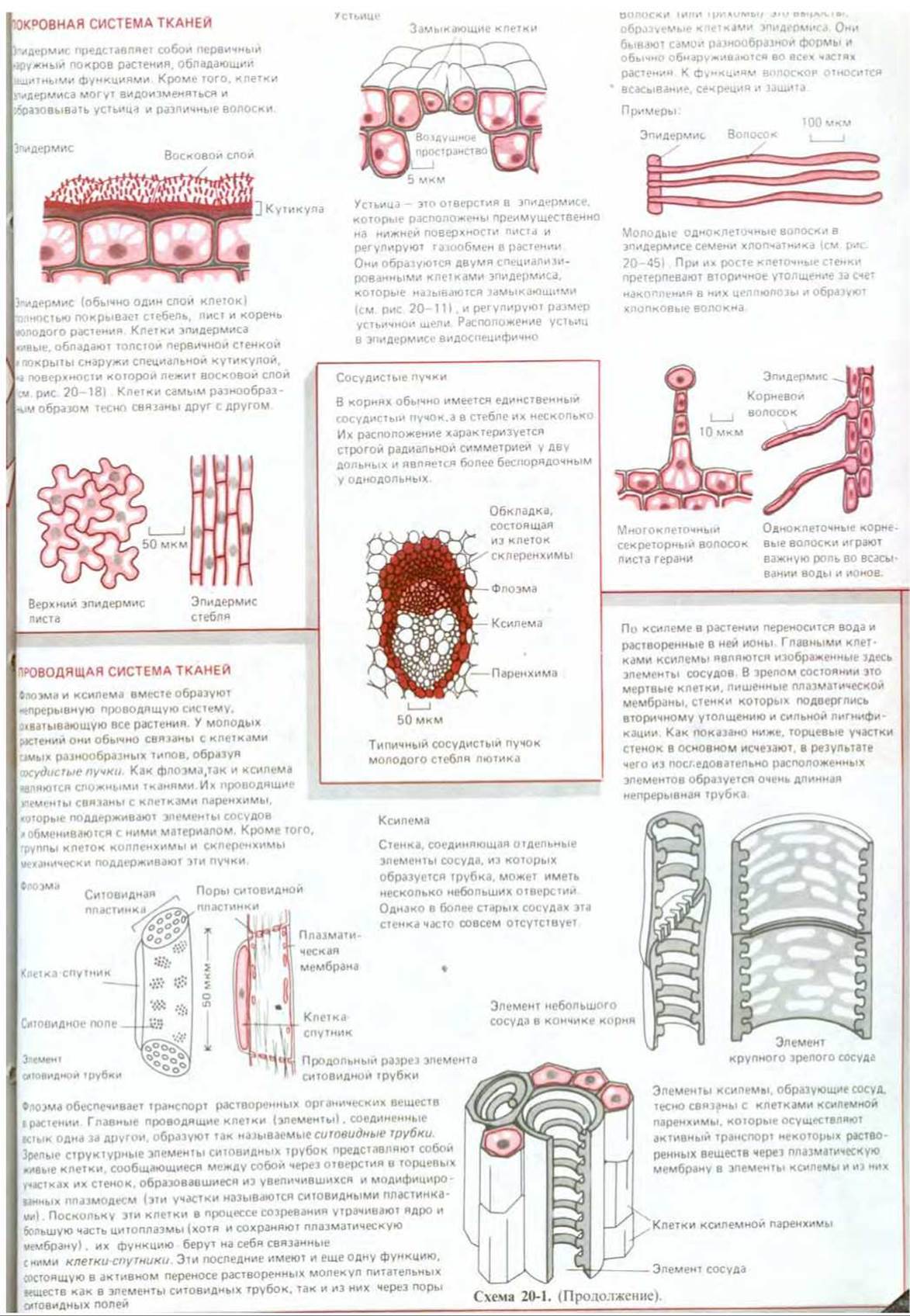
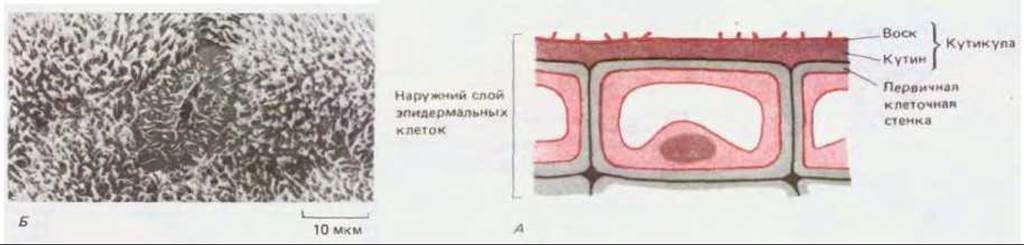
Рис. 20-18. А. Типичная зрелая клетка из эпидермиса листа (схематический разрез). На наружной поверхности толстой первичной клеточной стенки откладываются водонепроницаемые слои кутина и воска, в совокупности образующие кутикулу. Восковые отложения кутикулы зачастую создают на ее поверхности сложный рельеф. Б. Микрофотография нижнего эпидермиса листа гороха, полученная с помощью сканирующего электронного микроскопа. Хорошо видны характерные особенности отложения воска вокруг устьичной щели. (С любезного разрешения P. Linstead.)
Заключение
Высшие растения состоят из огромного числа клеток, определенным образом скрепленных друг с другом окружающими их клеточными стенками. Многие характерные свойства растений прямо или косвенно связаны с наличием этих клеточных стенок. Состав и внешний вид клеточных стенок непосредственно определяются тем, к какому типу принадлежит данная клетка и каковы ее функции. Вместе с тем основные принципы построения всех клеточных стенок поразительно сходны: жесткие волокна целлюлозы погружены в матрикс, содержащий множество поперечных сшивок и состоящий из таких полисахаридов, как пектины и гемицеллюлозы, а также из гликопротеинов. Благодаря такому строению первичная клеточная стенка обладает большим запасом прочности при растяжении и способна пропускать лишь молекулы относительно небольшого размера. Если растительную клетку, лишенную клеточной стенки (протопласт), поместить в воду, то она осмотическим путем наберет воду, набухнет и лопнет. В то же время живое содержимое клетки, заключенное в оболочку, набухает и давит на последнюю, в результате чего возникает давление, известное под названием тургорного. Тургор строго регулируется и жизненно необходим как для увеличения размеров клетки, так и для механической жесткости молодого растения.
В формировании видового разнообразия высших растений участвует относительно небольшое число специализированных типов клеток, при образовании которых (например, сосудистых элементов двух проводящих тканей-ксилемы и флоэмы) клеточная стенка подвергается значительным изменениям. Определенные участки клеточной стенки могут быть укреплены. Часто это происходит путем добавления одного или более слоев, образующих вторичную клеточную стенку. Другие участки клеточной стенки могут избирательно удаляться, как это происходит с торцевыми стенками при образовании проводящей трубки сосуда из длинного ряда цилиндрических клеток. Эти изменения клеточной стенки контролируются временными и пространственными изменениями в цитоплазме развивающихся клеток. Клеточная стенка представляет собой динамическую структуру, состав и форма которой могут подвергаться заметным изменениям не только в процессе роста и дифференцировки клеток, но и после их созревания.