Основы молекулярной биологии. Часть 1: Молекулярная биология клетки - А.Н. Огурцов 2011
Нуклеиновые кислоты и белки
Белки. Классификация аминокислот
Белки - это нерегулярные полимеры, мономерами которых являются a-L-аминокислоты.
5.4.1. Строение аминокислот. Каждая аминокислота имеет аминогруппу, связанную с атомом углерода, с этим же атомом связана карбоксильная группа, водород и аминокислотный остаток. Такая конфигурация присутствует во всех аминокислотах. Аминогруппа может быть присоединена к первому за карбоксильной группой атому углерода или ко второму атому и т. д. (рисунок 69).
Атомы нумеруются греческими буквами, и в зависимости от того, к какому по порядку атому присоединена аминокислота, её называют альфа-аминокислота или бета-аминокислота и т. д. В состав белков входят только альфа-аминокислоты.
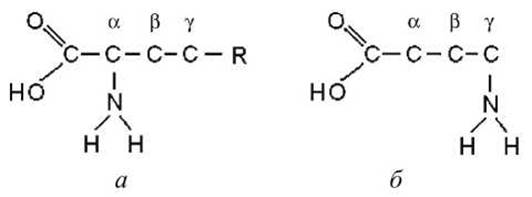
Рисунок 69 - Строение аминокислот: а - а-аминокислота, 6 - у-аминокислота
Карбоксильная группа имеет кислотный характер, она диссоциирует на ионы в водном растворе с образованием протона и отрицательно заряженной группы СОО-, а аминогруппа (NH2) имеет основной характер, она способна присоединять протон водорода, становясь положительно заряженной. В молекуле аминокислоты протон от карбоксильной группы может переносится на аминогруппу - такие образования называются цвиттерионы (биполярные ионы). В водном растворе аминокислоты находятся в виде цвиттер-ионов (рисунок 70).
Существенно, что молекулы аминокислот могут отличаться своей пространственной конфигурацией. Это явление называется стереоизомерией. Такие молекулы называются D-изомерами и L-изомерами (правовращающими и левовращающими, соответственно) (рисунок 71).
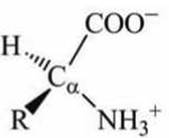
Рисунок 70 - Схема цвиттериона аминокислоты
D- и L-изомеры являются зеркальным отображением друг друга, и иначе, чем через четвертое измерение они один в другой перейти не могут. На схематических рисунках (например, на рисунке 70) тот атом, который находится ближе, перед плоскостью рисунка, принято изображать треугольной стрелкой, тот, что дальше, за плоскостью - пунктиром.
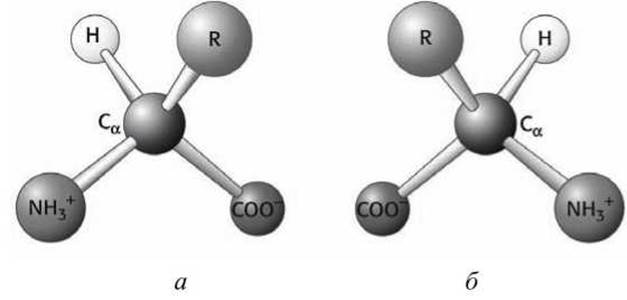
Рисунок 71 - Изомеры аминокислот: а - L-изомер, б - D-изомер
В живом организме все аминокислоты - L-изомеры, точнее 19 хиральных асимметричных L-аминокислот, а двадцатая аминокислота - глицин - не имеет хиральности. D-изомеры встречаются довольно редко и имеют определенные функции, например, могут входить в состав антибиотиков.
Всего живая клетка использует 20 стандартных аминокислот (точнее, 19 аминокислот и одна имнокислота - пролин).
Обозначения протеиногенных аминокислот приведены в таблице 5, а схемы их аминокислотных остатков изображены на рисунке 72.
Таблица 5 - Названия и обозначения аминокислот
|
№ |
Аминокислоты |
Амінокислоти |
Обозначения |
Amino acids |
||
|
суг |
symb |
lat |
||||
|
1 |
Аланин |
Аланін |
Ала |
А |
Ala |
Alanine |
|
2 |
Аргинин |
Аргінін |
Apr |
R |
Arg |
Arginine |
|
3 |
Аспарагин |
Аспарагін |
Асн |
N |
Asn |
Asparagine |
|
4 |
Аспарагиновая кислота |
Аспарагінова кислота |
Асп |
D |
Asp |
Aspartate |
|
5 |
Валин |
Валін |
Вал |
V |
Val |
Valine |
|
6 |
Гистидин |
Гістидин |
Тис |
Н |
His |
Histidine |
|
7 |
Глицин |
Гліцин |
Гли |
G |
Gly |
Glycine |
|
8 |
Глутамин |
Глутамін |
Глн |
Q |
Gin |
Glutamine |
|
9 |
Глутаминовая кислота |
Глутамінова кислота |
Тлу |
Е |
Glu |
Glutamate |
|
10 |
Изолейцин |
Ізолейцин |
Иле |
І |
Ile |
Isoleucine |
|
11 |
Лейцин |
Лейцин |
Лей |
L |
Leu |
Leucine |
|
12 |
Лизин |
Лізин |
Лиз |
К |
Lys |
Lysine |
|
13 |
Метионин |
Метионін |
Мет |
м |
Met |
Methionine |
|
14 |
Пролин |
Пролін |
Про |
р |
Pro |
Proline |
|
15 |
Серин |
Серин |
Сер |
S |
Ser |
Serine |
|
16 |
Тирозин |
Тирозин |
Тир |
Y |
Tyr |
Tyrosine |
|
17 |
Треонин |
Треонін |
Тре |
Т |
Thr |
Threonine |
|
18 |
Триптофан |
Триптофан |
Трп |
W |
Trp |
Tryptophan |
|
19 |
Фенилаланин |
Фенілаланін |
Фен |
F |
Phe |
Phenylalanine |
|
20 |
Цистеин |
Цистеїн |
Цис |
С |
Cys |
Cysteine |
В состав аминокислот входят центральный атом а-углерода (Са или Са), и три боковые группы: аминогруппа, карбоксильная кислотная группа, и боковая группа аминокислотного остатка. В белковой цепи аминогруппа каждой аминокислоты соединена пептидной связью с карбоксилом последующей аминокислоты.
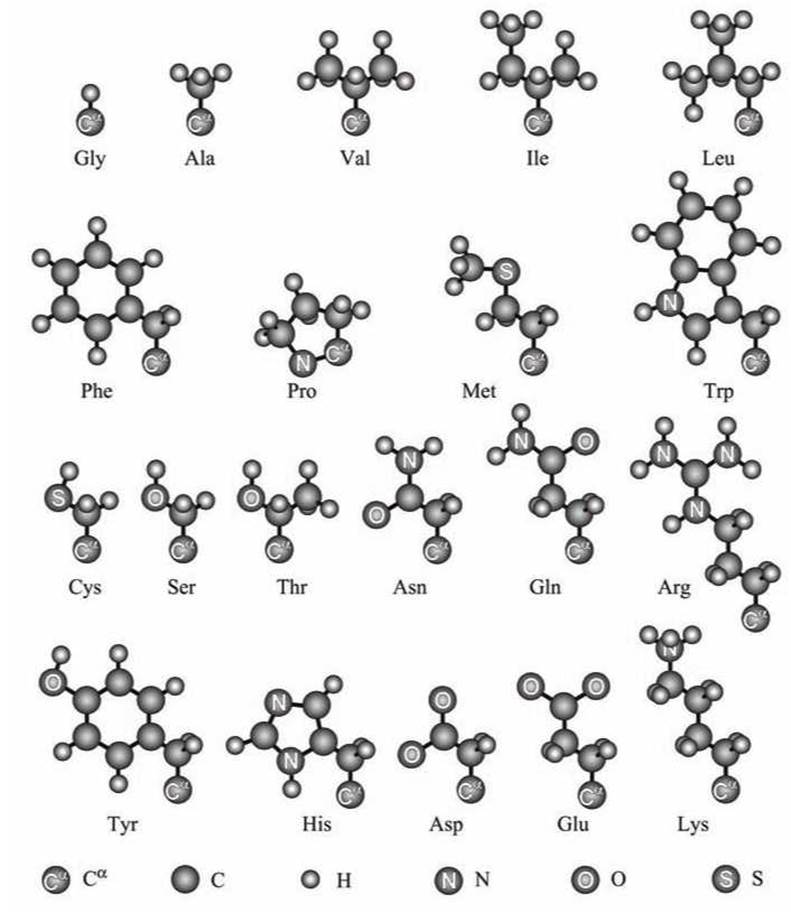
Рисунок 72 - Боковые цепи стандартных аминокислотных остатков
Двадцать стандартных аминокислот, которые используются в биосинтезе белка (из-за чего их и называют протеиногенными аминокислотами), отличаются как химически, так и структурно. Комбинируя эти аминокислоты можно добиться как желаемой формы белковой глобулы, так и того, чтобы данная глобула была устойчивым образованием.
Кроме того, необходимые для реализации той или иной биохимической реакции боковые группы могут быть размещены в необходимых местах белковой цепи.
Аминокислоты принято классифицировать следующим образом:
✵ неполярные (глицин, пролин, аланин, валин, лейцин, изолейцин),
✵ ароматические (фенилаланин, тирозин, триптофан),
✵ полярные незаряженные (серин, треонин, цистеин, метионин, аспарагин, глутамин),
✵ заряженные (отрицательно заряженные: аспарагиновая кислота и глутаминовая кислота; положительно заряженные: лизин и аргинин).
✵ гистидин в силу своей специфичности может быть отнесен как к полярным незаряженным, так и к положительно заряженным аминокислотам.
5.4.2. Специальные аминокислоты. Четыре аминокислоты: глицин, пролин, цистеин и метионин - часто называют специальными, поскольку их наличие в белковой цепи связано с выполнением ими специфических функций.
Аминокислоты глицин (Gly, рисунок 73) и пролин (Pro, рисунок 74) выполняют специфические структурные функции при "строительстве" белковой глобулы.
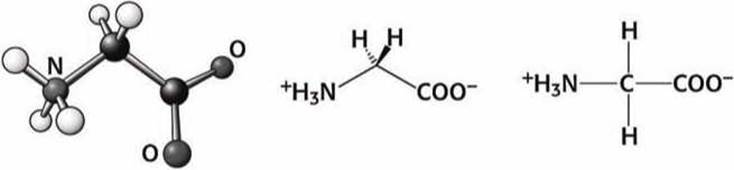
Рисунок 73 - Схема аминокислоты глицин (Gly)
Глицин - это самая маленькая аминокислота, не имеющая бокового радикала. Вследствие этого полипептидная цепь в том месте, где расположен глицин, более лабильна (подвижна).
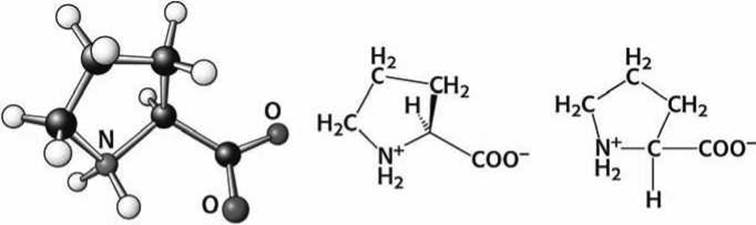
Рисунок 74 - Схема аминокислоты пролин (Pro)
Глицин используется в тех местах белковой цепи, которые для достижения наиболее плотной конформации должны быть максимально изогнуты, и там, где другие аминокислоты просто не поместились бы вследствие плотной упаковки окружающих атомов, как это имеет место, например, в случае плотного тройного спирального жгута коллагена, изображенного на рисунке 75.
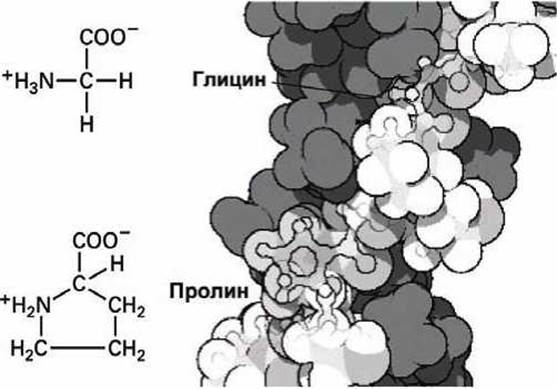
Рисунок 75 - Структурные особенности глицина и пролина
Проліт является единственной циклической аминокислотой (точнее, пролин - это иминокислота), у которой радикал присоединен к полипептидной цепи двумя ковалентными связями (СН2-аС и СН2-N). Пролин формирует жесткий изгиб (кинк) в белковой цепи. В коллагене такие кинки обеспечивают формирование тугой тройной белковой спирали.
Аминокислоты цистеин и метионин содержат атомы серы (рисунки 76, 77, 79).
Цистеин (Cys) является наиболее реакционно-способной аминокислотой, он содержит тиольную (SH) группу.
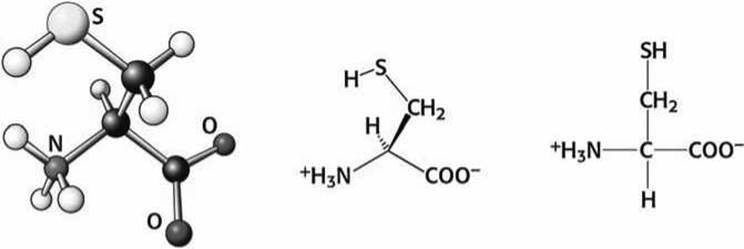
Рисунок 76 - Схема аминокислоты цистеин (Cys)
Два цистеина из разных участков белковой цепи способны образовать ковалентно связанный дисульфидный мостик.
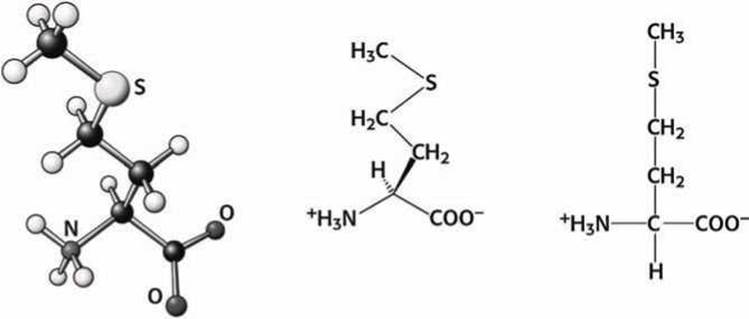
Рисунок 77 - Схема аминокислоты метионин (Met)
Цистеин также (как и серин) используется в формировании каталитических активных центров ферментов. Цистеин эффективно взаимодействует с ионами металлов и используется при формировании металлосвязывающих центров.
Метионин (Met) имеет гидрофобный атом серы. Именно с метионина (точнее с формилметионина (рисунок 78(a)) начинается синтез любой белковой цепи.
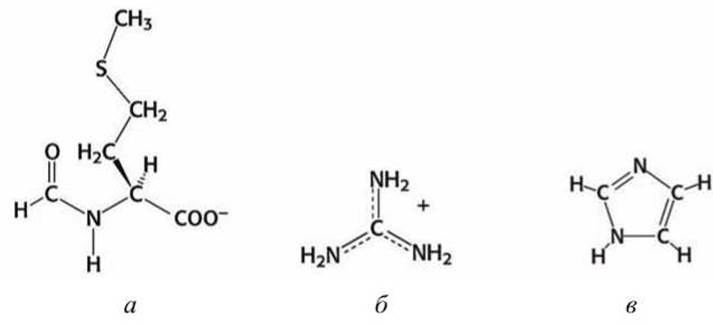
Рисунок 78 - Структурные схемы: а - формилметионин, б - гуанидин, в - имидазол
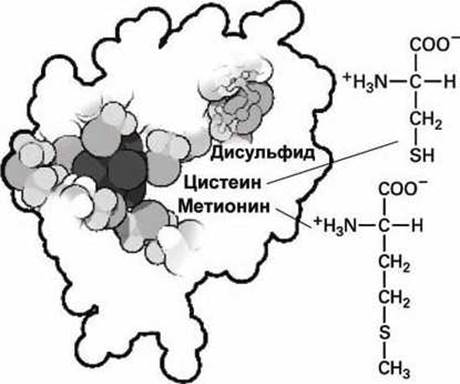
Рисунок 79 - Структурные особенности цистеина и метионина
Метионин часто используется подобно гидрофобным алифатическим аминокислотам для обеспечения фолдинга белка. Атом серы является нуклеофильным и может взаимодействовать с некоторыми типами ионов металла.
Эти свойства цистеина и метионина используются в малом электрон-несущем белке ферредоксин (рисунок 79). Дисульфидная связь показана в правом верхнем углу ферредоксина, четыре цистеина удерживают кластер, состоящий из атома железа и четырех атомов серы (кластер показан темно-серым цветом в центре ферредоксина). Два метионина окружают кластер, стабилизируя его внутри белка.
5.4.3. Неполярные и ароматические аминокислоты. Аминокислоты аланин (Ala), валин (Val), лейцин (Leu) и изолейцин (Не) (рисунки 80 - 83) являются неполярными алифатическими аминокислотами, боковые цепи которых насыщены углеводородными группами и различаются формой и размером.
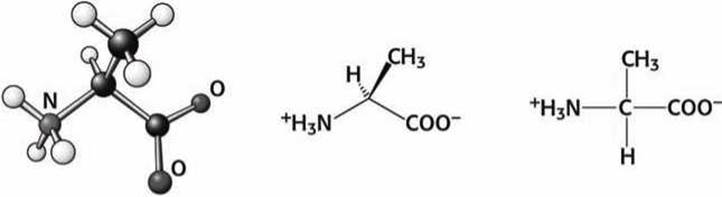
Рисунок 80 - Схема аминокислоты аланин (Ala)
Аминокислоты аланин, валин, лейцин и изолейцин обеспечивают относительную жесткость, негибкость, полипептидной цепи и являются сильно гидрофобными.
Зачастую именно наличие этих гидрофобных аминокислот обеспечивает фолдинг белковой цепи.
На рисунке 84 изображено положение этих аминокислот внутри глобулы инсулина, образуя плотно упакованный кластер внутри белка.
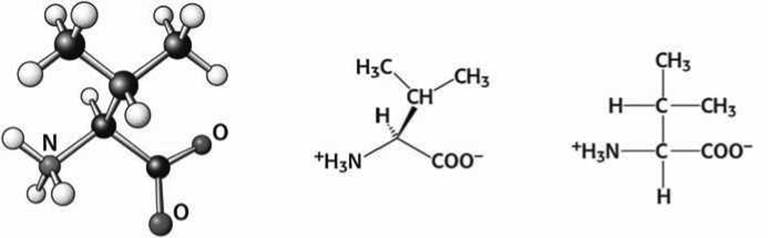
Рисунок 81 - Схема аминокислоты валин (Val)
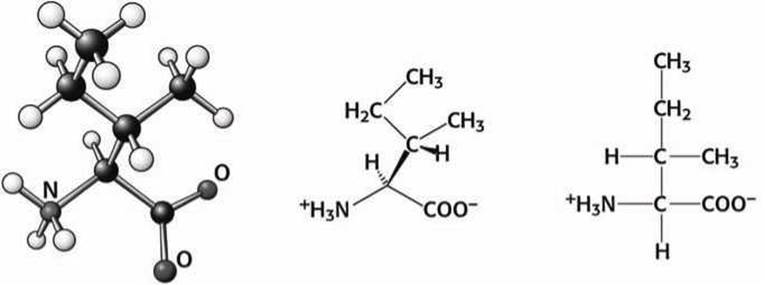
Рисунок 82 - Схема аминокислоты изолейцин (Не)
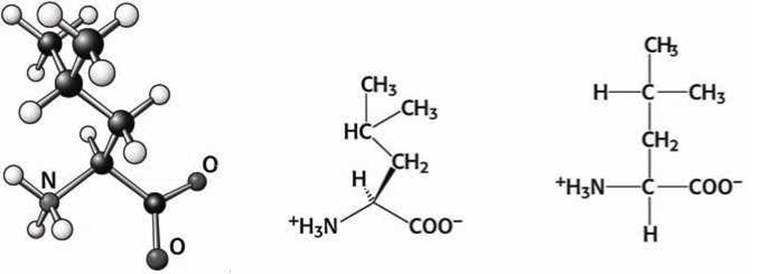
Рисунок 83 - Схема аминокислоты лейцин (Leu)
Хотя можно представить себе большое количество других подобных аминокислотных остатков, отличающихся числом и расположением углеводородных групп, но только эти четыре аминокислоты кодируются генетически в естественных биосистемах.
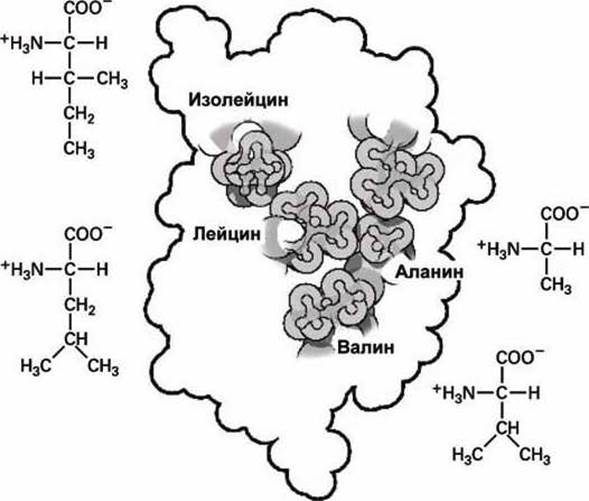
Рисунок 84 - Структурные особенности изолейцина, лейцина, аланина и валина
Фенилаланин, тирозин и триптофан. Аминокислотные остатки фенилаланина (Phe), тирозина (Туr) и триптофана (Тrр) содержат ароматические группы (рисунки 85 - 87).
Так же, как и в случае алифатических аминокислот, эти аминокислоты являются гидрофобными и также обеспечивают фолдинг белковых цепей.
Ароматические кольца этих аминокислот часто располагаются стопкой друг над другом или над основаниями ДНК (также имеющими циклическую структуру) и используются для обеспечения специфичности участков связывания данного белка с другими белковыми молекулами или нуклеиновыми кислотами.
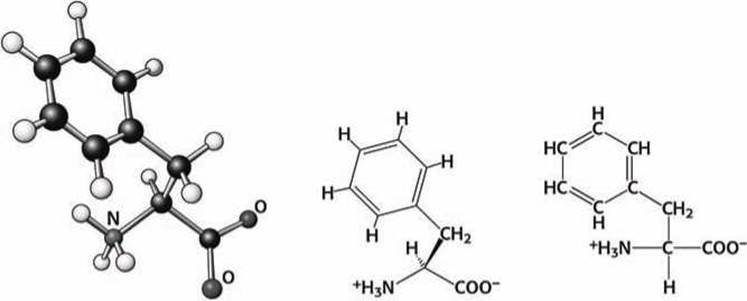
Рисунок 85 - Схема аминокислоты фенилаланин (Phe)
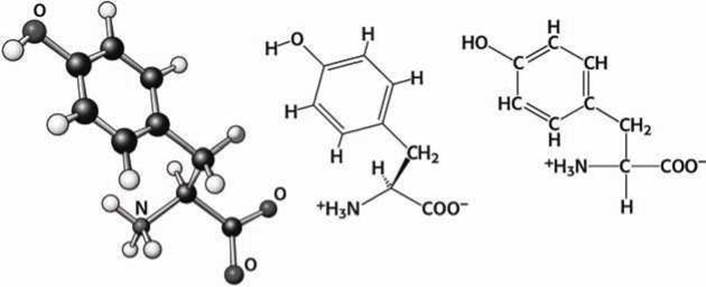
Рисунок 86 - Схема аминокислоты тирозин (Туr)
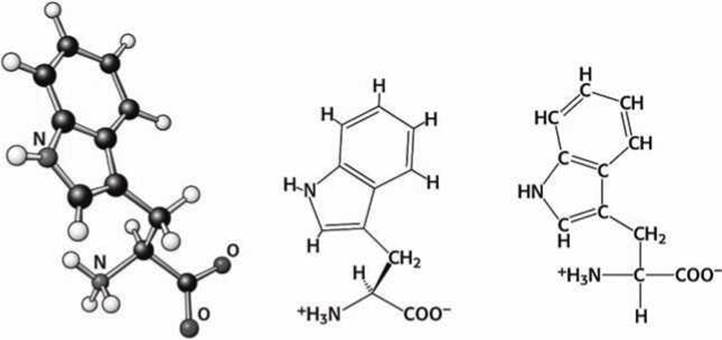
Рисунок 87 - Схема аминокислоты триптофан (Тrр)
Тирозин, кроме ароматического кольца, имеет ещё и гидроксильную группу. Этим обеспечиваются его особые свойства, которые используются для обеспечения взаимодействия с малыми органическими молекулами. Активные центры, в которых присутствует тирозин, одновременно могут и связываться с гидрофобными участками лигандов, и образовывать водородные связи с лигандами.
На рисунке 88 представлена схема молекулы бактериального порина, погруженного в липидную мембрану. Мембрана изображена на рисунке схематически в виде серого прямоугольника.
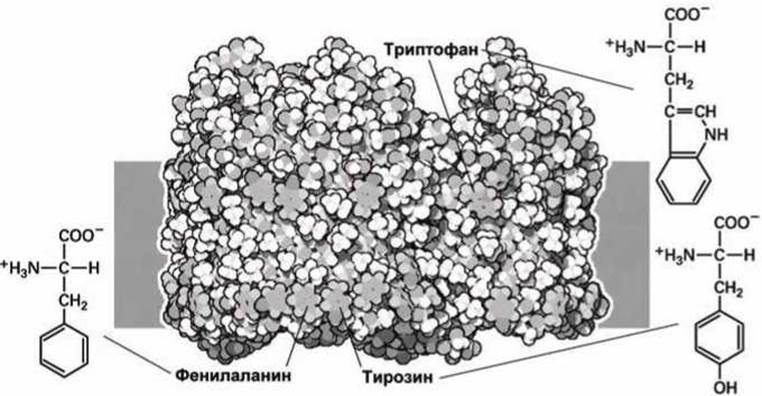
Рисунок 88 - Структурные особенности фенилаланина, тирозина и триптофана
Ароматические аминокислоты расположены по периметру порина, образуя целые зоны на поверхности белка, которые взаимодействуют с гидрофобной внутренней областью биомембраны.
5.4.4. Полярные незаряженные аминокислоты. К полярным незаряженным аминокислотам относятся серин (Ser), треонин (Thr), аспарагин (Asn), глутамин (Gln) и гистидин (His) (рисунки 89 - 93).
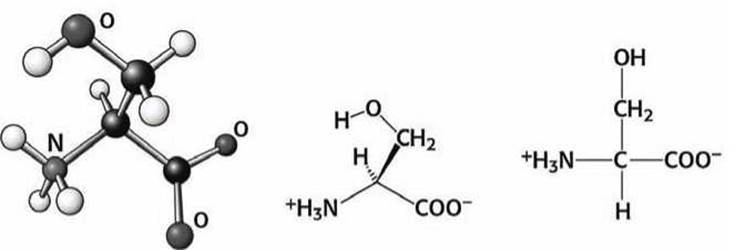
Рисунок 89 - Схема аминокислоты серин (Ser)
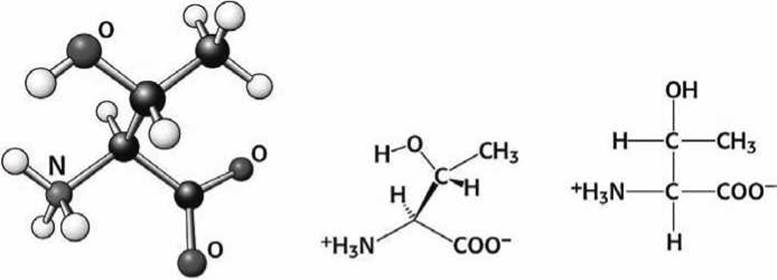
Рисунок 90 - Схема аминокислоты треонин (Thr)
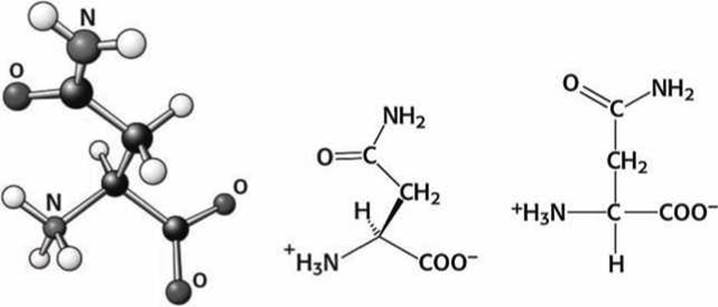
Рисунок 91 - Схема аминокислоты аспарагин (Asn)
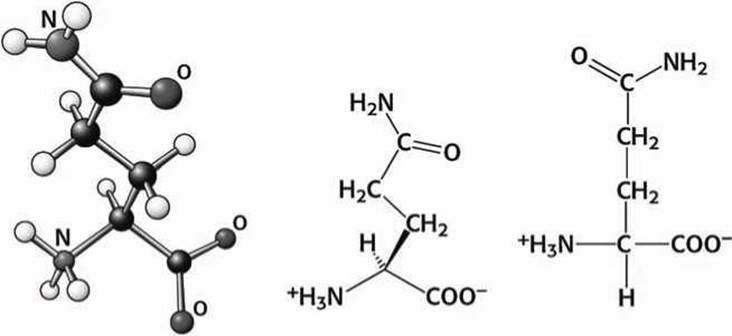
Рисунок 92 - Схема аминокислоты глутамин (Glu)
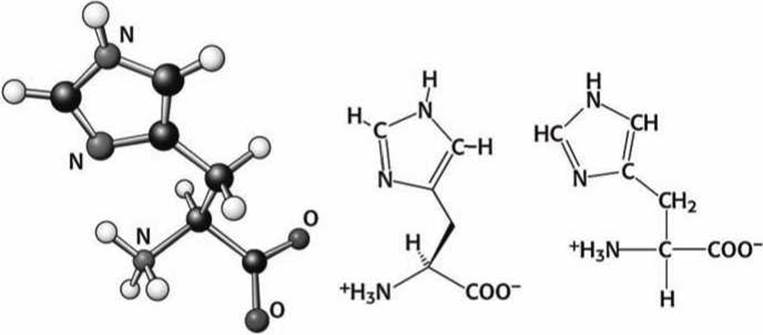
Рисунок 93 - Схема аминокислоты гистидин (His)
Аминокислотные остатки серина, треонина, гистидина, аспарагина и глутамина участвуют в образовании водородных связей. Эти аминокислоты, как правило, располагаются на поверхности белковой глобулы, где они взаимодействуют с окружающей водой (рисунок 94).
Полярные незаряженные аминокислоты часто используются для соединения белковых структур между собой и для формирования специфических взаимодействий с другими молекулами.
Гистидин выполняет особые функции. Он содержит имидазольную группу (рисунок 78(b)), которая может принимать заряженную или нейтральную формы в слегка отличающихся условиях. В нейтральной форме в гистидине сочетаются одновременно и электрофильный протонированый вторичный азот, который может быть донором водородной связи, и сильно нуклеофильный третичный азот, который может быть акцептором водородной связи. Поскольку третичный азот зачастую протонируется в цитозоле, то гистидин иногда относят к положительно заряженным аминокислотам.
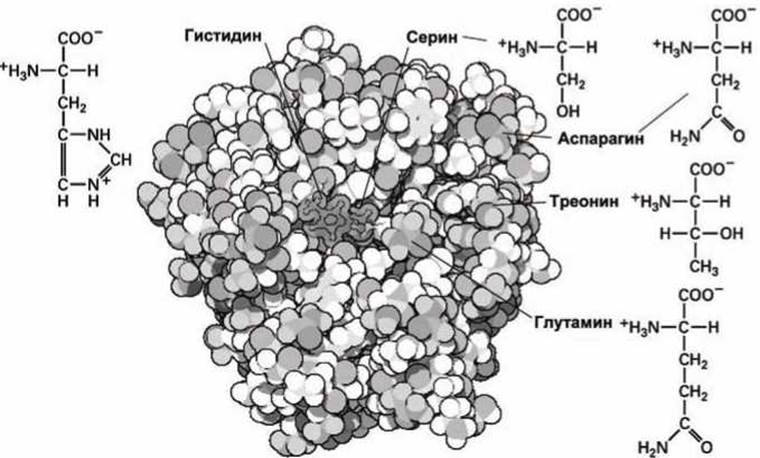
Рисунок 94 - Структурные особенности гистидина, серина, аспарагина, треонина и глутамина
Гистидин не часто используется в белках. Главным образом, он участвует в формировании специализированных каталитических активных центров ферментов.
Например, на рисунке 94 показано, как гистидин использован в протеолитическом ферменте трипсине для активации аминокислоты серин. Обычно гидроксильная группа серина неактивна, но в активированной форме серин участвует в каталитических реакциях, в которых нужно либо добавить, либо отвести атом водорода.
Гистидин также эффективно взаимодействует с ионами металлов и используется для формирования специфических металл-связывающих центров.
5.4.5. Заряженные аминокислоты. К заряженным аминокислотам относят аспарагиновую (Asp) и глутаминовую (Glu) кислоты - отрицательно заряженные аминокислоты, и лизин (Lys) и аргинин (Arg) - положительно заряженные аминокислоты.
Аспарагиновая и глутаминовая кислота содержат карбоксильные кислотные группы (рисунки 95-97).
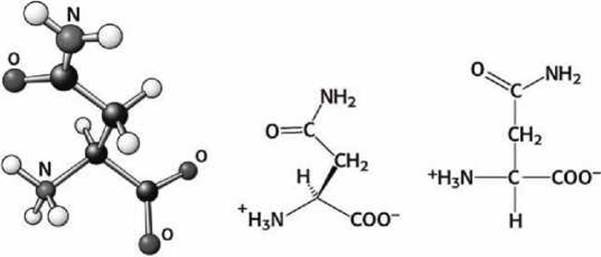
Рисунок 95 - Схема аспарагиновой кислоты (Asp)
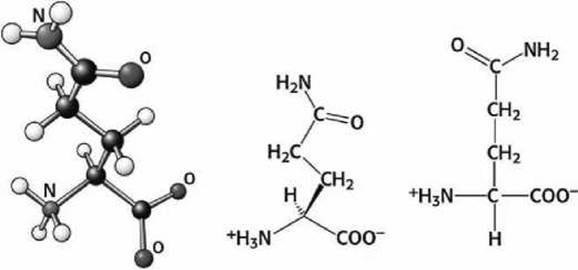
Рисунок 96 - Схема глутаминовой кислоты (Glu)
В нормальных физиологических условиях при нейтральном pH эти аминокислотные остатки ионизованы и отрицательно заряжены. Они характерны для поверхности белков (рисунок 97) и часто используются в биохимическом катализе и для прочного связывания металлических катионов.
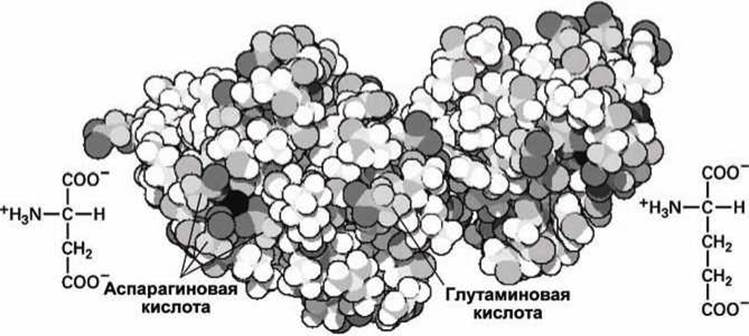
Рисунок 97 - Структурные особенности аспарагиновой и глутаминовой кислот
Лизин и аргинин. Положительно заряженные аминокислоты лизин и аргинин имеют основные группы на конце длинной углеводородной цепи (рисунки 98-100).
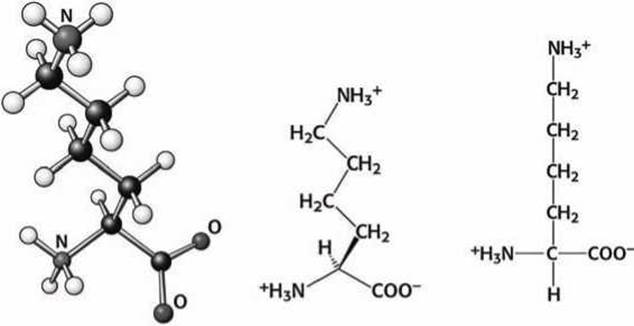
Рисунок 98 - Схема аминокислоты лизин (Lys)
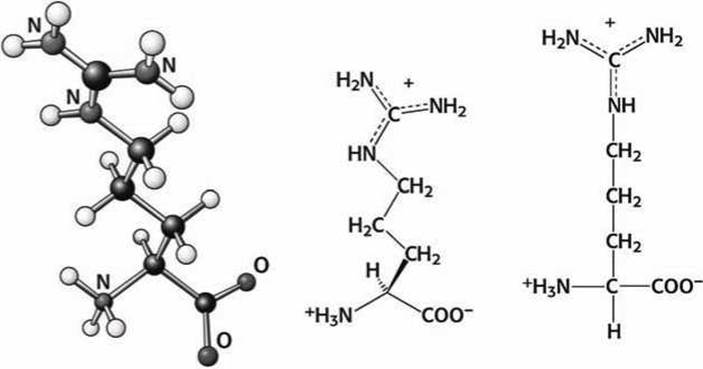
Рисунок 99 - Схема аминокислоты аргинин (Arg)
Аминогруппа на конце лизина и гуанидиновая (рисунок 78(6)) группа на конце аргинина ионизованы при физиологических условиях и нормальном pH и несут положительный заряд. Лизин и аргинин располагаются на поверхности белковых глобул и используются для распознавания отрицательно заряженных молекул.
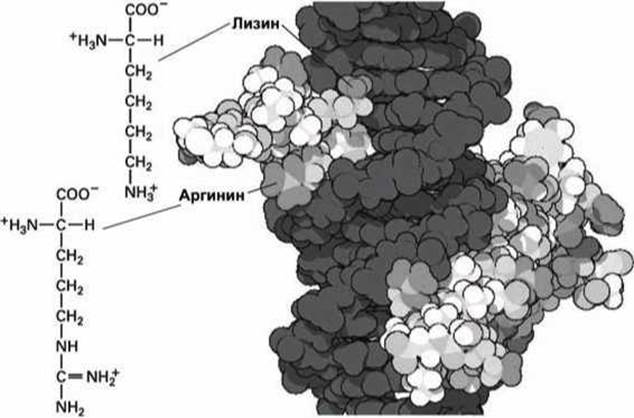
Рисунок 100 - Структурные особенности лизина и аргинина (темно-серым цветом изображена молекула ДНК)
В частности, аргинин используется для связывания белков с нуклеиновыми кислотами — на рисунке 100 показан репрессорный белок, связанный с двойной спиралью ДНК.
Длинная гибкая углеводородная цепь аргинина также участвует в гидрофобных взаимодействиях с другими гидрофобными молекулами.