Основы молекулярной биологии. Часть 1: Молекулярная биология клетки - А.Н. Огурцов 2011
Молекулярные основы функционирования белков
Фолдинг, модификация и деградация белков
Механизм биосинтеза белков будет рассмотрен во второй части пособия. Сейчас мы остановимся на работе клеточных систем, обеспечивающих правильное сворачивание (фолдинг) и "дозревание" белковых цепей.
Клетка имеет системы контроля, которые детектируют ошибки синтеза и фолдинга белков. Неверно свернутая белковая нить не обладает специфической для данного белка активностью и может быть причиной заболеваний. Ошибки процесса сворачивания белковой цепи в глобулярный нативный белок - мисфолдинг (misfolding) - не допускаются с помощью двух различных механизмов.
Во-первых, клетка имеет системы, которые предохраняют белковую цепь от неправильного сворачивания.
Во-вторых, все неверно свернутые белковые глобулы и все цитозольные белки, которые более не нужны клетке, деградируют (расщепляются на аминокислоты) в клетке.
6.5.1. Фолдинг белков. Белковая цепь самопроизвольно сворачивается в функциональную нативную конформацию, которая является энергетически наиболее выгодной, и все параметры которой задаются исключительно первичной структурой белка.
Эксперименты по денатурации и ренатурации белковой цепи под действием обратимых изменений температуры, кислотности среды или наличия особых химикалий, ослабляющих, например, дисульфидные связи, показали, что сворачивание происходит самопроизвольно и никакие дополнительные белковые и небелковые факторы не нужны для фолдинга.
Однако самопроизвольный фолдинг является очень медленным процессом, и нерационально синтезировать белковые цепи, которые долгое время не будут принимать активную форму. Кроме того, фолдингу могут препятствовать процессы агрегации белковых цепей, чего не наблюдается in vivo.
Универсальным механизмом, обеспечивающим быстрый и безошибочный фолдинг, является участие в сворачивании белковых цепей шаперонов - специализированных белков, обнаруженных во всех органеллах всех организмов от бактерий до приматов (рисунок 121).
Вообще говоря, шапероны бывают двух типов.
1. Молекулярные шапероны, которые связываются с белковой нитью, предотвращая её агрегацию или деградацию.
2. Шаперонины, которые обеспечивают фолдинг белков.
Молекулярные шапероны состоят из белков Hsp70 и их гомологов.
- Hsp70 в цитозоле и матриксе митохондрий,
- ВіР в эндоплазматическом ретикулуме,
- DnaK в бактериях.
Белки Hsp70 называют белками теплового шока (heat shock proteins), поскольку они активно синтезируются клеткой при нагревании. (Hsc70 это конститутивно (постоянно) синтезируемый гомолог Hsp70).
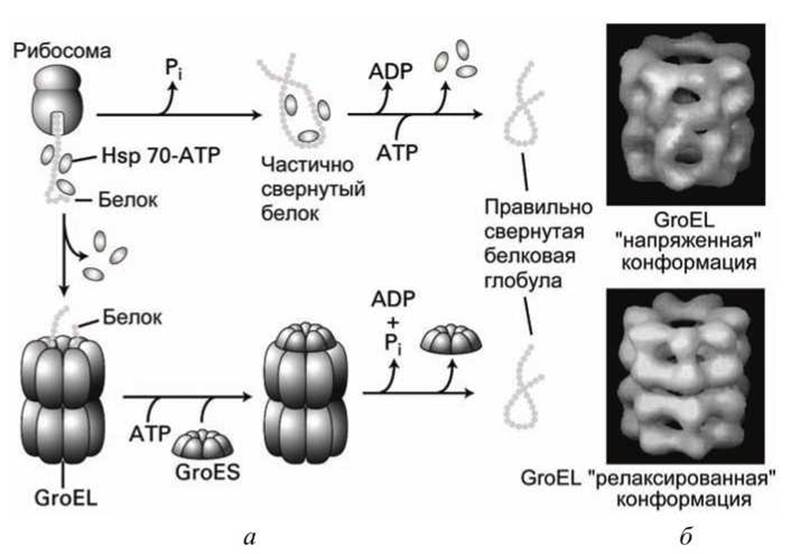
Рисунок 121 - Фолдинг белков с участием шаперонов и шаперонинов: а - схема фолдинга; б - конформации шаперонина
Связанный с АТФ Hsp70 присоединяется к гидрофильному участку белковой цепи. Гидролиз АТФ→АДФ разрешает фолдинг белковой цепи. Замена АДФ на АТФ приводит к диссоциации Hsp70 со свернутой белковой цепи (рисунок 121 вверху).
Шаперонины - большие цилиндрические макромолекулярные комплексы, состоящие из двух олигомерных колец (по восемь мономеров в шаперонине эукариот TriC и по семь мономеров в шаперонинах бактерий, митохондрий и хлоропластов GroEL) - обеспечивают изоляцию белковой нити на время фолдинга (рисунок 121 внизу). Связывание GroEL с АТФ высвобождает свернутый белок. Функционирование GroEL осуществляется с участием ко-шаперонина GroES, который закрывает (кэпирует) полость шаперона на время фолдинга.
6.5.2. Химическая модификация белков. Почти все белки претерпевают химическую модификацию после синтеза на рибосоме.
Такая модификация, которая изменяет активность, время жизни или расположение в клетке белка, главным образом заключается в присоединении либо к свободным -NEE или -СООН концам белковой цепи, либо к боковым цепям "внутренних" аминокислотных остатков специфических реакционных групп.
Хотя при биосинтезе клетка использует только 20 аминокислот, анализ белковых молекул обнаруживает до 100 аминокислот в них. "Избыточные" аминокислоты образуются в белковой молекуле именно вследствие химической модификации.
Примеры химической модификации. Ацетилирование - добавление ацетил-группы (СН3СО) к аминогруппе на N-конце - претерпевают до 80% всех белков (рисунок 122(a)).
Ацетилирование предохраняет белки от быстрой деградации. Ацетильные и другие химические группы могут присоединяться к специфическим аминокислотным остаткам в белках (рисунок 122).
Фосфорилирование и дефосфорилирование серина, треонина, тирозина и гистидина - важная обратимая химическая модификация, управляющая активностью многих белков (рисунок 122(д)).
Гликозилирование - это присоединение линейных или разветвленных полисахаридных цепей - к аспарагину, серину и треонину.
Гидроксилирование пролина и лизина в коллагене (рисунок 8.8(д)).
Метилирование гистидина мембранных рецепторов (рисунок 122(6)).
у-Карбоксилирование глутамата в протромбине - важном факторе свертывания крови (рисунок 122(e)).
Протеолиз. Другой тип необратимой посттрансляционной модификации белковых молекул не связан с изменением структуры аминокислот. Его часто называют - процессинг. Обычно происходит ферментативное "отрезание" части полипептидной цепи на С- или N-конце ферментами протеазами.
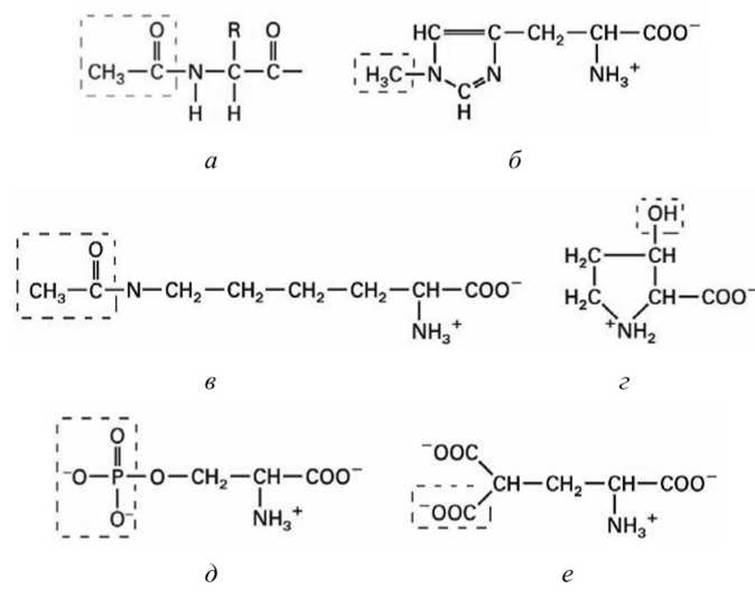
Рисунок 122 - Типичные химические модификации белков: а - ацетилирование N-конца; б - 3-метилгистидин; в - ацетил лизин; г - 3-гидроксипролин; д - фосфосерин; е - у-карбоксиглутаминовая кислота
Протеолитическое разрезание (протеолиз) является обычным механизмом активирования ферментов, которые задействованы в процессах сворачивания крови, пищеварения, и программируемой клеточной смерти.
Посредством протеолиза также формируются активные белковые гормоны, такие, как EGF и инсулин, из больших полипептидов- предшественников.
Самосплайсинг белков - это относительно редкий вид процессинга белков, при котором, в отличие от протеолиза (без участия особых ферментов), происходит самопроизвольное (автокаталитическое) вырезание внутреннего участка белковой цепи и соединение оставшихся частей в новую нить.
Вариантом самосплайсинга является самообрезание конца белковой цепи ("отбрасывание хвоста").
6.5.3. Деградация белков. Активность ферментов зависит от их концентрации, а значит, определяется балансом процессов синтеза и деградации белков в клетке.
Диапазон времени жизни белков - от нескольких минут (например, белки обеспечивающие митоз, митотические циклины) до времени жизни всего организма (например, белки в хрусталике глазного яблока).
Эукариотические клетки имеют несколько внутриклеточных протеолитических механизмов деградации (утилизации) в основном следующих трех типов белков
1) неверно свернутые (misfolded) или денатурированные (развернутые) белки,
2) "нормальные" белки, чья концентрация должна быть снижена,
3) внеклеточные белке, захваченные клеткой в результате, например, эндоцитоза или фагоцитоза.
Главный внутриклеточный механизм деградации - это ферментативный протеолиз в лизосомах, чья "кислая" среда заполнена гидролитическими ферментами (рисунок 123).
Деградация в лизосомах предназначена главным образом для протеолиза чужих белков, попадающих в клетку в результате
1) эндоцитоза,
2) фагоцитоза,
3) протеолиза нефункциональных органелл клетки, которые отторгаются и "перевариваются" клеткой (аутофагия).
Юбиквитирование. Другой, отличный от лизосомального, цитозольный механизм деградации белков реализуется путем модификации лизина в белке добавлением юбиквитина (или убикитина, ubiquitin), полипептида из 76 аминокислотных остатков. Убикитированные белки деградируют затем в протеосомах (рисунок 124).
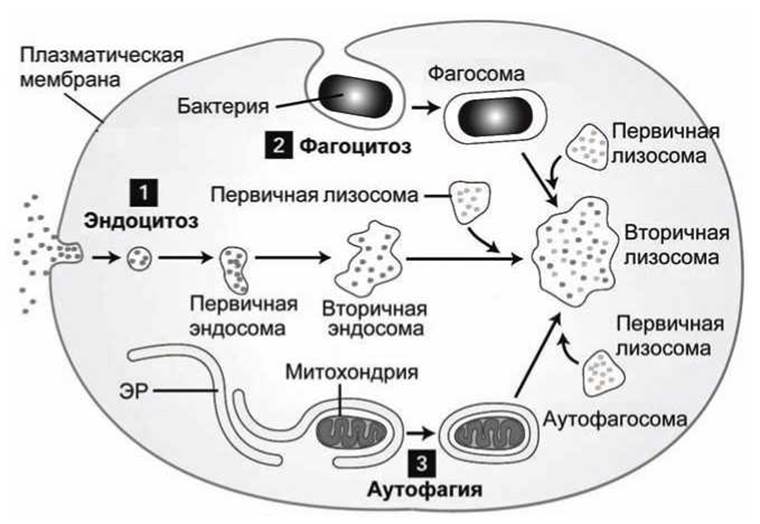
Рисунок 123 - Протеолиз в лизосомах
Юбиквитирование (или убикитирование, ubiquitination) осуществляется в три этапа тремя ферментами.
1. АТФ-зависимая активация юбиквитин-активирующего фермента E1 (ubiquitin-activating enzyme) посредством присоединения к нему молекулы юбиквитина.
2. Перенос молекулы юбиквитина на цистеин юбиквитин-сопряженного фермента Е2 (ubiquitin-conjugating enzyme).
3. Формирование пептидной связи между молекулой юбиквитина, находящейся на ферменте Е2, и лизином на белке, который должен деградировать, реакция катализируется ферментом юбиквитин лигаза Е3 (ubiquitin ligase).
Эти три этапа повторяются много раз, новые молекулы юбиквитина присоединяются к уже присоединенным, в результате чего полиюбиквитиновая цепь распознается протеосомой.
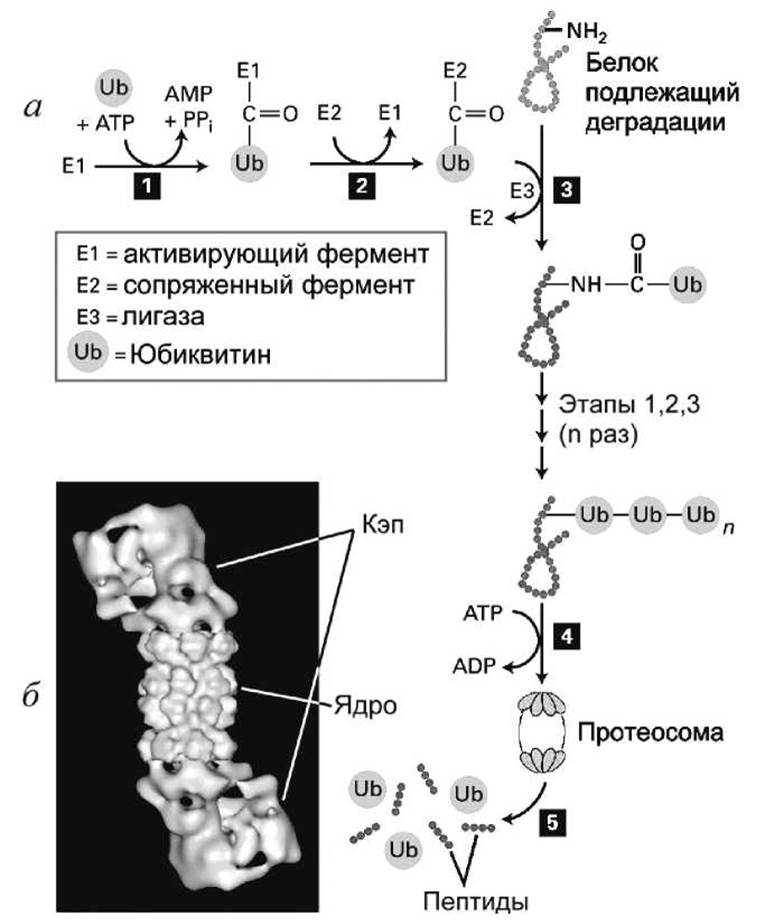
Рисунок 124 - Юбиквитиновый протеолиз: а - этапы протеолиза; б - схема протеосомы
Протеосома имеет полое цилиндрическое ядро, закрытое с двух сторон кэпирующими белками. Внутри протеосомы юбиквитированные белки разрезаются на короткие (7-8 остатков) пептиды множественными протеазами, расположенными на стенках протеосомы, а молекулы юбиквитина отделяются от белков (этап 5 на рисунке 124).
Юбиквитиновая деградация белков используется в двух случаях.
1. Удаление цитозольных белков, чья концентрация должна быть снижена.
Например, циклин должен присутствовать в клетке только во вполне определенном этапе клеточного цикла. Фосфорилирование циклина изменяет его конформацию, и внутренняя, исходно погруженная внутрь белковой глобулы, последовательность Arg-X-X-Leu-Gly-X-Іle-Gly- Asp/Asn (где X - любая аминокислота) становится доступной ферментам юбиквитинизации.
2. Протеолиз белковых молекул неправильно свернутых (misfolding) в эндоплазматическом ретикулуме.
Мисфолдинг, так же как и в предыдущем случае, делает доступными те гидрофильные части белковой нити, которые спрятаны внутрь глобулы при правильном фолдинге. Эти белки переносятся в цитозоль, где распознаются ферментами юбиквитинизации.
В обоих случаях белки содержат последовательности аминокислот, распознаваемые ферментами юбиквитинизации.